紅花黃萎病病原菌鑒定
王成成, 岳永亮, 任毓忠, 張 莉, 金恭璽, 李國英
(石河子大學農學院,新疆綠洲農業病蟲害治理與植保資源利用自治區高校重點實驗室,石河子 832003)
紅花黃萎病病原菌鑒定
王成成, 岳永亮, 任毓忠, 張 莉, 金恭璽, 李國英*
(石河子大學農學院,新疆綠洲農業病蟲害治理與植保資源利用自治區高校重點實驗室,石河子 832003)
2014年在石河子大學試驗站和實驗農場種植的紅花出現了一種植株矮化,葉片發黃,枯死的病害,切開莖稈,維管束變成褐色。采用常規組織分離法對病組織莖稈進行分離、純化獲得單孢純培養菌株;通過常規紙缽撕底沾根法對其進行致病性測定;用形態學和rDNA-ITS序列分析對病原菌進行鑒定。結果表明,分離菌株的菌落形態、分生孢子梗和分生孢子的形態都與大麗輪枝菌Verticilliumdahliae一致;經分子生物學鑒定,該菌的rDNA-ITS序列與中國棉花黃萎病菌V.dahliae的ITS序列(登錄號KT803074)同源性為99%以上 。故將引起新疆紅花黃萎病的病原菌鑒定為大麗輪枝菌V.dahliae。
紅花; 黃萎病; 病原鑒定
紅花CarthamustinctoriusL.屬于雙子葉植物,菊科,紅花屬。在新疆種植面積較大,是一種經濟價值很高的經濟作物。其紅花油中含有較高的亞油酸,具有降血脂、軟化血管、增加血液循環的作用。其花不僅可作染料,同時也可藥用,具有活血通經、化痰止痛的功效。紅花油不僅是良好的食用油,也是良好的工業和醫藥用油。紅花抗旱、抗寒,并且耐鹽堿,適于中國北方及西北地區栽培。
新疆維吾爾自治區是我國重要的紅花生產基地,無論種植面積、干花產量和紅花籽產量都占全國的80%左右[1]。在新疆紅花主要分布于塔城、伊犁和昌吉等地,是這些地區重要的經濟和油料作物。自2013年以來,石河子大學農學院試驗站和試驗場種植的紅花經常出現葉片發黃,植株矮化,甚至枯死,剖稈檢查維管束變褐色,嚴重時發病率達15%。尤其在前茬為棉花且黃萎病發病重的田塊,發病較重。在國外,Koike等[2]報道了美國加利福尼亞榨油紅花和觀賞紅花發生黃萎病,有的地塊發病率高達50%。植株由于品質喪失或植株死亡而不能收獲。Koike等[2]將其病原鑒定為大麗輪枝菌Verticilliumdahliae。目前國內尚未發現這方面的報道。賈菊生等[3]報道新疆棉花黃萎病菌Verticilliumdahliae人工接種可以侵染紅花,但沒有自然情況下導致紅花發病的直接證據。
1 材料與方法
1.1 材料
供試的紅花病株于2014年和2015年采自石河子大學農學院試驗站和大學實驗農場紅花地中。人工接種所用紅花種子為健康的‘裕民無刺’品種。通過田間病株和人工接種發病的病株進行癥狀描述。
1.2 病原菌分離純化及致病性測定
2014年7月在田間采集癥狀典型的病株,棄去葉片,將莖稈切成小段,用1%的升汞表面消毒30 s,取出后連續用無菌水沖洗3次,之后置于馬鈴薯葡萄糖洋菜培養基上,27℃溫箱中黑暗培養,待長出菌絲并進一步純化培養后,按常規方法進行單孢分離,將單胞純化菌株轉接于試管斜面培養10 d后,4℃冰箱中保存,并以20%甘油孢子懸浮液保存于-70℃冰箱中備用。其致病性測定參照馬存的紙缽撕底蘸根接種法進行[4],即選取直徑12 cm的營養缽,其內裝入無菌土,播入‘裕民無刺’紅花品種的種子,放入25℃的溫室,待幼苗長到6片真葉時,撕去營養缽底部(傷部分幼根),放入盛有孢子濃度為1×107個/mL的15 mL新鮮菌液中,以接種15 mL無菌水為對照,每個處理3缽,每缽10株苗,試驗重復3次。10 d后開始對發病情況進行調查,并采集病樣對病原菌進行再分離。
1.3 形態學鑒定
分離菌的形態鑒定,包括不同溫度下菌落的生長情況和形態特征、微菌核產生情況、分生孢子梗和分生孢子的形態及其大小的顯微測量和拍照等均參照岳永亮等[5]的方法進行。
1.4 分子生物學鑒定
1.4.1 基因組DNA提取
從分離純化的菌株中選3個代表性菌株在PDA平板上25℃培養7 d,收集菌絲,采用CTAB法提取菌體的基因組DNA[6]。
1.4.2 rDNA-ITS區的擴增及測序
代表菌株rDNA-ITS區序列的PCR擴增選用真核生物通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′);PCR反應總體積25 μL,引物ITS1/ ITS4 0.4 μmol/L,dNTPs 0.2 mmol/L,10×PCR buffer 2.5 μL,TaqDNA聚合酶1U,DNA模板1 μL。用TECHNE TC-3000 PCR儀進行擴增,94℃ 3 min預變性;94℃,30 s;55℃,30 s;72℃,40 s;30次循環;72℃延伸10 min,擴增產物用1%的瓊脂糖凝膠進行電泳檢測,然后將PCR產物送交生工生物工程(上海)股份有限公司進行序列測定。
1.4.3 rDNA-ITS序列分析
將測得的序列在NCBI數據庫進行BLAST比對(https:∥blast.ncbi.nlm.nih.gov/),并與GenBank已登錄的相似序列進行同源性分析,利用MEGA 5.0軟件構建序列的系統發育樹。
2 結果與分析
2.1 病害癥狀
紅花黃萎病在田間一般于紅花開花后開始發生,并很快進入發病盛期。植株葉片自下而上開始褪綠變黃,有些葉片褪綠不均,呈“花葉”狀,嚴重者整株枯死。剖稈檢查可見維管束變成褐色。室內人工接種后,一般10~15 d開始發病,葉片自下而上出現黃化,有些葉脈也明顯變黃,發病后期常整個植株萎蔫,剖稈檢查可見維管束變褐色。其人工接種癥狀和田間癥狀一致(圖1)。

圖1 紅花黃萎病癥狀Fig.1 Symptoms of Verticillium wilt on safflower
2.2 致病性測定
室內植株人工接種10~15 d后, 葉片開始出現褪綠發黃癥狀,一個月后進入發病盛期,發病率在68%以上,未接種植株表現正常。從發病的紅花組織上再分離得到與接種菌株相同形態的真菌。
2.3 形態學鑒定
病原菌在PDA培養基上培養16 d,其菌落均為圓形或近圓形。在10、15、20和25℃條件下培養,均產生微菌核,氣生菌絲白色,不發達;在25℃生長最快,20℃次之;30℃不產生微菌核,菌落正面呈規則的放射狀乳白色,背面米黃色;35℃下不生長(圖2a)。普通光學顯微鏡觀察,分生孢子梗無色透明,多由1~3層輪生小梗和一個頂枝小梗組成,每層有2~4個分枝(圖2b),頂枝長度32.9~75.8 μm,平均長度55.8 μm;輪枝小梗長度10.4~87.2 μm,平均長度23.9 μm;輪層間距28.5~67.5 μm,平均為50.9 μm。分生孢子無色透明,橢圓形、卵形等,大小為(5.0~12.4)μm×(2.5~6.9)μm。微菌核念珠狀、橢圓形、長圓形或不規則形(圖2c),大小差別很大,一般(32.2~120.0)μm×(24.0~61.4)μm。與已報道的大麗輪枝菌(V.dahliae)一致。
2.4 分子生物學鑒定
3個代表性菌株(xj-1,xj-2,xj-3)的 rDNA-ITS區序列大小均為516 bp,將擴增產物的序列與GenBank中已登錄的輪枝菌屬不同來源分離物的核苷酸序列進行比對,并構建系統發育樹。結果顯示,來自新疆紅花上的分離物的rDNA-ITS序列與已登錄的大麗輪枝菌Verticilliumdahliae棉花、茄子、葡萄及芒果樹分離物(登錄號分別為EU835817.1、KJ696553.1、FJ475122.1和KF878396.1)的序列同源性達100%~99.77%,結合病菌的形態特征,將引起新疆紅花黃萎病的病原鑒定為大麗輪枝菌Verticilliumdahliae。

圖2 紅花黃萎病病原菌的形態Fig.2 Morphology of the pathogen causing Verticillium wilt on safflower
3 結論與討論
通過病害田間癥狀的系統觀察,病菌的形態特征、培養性狀和ITS序列的分析,以及致病性試驗,結合國外有關資料,將引起新疆紅花CarthamustinctoriusL.黃萎病的病原確定為大麗輪枝菌Verticilliumdahliae。
大麗輪枝菌所引起的黃萎病是一種典型的土傳病害,具有寄主多、分布廣、防治難的特點,常引起多種植物黃萎病[7]。作為重要的藥用和油料作物,國內尚未見紅花黃萎病的報道。目前新疆棉花黃萎病發生較重[8-9],為此在棉花黃萎病重病田輪作倒茬時不要種植紅花,以免引起不必要的經濟損失。
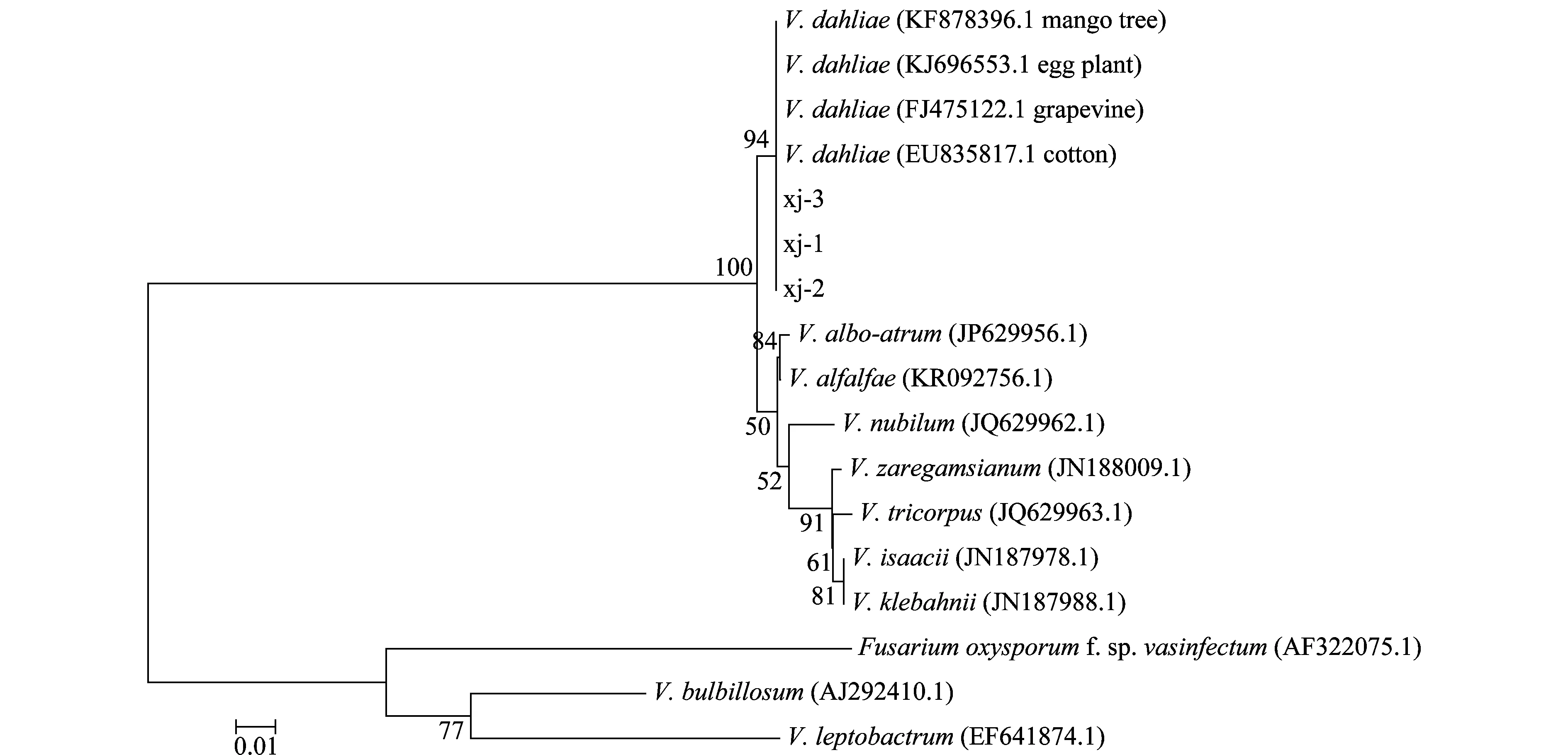
圖3 基于ITS序列構建的系統進化樹Fig.3 Phylogenetic tree based on the ITS sequences
[1] 王兆木, 陳躍華. 紅花及其開發利用[J]. 新疆農業科學, 1995(5): 203-205.
[2] Koike S T.Baameur A, Maruthachalam K, et al.Verticilliumwilt of spineless safflower caused byVerticilliumdahliaein California [J]. Plant Disease, 2012, 96(9): 1383.
[3] 賈菊生,郭輝.新疆幾株黃萎輪枝菌株的形態學鑒定與生物學特征特性比較研究[J].新疆農業大學學報,2006,29(3):73-77.
[4] 馬存. 棉花枯萎病與黃萎病[M]. 北京: 中國農業出版社, 2007: 61-106.
[5] 岳永亮,任毓忠,張莉,等.新疆榆樹黃萎病的鑒定 [J].植物保護,2016,42(2):251-253.
[6] 沈萍, 陳向棟. 微生物學實驗[M].第四版.北京: 高等教育出版社, 2010: 149-151.
[7] Pegg G F, Brady B L.Verticilliumwilts [M]. UK: CABI Publishing, 2002.
[8] 韓宏偉, 劉培源, 吉麗麗, 等. 新疆北部棉區棉花黃萎病菌病原種群致病性分化及變異[J]. 植物保護學報, 2011, 38(2): 121-126.
[9] 韓宏偉, 任毓忠, 劉培源, 等. 新疆南部棉區黃萎病菌種群致病性分化及變異[J]. 棉花學報, 2012, 24(2): 147-152.
(責任編輯:楊明麗)
Identification of the pathogen causingVerticilliumwilt on safflower
Wang Chengcheng, Yue Yongliang, Ren Yuzhong, Zhang Li, Jin Gongxi, Li Guoying
(AgriculturalCollegeofShiheziUniversity,KeyLaboratoryofXinjiangUygurAutonomousRegionforOasisAgriculturalPestManagementandUtilizationofPlantProtectionResource,Shihezi832003,China)
A disease causing leaf yellowing, stunting, and death on safflower was found at the Shihezi University Agricultural Experimental Station and Farm, Xinjiang Uygur Autonomous Region in 2014. Vascular bundles in the stem also became brown. The pathogenicity of the isolates was tested by using the root-dipping method in paper cups with the bottom torn out. The colony morphology, conidiophores, and conidia of the isolates were identical to those ofVerticilliumdahliae. Its rDNA-ITS sequence showed 99% homology with that of China cotton isolate ofV.dahliae(KT803074). It is supposed that this safflower disease was caused byV.dahliae.
safflower;Verticilliumwilt; pathogen identification
2016-01-16
2016-03-25
中小企業創新項目(14C26216513812);石河子科技局項目(2012NY04)
S435.67
A
10.3969/j.issn.0529-1542.2017.01.044
* 通信作者 E-mail: lgyshzu@163.com.

