ADMA/NOS/NO/cGMP通路系統在子癇前期患者母胎界面的表達及意義①
盧 敏 黃珊萍 鄭林媚 許 艷
(海南省人民醫院產科,海口570311)
ADMA/NOS/NO/cGMP通路系統在子癇前期患者母胎界面的表達及意義①
盧 敏 黃珊萍 鄭林媚 許 艷
(海南省人民醫院產科,海口570311)
目的:探討ADMA/NOS/NO/cGMP通路系統在子癇前期患者母胎界面的表達及意義。方法:分別選取重度子癇前期、輕度子癇前期、妊娠期高血壓患者各20例,另選同期行剖宮產的單胎初產健康妊娠婦女20例作為對照。檢測并比較各組胎盤組織NO和cGMP水平、總NOS活性,免疫組化SP法檢測胎盤組織eNOS和iNOS表達。高效液相色譜法檢測各組臍靜脈內皮細胞(Human umbilical vein endothelial cells,HUVECs)內ADMA水平。結果:重度、輕度子癇前期組胎盤組織NO水平分別為(7.6±3.6) μmol/g、(11.4±4.3) μmol/g,均顯著低于對照組(均P<0.05);重度、輕度子癇前期組胎盤組織cGMP水平分別為(3.26±0.31)pmol/g、(4.53±0.42)pmol/g,均顯著低于對照組(均P<0.05),且4組胎盤組織cGMP水平與NO水平呈正相關關系(r=0.672);重度、輕度子癇前期組胎盤組織總NOS活性分別為(10.4±3.0)、(14.8±1.6 )U/mg蛋白質,顯著低于對照組(均P<0.05),4組胎盤組織總NOS活性與NO水平呈正相關關系(r=0.785);重度、輕度子癇前期組胎盤組織eNOS表達顯著低于對照組(均P<0.05),重度子癇前期組iNOS表達顯著高于對照組(P<0.05);重度子癇前期、輕度子癇前期及妊娠期高血壓3組HUVECs內ADMA水平均顯著高于對照組(均P<0.05),且4組患者HUVECs內ADMA水平與胎盤組織NO水平呈負相關關系(r=-0.582)。結論:ADMA/NOS/NO/cGMP通路系統可能在子癇前期的發病中起重要作用。
子癇前期;非對稱二甲基精氨酸;一氧化氮合酶;一氧化氮;環磷酸鳥苷
子癇前期(Preeclampsia,PE)是妊娠期特有的疾病,威脅母嬰健康。在各種發病機制中,免疫遺傳因素,特別是母胎界面的免疫耐受異常是目前的研究熱點[1]。一氧化氮(Nitric oxide,NO)是最重要的內源性血管舒張因子,NO彌散進入血管平滑肌細胞后,可激活產生環磷酸鳥苷(cGMP),啟動一系列胞內生物學過程。一氧化氮合酶(Nitric oxide synthase,NOS)和其主要內源性抑制物非對稱二甲基精氨酸(Asymmetric dimethylarginine,ADMA)在調節NO的表達和活性方面起重要作用。本篇通過研究子癇前期患者ADMA/NOS/NO/cGMP通路系統的表達,探討該通路在子癇前期發病中的作用和意義,以及免疫遺傳因素在其中所起的作用。
1 資料與方法
1.1 一般資料 選取2014年1月至2015年12月在本院產科住院并符合入組條件的孕婦60例,按分類標準分為3組,每組20例。入組條件:符合相應診斷標準,單胎初產婦,剖宮產終止妊娠,排除標準:原發性高血壓、肝腎疾病、心臟疾病,急性炎癥、糖尿病等合并癥,胎盤早剝、前置胎盤等病理妊娠。A組為重度子癇前期組;B組為輕度子癇前期組;C組妊娠期高血壓組。另選行剖宮產分娩的單胎初產健康妊娠婦女20例作為對照組(N組)。診斷和分類標準按人民衛生出版社第七版《婦產科學》。4組在年齡、孕周等方面比較差異無統計學意義(P>0.05)。各組病例均為海南地區漢族居民,無異族通婚史。本研究經本院倫理委員會同意,研究對象均簽署知情同意書。
1.2 實驗方法
1.2.1 標本采集與準備 胎盤標本:胎盤娩出后即刻取胎盤母體面組織2塊(重分別為10 g、2 g),冷鹽水沖洗,其中1塊(10 g)濾紙吸干后準確稱重,置勻漿機中按比例制成10%的組織勻漿,2 000 r/min低溫離心20 min后取上清液,置凍存管中-80℃保存;另1塊置10%福爾馬林溶液中固定備用。臍靜脈內皮細胞(Human umbilical vein endothelial cells,HUVECs):無菌狀態下獲取18~20 cm新生兒臍帶,置4℃滅菌含雙抗的PBS溶液中,4 h內參照常規方法[2]分離HUVECs,然后將其凍存于液氮備用。
1.2.2 NO檢測 采用Griess法測定胎盤組織勻漿NO水平。按照NO檢測試劑盒(南京建成)說明,測定管依次加入待測10%胎盤組織勻漿上清液、反應液振蕩混勻,37℃水浴反應15 min,再加入終止液,紫外分光光度儀在540nm波長處測定OD值。然后根據公式計算出NO2-含量,以此來反映胎盤組織NO水平。
1.2.3 cGMP檢測 取待測10%胎盤組織勻漿,用放射免疫法按照cGMP試劑盒(南京建成)說明,測定NO的第二信使cGMP水平。
1.2.4 胎盤組織總NOS活性測定 采用Griess法測定胎盤組織勻漿NO水平,此即間接代表胎盤組織總NOS活性。按照NOS檢測試劑盒(南京建成)要求,測定管依次加入10%胎盤組織勻漿上清液、反應液振蕩混勻,37℃水浴反應15 min,再加入終止液,分光光度儀在540nm波長處測定OD值。BCA蛋白定量試劑盒(Hycline,USA)測定組織勻漿上清液的蛋白含量。酶的活性定義為每毫克組織蛋白每分鐘生成的1 nmol NO為一個活性單位。
1.2.5 胎盤組織eNOS和 iNOS的表達 采用免疫組化SP法。取各組胎盤標本,包埋、切片、脫蠟,3%過氧化氫滅活內源性酶,修復抗原,加山羊封閉血清,滴加一抗(eNOS 1∶150,iNOS 1∶100),漂洗后依次添加生物素標記二抗(羊抗兔IgG)和SABC試劑,DAB顯色,蘇木素復染。結果判定:參照Fromowitz[3]綜合計分法,以胞漿出現明顯的棕褐色顆粒或胞漿呈棕褐色為陽性,無著色或與背景顏色一致為陰性;隨機選擇5個高倍視野計數細胞總數和陽性細胞數,得出陽性細胞百分率并計分,無陽性細胞為0分,陽性細胞占1~25%為1分,26~49%為2分,≥50%為3分;并根據多數細胞的著色強度計算強度得分,無著色0分,淺棕褐色為1分,棕褐色為2分,深棕褐色為3分;陽性率和強度計分相乘的結果:0~1分為(-),2分為(+),3~4分為(++),6分為(+++),9分(++++)。
1.2.6 測定HUVECs內ADMA水平 取HUVECs解凍復蘇后,培養傳代,鏡下觀察細胞貼壁后,消化收集細胞,離心后取沉淀,加入同體積細胞裂解液,加入5-磺基水楊酸沉淀蛋白,混勻后離心,取上清液,用高效液相色譜(High-performance liquid chromatography,HPLC)法測定ADMA水平(HPLC系統:LC-10Advp;色譜柱:Nova-Pak C18)。取10 μl待測樣品或標準品(Sigma,USA)加入100 μl衍生試劑混勻,室溫下反應3 min后進樣分析。然后用線性梯度洗脫的方式將樣品從色譜柱中洗脫,經預柱處理后,用熒光檢測器對其及內標ADMA進行檢測(激發波長338nm;吸收波長425nm),并比較各組HUVECs內ADMA水平。
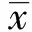
2 結果
2.1 4組患者胎盤組織中NO和cGMP濃度水平 重度子癇前期(A)組、輕度子癇前期(B)組患者胎盤組織NO水平分別為(7.6±3.6) μmol/g、(11.4±4.3) μmol/g,均顯著低于對照(N)組(18.3±3.5) μmol/g(t=2.633、3.857,均P<0.05)。A、B組患者胎盤組織cGMP水平分別為(3.26±0.31)pmol/g、(4.53±0.42)pmol/g,均顯著低于N組(7.26±0.31)pmol/g(t=2.846、3.824,均P<0.05)。4組胎盤組織中cGMP水平與NO水平呈正相關關系(r=0.672)。見表1。
2.2 4組患者胎盤組織總NOS活性測定 重度子癇前期(A)組胎盤組織總NOS活性為(10.4±3.0) U/mg蛋白質,輕度子癇前期(B)組為(14.8±1.6)U/mg蛋白質,妊娠期高血壓(C)組為(17.8±1.6)U/mg,A、B組胎盤組織總NOS活性顯著低于對照(N)組(t=3.157、2.352,均P<0.05),A組胎盤組織總NOS活性也顯著低于B組(t=2.136,P<0.05),見圖1。4組胎盤組織總NOS活性與NO水平呈正相關關系(r=0.785)。
2.3 4組患者胎盤組織eNOS和iNOS的表達 免疫組化切片顯示4組胎盤絨毛血管內皮細胞、絨毛合體滋養細胞和細胞滋養細胞的胞漿中均可見eNOS和iNOS抗原的陽性表達。4組胎盤絨毛血管內皮細胞中的eNOS表達明顯強于合體滋養細胞,而iNOS在絨毛合體滋養細胞中表達較其他細胞更明顯(尤其是重、輕度子癇前期組)。重度子癇前期(A)組、輕度子癇前期(B)組胎盤組織的eNOS表達明顯弱于對照(N)組(χ2=14.29、9.69,P<0.05),見表2。N組、B組及妊娠期高血壓(C)組胎盤各部分組織中iNOS表達均較弱,A組的iNOS表達顯著強于N組(χ2=13.28,P<0.05),見表3。



GroupsnNO(μmol/g)cGMP(pmol/g)Agroup2076±361)326±0311)Bgroup20114±431)453±0421)Cgroup20138±26586±025Ngroup20183±35726±031
Note:Compared to N group,1)P<0.05.
2.4 4組HUVECs內ADMA水平測定 重度子癇前期(A)組、輕度子癇前期(B)組及妊娠期高血壓(C)組3組HUVECs內ADMA水平分別為(3.91±0.27)、(3.08±0.31)、(2.46±0.26 ) μmol/L,與對照(N)組比較均有顯著性差異(t=4.542、3.815、2.808,均P<0.05),見表4。4組患者HUVECs內ADMA水平與胎盤組織NO水平呈負相關關系(r=-0.582)。

圖1 4組胎盤組織總NOS活性比較Fig.1 Activities of total NOS in placenta of four groupsNote: Compared to N group,△.P<0.05.
表2 4組胎盤組織eNOS表達比較
Tab.2 Expression of eNOS in placenta of four groups

Groupsn-++++++++++Agroup1)2067520Bgroup1)2038540Cgroup2024662Ngroup2003683
Note:Compared to N group,1)P<0.05.
表3 4組胎盤組織iNOS表達比較
Tab.3 Expression of iNOS in placenta of four groups

Groupsn-++++++++++Agroup1)2013592Bgroup2065720Cgroup2069320Ngroup2078410
Note:Compared to N group,1)P<0.05.



GroupsnADMA(μmol/L)Agroup20391±0271)Bgroup20308±0311)Cgroup20246±0261)Ngroup20136±012
Note:Compared to N group,1)P<0.05.
3 討論
子癇前期的基本病理變化是全身小血管痙攣,血管內皮細胞的激活與損傷,以及各組織、器官灌流量減少。關于其病因和發病機理,國內外學者進行了大量的研究[4,5],認為可能與遺傳易感性、免疫失衡、胎盤滋養細胞缺血缺氧等原因有關。其中免疫學說和遺傳學說相互影響和滲透,逐漸形成了免疫遺傳學說[6,7],并以免疫遺傳因素,特別是母胎界面的免疫耐受異常作為子癇前期發病的起始因子。我們推測由于母胎界面的免疫耐受異常導致ADMA/NOS/NO/cGMP通路表達的改變,造成胎盤血管舒縮機制的紊亂,胎盤微小血管痙攣或收縮,最終出現子癇前期的病理生理改變。
NO是最重要的內源性血管舒張因子,廣泛存在于血管內皮細胞中,它能抑制血管疾病的關鍵步驟[8,9],如白細胞黏附、血小板聚集、血管平滑肌細胞增生等,也能抑制內皮素等縮血管物質的分泌,在穩定內皮功能、調節母體和胎兒胎盤循環中都起重要作用[10]。內皮細胞功能受損,NO合成不足時,血管收縮、血壓升高、內皮功能不全、血小板聚集、血管平滑肌細胞增生,與子癇前期的病理生理改變極為類似。NO彌散進入血管平滑肌細胞后,可通過激活細胞內的可溶性鳥苷酸環化酶產生cGMP,啟動細胞內一系列蛋白磷酸化反應,發揮舒張血管、調節血壓、保護內皮細胞等廣泛的生理作用[11]。本研究驗證了子癇前期患者胎盤組織中NO水平顯著降低,其降低程度與子癇前期病情輕重密切相關,且胎盤組織中的cGMP水平與NO水平呈正相關關系。
NOS作為NO生成唯一、關鍵的限速因子[12],它和其抑制物對NO生物學功能的發揮起著重要的作用。胎盤是妊娠時內源性NO合成的主要場所,含有大量具有NOS活性的滋養細胞及內皮細胞。NOS有三個亞型[13],分別為內皮型一氧化氮合酶(eNOS)、誘導型一氧化氮合酶(iNOS)、神經型一氧化氮合酶(nNOS),nNOS和eNOS通常參與生理狀態下NO生成,而iNOS病理狀態下可在細胞因子、免疫炎癥等因素作用下產生大量iNOS,進而生成過量的NO發揮毒性效應。本實驗結果顯示妊娠期高血壓組、輕度子癇前期組、重度子癇前期組胎盤組織總NOS活性均低于對照組,且活性依次下降,提示NOS活性降低程度可能與子癇前期病情輕重相關。免疫組化分別研究eNOS和iNOS表達,結果顯示:重度、輕度子癇前期組胎盤組織中eNOS的表達均較對照組明顯下降,推測子癇前期時內皮細胞受損,eNOS活性降低;而重度子癇前期組胎盤組織iNOS表達顯著高于對照組,提示免疫炎癥因素可能參與子癇前期的發病過程。我們推測可能是子癇前期時母胎界面的免疫耐受狀態異常,免疫細胞或因子等被異常激活所致。
ADMA是主要的內源性NOS抑制物,主要由血管內皮細胞產生,其在局部組織和細胞內濃度遠高于血漿中[14],所以本實驗僅檢測HUVECs內ADMA 水平,以判斷其對胎盤組織NOS活性的抑制程度,研究結果顯示重度、輕度子癇前期組及妊娠期高血壓組3組HUVECs內ADMA水平均顯著高于對照組,且HUVECs內ADMA水平與胎盤組織NO水平呈負相關,表明ADMA水平變化可能與子癇前期的發病有關,且其變化程度與病情輕重相關。ADMA可以通過抑制內皮細胞內eNOS活性,減少NO生成,影響內皮依賴性血管舒張功能,被認為是子癇前期早期的預測標志[15]。
有關研究顯示子癇前期患者體內ADMA水平升高與胎盤組織中ADMA水解酶,即二甲基精氨酸二甲胺水解酶(Dimethylarginine dimethylaminohyd-rolase,DDAH)低表達有關[16],胎盤組織中DDAH表達下降,通過調節ADMA代謝,影響eNOS活性,導致NO合成減少。人類主要組織相容性復合體(MHC)是參與移植免疫應答調控的最主要基因系統。而DDAH基因恰好位于MHC Ⅲ區域,有可能在調節宿主防御反應和免疫耐受中發揮重要作用。妊娠是一個半同種異體移植過程,胎兒攜帶父源性基因,卻不被母體免疫細胞識別,此過程有賴于母胎間的免疫耐受,而此免疫耐受異常,則可能引起子癇前期等病理妊娠。
據此,我們推測母胎界面的免疫耐受異常導致位于MHC區域的DDAH基因異常表達和活性改變,通過影響體內ADMA的濃度,調節NOS活性及NO、cGMP水平,從而改變胎盤和全身微小血管的緊張性和內皮細胞功能,造成子癇前期相關病理生理改變。綜上所述,ADMA/NOS/NO/cGMP通路系統可能在子癇前期病因和發病機理中的起著重要作用。今后,有待進一步明確DDAH的表達和調控機制,以完善該通路理論。
[1] Wang A,Rana S,Karumanchi SA.Preeclampsia:the role of angiogenic factors in its pathogenesis[J].Physiology (Bethesda),2009,24(6):147-158.
[2] 朱晨輝,范代娣,薛文嬌,等.臍靜脈內皮細胞的提取與形態學觀察[J].西北大學學報(自然科學版),2009,39(5):809-812.
[3] Fromowitz FB,Viola MV,Chao S,etal.ras p21 expression in the progression of breast cancer[J].Hum Pathol,1987,18(12):1268-1275.
[4] Zhang Z,Li Y,Zhang LL,etal.Association of 14 bp insertion/deletion polymorphism of the HLA-G gene in father with severe preeclampsia in Chinese[J].Tissue Antigens,2012,80(2):158-164.
[5] Salustiano EM,De Pinho JC,Provost K,etal.Maternal serum hormonal factors in the pathogenesis of preeclampsia[J].Obstet Gynecol Surv,2013,68(2):141-150.
[6] Pendeloski KP,Sass N,Torloni MR,etal.Immunoregulatory gene polymorphisms in women with preeclampsia[J].Hypertens Res,2011,34(3):384-388.
[7] Williams PJ,Morgan L.The role of genetics in pre-eclampsia and potential pharmacogenomic interventions[J].Phar Mgenomics Pers Med,2012,5:37-51.
[8] Matsubara K,Higaki T,Matsubara Y,etal.Nitric oxide and reactive oxygen species in the pathogenesis of preeclampsia[J].Int J Mol Sci,2015,16(3):4600-4614.
[9] Saha T,Halder M,Das A,etal.Role of nitric oxide,angiogenic growth factors and biochemical analysis in preeclampsia[J].Indian J Biochem Biophys,2013,50(5):462-466.
[10] Johal T,Lees CC,Everett TR,etal.The nitric oxide pathway and possible therapeutic options in pre-eclampsia[J].Br J Clin Pharmacol,2014,78(2):244-257.
[11] Wang L,Yang T,Ding Y,etal.Chemerin plays a protective role by regulating human umbilical vein endothelial cell-induced nitric oxide signaling in preeclampsia[J].Endocrine,2015,48(1):299-308.
[12] Scatena R,Bottoni P,Pontoglio A,etal.Pharmacological modulation of nitric oxide release:new pharmacological perspectives,potential benefits and risks[J].Curr Med Chem,2010,17(1):61-73.
[13] Zawiejska A,Wender-Ozegowska E,Iciek R,etal.Concentrations of endothelial nitric oxide synthase,angiotensin-converting enzyme,vascular endothelial growth factor and placental growth factor in maternal blood and maternal metabolic status in pregnancy complicated by hypertensive disorders[J].J Hum Hypertens,2014,28(11):670-676.
[14] Laskowska M,Laskowska K,Terbosh M,etal.A comparison of maternal serum levels of endothelial nitric oxide synthase,asymmetric dimethylarginine,and homocysteine in normal and preeclamptic pregnancies[J].Med Sci Monit,2013,19(5):430-437.
[15] Masoura S,Kalogiannidis IA,Gitas G,etal.Biomarkers in pre-eclampsia:a novel approach to early detection of the disease[J].J Obstet Gynaecol,2012,32(7):609-616.
[16] Anderssohn M,Maass LM,Diemert A,etal.Severely decreased activity of placental dimethylarginine dimethyla minohydrolase in pre-eclampsia[J].Eur J Obstet Gynecol Reprod Biol,2012,161(2):152-156.
[收稿2016-07-24 修回2016-10-10]
(編輯 張曉舟)
Expression and significance of ADMA/NOS/NO/cGMP pathway in maternal-fetal interface of patients with preeclampsia
LUMin,HUANGShan-Ping,ZHENGLin-Mei,XUYan.
DepartmentofObstetrics,HainanGeneralHospital,Haikou570311,China
Objective:To study the expression and significance of ADMA/NOS/NO/cGMP pathway in the maternal-fetal interface of patients with preeclampsia.Methods: 60 patients were selected and divided into severe preeclampsia group,mild preeclampsia group and gestational hypertensive group according to the disease condition,meanwhile 20 healthy pregnant women of singleton receiving cesarean section were chosen as control group.Levels of NO and cGMP in placenta of the four groups were detected and compared,and activities of total NOS in placenta were measured and compared.The expression of eNOS and iNOS in placental tissue was detected by immunohistochemistry SP method.High-performance liquid chromatography was used to detect the level of ADMA in HUVECs.Results: The levels of NO in placenta of severe and mild preclampsia groups were (7.6±3.6) and (11.4±4.3) μmol/g,which were statistically significantly lower than that in control group(P<0.05).The levels of cGMP in placenta of severe and mild preclampsia groups were (3.26±0.31) and (4.53±0.42)pmol/g,which were aslo significantly lower than that in control group(P<0.05).In the four groups,the level of cGMP in placenta was positively correlated with the level of NO in placenta(r=0.672).The activities of total NOS in placenta of severe and mild preeclampsia groups were (10.4±3.0)and (14.8±1.6)U/mg protein,which were statistically significantly lower than that in control group(P<0.05).In placenta of the four groups,the activity of total NOS was positively correlated with the level of NO(r=0.785).The expression of eNOS in placenta of severe and mild preeclampsia groups was statistically significantly lower than that in control group(P<0.05),the expression of iNOS in severe preeclampsia group was significantly higher than that in the control group(P<0.05).The levels of ADMA in HUVECs of severe preeclampsia group,mild preeclampsia group and gestational hypertensive group were statistically significantly higher than that in the control group(P<0.05).The level of ADMA in HUVECs was negatively correlated with the level of NO in placenta of the four groups(r=-0.582).Conclusion: ADMA/NOS/NO/cGMP pathway may play an important role in the pathogenesis of preeclampsia.
Preeclampsia;Asymmetric dimethylarginine;Nitric oxide synthase;Nitric oxide;cGMP
10.3969/j.issn.1000-484X.2017.01.019
①本文受海南省自然科學基金(瓊科814320)、海南省衛生廳普通科研項目(瓊衛13A210303)資助。
盧 敏(1978年-),女,碩士,副主任醫師, 主要從事病理產科基礎與臨床研究,E-mail: qiyoufei@aliyun.com。
R714.7
A
1000-484X(2017)01-0094-05