Thermotoga neapolitana中α-半乳糖苷酶基因的克隆表達與酶學性質研究
畢云楓,徐琳琳,姜 珊,李 娜,王溪竹,王玉華*
(吉林農業大學食品科學與工程學院,吉林長春130118)
Thermotoga neapolitana中α-半乳糖苷酶基因的克隆表達與酶學性質研究
畢云楓,徐琳琳,姜 珊,李 娜,王溪竹,王玉華*
(吉林農業大學食品科學與工程學院,吉林長春130118)
將新阿波羅棲熱袍菌(Thermotoga neapolitana)的耐熱α-半乳糖苷酶基因經PCR擴增,以pET-28a為表達載體,轉化至大腸桿菌(Escherichia coli)BL21(DE3)中進行表達,用0.8 mmol/L的異丙基-β-D-硫代半乳糖苷(IPTG)誘導,采用超聲波細胞破碎菌體得到α-半乳糖苷酶。通過十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)的方法獲得α-半乳糖苷酶的分子質量約為35 ku。并對α-半乳糖苷酶的酶學性質進行研究,結果表明:該α-半乳糖苷酶的最適反應溫度為85℃;最適反應pH值為5.0;在金屬離子對酶活影響的研究中發現Al3+、Na+、K+、Ca2+、Mg2+、Zn2+、Co2+對酶活起到促進作用,Cu2+、Fe2+、Ag2+、Mn2+、Ni2+的終濃度達到100 mmol/L時對酶活有較強的抑制作用;具有較好的熱穩定性,在95℃處理38 h后仍具有50%的活性。
α-半乳糖苷酶;基因克隆;表達;酶學性質
α-半乳糖苷酶(α-galactosidase,α-gal)又稱α-D-半乳糖苷水解酶、α-D-半乳糖苷酶A、蜜二糖酶。屬外切糖苷酶,是水解酶的一種。α-半乳糖苷酶具有較強的水解能力,可催化水解α-D-半乳糖苷末端非還原性α-D-半乳糖殘基,包括半乳糖寡糖、半乳甘露聚糖和半乳糖脂,也可水解蜜二糖、棉子糖、水蘇糖[1-2]。α-半乳糖苷酶在自然界分布較為廣泛,常存在于動物、植物及微生物中,主要應用在食品加工、飼料生產、醫藥研發等。由于豆類植物中含有α-半乳糖苷,這種含糖衍生物被人和動物攝食到體內后很難消化,易引起脹氣、腹瀉等癥狀,影響人和動物對營養物質的吸收,而α-半乳糖苷酶的水解特性恰好能夠降解豆類植物中的α-D-半乳糖苷,利于人和動物對豆類植物中營養物質的吸收,工業中常將α-半乳糖苷酶用于豆類食品的加工及飼料生產中用來改善抗營養因子,促進動物生長[3-5]。有研究報到α-半乳糖苷酶可改變紅血球類型,人類常見的血液類型有A、B、AB、O型,其中,O型為通用血型,而B型與O型的區別在于B型紅細胞膜表面糖鏈末端連接α-半乳糖苷,因此,可利用α-半乳糖苷酶將B型糖鏈末端的α-半乳糖苷水解掉,實現B→O血型的轉變,在制備通用血型時α-半乳糖苷酶可作為血型轉變的工具酶[6-7]。現代醫學研究表明,α-半乳糖苷酶可用于治療由于α-半乳糖苷酶A缺乏而引起糖鞘脂代謝障礙的法布里病,在治療中α-半乳糖苷酶可彌補先天缺陷,改善患者全身脂質的代謝[8-9]。對α-半乳糖苷酶的研究還涉及到產α-半乳糖苷酶的菌株來源、酶學性質及應用研究等[10-12],但普遍酶反應溫度較低,難以適應實際應用。
新阿波羅棲熱袍菌(Thermotoga neapolitana)是一種超嗜熱菌,可用于發酵制氫[13-14],經培養后可產多種嗜熱酶(如α-葡萄糖苷酶、纖維素酶、直鏈淀粉酶、木聚糖酶等),這些酶由于具有較強的耐熱性而具有廣泛的應用前景[15-16]。目前,對于耐熱酶的研究較多,耐熱酶因其特殊的酶學性質而具有廣泛的應用前景,耐熱酶來源的原始菌株多為嗜熱菌和超嗜熱菌,這些嗜熱菌的培養條件極為苛刻,因此,通過基因克隆和基因重組的手段使得高溫酶的基因片段在常溫菌中表達,可實現大規模培養并可大量獲得所需高溫酶。因此,本研究從新阿波羅棲熱袍菌(Thermotoga neapolitana)DSM4359中獲取α-半乳糖苷酶基因片段,利用基因重組手段以pET-28a為載體,通過大腸桿菌(Escherchia coil)BL21(DE3)進行表達,得到新型α-半乳糖苷酶,并對該α-半乳糖苷酶的酶學性質進行研究,旨在得到具有較高反應溫度及較強耐熱性的α-半乳糖苷酶,為大規模工業生產提供理論參考。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株和載體
新阿波羅棲熱袍菌(Thermotoga neapolitana)DSM4359由Laura Dipasquale教授惠贈,大腸桿菌(Escherichia coli)BL21(DE3)及質粒pET-28a由本實驗室保存。
1.1.2 主要試劑
細菌基因組DNA提取試劑盒,高純質粒小量制備試劑盒:北京百泰克生物技術有限公司;十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳制備試劑盒:北京博特森生物技術有限公司;酵母浸粉、胰蛋白胨、瓊脂粉:英國OXOID公司;氯化鈉、碳酸鈉、乙酸、乙酸鈉、檸檬酸、檸檬酸鈉、磷酸氫二鈉、磷酸二氫鈉、氫氧化鈉、鹽酸:北京化工廠;硫酸卡那霉素(kanamycin sulfate):北京Solarbio科技有限公司;異丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、咪唑:美國Genview公司;考馬斯亮藍R-250:上海化學試劑有限公司;三羥甲基氨基甲烷(Tris)、甘氨酸(Gly)、4-硝基苯基-β-D-吡喃葡萄糖苷、對硝基苯-α-D-葡萄糖吡喃苷、對-硝基苯酚(p-nitrophenol,pNP):北京鼎國昌盛生物技術有限公司;乳糖、蔗糖、海藻糖、麥芽糖、松二糖、纖維二糖、明串珠菌二糖、龍膽二糖、曲二糖、昆布二糖、蔗糖、甘露聚糖、普魯蘭多糖、羧甲基纖維素(carboxymethylcellulose,CMC)、昆布糖、木聚糖、纖維素、凝膠多糖、淀粉、菊糖、4-硝基苯基-α-D-吡喃半乳糖苷、4-硝基苯基-β-D-吡喃半乳糖苷、4-硝基苯基-α-D-吡喃甘露糖苷、4-硝基苯基-β-D-吡喃甘露糖苷、4-硝基苯基-α-L-吡喃巖藻糖苷、4-硝基苯基-β-D-吡喃巖藻糖苷、4-硝基苯基-β-D-吡喃木糖苷、4-硝基苯基-α-L-吡喃鼠李糖苷、4-硝基苯基-α-L-吡喃阿拉伯糖苷:北京百靈威科技有限公司。
1.1.3 培養基
LB培養基:酵母浸粉5 g/L,胰蛋白胨1.0 g/L,NaCl 1.0 g/L,固體培養基添加15 g/L瓊脂粉,NaOH調節pH至7,120℃、20 min高壓滅菌。
1.2 儀器與設備
FA1204B電子天平:上海佑科儀器儀表有限公司;Red-96G型PCR擴增儀:上海山富科學儀器有限公司;DYY-11型電泳儀:北京市六一儀器廠;WMW-02型電熱恒溫培養箱:湖北省黃石市醫療器械廠;KYC-100B空氣恒溫搖床:上海新苗醫療器械制造有限公司;JYP2-Ⅱ超聲波細胞破碎儀:寧波新芝生物科技股份有限公司;GL-16G-Ⅱ高速冷凍離心機:上海安亭科學儀器廠;UV-1800紫外分光光度計:日本島津公司。
1.3 方法
1.3.1 α-半乳糖苷酶工程菌的構建
根據GeneBank數據庫中公布α-半乳糖苷酶信息設計并合成引物。上游引物:5′-CGCGGCAGCCATATGGCTAGCATGGAGATCTTCAAAAGA-3′,內切酶為NheⅠ;下游引物:3′-TTGTCGACGGAGCTCGAATTCTCATTCTC TCTCACCCTCTTCGTAG-5′,內切酶為EcoRⅠ。以源于新阿波羅棲熱袍菌(Thermotoga neapolitana)DSM4359的基因組為模板,利用上下游引物對目的基因進行聚合酶鏈反應(polymerase chain reaction,PCR)擴增,PCR反應體系:10×PCR buffer 2.5 μL、脫氧核苷三磷酸(deoxynucleside triphosphate,dNTP)2 μL、上游引物1 μL、下游引物1 μL、Taq酶1 μL、脫氧核糖核酸(deoxyribonucleic acid,DNA)模板1 μL、雙蒸水17.5 μL。將總25 μL的反應體系稍加離心使各成分混合均勻后立即進行PCR,95℃預變性5 min后進入循環階段:94℃變性40 s,58℃退火30 s,在72℃下延伸60s,循環階段循環3次,最后在72℃延伸7min。用NheⅠ和EcoRⅠ對PCR產物進行雙酶切,后切膠回收并對目的基因進行純化,利用DNA連接酶將α-半乳糖苷酶基因與pET-28a載體質粒進行連接,15℃連接12 h。將重組載體質粒送至生工生物工程(上海)股份有限公司處進行測序并對結果進行測定。
將重組后的質粒轉化至感受態細胞Escherchia coil BL21(DE3)中,涂布于硫酸卡那霉素抗性的LB固體培養基上,37℃培養12 h,篩選陽性菌落,于LB液體培養基中培養12 h,即得到α-半乳糖苷酶的工程菌。
1.3.2 工程菌中α-半乳糖苷酶的誘導表達
將構建好的工程菌在硫酸卡那霉素抗性的LB固體培養基上進行培養,在37℃恒溫培養箱中恒溫培養12 h。挑取活化后的單菌落于硫酸卡那霉素抗性的LB液體培養基中培養12 h,繼續接入已滅菌的LB液體培養基進行誘導培養,接菌量為2%,菌體培養至吸光度值OD600nm為0.4~0.5,加入0.8 mmol/L的IPTG進行誘導,6 h后取出7 000 r/min離心15 min,收集菌體,用pH值為5.0,濃度為50 mmol/L的乙酸(HAc)-乙酸鈉(NaAc)緩沖溶液懸浮菌體,在冰水浴下進行超聲波細胞破碎(400 W,超聲時間3 s,間隔時間5 s,90次),破碎后細胞液6 000 r/min離心10 min,收集上清液即為α-半乳糖苷酶。
1.3.3 α-半乳糖苷酶的純化及分子質量確定
用His TrapTM HP柱對目的蛋白α-半乳糖苷酶進行純化。純化條件:結合緩沖溶液(磷酸鈉20 mmol/L、NaCl 0.5mol/L、咪唑20mmol/L),洗脫緩沖溶液(磷酸鈉20mmol/L、NaCl0.5mol/L、咪唑500mmol/L),收集洗脫液,置于D25mm透析袋(截流分子質量6 000~8 000 u)中,放入pH 7.5的Tris-HCl透析液中透析12 h,聚乙二醇除去多余水分,10%的十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)測定蛋白分子質量。
1.3.4 α-半乳糖苷酶底物特異性
α-半乳糖苷酶對底物具有高度的專一性,很少會產生副產物。試驗所選取的底物有二糖、多糖以及糖苷(見表1),通過試驗確定α-半乳糖苷酶最佳底物。

表1 α-半乳糖苷酶受試底物Table 1 Tested substrates ofα-galactosidase
1.3.5 α-半乳糖苷酶酶活的測定
配制200 μL酶反應體系:10 μLα-半乳糖苷酶粗酶液,10μL4-硝基苯基-α-D-吡喃半乳糖苷,180μL50mmol/L HAc-NaAc緩沖溶液(pH 5.0)。65℃水浴反應20 min,加入400 μL濃度為1 mol/LNa2CO3終止反應,于波長410 nm處測定吸光度值。按照pNP的標準曲線回歸方程y=0.08889x+ 0.302 63計算α-半乳糖苷酶活。α-半乳糖苷酶酶活定義:每分鐘產生1 μmol對-硝基苯酚(p-nitrophenol,pNP)的酶的量為一個酶活單位(U)。
1.3.6 α-半乳糖苷酶的酶學性質
(1)α-半乳糖苷酶最適反應溫度
設定α-半乳糖苷酶反應溫度條件:45℃、55℃、65℃、75℃、85℃、95℃,按1.3.4中的方法配制好反應體系,水浴反應20 min后,加入反應體系2倍體積的Na2CO3濃度為1 mol/L終止反應,于波長410 nm處測定吸光度值,同時做空白對照組,以測定的最高酶活為100%,計算其他相對酶活。
(2)α-半乳糖苷酶最適反應pH值
設定α-半乳糖苷酶反應pH值范圍為pH 3.0~11.0。配制緩沖溶液:檸檬酸-檸檬酸鈉pH 3.0-5.0,HAc-NaAc pH 5.0~6.0,磷酸氫二鈉-磷酸二氫鈉pH 6.0~8.0,Tris-HCl pH 8.0~9.0,Gly-NaOH pH 9.0~11.0。按1.3.4中描述的方法配制反應體系,以測定最高酶活為100%,計算其他相對酶活。
(3)金屬離子對α-半乳糖苷酶的影響
選取金屬離子Mg2+、Na+、Cu2+、Ag+、Ni2+、Ca2+、Al3+、K+、Mn2+、Zn2+、Fe2+、Co2+,按1.3.4中的方法配制酶反應體系,其中酶的量與底物的量不變,減少緩沖溶液的量,加入金屬離子,使每種金屬離子在反應體系中的終濃度為1mmol/L、10 mmol/L、100 mmol/L。以測定的最高酶活為100%,計算其他相對酶活。
(4)α-半乳糖苷酶的熱穩定性
選取溫度75℃、85℃、95℃進行α-半乳糖苷酶的熱穩定性試驗,將α-半乳糖苷酶在選取的試驗溫度下進行保溫處理,每1 h取樣一次,按1.3.4中的方法配制反應體系,以測定的最高酶活為100%,計算其他相對酶活。
2 結果與分析
2.1 α-半乳糖苷酶的分子質量
α-半乳糖苷酶的SDS-PAGE測定結果見圖1。由圖1可知,α-半乳糖苷酶可在宿主菌中表達,分子質量約為35ku。
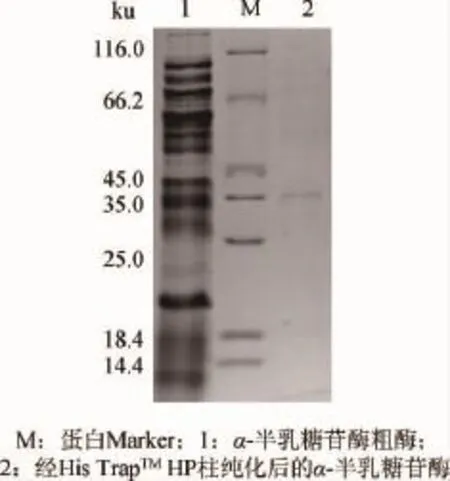
圖1 α-半乳糖苷酶的分子質量SDS-PAGE測定結果Fig.1 SDS-PAGE determination results of molecular mass of α-galactosidase
2.2 α-半乳糖苷酶底物特異性
α-半乳糖苷酶分別以二糖、多糖以及糖苷為特異性底物進行反應,得到α-半乳糖苷酶的底物特異性結果見表2。
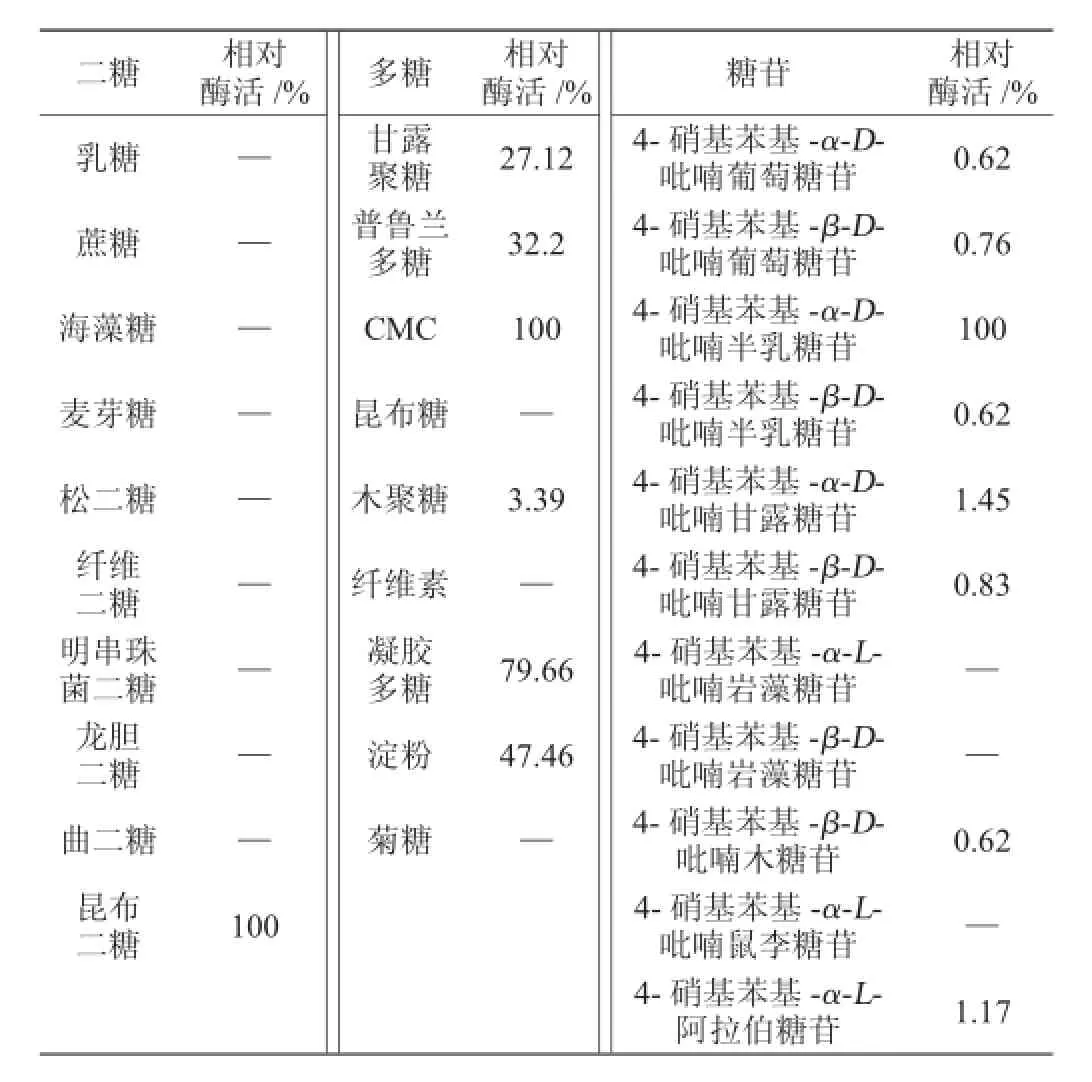
表2 α-半乳糖苷酶的底物特異性Table 2 Substrate specificity ofα-galactosidase
由表2可知,4-硝基苯基-α-D-吡喃半乳糖苷作為顯色底物,可被半乳糖苷酶降解為半乳糖和黃色的對-硝基苯酚(pNP),經酶解后顯色十分明顯,且實驗方法簡便,實驗成本低,因此選用4-硝基苯基-α-D-吡喃半乳糖苷為底物。根據pNP的標準曲線回歸方程計算α-半乳糖苷酶的酶活力為5.819 U/mL。
2.3 α-半乳糖苷酶的酶學性質
2.3.1 α-半乳糖苷酶的最適反應溫度
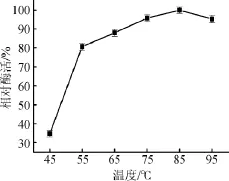
圖2 α-半乳糖苷酶最適反應溫度Fig.2 Optimal reaction temperature ofα-galactosidase
由圖2可知,在反應體系相同條件下,α-半乳糖苷酶的酶活力隨著所在的反應體系溫度的上升而上升,當反應溫度達到85℃時,α-半乳糖苷酶的酶活力達到最大值100%,隨著反應溫度的繼續上升,α-半乳糖苷酶的酶活略有下降。由此可得,α-半乳糖苷酶的最適反應溫度為85℃。
2.3.2 α-半乳糖苷酶的最適反應pH值
由圖3可知,α-半乳糖苷酶的酶活力隨反應環境pH值的變化而有所改變,反應環境的起始pH值為3.0時,α-半乳糖苷酶的相對酶活為55.75%;當pH值在3.0~5.0范圍,α-半乳糖苷酶的酶活力隨反應環境pH值的增加而逐漸增大;當pH值為5.0時,酶活力達到最大值100%;當酶反應環境pH值>5.0之后,α-半乳糖苷酶反應活力逐漸下降。因此,α-半乳糖苷酶的最適pH值為5.0。
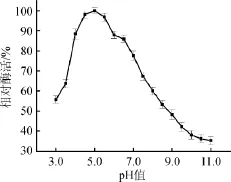
圖3 α-半乳糖苷酶最適反應pH值Fig.3 Optimal reaction pH ofα-galactosidase
2.3.3 金屬離子對α-半乳糖苷酶的影響
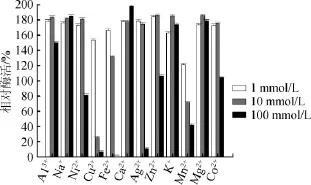
圖4 金屬離子對α-半乳糖苷酶的影響Fig.4 Effect of metal ions onα-galactosidase
由圖4可知,不同金屬離子以及同種金屬離子的不同濃度對酶活有不同的影響。在實驗選取的12種金屬離子中Al3+、Na+、K+、Ca2+、Mg2+、Zn2+、Co2+在設定的三種濃度梯度下均對α-半乳糖苷酶具有不同程度的促進作用,其中Ca2+的終濃度達到100 mmol/L時α-半乳糖苷酶的活力提升約2倍;當濃度為10 mmol/L時Cu2+和Mn2+對酶活具有明顯的抑制作用;而Cu2+、Fe2+、Ag2+、Mn2+、Ni2+這五種金屬離子濃度為1mmol/L可促進α-半乳糖苷酶的活力,當終濃度達到100 mmol/L時可明顯抑制α-半乳糖苷酶的活力,尤其Fe2+濃度達到100mmol/L時,幾乎完全抑制α-半乳糖苷酶的活力。
2.3.4 α-半乳糖苷酶的熱穩定性
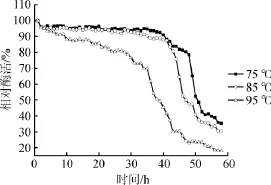
圖5 α-半乳糖苷酶的熱穩定性Fig.5 Thermal stability of α-galactosidase
由圖5可知,試驗選取的三個溫度梯度進行保溫處理,隨著保溫時間的延長,α-半乳糖苷酶的酶活力保持相對的穩定性,其中75℃和85℃的趨勢在保溫時間達到45 h時,酶活力開始明顯下降,當保溫時間達到50 h時,α-半乳糖苷酶仍具有50%的酶活力;而95℃保溫處理的α-半乳糖苷酶熱穩定性較差,在30 h以后酶活力開始明顯下降,當保溫時間超過38 h以后酶活力<50%。由此可見,經基因重組構建后得到的新α-半乳糖苷酶具有較好的熱穩定性。
3 結論
本研究將源于嗜熱菌新阿波羅棲熱袍菌(Thermotoga neapolitana)DSM4359的半乳糖苷酶耐熱基因片段經基因重組的方法成功構建耐熱型α-半乳糖苷酶,在對α-半乳糖苷酶底物特異性選擇中,篩選出最佳反應底物4-硝基苯基-α-D-吡喃半乳糖苷,由HisTrapTMHP純化后的α-半乳糖苷酶經SDS-PAGE檢測到分子質量約為35 ku。酶學性質的試驗結果顯示,這種新α-半乳糖苷酶的最適反應溫度為85℃,與其他研究報道中提到的α-半乳糖苷酶的最適反應溫度相比較高,且熱穩定性極強[17-18];最適反應pH值為5.0,該最適pH值可以保證α-半乳糖苷酶在豆制品加工中不受環境影響,提高降解豆制品中的棉子糖等抗營養因子的程度,使得豆制品的吸收利用率得以提高[19-20];100 mmol/L的Ca2+對α-半乳糖苷酶酶活具有極大的促進作用,可使α-半乳糖苷酶酶活提升近2倍,100 mmol/L的Fe2+可幾乎完全抑制α-半乳糖苷酶酶活。結果表明,本研究得到的新型α-半乳糖苷酶具有較好的酶學性能,因此應用前景可觀。
[1]郝桂娟,張凱,王學智,等.α-半乳糖苷酶的研究進展[J].中國畜牧獸醫,2013,40(3):149-154.
[2]YU J H,GUO T T,XUE R G,et al.A protease-resistant α-galactosidase fromPleurotus citrinopileatuswith broad substrate specificity and good hydrolytic activity on raffinose family oligosaccharides[J].Process Biochem,2016,51(4):491-499.
[3]YAN Y C,ERIC M X,ALMA D T,et al.The pH-dependent protection ofα-galactosidase activity by proteins against degradative enzymes during soymilkin vitrodigestion[J].LWT-Food Sci and Technol,2016,6 (69):244-250.
[4]林謙,蔣桂韜,張旭,等.不同水平α-半乳糖苷酶對1~21日齡愛拔益加肉雞生長性能的影響及相關機理研究[J].動物營養學報,2015,27(8):2466-2475.
[5]蔣小豐,戴求仲,蔣桂韜,等.α-半乳糖苷酶對斷奶仔豬生產性能、血液生化指標和營養物質消化率的影響[J].家畜生態學報,2009,30(6):44-49.
[6]MARTIN L O.SI14 stripped red cells-efforts to eliminate A and B antigens from the blood supply[J].Transfusion Med,2006,16(s1):9-19.
[7]MARTIN L O,HENRIK C.Modifying the red cell surface:towards an ABO-universal blood supply[J].Br J Haematol,2008,140(1):3-12.
[8]JARMILA L,VINCENZO D,ROCCO L,et al.Characterization of human dermal fibroblasts in Fabry disease[J].J Cell Physiol,2016,231(1): 192-203.
[9]OZELSANCAK R,UYAR B.p.R301X mutation and variable phenotypic appearance of Fabry disease[J].Am J Case Rep,2016,17(5):315-319.
[10]辛永平,孔文濤,陸文偉,等.Paenibacillussp.K1α-半乳糖苷酶酶學性質[J].山東大學學報:理學版,2015,50(1):50-55.
[11]DANIEL L F,VAL RIA M G,MARISA V Q,et al.Covalent immobilization ofα-galactosidase fromPenicillium griseoroseumand its application in oligosaccharides hydrolysis[J].Appl Biochem Biotechnol, 2009,158(3):540-551.
[12]林謙,蔣桂韜,張旭,等.飼料添加α-半乳糖苷酶對AA肉雞屠宰性能及血清生化、激素指標的影響[J].家畜生態學報,2016,37(3):27-33.
[13]NIRAKAR P,LAURA D,GIULIANA D,et al.Kinetic modeling of fermentative hydrogen production byThermotoga neapolitana[J].Int J Hydrogen Energy,2016,41(9):4931-4940.
[14]馬詩淳,羅輝,尹小波,等.厭氧產氫微生物研究進展[J].微生物學通報,2009,38(8):1244-1252.
[15]SO Y J,JIN S K,KYOUNG H C,et al.Structure of a novelα-amylase AmyB fromThermotoga neapolitanathat produces maltose from the nonreducing end of polysaccharides[J].Acta Crystallogr,2013,69(3): 442-450.
[16]OKAZAKI F,NAKASHIMA N,OGINO C,et al.Biochemical characterization of a thermostable β-1,3-xylanase from theHyperthermophilic eubacterium,Thermotoga neapolitanastrain DSM 4359[J].Appl Microbiol Biotechnol,2012,97(15):6749-6757.
[17]NAIDU R B,RISHIKESH K G,KAMINI N R.Production ofα-galactosidase fromAspergillus foetidusMTCC 6322 by solid state fermentation and its application in soymilk hydrolysis[J].Indian J Exp Biol, 2016,54(1):72-75.
[18]李麗滿,易戈,韋陽道,等.Neosartorya fischeri α-半乳糖苷酶酶學性質的研究[J].飼料研究,2016(8):40-44.
[19]WANG H M,SHI P J,LUO H Y,et al.A thermophilicα-galactosidase fromNeosartorya fischeriP1 with high specific activity,broad substrate specificity and significant hydrolysis ability of soymilk[J].Bioresour Technol,2014,153(2):361-364.
[20]VAL RIA M G,SEBASTIO T D R,MAURILIO A M,et al.Characterization ofα-galactosidases from germinating soybean seed and their use for hydrolysis of oligosaccharides[J].Phytochemistry,2001,58(1): 67-73.
Cloning and expression of α-galactosidase gene fromThermotoga neapolitanaand α-galactosidase property
BI Yunfeng,XU Linlin,JIANG Shan,LI Na,WANG Xizhu,WANG Yuhua*(College of Food Science and Engineering,Jilin Agriculture University,Changchun 130118,China)
The heat resistant α-galactosidase gene fromThermotoga neapolitanawas amplified by PCR.Using the pET-28a as expression vector,the gene was converted into(Escherichia coli)BL21(DE3)and expressed.After 0.8 mmol/L isopropylthio-β-D-galactoside(IPTG)inducing,the modifiedE.coilcell was broken by ultrasonic wave and α-galactosidase was gotten.The molecular mass of α-galactosidase was about 35 ku by SDS-PAGE.The α-galactosidase property was researched.The results showed that the optimal reaction temperature of α-galactosidase was 85℃,the optimal reaction pH was 5.0.Al3+,Na+,K+,Ca2+,Mg2+,Zn2+,and Co2+had a promoting effect on α-galactosidase activity.Cu2+,Fe2+,Ag2+,Mn2+,and Ni2+had a strong inhibiting effect on α-galactosidase activity when the final concentration reached 100 mmol/L.The α-galactosidase had good thermal stability and still had 50%activity at 95℃for 38 h.
α-galactosidase;gene cloning;expression;characterizations enzyme property
TS261.1
0254-5071(2017)01-0061-05
10.11882/j.issn.0254-5071.2017.01.012
2016-10-28
吉林省教育廳“十二五”科學技術研究項目(吉教科合字[2015]第207號);吉林省科技廳科技創新人才培育計劃項目(201405 19011JH);吉林省科技廳科技成果轉化計劃項目(20130302017NY)
畢云楓(1976-),男,副教授,博士,研究方向為食品酶學。
*通訊作者:王玉華(1972-),女,教授,博士,研究方向為食品微生物學及功能性食品。

