pH對肌原纖維蛋白及其熱誘導凝膠非共價鍵作用力與結構的影響
張興,楊玉玲,馬云,王靜宇
(南京財經大學食品科學與工程學院/江蘇省現代糧食流通與安全協同創新中心/江蘇高校糧油質量安全控制及深加工重點實驗室,南京 210023)
pH對肌原纖維蛋白及其熱誘導凝膠非共價鍵作用力與結構的影響
張興,楊玉玲,馬云,王靜宇
(南京財經大學食品科學與工程學院/江蘇省現代糧食流通與安全協同創新中心/江蘇高校糧油質量安全控制及深加工重點實驗室,南京 210023)
【目的】研究pH對雞肉肌原纖維蛋白熱誘導凝膠非共價鍵作用力和結構的影響,揭示凝膠非共價鍵作用力與結構之間的關系。【方法】活AA雞宰殺,提取雞胸肉肌原纖維蛋白,配制不同pH(5.0、5.5、6.0、6.5、7.0)的肌原纖維蛋白溶液并制成熱誘導凝膠,運用Zeta電位儀測定肌原纖維蛋白凝膠分子表面的電位值來表征靜電相互作用;利用拉曼光譜儀測定肌原纖維蛋白凝膠I760/I1003反映疏水相互作用變化,I850/I830反映凝膠氫鍵變化,并通過分析酰胺帶I最大峰的波數計算蛋白和凝膠的二級結構含量;用粒度儀測定肌原纖維蛋白粒徑大小和分布情況;用掃描電鏡觀察凝膠微觀結構。【結果】pH由7.0降至5.0,肌原纖維蛋白熱誘導凝膠的Zeta電位值從-17.87顯著變化到-0.263(P<0.05),表明肌原纖維蛋白凝膠分子表面所帶負電荷急劇減少,靜電斥力顯著減弱;歸一化強度I760/I1003比值由0.86逐漸增大到0.927,表明肌原纖維蛋白中色氨酸包埋程度增加,凝膠分子間的疏水相互作用增強;歸一化強度I850/I830比值從1.039減小至0.987,表明肌原纖維蛋白酪氨酸殘基苯環上-OH與水分子生成的氫鍵逐漸減少、與蛋白質上其他基團生成的氫鍵逐漸增加,即蛋白分子間的氫鍵作用增強,蛋白與水的作用減弱。pH由7.0降至6.5,肌原纖維蛋白熱誘導凝膠的α-螺旋含量從59.96%降低到55.24%(P<0.05),β-折疊含量從15.83%顯著增加到19.44%(P<0.05),β-轉角和無規則卷曲含量都顯著增加(P<0.05);pH 在6.5—6.0時,各種結構含量變化都不顯著(P>0.05);pH 在6.0—5.0時,肌原纖維蛋白熱誘導凝膠的α-螺旋含量從51.61%降低到16.76%(P<0.05),β-折疊含量從22.23%顯著增加到48.93%(P<0.05),β-轉角和無規則卷曲含量都顯著增加(P<0.05)。隨著pH降低,肌原纖維蛋白α-螺旋的含量逐漸降低,而β-折疊、β-轉角和無規則卷曲含量都顯著增加(P<0.05)。pH 在7.0—5.0時,肌原纖維蛋白粒徑大小逐漸增大,D10從13.4 μm上升到48.4 μm,D50從38 μm上升到253 μm,D90從236 μm上升到805 μm。pH 7.0時形成的凝膠微觀結構有序,孔徑最大;隨著pH減小,凝膠微觀結構有序程度降低,孔徑變小;pH 5.0時形成的凝膠微觀結構無序、孔徑最小。pH與凝膠靜電相互作用、疏水相互作用極顯著負相關(P<0.01),與氫鍵、α-螺旋含量顯著正相關(P<0.05),與β-折疊含量顯著負相關(P<0.05),這表明pH顯著影響靜電斥力、疏水相互作用、分子間氫鍵和二級結構含量。靜電相互作用、疏水相互作用、氫鍵與蛋白凝膠二級結構都顯著相關(P<0.05),表明非共價鍵作用力顯著影響二級結構。【結論】肌原纖維蛋白凝膠非共價鍵作用力、二級結構和微觀結構與pH密切相關;pH從7.0降到5.0,靜電斥力減小、疏水相互作用增大、分子間氫鍵增大,是α-螺旋含量減小、β-折疊含量增多以及凝膠微觀結構變得無序、孔徑減小的原因。
肌原纖維蛋白凝膠;靜電;疏水;氫鍵;二級結構;粒徑;微觀結構
0 引言
【研究意義】肌原纖維蛋白(myofibrillar proteins,MP)熱誘導凝膠形成過程中,蛋白分子由天然狀態轉變到變性狀態,構象改變,分子鏈伸展,各種基團暴露,相鄰多肽鏈間吸引力和排斥力達到平衡,最終形成穩定的三維網絡結構[1]。形成和維持蛋白質結構及其凝膠網狀結構的作用力主要有靜電相互作用、疏水相互作用、氫鍵、二硫鍵等[2]。pH通過影響肌原纖維蛋白氨基酸側鏈電荷分布,改變蛋白質分子間的相互作用,影響蛋白質及其熱誘導凝膠的非共價鍵作用力和結構。研究pH對肌原纖維蛋白熱凝膠非共價鍵作用力和結構的影響,探究非共價鍵作用力對蛋白質及其凝膠結構的控制機理,對闡述凝膠形成機制具有十分重要的意義。【前人研究進展】LIU等[3]通過添加DTT、尿素等化學試劑研究蛋白質間的作用力,發現蛋白質熱誘導凝膠形成過程中非共價鍵的貢獻比共價鍵(二硫鍵)更大。Zeta電位是帶電顆粒表面剪切層的電位,是表征膠體體系穩定性的重要指標,可用于描述膠體(如蛋白)顆粒之間的靜電相互作用[4-5]。拉曼光譜根據光子頻率變化就可判斷出分子中所含有的化學鍵或功能基團,通過多肽鏈骨架和氨基酸側鏈振動引起拉曼條帶強度改變來反映這些基團周圍微環境的變化[6-7]。蛋白質中的苯丙氨酸和色氨酸在拉曼光譜中出現的特征峰能夠反映微環境中疏水相互作用的變化[8]。酪氨酸殘基在拉曼光譜存在的兩個譜峰,能反映蛋白凝膠中酪氨酸氫鍵的變化[7],ZHANG等[2]利用拉曼光譜法研究了壓力對肌原纖維蛋白凝膠非共價鍵作用力的影響。蛋白二級結構是指多肽鏈的部分氨基酸借助于氫鍵沿一維方向排列成具有周期性有規則的空間排列,主要包括 α-螺旋、β-折疊、β-轉角、無規則卷曲等形式[9]。肌原纖維蛋白分子在拉曼光譜1 600—1 700 cm-1附近的條帶屬于酰胺帶I的伸縮振動,是由脂肪族仲酰胺 C=O的伸縮振動引起,部分來自Cα-C-N的彎曲振動、C-N的伸縮振動和N-H的面內彎曲振動[6,10]。通過酰胺帶I最大峰的波數可以對蛋白質二級結構進行定量分析[10]。CHOI[11]用拉曼光譜法研究了普通蕎麥中球蛋白的二級結構。【本研究切入點】氫鍵等非共價鍵作用力難以量化測定,直接測量的方法幾乎沒有。傳統研究凝膠作用力的方法是通過添加化學試劑(如SDS、尿素等),測定凝膠特性來推測作用力變化,由于化學試劑同時影響多種作用力,其方法的科學性有待考證。拉曼光譜法從分子水平定性定量分析蛋白質的功能基團直接測定蛋白凝膠作用力和二級結構含量,適用高濃度的蛋白凝膠,并且無損蛋白質結構,不受水的干擾[12]。【擬解決的關鍵問題】在不同pH條件下用Zeta電位儀、拉曼光譜儀、粒徑儀直接測量肌原纖維蛋白凝膠的靜電作用、疏水相互作用、氫鍵、二級結構含量、蛋白粒徑分布的變化,同時用電鏡觀察凝膠微觀結構;探討凝膠非共價鍵作用力與結構的關系。
1 材料與方法
試驗于2015年5—12月在南京財經大學糧油質量檢測工程技術研究中心進行。
1.1 主要材料與試劑
活AA雞(40日齡)30只,其中公雞和母雞各15只,購于南京青龍山養雞場,宰殺,取雞胸肉,于-18℃下儲存。
試驗所用化學試劑均為分析純。
1.2 主要儀器與設備
DS-1高速組織搗碎機,上海標本模型廠;Avanti J-26XP高效冷凍離心機,美國Beckman Coulter公司;Zeta電位分析儀(Zetasizer Malvern Nano ZS90),英國馬爾文公司;動態光散射粒度儀(Mastersizer 2000,Malvern Instruments Ltd.,Worcester shire,UK),英國馬爾文公司;LABRAM 800激光拉曼光譜儀,法國JY公司;日本TM 300掃描電鏡,日本日立公司。
1.3 試驗方法
1.3.1 肌原纖維蛋白的提取 雞胸肉于 4℃下解凍20 min,剔除結締組織和脂肪,切碎后用于提取雞胸肉肌原纖維蛋白,蛋白提取和濃度測定方法參考文獻[13]。4℃下保存。
1.3.2 pH處理肌原纖維蛋白熱誘導凝膠的制備 用磷酸鹽緩沖液(10 mmol·L-1K2HPO4,0.6 mol·L-1KCI,pH 6.0)溶解肌原纖維蛋白沉淀,分別配制1 mg·mL-1、40 mg·mL-1的肌原纖維蛋白溶液,用1 mol·L-1的NaOH或HCI將蛋白溶液的pH分別調至5.0、5.5、6.0、6.5、7.0,水浴加熱至 65℃(1℃·min-1)制成凝膠,保溫20 min,取出,自然冷卻,并在4℃下保存9—16 h,分別用于其非共價鍵作用力和結構的測定。
1.3.3 靜電相互作用的測定 將肌原纖維蛋白凝膠樣品注入Zeta電位儀后,蓋上塞子,進行電位測試。注意勿留氣泡。測試參數:散射角:90°,平衡時間:60 s,測試溫度:25℃。每次測定最終電位值都為連續3次測試的平均值。
1.3.4 疏水相互作用、氫鍵、二級結構的測定 用激光拉曼光譜儀進行測量,激發波長514.5 nm;激光出射功率:10 mW;顯微物鏡:50倍長焦距;光柵:600;狹縫:200 μm;積分時間:60 s;重復3次,累加得譜。
1.3.5 肌原纖維蛋白粒徑分布測定 將肌原纖維蛋白樣品緩慢加入Malvern動態光散射粒度儀中,達到測試范圍,進行測試[14],每次測定最終粒徑分布均為連續3次測試的平均值。
1.3.6 肌原纖維蛋白凝膠微觀結構的觀察 將制備的肌原纖維蛋白凝膠切塊,用2.5%的戊二醛溶液固定2—3 h,pH 7.4的磷酸鹽清洗,進行乙醇(50%、70%、90%、95%和100%)梯度脫水,每次20—30 min,再用叔丁醇置換,-70℃冷凍干燥,鍍膜后用掃描電鏡(SEM)觀察微觀結構,加速電壓15 kV。
1.3.7 統計分析 用SPSS17.0軟件進行相關性分析和方差分析,若方差分析效應顯著則用Duncan multiple range test進行多重比較(P<0.05)。
2 結果
2.1 pH對肌原纖維蛋白凝膠靜電相互作用的影響
如圖1所示,隨著pH靠近肌原纖維蛋白等電點(等電點約為 5.0—5.2[15-16]),肌原纖維蛋白熱誘導凝膠Zeta電位絕對值顯著降低(P<0.05),在5.0時Zeta電位值為-0.26,電位絕對值最小,在等點電附近,Zeta電位值接近0。中性條件下Zeta電位值為-17.87,電位絕對值最大。蛋白質分子中幾乎所有的帶電基團都分布在蛋白質分子表面。在蛋白質聚集過程中靜電相互作用通常表現為相互斥力,Zeta電位值為負值,表明肌原纖維蛋白呈負電荷。在等電點時,肌原纖維蛋白分子中正電荷和負電荷的數目接近相等,吸引和排斥的靜電作用達到平衡,此時的靜電相互作用最小,等電點時有利于蛋白質-蛋白質相互作用[17]。靠近中性條件時,氫離子濃度減小,蛋白凝膠表面負電荷增多,Zeta電位值絕對值增大,因此,靜電斥力隨著pH的增加而增大。
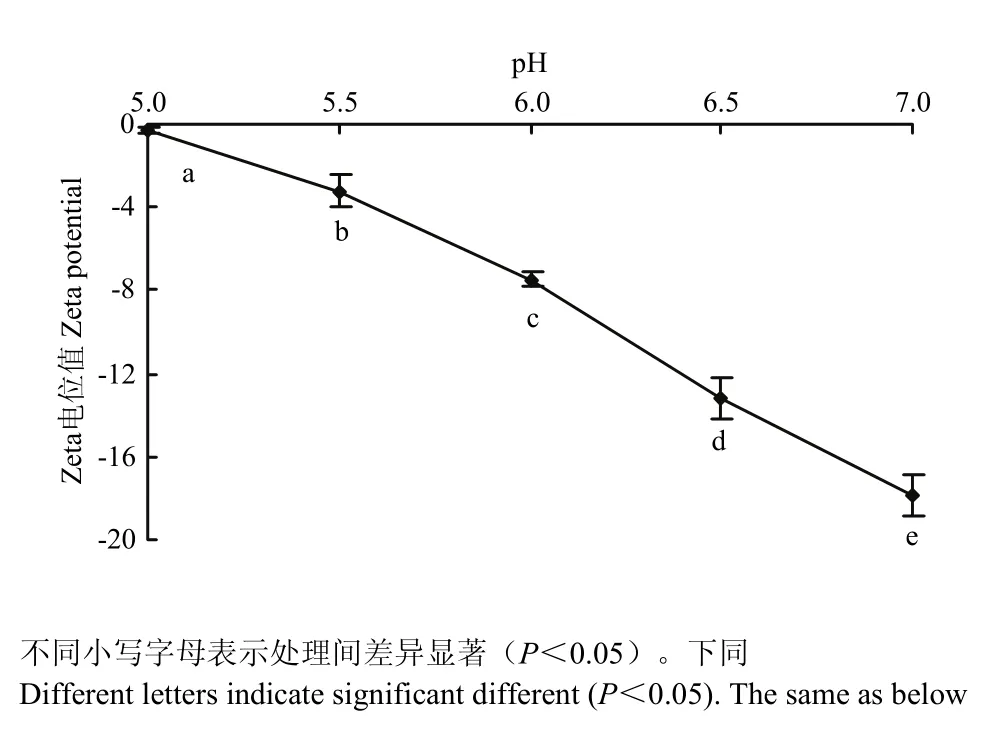
圖1 pH對肌原纖維蛋白凝膠Zeta電位的影響Fig. 1 Effect of pH on the Zeta potential of myofibrillar protein heat-induced gel
2.2 pH對肌原纖維蛋白凝膠疏水相互作用的影響
苯丙氨酸和色氨酸的某些基團在拉曼光譜中出現特征譜帶[6],其中將1 003 cm-1處苯丙氨酸環的呼吸振動作為內標(強度不隨蛋白質結構改變而發生變化),760 cm-1處色氨酸伸縮振動反映了微環境中疏水相互作用的變化[7]。隨著pH遠離中性條件7.0,肌原纖維蛋白熱誘導凝膠760 cm-1處歸一化強度I760/I1003比值逐漸增大(圖 2),表明蛋白分子間疏水相互作用在pH降低時逐漸增強。在pH 5.0時,I760/I1003比值最大,達到0.927;在pH 7.0時,I760/I1003比值最小,為0.860,pH 5.0、5.5,pH6.0、6.5和pH 7.0這三組比值間差異顯著(P<0.05)。離等電點較近時,蛋白分子間減弱的靜電斥力有利于疏水相互作用的增強,蛋白間的作用加強,蛋白與水的作用減弱[16]。遠離等電點時,肌原纖維蛋白分子負電荷數量增加,靜電斥力增大,肌原纖維蛋白分子充分展開,包埋的色氨酸等疏水性氨基酸得以暴露,疏水相互作用減弱,表現為I760/I1003比值的減小,同時蛋白與水的作用增強。
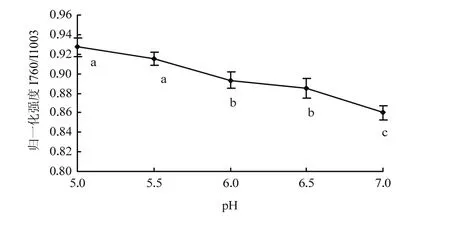
圖2 pH對肌原纖維蛋白凝膠歸一化的760 cm-1處條帶強度的影響Fig. 2 Effect of pH on the normalized intensity of the 760 cm-1band of myofibrillar protein heat-induced gel
2.3 pH對肌原纖維蛋白凝膠氫鍵的影響
I850/I830可以反映酪氨酸殘基苯環上-OH是與溶劑水分子生成氫鍵(“暴露”式)還是與蛋白質分子其他基團(如-COOH)生成氫鍵(“埋藏”式)。比值I850/I830≥1.25,說明酪氨酸殘基是完全暴露在極性環境或者水環境中,如果I850/I830≤0.5,表明酪氨酸殘基處在一個埋藏的疏水環境中或者作為強氫鍵供體的狀態存在。比值在0.5—1.25,則表明酪氨酸殘基既有“暴露”式,又有“埋藏”式[2]。肌原纖維蛋白混合凝膠體系中,氫鍵作用包括了蛋白分子間以及蛋白分子和溶質水之間的氫鍵作用。
如圖3所示,I850/I830比值在遠離中性條件時呈下降的趨勢,在 pH 7.0時 I850/I830比值最大,為1.039,在pH 5.0時I850/I830比值最小,為0.987。pH 5.0、5.5和pH 6.0、6.5、7.0這兩組比值間差異顯著(P<0.05)。I850/I830比值在 0.5—2.5,說明酪氨酸殘基形成的氫鍵既包括暴露的氫鍵也包括埋藏的氫鍵。隨著靠近等電點,I850/I830比值減小表明肌原纖維蛋白酪氨酸殘基苯環上的-OH基團與水分子生成的氫鍵逐漸轉變為與其他殘基(如-COOH)生成的氫鍵,肌原纖維蛋白肽鏈分子間的氫鍵作用增強,蛋白分子與水的氫鍵作用減弱。
遠離等電點時,靜電斥力增大,蛋白間發生解離,基團與基團間氫鍵作用被破壞,導致蛋白分子間的氫鍵減少,肌原纖維蛋白分子展開,同時疏水性氨基酸暴露,疏水相互作用減弱,酪氨酸殘基處于一個疏水性微環境中,氫鍵與水的結合增多,故靠近中性條件是埋藏的肌原纖維蛋白分子間氫鍵轉變為蛋白分子與水分子之間氫鍵的過程。增大的靜電斥力,使得蛋白完全伸展,在蛋白表面給水提供了更多的結合位點,增大水化的表面積[18],故肌原纖維蛋白分子與水的氫鍵作用增強。

圖3 pH對肌原纖維蛋白凝膠歸一化的I850/I830強度隨的影響Fig. 3 Effect of pH on the normalized intensity of the I850/I830 doublet bands of myofibrillar protein heat-induced gel
2.4 pH對肌原纖維蛋白及其凝膠二級結構的影響
蛋白質二級結構是指在多肽鏈的某些氨基酸殘基周期性的空間排列,包括 α-螺旋、β-折疊、β-轉角和無規則卷曲結構。拉曼光譜中酰胺帶 I處振動是與蛋白質二級結構密切相關,包括高α-螺旋含量的酰胺I帶振動主要集中在(1 655±5)cm-1處,高β-折疊含量的酰胺I帶振動的拉曼光譜條帶主要集中在(1 670±5)cm-1,此外,還有1 680 cm-1處β-轉角和(1 665±5)cm-1處的無規則卷曲[11]。
如圖4所示,pH從7.0降到5.5,肌原纖維蛋白α-螺旋的含量從76.79%顯著降低到31.16%(P<0.05);pH 5.5—5.0,α-螺旋含量變化不顯著(P>0.05);pH 7.0—5.0,肌原纖維蛋白β-折疊含量從2.92%顯著增加到 42.33%(P<0.05);β-轉角和無規則卷曲含量總體呈上升的趨勢(P<0.05)。如圖5所示,從pH 7.0到pH 6.5,肌原纖維蛋白熱誘導凝膠的α-螺旋含量從59.96%降低到 55.24%(P<0.05),β-折疊含量從15.83%顯著增加到 19.44%(P<0.05),β-轉角和無規則卷曲含量都顯著增長(P<0.05);pH 6.5—6.0,各種結構含量變化都不顯著(P>0.05);接近等電點(pH 6.0—5.0),肌原纖維蛋白熱誘導凝膠的α-螺旋含量從51.61%降低到16.76%(P<0.05),β-折疊含量從22.23%顯著增加到48.93%(P<0.05);β-轉角和無規則卷曲含量同樣呈上升的趨勢(P<0.05)。肌原纖維蛋白及其熱凝膠二級結構中α-螺旋含量和β-折疊含量最多,隨pH降低,各種結構變化趨勢一致,有序結構總體減少,無序結構總體增加,凝膠的α-螺旋含量總體較低于蛋白加熱前,β-折疊含量比蛋白加熱前較多。
α-螺旋結構的穩定主要由單肽鏈上羰基(C=O)與(N-H)間形成的鏈內氫鍵維持[19],β-折疊結構則依賴蛋白質分子肽鏈間的氫鍵形成。靜電相互作用是影響蛋白質二級結構的重要非共價鍵作用力之一[20],pH通過影響帶電氨基酸和蛋白表面α-羧基、α-氨基末端基團的質子化狀態來影響蛋白分子間的相互作用[21]。從二級結構含量變化上來看,靠近等電點,蛋白負電荷減少,靜電斥力減小,導致蛋白分子內的氫鍵減少,氫鍵與水的結合減弱,分子間的氫鍵增多,對應的是 α-螺旋含量減少,β-折疊含量增多。靜電斥力的減弱使得蛋白分子內氫鍵的增多是α-螺旋含量減少的原因[22]。加熱會使α-螺旋結構解開[23],埋藏的疏水性氨基酸得以暴露,導致肌原纖維蛋白間疏水相互作用的變化,升溫過程中α-螺旋逐漸減少,β-折疊逐漸增加[24-25],故肌原纖維蛋白凝膠的 α-螺旋含量總體比蛋白加熱前低,β-折疊含量則比蛋白加熱前多。
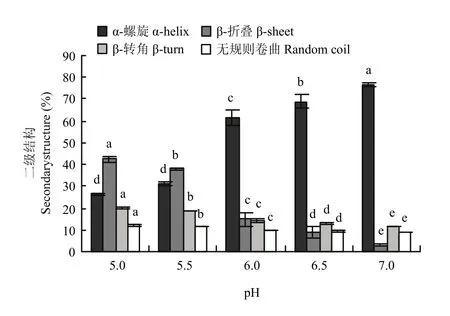
圖4 pH對肌原纖維蛋白二級結構含量的影響Fig. 4 Effect of pH on the secondary structure content of myofibrillar protein
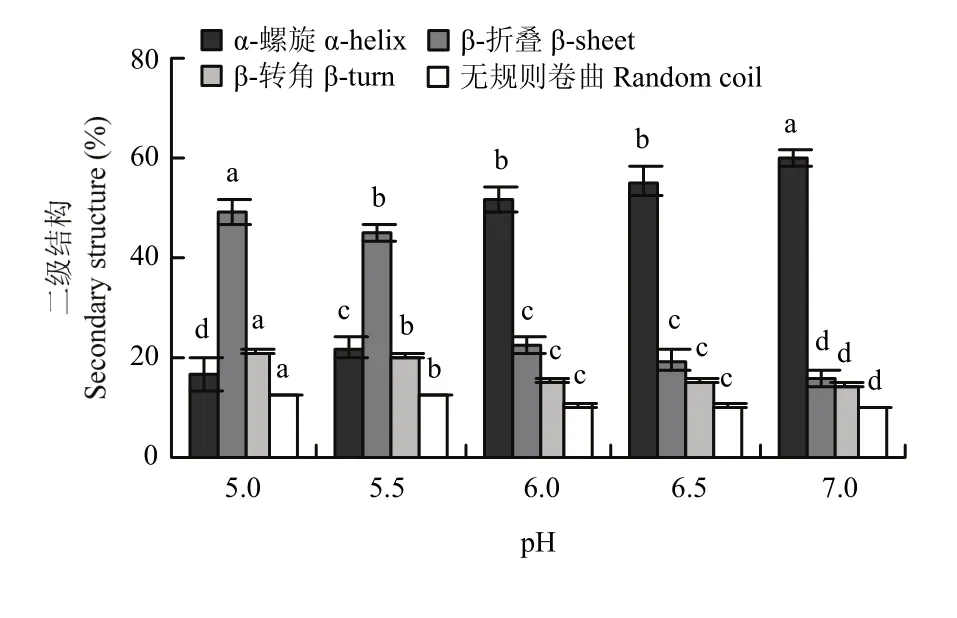
圖5 pH對肌原纖維蛋白熱誘導凝膠二級結構含量的影響Fig. 5 Effect of pH on the secondary structure content of myofibrillar protein heat-induced gel
2.5 pH對肌原纖維蛋白粒徑分布的影響
D10、D50、D90分別表示肌原纖維蛋白粒徑累計值達到體積10%、50%、90%時的粒徑大小,D50反應肌原纖維蛋白的平均粒徑大小。如圖6所示,肌原纖維蛋白的粒徑大小分布在0—3 500 μm,90%的顆粒大小分布在1 000 μm以下,50%的顆粒大小分布在300 μm以下,10%的顆粒大小在50 μm以下。由表1可知,隨著pH的降低,D10從13.4 μm上升到48.4 μm,D50從38 μm上升到253 μm,pH 5.0,pH 5.5、6.0和pH 6.5、7.0這三組間差異顯著(P<0.05)。D90從236 μm上升到805 μm,pH 5.0,pH 5.5、6.0,pH 6.5和pH 7.0這4組差異顯著(P<0.05)。
當 pH接近等電點時蛋白質分子會因增大的疏水相互作用而形成隨機聚合物,隨著pH增大,增大的靜電斥力會阻止蛋白間的隨機聚集,導致形成線性多聚體[26]。蛋白質粒徑變化主要由蛋白質分子內的交聯和聚集引起[27]。靠近等電點附近時,表面凈電荷最少,靜電斥力最小,蛋白發生解聚,充分伸展,結構變得無序,疏水基團等活性殘基的暴露,非共價作用力形成,蛋白質之間的作用最強,蛋白聚集速度最快,形成較大的聚集體,此時粒徑最大。靠近中性時,靜電斥力增大,蛋白間結合的能力減弱,不易發生聚集,此時粒徑最小。
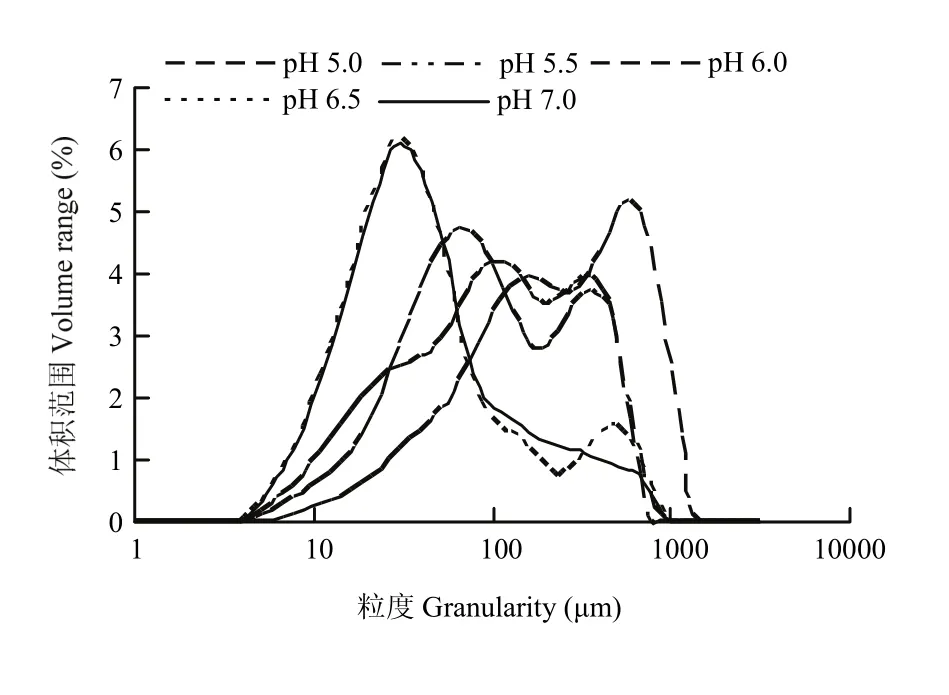
圖6 肌原纖維蛋白粒徑分布隨pH的變化Fig. 6 Effect of pH on the particle size distribution of myofibrillar protein

表1 pH對肌原纖維蛋白粒徑大小的影響Table 1 Effect of pH on myofibrillar protein particle size
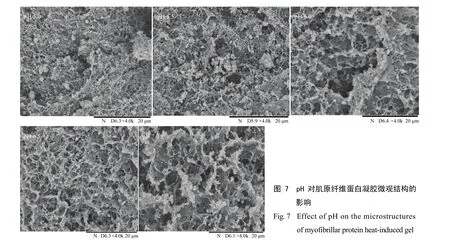
2.6 pH對肌原纖維蛋白凝膠微觀結構的影響
肌原纖維蛋白凝膠微觀結構如圖 7所示,在 pH 5.0和5.5時,肌原纖維蛋白凝膠微觀結構中有較多球狀或棒狀的聚集塊,即不溶解的肌原纖維蛋白,pH 5.0時多孔結構不明顯,pH 5.5時出現多孔結構,但多孔數量較少,凝膠網狀結構比較無序、致密;靠近中性條件時,凝膠網絡結構趨向有序和有層次,此時形成多孔和較大孔徑的三維網絡結構,不溶解的棒狀結構消失,在pH 7.0時,網狀結構中的孔徑達到最大。在凈電荷數量不多時,排斥的靜電相互作用和吸引的疏水相互作用,分子間的氫鍵保持較好的平衡,易于形成有序的凝膠網絡結構[28]。在pH 7.0時,肌原纖維蛋白質分子表面存在較多的負電荷,靜電排斥力占主導地位,因而不易發生聚集和交聯[29],此時形成的凝膠網狀結構凝膠孔徑較大,結構有序。
2.7 相關性分析
由表2可見,pH與凝膠的靜電相互作用、疏水相互作用呈極顯著負相關(P<0.01),與氫鍵、α-螺旋含量呈顯著正相關(P<0.05),與β-折疊、β-轉角和無規則卷曲含量顯著負相關(P<0.05)。表明 pH顯著影響靜電斥力、疏水相互作用、分子間氫鍵和二級結構含量。靜電相互作用、疏水相互作用與凝膠α-螺旋含量顯著負相關(P<0.05),與凝膠β-折疊、β-轉角和無規則卷曲含量顯著正相關(P< 0.05)。氫鍵與凝膠 α-螺旋含量極顯著正相關(P< 0.05),與凝膠 β-折疊、β-轉角和無規則卷曲含量極顯著負相關(P<0.01),表明非共價鍵作用力顯著影響二級結構含量。
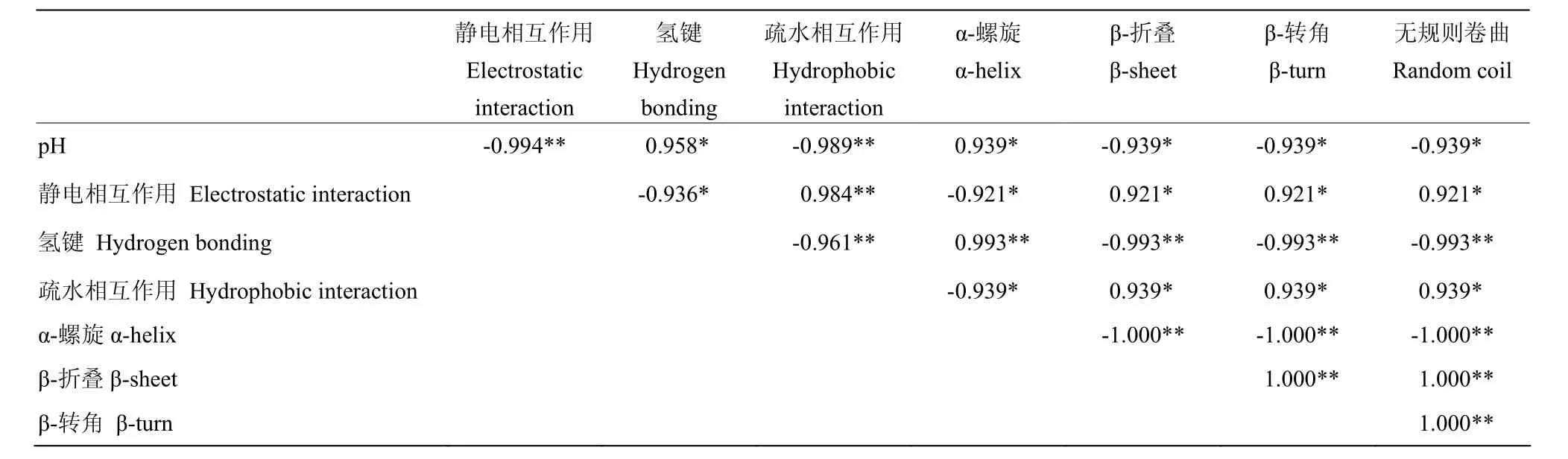
表2 pH與肌原纖維蛋白凝膠非共價鍵作用力、二級結構之間的相關性Table 2 Correlation of pH, non-covalent forces, secondary structure
3 討論
肌原纖維蛋白聚集和交聯形成的熱誘導凝膠網絡結構是蛋白質分子中引力和斥力平衡的結果,斥力由蛋白表面電荷提供,而引力是由蛋白受熱解開暴露出的功能基團形成[30]。靠近等電點時,蛋白分子中正電荷和負電荷的數目接近相等,吸引和排斥的靜電作用達到平衡,此時的靜電相互作用最小,蛋白多肽鏈結構中的非共價鍵平衡被打破,減弱的靜電斥力促進疏水相互作用的增強,并減少蛋白表面的氫鍵結合位點,導致蛋白分子內的氫鍵減少,蛋白與蛋白之間的作用增強,蛋白與水的作用減弱[16]。靠近中性條件時,氫離子濃度減小,蛋白表面負電荷增多,此時的靜電斥力達到最大,肌原纖維蛋白分子充分伸展,包埋的色氨酸等疏水性氨基酸得以暴露,表面疏水性增大,疏水相互作用減弱,暴露出的酪氨酸殘基處于一個疏水性微環境中,蛋白與溶質水結合形成的氫鍵數量增多。
LIU等[22]通過圓二色譜(circular dichroism,CD)研究豬肉肌球蛋白二級結構時發現,隨著 pH從 7.0向等電點靠近,α-螺旋結構含量減少,而β-折疊含量增多。費英等[16]研究發現隨著pH偏離肌原纖維蛋白等電點范圍(約5—5.2),向中性條件靠近時,肌原纖維蛋白的 α-螺旋呈現增多的趨勢。本試驗中隨著pH從7.0接近等電點,肌原纖維蛋白及其凝膠的α-螺旋含量都逐漸減少,β-折疊含量顯著增多,凝膠的α-螺旋含量相比蛋白加熱前要少,β-折疊含量則相比要多。WANG等[31]研究了肌球蛋白熱凝膠形成與其二級結構含量變化之間的關系,發現蛋白凝膠形成過程中,在55℃時肌球蛋白的伸展導致α-螺旋的減少,在 65℃時蛋白分子間氫鍵增多導致β-折疊結構的增加。在相同pH條件下,加熱導致α-螺旋含量的降低,β-折疊含量的增加。β-折疊結構形成是蛋白分子聚集和交聯的前提,α-螺旋和無規則結構轉化為β-折疊,β-折疊含量達到一定臨界水平才會形成凝膠網絡,平行或反平行 β-折疊分子間的氫鍵使得凝膠網絡更加穩定[32]。加熱使得 α-螺旋結構解開,而后通過分子間氫鍵作用,暴露的疏水基團之間的疏水作用形成了β-折疊結構或β-轉角和無規則卷曲結構。故本試驗中隨著pH降低,蛋白和凝膠中的有序結構總體減少,無序結構總體增加。在同一pH條件下,肌原纖維蛋白凝膠相比蛋白中的 α-螺旋含量較少,而 β-折疊較多。楊玉玲等[25]通過CD法研究了從30℃加熱到80℃時肌原纖維蛋白二級結構的變化情況,發現其 α-螺旋含量顯著下降,β-折疊含量顯著提高,與本研究結論一致。
靜電相互作用、疏水相互作用、氫鍵與二級結構含量都呈顯著相關(P<0.05),表明非共價作用力顯著影響肌原纖維蛋白二級結構。α-螺旋結構由蛋白分子內氫鍵形成,β-折疊結構由蛋白分子間的氫鍵形成。疏水相互作用增大使蛋白間作用加強,破壞了維持α-螺旋結構穩定的肽鏈內部氫鍵,使α-螺旋結構解開或向其他構象轉化[33]。靠近等電點,肌原纖維蛋白負電荷減少,靜電斥力減小,導致蛋白分子內的氫鍵減少,氫鍵與水的結合減少,α-螺旋含量減少,分子間的氫鍵增多,疏水相互作用形成的β-折疊含量或β-轉角和無規則卷曲結構相繼增多。靜電斥力減小,使得蛋白分子內氫鍵減少是α-螺旋含量減少的原因,分子間的氫鍵增多是β-折疊結構增多的原因。
加熱時,折疊的肌原纖維蛋白分子受熱變性,側鏈結合鍵斷開使得蛋白伸展,活性基團暴露(如疏水殘基、氫鍵結合位點等),同時蛋白質分子構象也發生改變,隨著溫度升高,蛋白質分子通過活性基團的非共價鍵作用,發生交聯和聚集形成大的膠凝體,進而構建復雜的三維網絡結構。凝膠網絡結構取決于蛋白伸展和聚集的相對快慢,當蛋白的伸展快于聚集,此時蛋白分子能充分展開、加熱使蛋白緩慢聚集,形成有序、細致的凝膠;反之,則形成粗糙無序的凝膠結構[34]。費英等[16]通過 SEM 觀察發現豬肉肌球蛋白在等電點時形成粗糙、無序的凝膠網絡結構,在pH 7.0時形成致密、有序的凝膠網絡結構。肌原纖維蛋白中疏水性氨基酸暴露與包埋引起蛋白質間疏水相互作用變化是粒徑改變的主要原因[33]。本試驗中疏水作用力的改變是由靜電斥力的改變引起。等電點時,靜電斥力最小,疏水相互作用最強,蛋白聚集發生在伸展之前,此時蛋白分子聚集速率最快,形成較大蛋白聚集顆粒,加熱形成的凝膠網絡結構粗糙、緊密,膠孔不明顯,同時有大量球狀或棒狀的聚集塊存在。在靠近中性時,較大的靜電斥力使蛋白分子間保持分離狀態,蛋白分子充分展開,不易聚集,蛋白顆粒較小;加熱使得蛋白緩慢聚集,變性鏈定向且有序,球狀或棒狀的聚集塊消失,使得凝膠微觀結構有序,凝膠孔徑最大、數量最多。凝膠三維網絡結構影響肉制品的功能特性,韓敏義等[18]認為在中性條件時形成的凝膠孔徑增大是其保水性上升的主要原因。
4 結論
pH顯著改變肌原纖維蛋白凝膠的靜電相互作用、疏水相互作用、氫鍵和二級結構含量。在 pH由中性靠近等電點時,凝膠的靜電斥力減小,疏水相互作用增大,分子間氫鍵作用增大,導致其α-螺旋含量減小,β-折疊含量增多。這也是凝膠微觀結構由有序趨于無序,凝膠孔徑逐漸減小的原因。因此,肌原纖維蛋白凝膠非共價鍵作用力可決定凝膠二級結構和微觀結構。
[1] OAKENFULL D, PEARCE J, BURLEY R W. Protein Gelation: Food Proteins and Their Applications. New York: Marcel Dekker, 1997.
[2] ZHANG Z Y, YANG Y L, TANG X Z, CHEN Y J, YOU Y. Chemical forces and water holding capacity study of heat-induced myofibrillar protein gel as affected by high pressure. Food Chemistry, 2015, 188: 111-118.
[3] LIU K S, HSIEH F H. Protein-protein interactions in high moisture-extruded meat analogs and heat-induced soy protein gels. Journal of the American Oil Chemists' Society, 2007, 84(8): 741-748.
[4] HUNTER R J. Zeta Potential in Colloid Science: Principles and Applications. New York/London: Academic Press, 2013.
[5] RUNKANA V, SOMASUNDARAN P, KAPUR P C. Mathematical modeling of polymer-induced flocculation by charge neutralization. Journal of Colloid and Interface Science, 2004, 270(2): 347-358.
[6] NONAKA M, LI-CHAN E, NAKAI S. Raman spectroscopic study of thermally induced gelation of whey proteins. Journal of Agricultural and Food Chemistry, 1993, 41(8): 1176-1181.
[7] IKEDA S, LI-CHAN E C Y. Raman spectroscopy of heat-induced fine-stranded and particulate β-lactoglobulin gels. Food Hydrocolloids, 2004, 18(3): 489-498.
[8] LINLAUD N, FERRER E, PUPPO M C, FERRERO C. Hydrocolloid interaction with water, protein, and starch in wheat dough. Journal of Agricultural and Food Chemistry, 2010, 59(2): 713-719.
[9] 耿信篤, 白泉, 王超展. 蛋白折疊液相色譜法. 北京: 科學出版社, 2006.
GENG X D, BAI Q, WANG C Z. Protein Folding Liquid Chromatography. Beijing: Science Press, 2006. (in Chinese)
[10] ALIX A J P, PEDANOU G, BERJOT M. Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman amide I band. Journal of Molecular Structure, 1988, 174: 159-164.
[11] CHOI S M, MA C Y. Structural characterization of globulin from common buckwheat (Fagopyrum esculentum Moench) using circular dichroism and Raman spectroscopy. Food Chemistry, 2007, 102(1): 150-160.
[12] LI-CHAN E C Y. The applications of Raman spectroscopy in food science. Trends in Food Science & Technology, 1996, 7(11): 361-370.
[13] ZHANG Z Y, YANG Y L, TANG X Z, CHEN Y J, YOU Y. Effects of ionic strength on chemical forces and functional properties of heat-induced myofibrillar protein gel. Food Science and Technology Research, 2015, 21(4): 597-605.
[14] LI K, KANG Z L, ZHAO Y Y, XU X L, ZHOU G H. Use of high-intensity ultrasound to improve functional properties of batter suspensions prepared from PSE-like chicken breast meat. Food and Bioprocess Technology, 2014, 7(12): 3466-3477.
[15] BERTRAM H C, KRISTENSEN M, ANDERSEN H J. Functionality of myofibrillar proteins as affected by pH, ionic strength and heat treatment-A low-field NMR study. Meat Science, 2004, 68(2): 249-256.
[16] 費英, 韓敏義, 楊凌寒, 周光宏, 徐幸蓮, 彭增起. pH對肌原纖維蛋白二級結構及其熱誘導凝膠特性的影響. 中國農業科學, 2010, 43(1): 164-170.
FEI Y, HAN M Y, YANG L H, ZHOU G H, XU X L, PENG Z Q. Studies on the secondary structure and heat-induced gelation of pork myofibrillar proteins as affected by pH. Scientia Agricultura Sinica, 2010, 43(1):164-170. (in Chinese)
[17] SUREL O, FAMELART M H. Heat induced gelation of acid milk: balance between weak and covalent bonds. Journal of Dairy Research, 2003, 70(2): 253-256.
[18] 韓敏義, 費英, 徐幸蓮, 周光宏. 低場 NMR 研究 pH 對肌原纖維蛋白熱誘導凝膠的影響. 中國農業科學, 2009, 42(6): 2098-2104.
HAN M Y, FEI Y, XU X L, ZHOU G H. Heat-induced gelation of myofibrillar proteins as affected by pH-A low field NMR study. Scientia Agricultura Sinica, 2009, 42(6): 2098-2104. (in Chinese)
[19] DAMODARAN S. 5 Amino acids, peptides, and proteins//Fennema's Food Chemistry. CRC Press, 2008: 217.
[20] SATOH Y, NAKAYA M, OCHIAI Y, WATABE S. Characterization of fast skeletal myosin from white croaker in comparison with that from walleye pollack. Fisheries Science, 2006, 72(3): 646-655.
[21] DUMETZ A C, CHOCKLA A M, KALER E W, LENHOFF A M. Effects of pH on protein-protein interactions and implications for protein phase behavior. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2008, 1784(4): 600-610.
[22] LIU R, ZHAO S M, XIONG S B, XIE B J, QIN L H. Role of secondary structures in the gelation of porcine myosin at different pH values. Meat Science, 2008, 80(3): 632-639.
[23] CHAN J K, GILL T A, PAULSON A T. The dynamics of thermal denaturation of fish myosins. Food Research International, 1992, 25(2): 117-123.
[24] LIU R, ZHAO S M, LIU Y M, YANG H, XIONG S B, XIE B J, QIN L H. Effect of pH on the gel properties and secondary structure of fishmyosin. Food Chemistry, 2010, 121(1): 196-202.
[25] 楊玉玲, 游遠, 彭曉蓓, 陳銀基. 加熱對雞胸肉肌原纖維蛋白結構與凝膠特性的影響. 中國農業科學, 2014, 47(10): 2013-2020.
YANG Y L, YOU Y, PENG X B, CHEN Y J. Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle. Scientia Agricultura Sinica, 2014, 47(10): 2013-2020. (in Chinese)
[26] BOYE J I, ALLI I, ISMAIL A A, GIBBS B F, KONISHI Y. Factors affecting molecular characteristics of whey protein gelation. International Dairy Journal, 1995, 5(4): 337-353.
[27] PROMEYRAT A, GATELLIER P, LEBRET B, KAJAKSIEMASZKO K, AUBRY L, SANTE-LHOUTELLIER V. Evaluation of protein aggregation in cooked meat. Food Chemistry, 2010, 121(2): 412-417.
[28] HERMANSSON A M. Aggregation and Denaturation Involved In Gel Formation: Functionality and Protein Structure. Washington DC: American Chemical Society. 1979.
[29] HAMADA M, ISHIZAKI S, NAGAI T. Variation of SH content and kamaboko-gel forming ability of shark muscle protein by electrolysis. Journal of the Shimonoseki University of Fisheries, 1994, 42: 131-135.
[30] KER Y C, TOLEDO R T. Influence of shear treatments on consistency and gelling properties of whey protein isolate suspensions. Journal of Food Science, 1992, 57(1): 82-85.
[31] WANG S F, SMITH D M. Dynamic rheological properties and secondary structure of chicken breast myosin as influenced by isothermal heating. Journal of Agricultural and Food Chemistry, 1994, 42(7): 1434-1439.
[32] WANG C H, DAMODARAN S. Thermal gelation of globular proteins: influence of protein conformation on gel strength. Journal of Agricultural and Food Chemistry, 1991, 39(3): 433-438.
[33] 曹錦軒, 張玉林, 韓敏義, 蔣亞婷, 潘道東, 歐昌榮. 臘肉加工過程中肌原纖維蛋白結構的變化. 中國農業科學, 2013, 46(18): 3871-3877.
CAO J X, ZHANG Y L, HAN M Y, JIANG Y T, PAN D D, OU C R. Changes of the construction of myofibrillar proteins in Chinese traditional bacon during processing. Scientia Agricultura Sinica, 2013, 46(18): 3871-3877. (in Chinese)
[34] LEFEVRE F, FAUCONNEAU B, OUALI A, CULIOLI J. Thermal gelation of brown trout myofibrils from white and red muscles: Effect of pH and ionic strength. Journal of the Science of Food and Agriculture, 2002, 82(4): 452-463.
(責任編輯 趙伶俐)
Effects of pH on the Non-Covalent Forces and Structure of Myofibrillar Protein and Heat Induced Gel
ZHANG Xing, YANG YuLing, MA Yun, WANG JingYu
(College of Food Science and Engineering, Nanjing University of Finance and Economics/Collaborative Innovation Center for Modern Grain Circulation and Safety/Key Laboratory of Grains and Oils Quality Control and Processing, Nanjing 210023)
myofibrillar protein gel; electrostatic; hydrophobic; hydrogen bond; secondary structure; particle size; microstructure
2016-05-18;接受日期:2016-07-18
國家自然科學基金(31371798)、江蘇省高校優勢學科建設工程項目
聯系方式:張興,E-mail:zhangxingnufe@163.com。通信作者楊玉玲,E-mail:yulingy@sina.com
Abstract:【Objective】The influence of pH on non-covalent forces and structure of myofibrillar protein heat-induced gel was studied. The relationship between gel non-covalent forces and gel structure was revealed. 【Method】 AA type broilers were slaughtered. The myofibrillar proteins were extracted from breast muscle. The myofibrillar protein solution and heat-induced gel with different pH values (5.0, 5.5, 6.0, 6.5, 7.0) were prepared. The potential on myofibrillar protein gel molecule presents the electrostatic interaction was measured by zeta potential instrument. The I760/I1003 showing the hydrophobic interaction of gel, the I850/I830 showing the hydrogen bonding of gel, and the secondary structure contents were calculated by analyzing the amide I Raman spectrum region, these were measured using Raman spectrometer. The particle size distribution was measured by a particle size analyzer. The microstructure was measured using scanning electron microscope.【Result】 From pH 7.0 to 5.0, Zeta potential value of the gel changed from -17.87 to -0.263 (P<0.05), which show that the surface negative charges and the electrostatic interaction of myofibrillar protein gel had significant decline. The normalized intensity of 760 cm-1increased from 0.86 to 0.927, which show more Trytophan were buried and a general increase in hydrophobic interactions of myofibrillar protein gel. The normalized intensity of I850/I830 ratio decreased from 1.039 to 0.927, which indicated hydroxyl groups on the phenyl ring of tyrosine are to form hydrogen bonds with water molecules change to generate hydrogen bonds with other protein molecule residues. The interactions between myofibrillar protein molecules increased, and the interactions between myofibrillar protein and water therefore declined. From pH 7.0 to 6.5, the α-helix content of myofibrillar protein gel abruptly decreased from 59.96% to 55.24% (P<0.05). The β-sheet content significantly increased from 15.83% to 19.44% (P<0.05). β-turn and random coil content both significantly increased (P<0.05). From pH 6.5 to 6.0, all structure content had no obvious change (P>0.05). From pH 6.0 to 5.0, the α-helix content of myofibrillar protein gel significantly decreased from 51.61% to 16.76% (P<0.05). The β-sheet content significantly increased from 22.23% to 48.93% (P<0.05). β-turn and random coil content both significantly increased (P<0.05). As the pH decrease, the α-helix content of myofibrillar protein gradually decreased, the β-sheet, β-turn and random coil content significantly increased (P<0.05). From pH 7.0 to 5.0, particle size of myofibrillar protein gradually increased. D10increased from 13.4 μm to 48.4 μm, D50increased from 38 μm to 253 μm, D90increased from 236 μm to 805 μm. As the pH far away from neutral condition, the microstructure of gel changed to unordered and had smaller pore. Gel has disordered microstructure in pH 5.0, when has ordered structure at pH 7.0. The largest gel pore ware found at pH 5.0, the least were found at pH 7.0. pH had a highly negative significant correlation with electrostatic interaction and hydrophobic interactions (P<0.01), and had a positive significant correlation with hydrogen bonding and α-helix content (P<0.05). pH also led to negative significant change of β-sheet content (P<0.05). These show that pH had a significant impacts on electrostatic repulsion, hydrophobic interactions, intermolecular hydrogen bonding and secondary structure. Electrostatic interaction, hydrophobic interactions and hydrogen bonding had significant correlation with secondary structure (P<0.05), which indicated non-covalent forces had significant effects on secondary structure.【Conclusion】 Non-covalent forces and secondary structure content are significantly correlated with the pH valves. The reasons of gel α-helix reduction and β-sheet increases are the decreases of electrostatic interaction, and the increase of the hydrophobic interaction and the intermolecular hydrogen bonding of myofibrillar protein gel, as the pH far away the neutral conditions.

