歷史時空觀念核心素養在高中課堂的教學策略研究
陳海發
歷史時空觀念核心素養在高中課堂的教學策略研究
陳海發
(甘肅省臨夏州臨夏回民中學,甘肅臨夏731800)
“時空觀念”是在特定的時間、空間中對發生的事件觀察它們的原因、經過和影響作用。任何歷史事件都是在特定的時間和空間條件下發生的,只有在特定的時間和空間當中,才可能對史實有準確的理解和把握。在高中歷史課堂中,明確時空觀念核心素養的價值,對歷史教學策略進行深入研究,對新課程改革、新高考的應對,無疑具有重大意義。
高中歷史;時空觀念;研究價值;教學策略
時空觀念素養要求學生掌握紀年(時)方式、歷史分期、時代特征、古今地名、空間劃分、區域特征、讀圖制表(地圖、年表或時間軸)等。涉及部分歷史地理學(或沿革地理),例如探討地理環境對歷史的影響、疆域政區的變遷等,也明確了把對人物、事物進行觀察分析的意識和思維方式應置于特定的時間聯系和空間聯系中的要求。
本文擬借助多種方式,引導學生提升歷史學科本質的體現——時空觀念。
一、建立時空坐標,體會歷史演變脈絡
我國當前中學課程體系下,高中歷史課程采用的是專題史板塊而非通史板塊,內容編排多以螺旋式結構為主,淡化了歷史事件的時間性,不便于學生對知識點的識記,也不利于學生時間觀念的培養。所以,如何打破教材原有順序,以大歷史觀重新整合歷史事件與專題的時間性,是一線教師面臨的重要課題。
“嚴格按照時間順序講授歷史,闡明歷史事件的發展變化,以及與其他事件的邏輯順序和因果關系,提示歷史事件發展的脈絡,使學生在歷史時間的縱向動態系統中認識和了解歷史,是學生形成正確的歷史時間觀念的主要方法。”新課標頒布后,五大核心素養目標的導向性愈發明晰。一般情況下,高考試題往往將時間的判斷作為解決問題的關鍵要素。建立時空坐標,建構時空情境,有助于學生體會歷史演變脈絡。
例如,人教版必修三《西方人文精神的起源與發展》這一章,主要介紹了近代歐洲思想史概況。而高中歷史課程設置中缺乏對歐洲中世紀(476年~1500年左右,中國史學家稱之為“西歐封建社會”)的具體介紹,學生對這段歷史知識存在盲區,學習歐洲近代思想解放運動時往往缺乏對歷史背景的理解,很難形成清晰的時間線索,難以理解人文精神、理性主義的定義。另一方面,近代歐洲在經濟、政治、思想、科技與社會生活各個領域的發展是有機融合的,學生容易產生記憶上的時間錯亂。鑒于此,筆者在補充講解歐洲中世紀的政治、經濟、宗教歷史概況后,以人文精神的發展為主線,以古希臘先哲思想為開端,以中世紀基督教神學在意識形態上占統治地位為鋪墊,引導學生建立兩個直觀性的時空坐標(如表1)。坐標一:確立西方人文精神發展歷程中重大事件的時間尺度;坐標二:確立西方人文精神發展在西方近代化歷程中的歷史影響。這樣,學生便會用文明發展的眼光看待問題,形成完整、立體的知識體系,在理解的基礎上進行記憶。
把時間和空間結合起來,構建以文藝復興、啟蒙運動為中心的中外歷史發展體系的基本框架,梳理中外共時性重大歷史事件。教師可鼓勵學生們在課堂上小組探究,用時間區間、階段特征等形式,結合時間的背景和影響,在全球史觀的視野下理解和探究文藝復興、啟蒙運動和宗教改革對中國的影響。并且,以小組為單位,論述自己對于歷史發展事件的偶然性與必然性的聯系、全球聯系的加強。進一步闡述明清之際帶有反封建色彩的思想為什么沒有能在歷史上除舊布新。
二、編寫大事年表,深化歷史因果關聯
“某個知識點在一個知識結構中的方位,以及這個知識點與另一個知識點之間的關系,這是我們需要強調的;對于每一個知識模塊,重要的是揭示這個模塊的知識結構,將這個模塊結構中知識點之間的邏輯關系展示給學生。”嚴格按照史實規律和分期,編寫大事年表(把以往發生過的較大事件根據某一主題按照年代排列起來的一種參考資料)。
表1
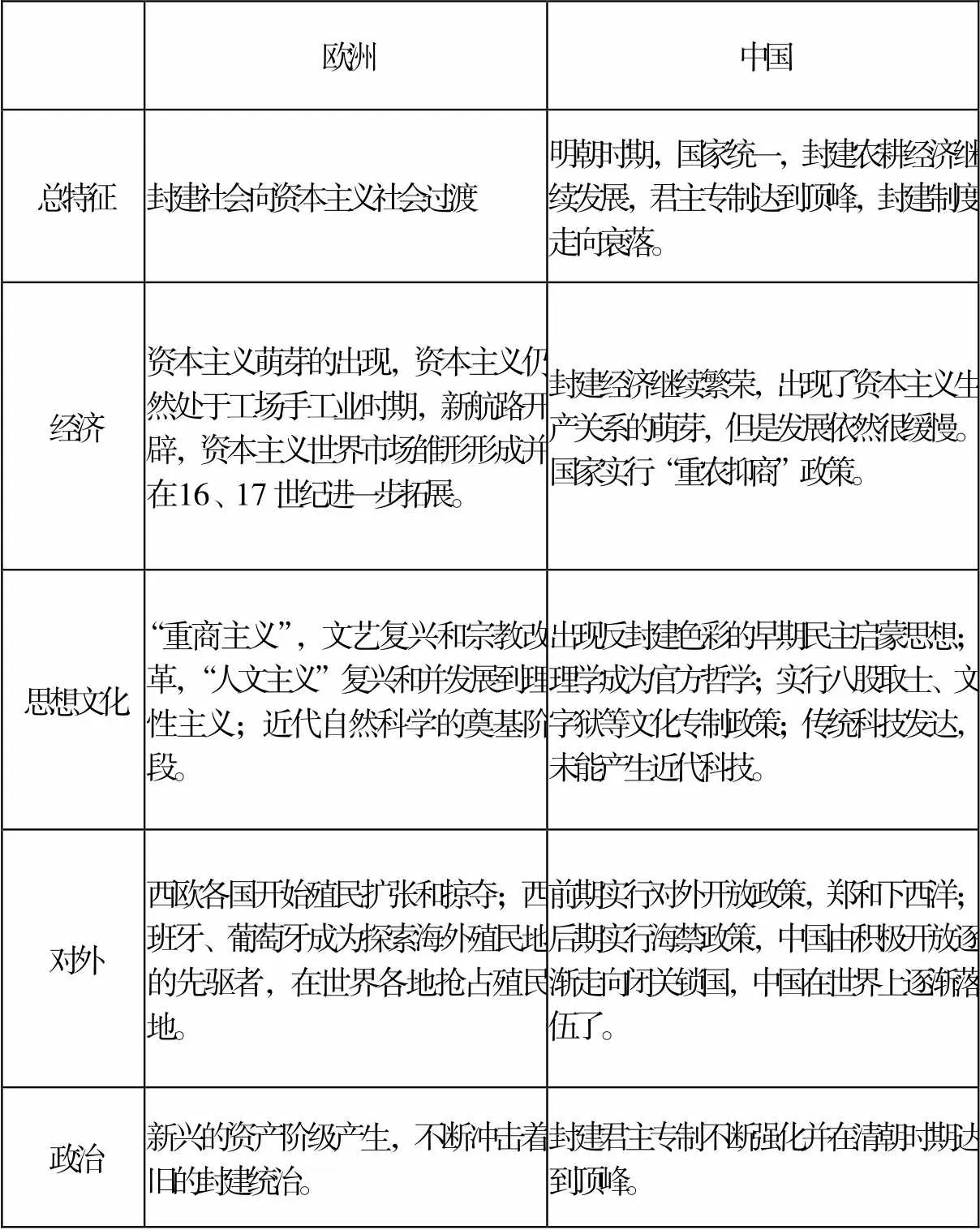
歐洲中國 總特征封建社會向資本主義社會過渡明朝時期,國家統一,封建農耕經濟繼續發展,君主專制達到頂峰,封建制度走向衰落。 經濟資本主義萌芽的出現,資本主義仍然處于工場手工業時期,新航路開辟,資本主義世界市場雛形形成并在16、17世紀進一步拓展。封建經濟繼續繁榮,出現了資本主義生產關系的萌芽,但是發展依然很緩慢。國家實行“重農抑商”政策。 思想文化“重商主義”,文藝復興和宗教改革,“人文主義”復興和并發展到理性主義;近代自然科學的奠基階段。出現反封建色彩的早期民主啟蒙思想;理學成為官方哲學;實行八股取士、文字獄等文化專制政策;傳統科技發達,未能產生近代科技。 對外西歐各國開始殖民擴張和掠奪;西班牙、葡萄牙成為探索海外殖民地的先驅者,在世界各地搶占殖民地。前期實行對外開放政策,鄭和下西洋;后期實行海禁政策,中國由積極開放逐漸走向閉關鎖國,中國在世界上逐漸落伍了。 政治新興的資產階級產生,不斷沖擊著舊的封建統治。封建君主專制不斷強化并在清朝時期達到頂峰。
高三復習專題《近代中國的民主革命》知識體系凌亂,對于基礎較差的學生來說,單純地記憶多場列強侵華戰爭、仁人志士救亡圖存英勇事跡、國內外環境的風起云涌已經很難,更何談建立起歷史環境與重大史實之間的相互影響了。筆者引導學生將近代中國重大史實分為“內憂外患”及“救亡圖存(民主實踐)”兩大線索,再依據時間,采用大事年表的方式記錄整理(如表2)。
以大事年表為認識工具,學生不只抓住了“內憂外患”“救亡圖存”兩大線索,明確列強侵華的時間及重大事件在歷史進程中的重要作用,而且容易將相關史實進行縱向對比,對照史實前后發生的次序并思考其中的微妙聯系。例如,義和團運動的爆發原因之一是天主教教徒在華擴張勢力范圍,與中國本土民間信仰產生文化和信仰方面的沖突;義和團以“滅洋”為口號,具有盲目排外的特征,從而引發了八國聯軍侵華、火燒“圓明園”的罪惡行徑。而清政府迫于列強施壓加入剿滅義和團的行列,在八國聯軍攻入北京之后淪為洋人統治中國的工具,這也就堅定了革命人士推翻清廷統治的決心。辛亥革命爆發后多個省份積極響應,隨后紛紛宣布獨立,華夏大地上延續上千年的帝制如巨峰瞬間轟然倒塌。
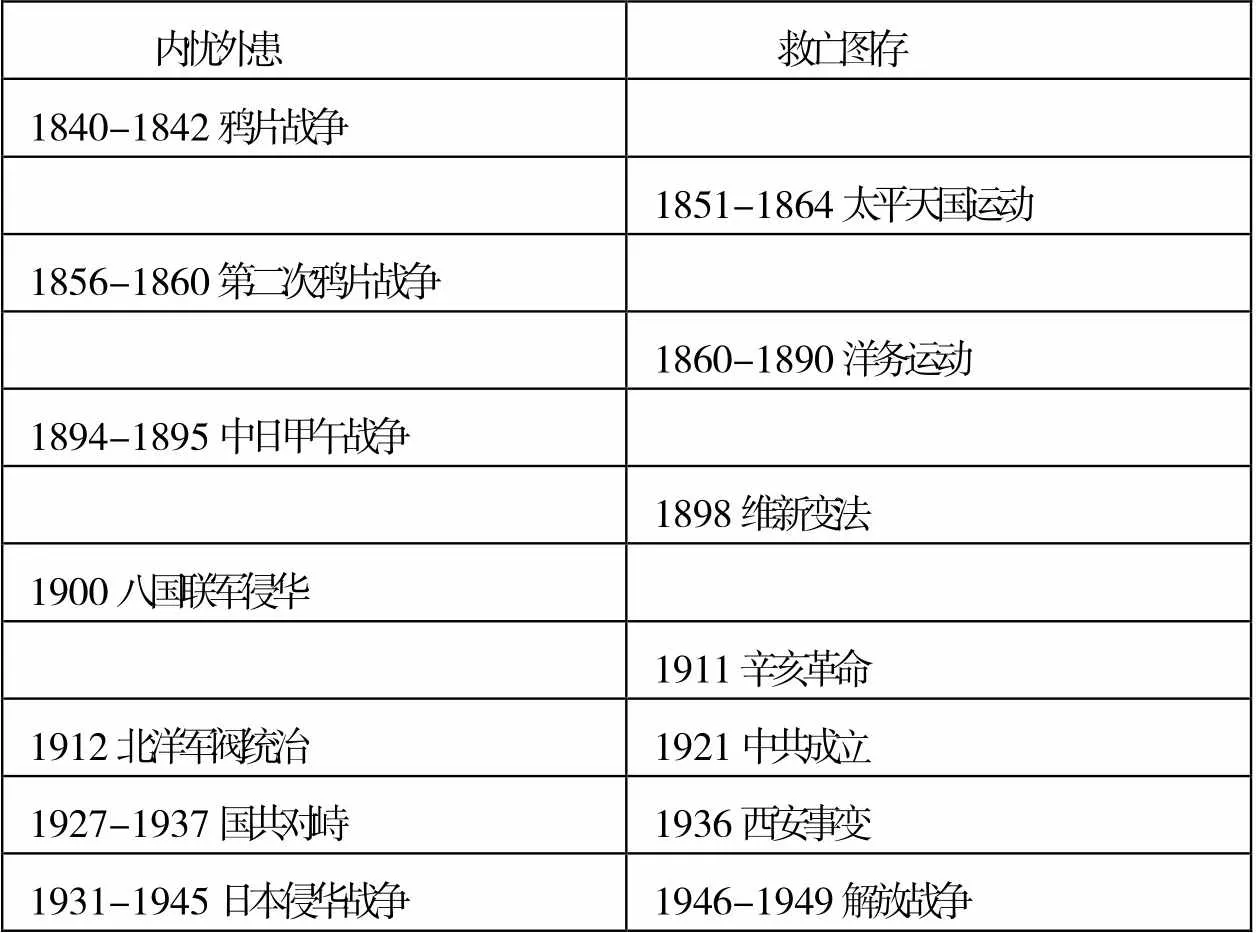
表2 百年中國1840-1949
三、運用時間軸,呈現歷史事件發展脈絡
教學統編教材《中外歷史綱要(上)》第19課《辛亥革命》時,教師也可以用時間軸的形式梳理革命的基本進程:
1911年10月10日,武昌起義爆發。
1912年1月1日,孫中山先生就任臨時大總統,中華民國成立。
1912年1月20日,南京臨時政府向袁世凱提交了清帝退位的諸項條件。
1912年2月12日,隆裕太后與宣統帝頒發詔書,宣布清帝退位。
1912年3月10日,袁世凱在北京宣誓,就任中華民國臨時大總統。
1912年3月11日,南京臨時政府頒布《臨時約法》。
而關于辛亥革命的背景(革命前十年),同樣也可以使用時間軸的形式呈現出來。
四、巧用地圖史料,拓寬歷史思維視角
德國史學界有一個形象生動的比喻:“歷史有兩只眼睛,一只是年代學,一只是地理學。”而傳統教學模式往往忽略了地理空間對學生思維觀念的培養,限制了他們思考問題的視角、廣度和思維深度。故歷史教師應充分利用教材及地圖冊,或者在課件中運用Flash(動畫制作),巧用地圖史料再現空間情境,實現對文字知識的有效補充,幫助學生形成鮮活生動的歷史體驗。
以日本侵華戰爭為例,教師可借助現代信息技術手段,采用當時中國地圖,考查中國與日本的相對方位,鼓勵學生思考:為什么日本入侵中國要把東北三省作為重要戰略目標?與中國其他省份相比,東北三省的地理方位、山川資源、要塞位置等方面有何特別之處?
其次,要求學生依照時間順序在地圖上標出有代表性的日本侵華事件,以及在國共兩黨的領導下中華民族“一寸山河一寸血”的前赴后繼的光輝事跡,包括長城抗戰、九一八事變、淞滬抗戰、華北事變、太原會戰、南京大屠殺、臺兒莊戰役、武漢會戰、長沙保衛戰、百團大戰、派遣遠征軍入緬作戰等。在這個過程中,學生不難發現地理方位、山川形勢、戰略資源甚至風土人情之于軍事作戰的重要影響。日本軍隊先行占領東北三省,從東北三省掠奪了大量戰略物資,再舉兵南下,步步為營,不斷蠶食和蹂躪我中華大地。而中國軍隊在敵強我弱的情況下,為了保留軍事斗爭的有生力量,抗戰初始階段不得不與敵人斡旋,甚至放棄一些戰略要塞,與日軍展開“拉鋸戰”,同時積極尋求戰略防御與反攻的突破口,明智地提出“持久戰”的方針。
再以《開辟新航路》為例,參考人教版高中歷史必修二第24頁“新航路開辟示意圖”(如圖1),讓學生了解舊航路及歐洲在舊航路中的角色,以便和新航路做對比,新航路究竟“新”在哪些方面?這樣,學生更能理解新航路開辟的原因(背景)及必要性和可能性,而且可以培養學生的比較思維,讓他們在自主學習的過程中強化對基本知識的掌握。
圖1
接著,教師可讓學生在課本的地圖上標出“1493年的教皇子午線”和“1484年西、葡兩國締結的條約規定的界限”(如圖2),(在授課過程中,教師可簡要介紹1493年教皇子午線的不合理之處)讓學生思考地理大發現對歐洲的深遠影響及具體表現。
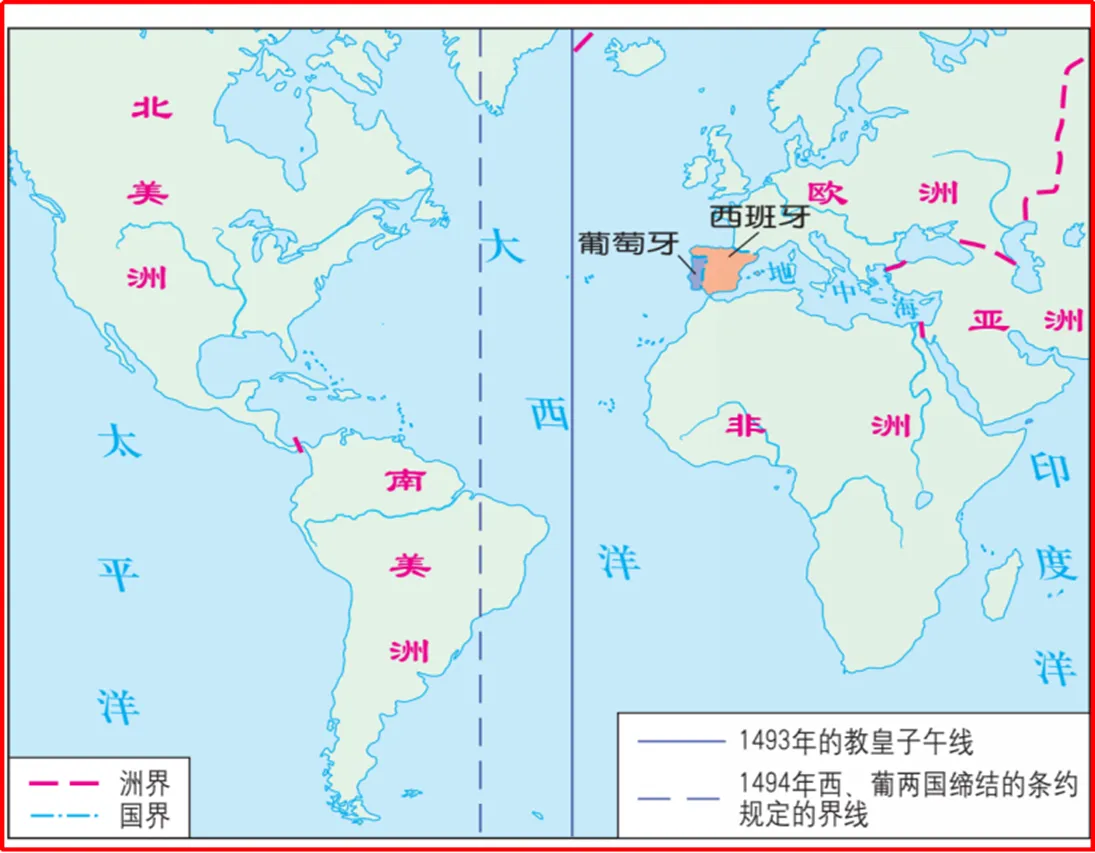
圖2
以上內容為筆者對在高中歷史課堂上落實學生“時空觀念”素養的一些淺顯思考,還需經過教學實踐繼續考驗。當然,“時空觀念”素養的真正落地生根不是件容易的事,需要歷史教師在日常的教學過程中反復引導學生自主地把事件與事件發生的時間、具體的空間聯系起來,把歷史事件、歷史人物放在特定的時間和具體的坐標軸下進行審視,對歷史事件從不同的角度進行思考。
[1] 教育部.普通高中歷史課程標準(2017年版)[M].人民教育出版社,2017:2.
[2] 教育部.普通高中歷史課程標準(2017年版)解讀[M].高等教育出版社,2018:56.
[3] 趙志漢.歷史學科的時間觀念教學[J].中學歷史教學,1992(11).
[4] 汪建紅.論高中生的歷史核心素養——基于高考試題的實際分析[J].歷史學科核心素養培養研究,武漢:武漢大學出版社,2017:93.
G632
A
1002-7661(2022)12-0126-03
本文為甘肅省臨夏州教育科學規劃2020年度課題。立項號:LX【2020】GH140。

