遮光對木荷和楓香光合特性的影響
朱婷婷,王懿祥,朱旭丹,尤譽杰,邱烷婷
(1.浙江農林大學 亞熱帶森林培育國家重點實驗室培育基地,浙江 臨安311300;2.浙江農林大學 環境與資源學院 浙江省森林生態系統碳循環與固碳減排重點實驗室,浙江 臨安 311300)
遮光對木荷和楓香光合特性的影響
朱婷婷1,2,王懿祥1,2,朱旭丹1,2,尤譽杰1,2,邱烷婷1,2
(1.浙江農林大學 亞熱帶森林培育國家重點實驗室培育基地,浙江 臨安311300;2.浙江農林大學 環境與資源學院 浙江省森林生態系統碳循環與固碳減排重點實驗室,浙江 臨安 311300)
在浙江臨安次生灌叢群落中設置3種不同遮光率的光環境(0%,50%,70%),觀測及比較不同光環境中木荷Schima superba和楓香Liquidambar formosana部分葉片特征、光合色素質量濃度、葉綠素熒光和凈光合速率,探討遮光處理對木荷和楓香生理生態的影響。結果表明:遮光處理下木荷葉片和楓香葉片比葉面積、相對含水量以及光合色素質量濃度均顯著增大(P<0.05);不同光照條件下木荷葉片比葉質量和葉綠素a/b均比楓香小,而比葉面積較大;遮光處理楓香葉片Fv/Fm均低于全光照,且70%遮光條件下Fv/Fm為0.74;木荷葉片Fv/Fm值均為0.75~ 0.85;50%遮光程度下,12:00時間段木荷葉片凈光合速率高于全光照條件。綜上所述,木荷較楓香耐蔭,能適應更寬的光照幅度。在亞熱帶次生灌叢演替進程中,木荷不同于楓香,在森林演替上屬于中間性類型,在強光條件下適度遮光可促進其生長。圖3表2參26
樹木生理學;遮光;比葉面積;比葉質量;光合色素質量濃度;光合系統Ⅱ最大光化學效率;凈光合速率日變化
常綠闊葉林因人類不合理利用,遭到嚴重破壞,其殘存的母樁、根莖、種子等地下繁殖體會因為亞熱帶地區有利的水熱條件而由殘存體發展成為大面積的次生林、次生灌叢和灌草叢[1]。自然條件下,屬于退化生態系統的亞熱帶次生灌叢經過長時間的逐步恢復形成針葉樹先鋒群落[2-3],但仍有大面積的次生灌叢群落存在著演替更新困難的問題[1]。順從生態系統的演替規律進行的人為干擾演替是促進次生灌叢正向演替最有效和最省力的辦法[4]。一般地,非耐蔭種會逐漸地被中度耐蔭種和更耐蔭種取代,從而演替成為頂極種。近年來,人為干擾演替成為生態方面研究的熱點,選取更多的功能組樹種,借助熒光技術,從光合生理特征和可塑性大小角度進行研究將成為今后的趨勢,而這對生態恢復和近自然林業建設具有重要的意義[5]。植物的耐蔭性(shaded-tolerance或shade-adapted)是由植物的遺傳特性和外部光環境變化的適應性共同決定的[6―8]。通過植物耐蔭性可判斷適宜其生長的演替階段。遮光條件下,植物一般通過減小比葉質量、增大比葉面積、增加葉綠素質量分數以及降低葉綠素a與葉綠素b比值等進行光合作用和光形態建成[9]。近年來,關于遮光對植物影響的研究得到重視,例如對遮光條件下植物的光合特性、葉綠素熒光特性以及其他的生理特性響應的研究[8-12]。這些研究有利于理解植物對不同光環境的響應機制,為葉片特征、葉綠素熒光和凈光合速率作為指標判斷植物耐蔭性提供依據,但這些實驗大多是針對園林樹種的盆栽實驗,缺乏實地驗證。天然次生灌叢中由于缺乏喬木層,光照充足,自然條件下演替中后期樹種更新困難[1]。如果通過人工設置遮光條件能夠成功補植中后期樹種,將對加快次生灌叢的演替起重要的作用。木荷Schima superba和楓香Liquidambar formosana是中國亞熱帶重要的優良鄉土速生闊葉樹種[13],是近些年來浙江省喜聞樂見的針葉林闊葉化改造混交樹種。本研究通過在天然次生灌叢群落種植常綠闊葉樹木荷(演替中后期代表種)和落葉闊葉樹楓香(演替早期代表種),并設置人工控制光照實驗,探討它們在不同光環境下葉片光合指標方面的響應差異,為把握次生灌叢的近自然演替規律及生態恢復和人工管理提供理論指導和實踐參考,對加速次生灌叢群落演替及生態恢復具有重要意義。
1 研究區域和研究方法
1.1 研究區域概況
研究樣地位于國家森林城市浙江省臨安市境內(29°56′~30°23′N,118°51′~119°52′E)。該地位于中亞熱帶季風氣候區,溫暖濕潤,四季分明,具有春多雨,夏濕熱,秋氣爽,冬干冷的氣候特征。全年平均氣溫為16.4℃,全年降水量1 628.6 mm,日照時數1 847.3 h,森林覆蓋率達76.5%。
試驗地為次生灌叢群落,樣地總面積為9 600 m2。由于人為干擾和破壞,該次生灌叢群落在20世紀70年代由常綠闊葉林退化形成,經調查目前主要樹種有短柄枹Quercus glandulifera,麻櫟Quercus acutissima,檵木Loropetalum chinensis,杜鵑Rhododendron simsii和白櫟Quercus fabri等。土壤類型為紅壤,貧瘠,且易受到采草藥、上墳等人為干擾,影響次生灌叢群落的正向演替,經過長時間的恢復整個群落高度依然不到2.0 m。
1.2 試驗設計
2013年10月,將生長良好,樹高均為1.2 m左右的木荷苗和楓香苗栽植到試驗地內,對栽植穴1.0 m直徑范圍以內進行撫育,不進行施肥澆水,任樹木在自然條件下生長。
2014年6月13日,選擇生長良好,長勢一致,且位于同一坡面的木荷和楓香作為實驗對象,采用2種不同遮光率的黑色遮陽網材料對樹木進行遮光處理。遮陽網設于離地面2.0 m處,遮光處理試驗分別為全光照(遮光率0%,透光100%),50%(遮光率50%,透光50%),70%(遮光率70%,透光30%)3個處理。光照強度根據LC pro-便攜式光合儀記錄的葉表光強來確定,各處理的空氣濕度、土壤濕度及氣溫經測定無明顯差異。木荷和楓香分別選擇10株·遮光度-1,隨機設置遮光處理。每次采樣時隨機選擇5株植株上部當年生的成熟葉片3片,對它們進行葉綠素熒光最大光化學效率(Fv/Fm)值和凈光合速率日變化測定,測量3次·葉片-1;完成光合參數測定后,采取所測葉片,葉片去除葉柄后裝入編好號的自封袋,帶回實驗室進行部分葉片特征和光合色素質量濃度測定。
1.3 測定項目與方法
1.3.1 葉片參數測定 2014年10月22日對采回來的葉片利用6 mm打孔器取葉圓片,30個·株-1,利用電子天平稱取鮮質量,然后用烘箱烘干(105℃下殺青30 min,80℃連續烘干至恒量)。比葉干質量為葉片干質量與葉面積的比值,是比葉面積(SLA)的倒數值[14],比葉鮮質量為葉片鮮質量與葉面積的比值。
1.3.2 光合色素質量濃度測定 2014年10月22日選取新鮮葉片,擦拭干凈,去主脈,稱取0.1 g,剪成大小均勻的小塊,放入具塞的試管中,加入10 mL體積分數為80%丙酮和無水乙醇1∶1混合提取液,放置于黑暗條件下,充分浸泡提取20 h直到葉片全白為止,然后采用722S可見光分光光度計測定提取液的吸收光譜,讀出各提取液分別在645 nm和663 nm處的吸光度,計算葉綠素a,葉綠素b以及葉綠素(a+b)質量濃度。
1.3.3 葉綠素熒光參數測定 葉綠素熒光參數的測定采用OS5p調制式葉綠素熒光儀(美國OPTSINCENS)。2014年10月17日9:00-14:00時間段,選取植株自生長點之下的第3片、第4片和第5片活體葉片,經過暗適應20 min后測定,選擇Fv/Fm模式。
1.3.4 光合日變化參數測定 采用LCpro+便攜式光合儀獲取凈光合速率。與葉綠素熒光參數同一天測定,2014年10月17日 8:00-16:00測定凈光合速率日變化過程,隔2 h測量1輪:8:00,10:00,12:00,14:00,16:00所示的時間點是指每一輪測量的起始時間點,選定3株樹進行采樣,選擇樹葉3片·株-1(葉片選擇當年生第3片、第4片、第5片葉子),每片葉子同一部位測定3個數據。每一輪測量的順序與上一輪保持一致
1.4 數據處理
采用Excel 2003以及SPSS 23對數據進行統計分析,采用單因素方差分析法(one-way ANOVA),利用Sigmaplot 10.0進行圖形繪制。文中的數據均為平均值±標準誤。
2 結果與分析
2.1 遮光對木荷和楓香葉片參數的影響
由表1可知:木荷葉片比葉面積隨遮光程度升高而增大,于70%遮光處理達到最大值,比全光照處理增加了46.15%,與全光照處理有顯著性差異(P<0.05);比葉干質量和比葉鮮質量均隨遮光率增加而降低,在遮光率70%處理下最小,相較于全光照,分別降低了31.93%和25.08%,與全光照處理差異顯著(P<0.05)。
楓香葉片比葉面積隨遮光率增加先增大后減小,于全光照處理取得最小值,50%遮光處理達到最大值,比全光照條件增加了55.47%,且3個不同處理間差異顯著(P<0.05);比葉干質量和比葉鮮質量均隨遮光率增加先下降后上升,均在50%遮光處理取得最小值,相較于全光照條件,分別減小了35.60%和27.48%;比葉干質量在全光照與遮光處理間差異顯著(P<0.05);比葉鮮質量在50%遮光與全光照處理差異顯著(P<0.05)。全光照條件下木荷葉片和楓香葉片的相對含水量均顯著小于遮光條件(P<0.05)。
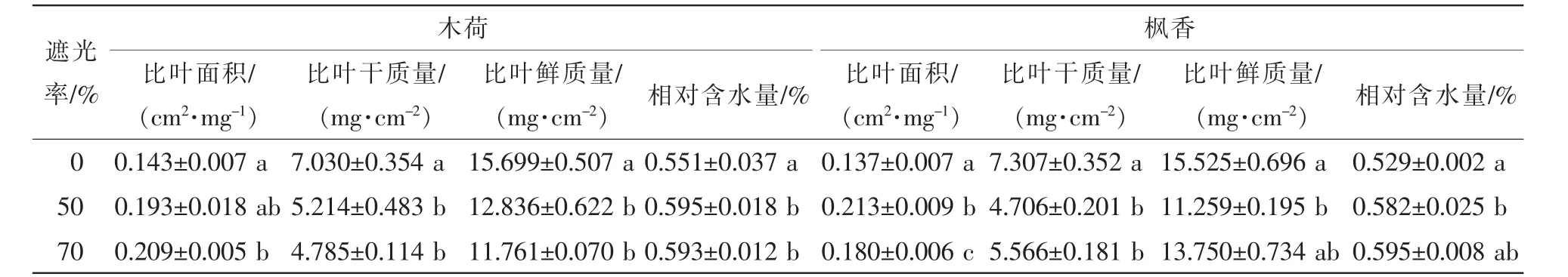
表1 遮光對木荷和楓香葉片特征的影響Table 1 Effect of shade on leaf morphography of Schima superba and Liquidambar formosana
2.2 遮光對木荷和楓香的光合色素質量濃度的影響
如表2所示:遮光處理下相同質量(0.1 g)木荷葉片和楓香葉片的葉綠素a(Chl a),葉綠素b(Chl b),以及葉綠素總量(Chl a+b)均高于全光照處理,且隨遮光率增加而增加,均在遮光率70%處理下取得最大值,與全光照相比分別增加66.92%,119.35%,79.95%和120.37%,171.56%,133.76%。木荷葉片葉綠素a與葉綠素b之比(Chl a/b)隨遮光率增加先下降后保持穩定。楓香葉片Chl a/b隨光蔭梯度增加呈現下降趨勢。楓香葉片和木荷葉片均在全光照條件下獲得最大Chl a/b,遮光處理與全光照處理均有顯著性差異(P<0.05)。遮光處理木荷Chl a/b值約為2.3,而楓香大于2.3。從不同遮光處理木荷葉片和楓香葉片的葉綠素變化量看,不同遮光處理對木荷葉綠素質量濃度各個指標值的影響并不大,而楓香葉綠素質量濃度變化劇烈。
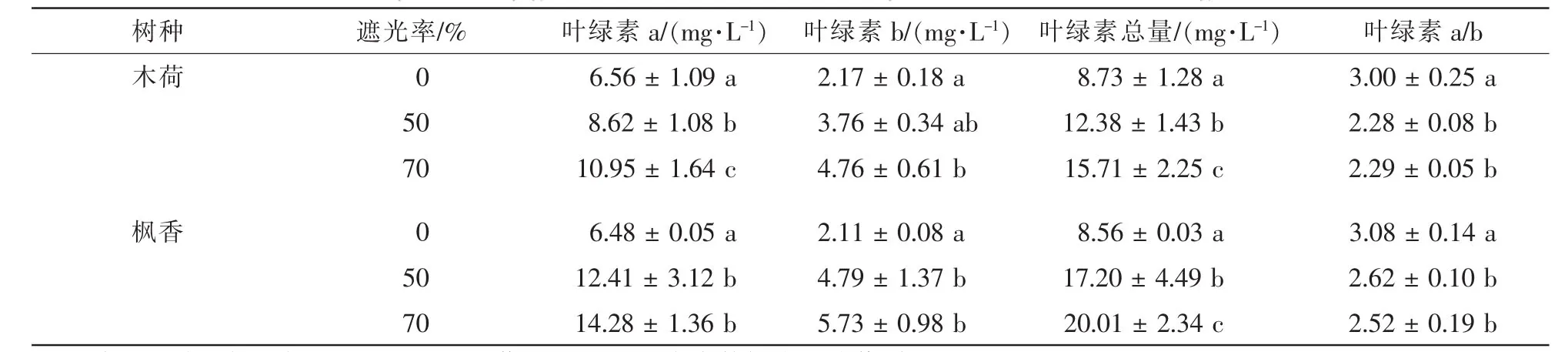
表2 不同遮光處理下2種植物葉片光合色素質量濃度Table 2 Comparison of pigment contents in leaves of two species under different shading treatments
2.3 遮光對木荷和楓香的凈光合速率日變化和葉綠素熒光Fv/Fm的影響
由圖1可得:3個不同光環境楓香葉表光強均呈先上升后下降趨勢,且具相似的變化趨勢,均于12:00取得峰值。全光照條件楓香葉表光強變化呈現 “單峰型”,且10:00和14:00,8:00和16:00分別具有相近的光照強度,近似 “對稱結構”;而遮光條件下葉表光強的日變化不具 “對稱結構”。木荷葉表光強也呈先上升后下降趨勢,且均于12:00取得1天中葉表光強最大值,12:00至14:00時間段的葉表光強下降幅度較大,木荷葉表光強均小于楓香葉表光強。
全光照下楓香葉片和木荷葉片凈光合速率均呈 “雙峰型”(圖2),分別于1 d中的10:00和14:00取得峰值,1 d中的12:00取得最低值,而遮光處理凈光合速率變化呈 “單峰型”,均于12:00取得峰值。2個不同遮光梯度楓香葉片凈光合速率具有相似的變化趨勢;1 d中3個不同光環境楓香凈光合速率為全光照>50%遮光>70%遮光。70%遮光下木荷凈光合速率日變化趨勢較平緩,而50%遮光變化劇烈,尤其是10:00-14:00時間段;50%遮光處理木荷葉片凈光合速率在12:00時間段明顯大于全光照條件。
由圖3所示:木荷葉片Fv/Fm值隨遮光率增加無明顯變化,3個不同處理組均為0.79,且各處理均無顯著性差異(P>0.05)。楓香葉片Fv/Fm值均低于全光照條件,且隨著遮光梯度增加呈現減小趨勢,于70%遮光條件達到最小值,與全光照條件相比減少2.97%;70%遮光處理與全光照處理有顯著性差異(P<0.05),其余各處理無顯著性差異(P>0.05)。不同遮光處理下,木荷葉片Fv/Fm值均位于0.75~ 0.85,而楓香葉片的Fv/Fm值在70%遮光處理下為0.74,其變化趨勢比木荷葉片明顯,且均小于木荷葉片Fv/Fm值。
3 討論
3.1 遮光對葉片特征的影響
葉片是植物響應光環境的一個較好的表征[15]。在植物葉形態特征中,比葉質量對光照敏感[16-17],與光合速率關系密切。很多研究表明,耐蔭植物比葉質量比非耐蔭植物低[18-19]。相對含水量和比葉面積被認為是不同光照密度條件下葉片結構和葉形態建成的指標[20]。弱光條件下,木荷和楓香2個樹種均具有擴大葉面積來進行光合作用的能力。單從不同遮光楓香葉片比葉面積和比葉質量判斷,中度遮光下楓香比高遮光程度生長好,但高遮光下木荷通過擴大葉面積進行光合作用的能力比楓香葉片強。由此可見,木荷耐蔭能力強于楓香。根據張云等[10]研究,弱光條件下耐蔭植物的比葉面積小于非耐蔭植物,這與上述結果有偏差。從實驗結果看,無論全光照還是遮光處理,木荷比葉質量均較小,比葉面積較大。
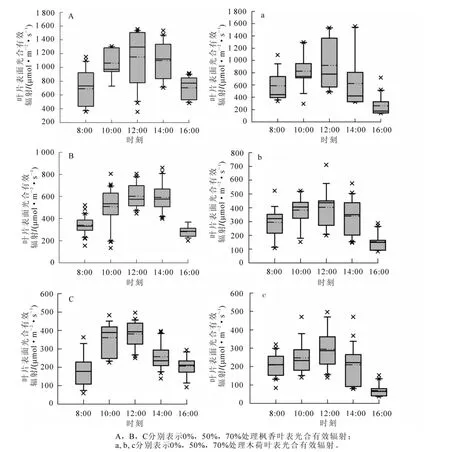
圖1 不同遮光下楓香和木荷葉表光合有效輻射日變化Figure 1 Diumal variation of photosynthetically active radiation(PAR)on leaf surface of Liquidambar formosana and Schima superba
3.2 遮光對光合色素質量濃度的影響
葉綠素a在紅光部分的吸收帶偏向長光波,葉綠素b藍紫光部分的吸收帶較寬[6,21]。弱光條件下,具有較高葉綠素 a+b質量濃度和較低葉綠素 a/b值的植物,有較高的光合活性,捕獲光能的效率更高些[6]。遮光處理不同程度地提高了木荷和楓香的葉綠素a,葉綠素b以及葉綠素總量,降低了葉綠素 a/ b值,與張聰穎等[10]在研究遮光對紅葉石楠Photinia×frasery和灑金桃葉珊瑚Aucuba japonica葉綠素影響的結果相同。本研究葉綠素與AYENI等[22]研究中的葉綠素質量分數值偏差不大。具有陽性適應能力的植物具有更高的葉綠素a/b值,也表明其光捕獲蛋白數量更少。本研究表明不同遮光梯度下楓香葉綠素質量濃度變化劇烈,而木荷變化較緩和。從遮光處理和全光照下木荷葉片葉綠素a/b的變化來看,木荷葉片對藍紫光的利用效率較高,更適應于遮光生長。陽性植物的葉綠素a/b約為3,耐蔭植物的葉綠素a/b約為2.3[9]。由此可見,木荷比楓香耐蔭,且能適應較寬的光照幅度。
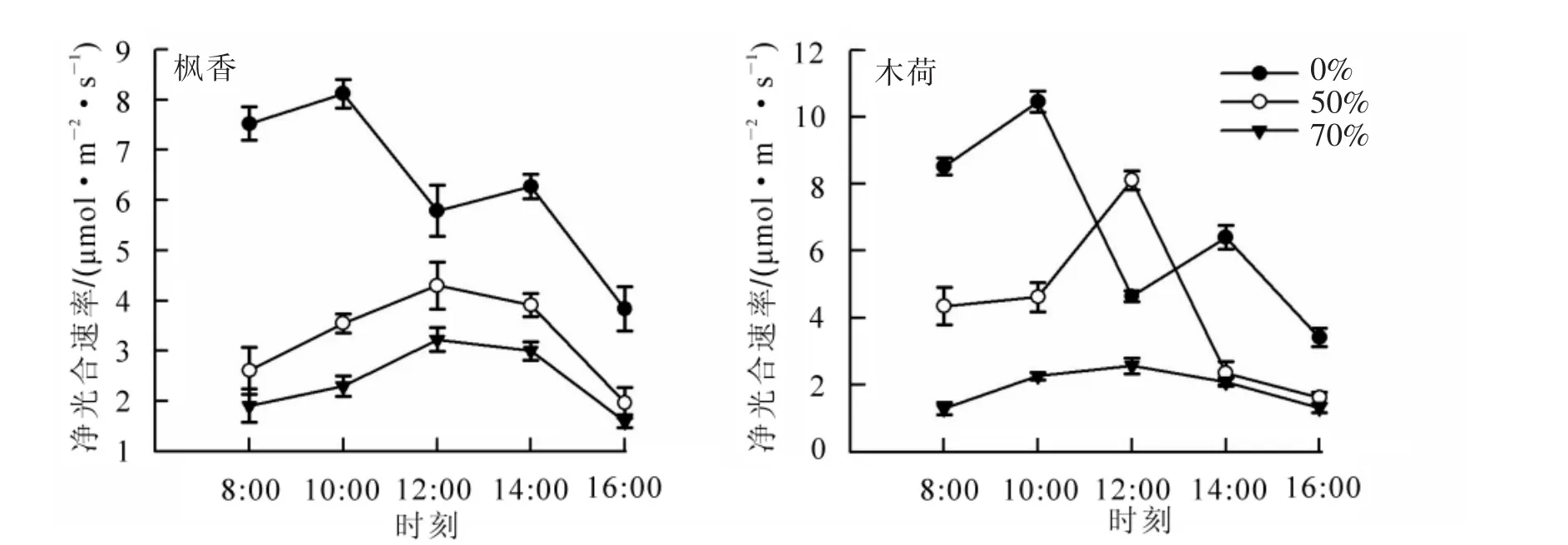
圖2 不同遮光條件下楓香和木荷凈光合速率日變化Figure 2 Diumal variation of net photosynthetic rate of Liguidamar formosana and Schima superba in different treatments
3.3 遮光對木荷和楓香凈光合速率日變化和熒光參數Fv/Fm的影響
植物凈光合速率可以直觀地表述植物進行光合作用的能力[9]。遮光對木荷和楓香的影響明顯不同。光照越強,楓香的凈光合速率越大,固碳釋氧能力越強。光照最強時,木荷遮光比全光照有更高凈光合速率,可能是由于全光照條件高溫和高光強引起部分氣孔關閉,導致氣體交換受阻,從而降低了光合速率,出現 “午休”現象[9-10]。葉綠素熒光信號被視為植物光合作用與環境關系的內在指標[23],可評估植物對環境的適應性和是否受到抑制[24],未受到任何外界條件的抑制,如水分、光強等,Fv/Fm的值一般為0.75~0.85[11,23],但植物一旦受到非生物和生物脅迫,Fv/Fm值便會減小[25]。本研究結果說明高程度遮光下楓香受到一定的脅迫[26]。不同光環境下Fv/ Fm值變化說明遮光對楓香具有一定的影響。根據實驗結果,高程度遮光使楓香葉片Fv/Fm變小,而木荷葉片Fv/ Fm值在不同光環境下均處于正常范圍,且遮光處理的Fv/ Fm值與全光照相比變化不大,表明遮光處理對木荷葉片的原初光能轉化效率影響不大,且均未受到脅迫。木荷既能適應強光,也能適應弱光,對光照的適應幅度較大。遮光條件下木荷部分葉片特征、光合色素質量濃度和葉綠素熒光參數Fv/Fm值等各個指標變化幅度較小,由此可見,木荷葉片對光照稍不敏感,能適應較大光照幅度。而遮光處理下楓香葉綠素a,葉綠素b以及葉綠素總量均大幅度增加,PSⅡ最大光化學效率(Fv/Fm)和凈光合速率均明顯小于全光照,楓香對光照敏感,且適合在強光條件下生長。
楓香幼苗喜光,對光照敏感,而木荷幼苗較楓香幼苗稍耐蔭且能適應更大的光照幅度,在光照充足的次生灌叢林地上(無喬木遮蔽),對木荷幼苗適度遮蔭在一定程度上能增加凈光合速率,促進木荷幼苗生長,有利于木荷在次生灌叢群落的定居,這對促進次生灌叢群落的正向演替具有重要意義。
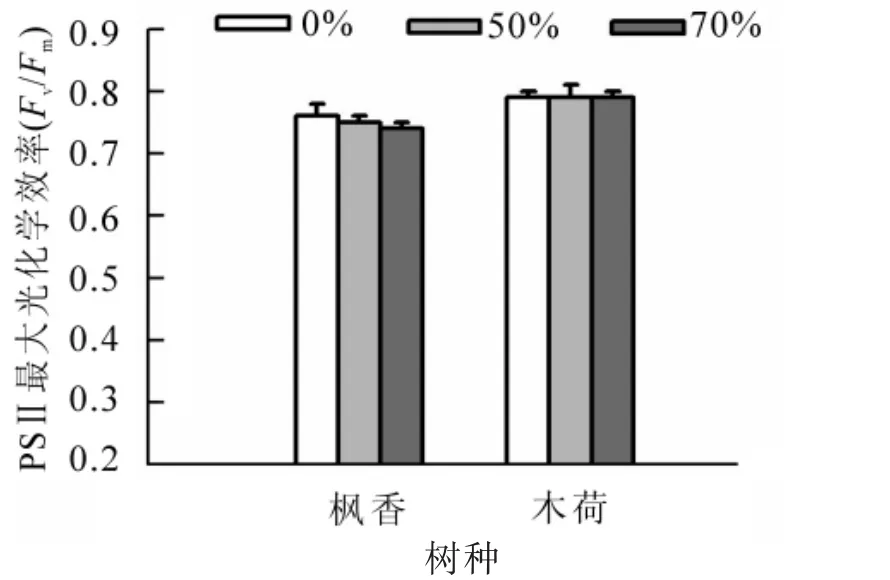
圖3 不同遮光處理下木荷和楓香葉片葉綠素熒光參數Fv/FmFigure 3 Chlorophyll fluorescence parameter Fv/Fmof S. superba and L.formosana in different treatments
[1] 王希華,閆恩榮,嚴曉,等.中國東部常綠闊葉林退化群落分析及恢復重建研究的一些問題[J].生態學報, 2005,25(7):1796-1803.
WANG Xihua,YAN Enrong,YAN Xiao,et al.Analysis of degraded evergreen broad-leaved forest communities in Eastern China and issues in forest restoration[J].Acta Ecol Sin,2005,25(7):1796-1803.
[2] 張光富,宋永昌.浙江天童苦櫧+白櫟灌叢群落的生物量研究[J].武漢植物學研究,2001,19(2):101-106.
ZHANG Guangfu,SONG Yongchang.Studies on the biomass of Castanopsis sclerophylla+Quercus fabri shrubland in Tiantong Region,Zhejiang Province[J].J Wuhan Bot Res,2001,19(2):101-106.
[3] 趙平,彭少麟,張經煒.恢復生態學——退化生態系統生物多樣性恢復的有效途徑[J].生態學雜志,2000,19(1):53-58.
ZHAO Ping,PENG Shaolin,ZHANG Jingwei.Restoration ecology:an effective way to restore biodiversity of degraded ecosystems[J].Chin J Ecol,2000,19(1):53-58.
[4] 李翠環,余樹全,周國模.亞熱帶常綠闊葉林植被恢復研究進展[J].浙江林學院學報,2002,19(3):325-329.
LI Cuihuan,YU Shuquan,ZHOU Guomo.Review of researches in restoration of rubtropical evergreen broad-leaved forests[J].J Zhejiang For Coll,2002,19(3):325-329.
[5] 胡啟鵬,孫玲玲,郭志華,等.常綠闊葉林中幾個不同功能組樹種葉形態、光合及光誘導對不同光環境的響應[J].華南農業大學學報,2013,34(2):207-212.
HU Qipeng,SUN Lingling,GUO Zhihua,et al.Response of leaf morphology,photosynthesis,and light induction of species seedlings from different functional groups to different light regimes in evergreen broad-leaved forest[J].J South China Agric Univ,2013,34(2):207-212.
[6] 王雁,蘇雪痕,彭鎮華.植物耐蔭性研究進展[J].林業科學研究,2002,15(3):349-355.
WANG Yan,SU Xuehen,PENG Zhenhua.Review of studies on plant shade tolerance[J].For Res,2002,15(3):349-355.
[7] 安鋒,林位夫.植物耐蔭性研究的意義與現狀[J].熱帶農業科學,2005,25(2):68-72.
AN Feng,LIN Weifu.Significances of plant shade-tolerance study and its advances[J].Chin J Trop Agric,2005,25(2):68-72.
[8] 王凱, 朱教君,于立忠,等.遮蔭對黃波羅幼苗的光合特性及光能利用效率的影響[J].植物生態學報,2009, 33(5):1003-1012.
WANG Kai,ZHU Jiaojun,YU Lizhong,et al.Effects of shading on the photosynthetic characteristics and light use efficiency of Phellodendron amurense seedlings[J].Chin J Plant Ecol,2009,33(5):1003-1012.
[9] 張云,夏國華,馬凱,等.遮蔭對堇葉紫金牛光合特性和葉綠素熒光參數的影響[J].應用生態學報,2014,25(7):1940-1948.
ZHANAG Yun,XIA Guohua,MA Kai,et al.Effects of shade on photosynthetic characteristics and chlorophyll fluorescence of Ardisia violacea[J].Chin J Appl Ecol,2014,25(7):1940-1948.
[10] 張聰穎,方炎明,姬紅利,等.遮蔭處理對紅葉石楠和灑金桃葉珊瑚光合特性的影響[J].應用生態學報, 2011,22(7):1743-1749.
ZHANG Congying,FANG Yanming,JI Hongli,et al.Effects of shading on photosynthesis characteristics of Photinia ×frasery and Aucuba japonica var.variegata[J].Chin J Appl Ecol,2011,22(7):1743-1749.
[11] 劉建鋒,楊文娟,江澤平,等.遮蔭對瀕危植物崖柏光合作用和葉綠素熒光參數的影響[J].生態學報,2011, 31(20):5999-6004.
LIU Jianfeng,YANG Wenjuan,JIANAG Zeping,et al.Effects of shading on photosynthetic characteristics and chlorophyll fluorescence parameters in leaves of the endangered plant Thuja sutchuenensis[J].Acta Ecol Sin,2011, 31(20):5999-6004.
[12] 李西文,陳士林.遮蔭下高原瀕危藥用植物川貝母(Fritillaria cirrhosa)光合作用和葉綠素熒光特征[J].生態學報,2008,28(7):3438-3447.
LI Xinwen,CHEN Shilin.Effect of shading on photosynthetic characteristics and chlorophyll fluorescence parameters in leaves of Fritillaria cirrhosa[J].Acta Ecol Sin,2008,28(7):3438-3447.
[13] 徐漫平,周侃侃,黃麗霞.木荷、楓香樹不同樹齡木材理化性能差異性研究[J].江蘇林業科技,2009,36(2): 23-27.
XU Manping,ZHOU Kankan,HUANG Lixia.The physical and chemical characteristics of wood of Schema superba and Liquidambar formosana with different ages[J].J Jiangsu For Sci Technol,2009,36(2):23-27.
[14] 薛偉,李向義,朱軍濤,等.遮蔭對疏葉駱駝刺葉形態和光合參數的影響[J].植物生態學報,2011,35(1):82-90.
XUE Wei,LI Xiangyi,ZHU Juntao,et al.Effects of shading on leaf morphology and response characteristics of photosynthesis in Alhagi sparsifolia[J].Chin J Plant Ecol,2011,35(1):82-90.
[15] POOTER L,BONGERS F.Leaf traits are good predictors of plant performance across 53 rain forest species[J].E-cology,2006,87(7):1733-1743.
[16] TERASHIMA I,MIYAZAWA S I,HANBA Y T.Why are sun leaves thicker than shade leaves?-consideration based on analyses of CO2diffusion in the leaf[J].J Plant Res,2001,114(1):93-105.
[17] OGUCHI R,HIKOSAKA K,HIROSE T.Does the photosynthetic light-acclimation need change in leaf anatomy?[J]. Plant Cell Environ,2003,26(4):505-512.
[18] KOIKE T,KITAO M,MARUYAMA Y,et al.Leaf morphology and photosynthetic adjustments among deciduous broad-leaved trees within the vertical canopy profile[J].Tree Physiol,2001,21(12/13):951-958.
[19] 齊欣,曹坤芳,馮玉龍.熱帶雨林蒲桃屬3個樹種的幼苗光合作用對生長光強的適應[J].植物生態學報, 2004,28(1):31-38.
QI Xin,CAO Kunfang,FENG Yulong.Photosynthetic acclimation to different growth light environments in seedlings of three tropical tainforest Syzygium species[J].Chin J Plant Ecol,2004,28(1):31-38.
[20] REED S,SCHNELL R,MOORE J M,et al.Chlorophyll a+b content and chlorophyll fluorescence in avocado[J].J Agric Sci,2012,15(1):101-113.
[21] 王建華,任士福,史寶勝,等.遮蔭對連翹光合特性和葉綠素熒光參數的影響[J].生態學報,2011,31(7): 1811-1817.
WANG Jianhua,REN Shifu,SHI Baosheng,et al.Effects of shades on the photosynthetic characteristics and chlorophyll fluorescence parameters of Forsythia suspense[J].Acta Ecol Sin,2011,31(7):1811-1817.
[22] AYENI O,NDAKIDEMI P,SNYMAN R,et al.Assessment of metal concentrations,chlorophyll content and photosynthesis in Phragmites australis along the lower diep river,Cape Town,South Africa[J].Energ Environ Res,2012, 2(1):128-139.
[23] 溫國勝,田海濤,張明如,等.葉綠素熒光分析技術在林木培育中的應用[J].應用生態學報,2006,17(10): 1973-1977.
WEN Guosheng,TIAN Haitao,ZHANG Mingru,et al.Application of chlorophyll fluorescence analysis in forest tree cultivation[J].Chin J Appl Ecol,2006,17(10):1973-1977.
[24] KARIM A,KOEDA K,NII N.Changes in anatomical features,pigment content and photosynthetic activity related to age of‘Irwin’mango leaves[J].Engei Gakkai Zasshi,1999,68(6):1090-1098.
[25] BAKER N R.Chlorophyll fluorescence:a probe of photosynthesis in vivo[J].Annu Rev Plant Biol,2008,59(1):89-113.
[26] 何炎紅,郭連生,田有亮.白刺葉不同水分狀況下光合速率及其葉綠素熒光特性的研究[J].西北植物學報, 2005,25(11):2226-2233.
HE Yanhong,GUO Liansheng,TIAN Youliang.Photosynthetic rates and chlorophyll fluorescence of Nitraria tangutorum at different leaf water potentials[J].Acta Bot Borleal-Occident Sin,2005,25(11):2226-2233.
Photosynthetic characteristics with shading for Schima superba and Liquidambar formosana
ZHU Tingting1,2,WANG Yixiang1,2,ZHU Xudan1,2,YOU Yujie1,2,QIU Wanting1,2
(1.The Nurturing Station for the State Key Laboratory of Subtropical Silviculture,Zhejiang A&F University,Lin’an 311300,Zhejiang,China;2.Zhejiang Provincial Key Laboratory of Carbon Cycling and Carbon sequestration in Forest Ecosystems,School of Environmental&Resource Sciences,Zhejiang A&F University,Lin’an 311300,Zhejiang, China)
The area of evergreen broad-leaf forest reversely evolved into the secondary brush community which was lower yields,weaker resistance ability and less diversity.So it was important to investigate that if it is helpful for trees growth to decrease the light intensity for sapling trees in the secondary brush stand which had a stronger light than evergreen broad-leaf forest.Schima superba and Liquidambar formosana were used in this experiment as materials to study the effects of three different shading levels (shading of 0%,50%,and 70%)on their photosynthetic characteristics.The experiment was set in a secondary bush community in Lin’an, Zhejiang.Some of the leaf characteristics,photosynthetic pigment content,chlorophyll fluorescence parameters, and net photosynthetic rate were measured.Each species were selected 10 trees as samples in every shading level,and 5 trees were chosen to measure the indicators mentioned above.Results showed that compared to the full light treatment,specific leaf area (SLA),relative water content,and photosynthetic pigment content in the shade treatments of both species increased significantly (P<0.05).The Fv/Fmvalue of L.formosana under shading was lower than that in full lightreaching 0.74 at 70%shading;whereas,Fv/Fmvalues of S.superbawere in the range of 0.75-0.85 in three different treatments.The net photosynthetic rate of S.superba with 50%shading(8.11 μmol·m-2·s-1)was higher than the full light treatment(4.64 μmol·m-2·s-1)at 12:00.Thus, S.superba which was more shade-tolerant than L.formosana could live in a wider range of light intensities including secondary bush community succession stages in the subtropics where it belonged to intermediate forest succession.[Ch,3 fig.2 tab.26 ref.]
tree physiology;shade;specific leaf area (SLA);lower specific leaf weight (SLW);pigment content;Fv/Fm;diurnal variation of net photosynthesis
S718.4
A
2095-0756(2017)01-0028-08
2016-01-20;
2016-04-07
“十二五”國家科技支撐計劃項目(2012BAD22B0503)
朱婷婷,從事森林可持續經營理論與技術研究。E-mail:zhutingting0325@163.com。通信作者:王懿祥,副教授,博士,從事森林可持續經營研究。E-mail:w_yixiang@126.com
浙 江 農 林 大 學 學 報,2017,34(1):36-41
Journal of Zhejiang A&F University
10.11833/j.issn.2095-0756.2017.01.006

