乳腺癌中BRCA通路相關基因的研究進展
劉偉玲 郭永軍(鄭州大學附屬腫瘤醫院 分子病理科 河南 鄭州 450003)
乳腺癌中BRCA通路相關基因的研究進展
劉偉玲 郭永軍
(鄭州大學附屬腫瘤醫院 分子病理科 河南 鄭州 450003)
BRCA;乳腺癌;FANCD2;PTEN;CHEK2
近年來乳腺癌是女性癌癥中最常見和死亡率最高的惡性腫瘤[1]。乳腺癌易感基因BRCA1和BRCA2是與乳腺癌發生有關的重要的抑癌基因,雖然散發性乳腺癌中BRCA1和BRCA2基因突變率不高,但攜帶BRCA1和BRCA2基因突變的女性發生乳腺癌的概率卻較高。BRCA基因已成為遺傳性乳腺癌的篩查基因,此外也存在其他易感基因與乳腺癌的發生相關。二代測序的發展使多基因檢測成為可能,本文就BRCA基因及其相互作用的乳腺癌易感基因的最新研究進展做相關綜述,為乳腺癌的預防與治療提供理論依據。
BRCA1基因由1990年Hall等[2]發現,定位于17 q21,由24個外顯子組成,編碼1 863個氨基酸。BRCA1具有轉錄調控活性及DNA損傷修復功能,參與細胞周期調控,DNA 雙鏈損傷修復,基因的轉錄調節,細胞凋亡和泛素化等重要的細胞活動。在BRCA1基因中與DNA修復有關的結構域有3個,主要包括:①N-端的鋅指結構域;②中間段Rad51結合區;③C端BRCT基序,3個區域任一區域出現突變均可使其基因產生功能,即產生BRCA1基因突變(見圖1)。BRCA2基因在1994年由Wooster等[3]發現,定位于13號染色體q12~q13,由27個外顯子組成,編碼3 418個氨基酸,其基因序列與BRCA1無明顯關系。BRCA2基因中與DNA修復有關的結構域主要為Rad51結合區(見圖1)。BRCA2的功能主要是通過同源重組和同源重組為基礎的DNA斷鏈修復,并且還在細胞生長和DNA損傷監測點控制起作用。
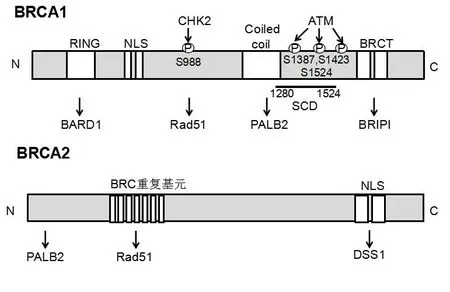
圖1 BRCA1和BRCA2基因的結構
研究發現,BRCA1和BRCA2基因突變攜帶者有很高的乳腺癌發病風險。國內數據顯示,BRCA1和BRCA2基因突變攜帶者70歲時單側乳腺癌的累積發病風險分別為67.2%和76.8%。與BRCA1不同的是,BRCA2基因突變70歲后乳腺癌的發病率繼續增加,到80歲時達93.1%。此外,BRCA1和BRCA2基因突變攜帶者對側乳腺癌10 a和20 a的累積發病率分別為19.4%和50.3%[4]。而在西方人口中BRCA1和BRCA2基因攜帶者70歲時乳腺癌發病風險也明顯增加,分別為35%和44%[5]。BRCA基因突變攜帶的高致癌風險,使得BRCA基因突變的研究更有意義。
1 BRCA通路相關基因
BRCA基因突變的乳腺癌中,除了BRCA1和BRCA2基因突變外,也有其他基因參與,不僅影響BRCA蛋白的表達,而且也影響了乳腺癌的預后。這里主要對乳腺癌FA/BRCA通路和PI3K/AKT通路對BRCA相互作用的基因及其作用機制加以闡述。
1.1 FA/BRCA通路 范可尼貧血(Fanconi anemia,FA)是一種常染色體或X染色體連鎖隱性遺傳病,表現為骨髓造血功能障礙,常伴發較高的癌癥易感性,主要為急性髓性白血病及各種實體性腫瘤。目前發現FA家族有15個基因亞型(FANCA、FANCB、FANCC、FANCD1/BRCA2、FANCD2、FANCE、FANCF、FANCG、FANCI、FANCJ/BRIP1、FANCL、FANCM、FANCN/PALB2、FANCO/RAD51C、FANCP/SLX42),而這15個基因所編碼的蛋白均參與同一條細胞信號轉導通路,此通路被命名為“范可尼貧血癥信號通路”(見圖2)。正常細胞中FA/BRCA通路處于休眠狀態,而在發生DNA 損傷時該通路被激活。DNA損傷后,由8種基因蛋白產物(FANC-A、B、C、E、F、G、L、M)組成FA復合體單泛素化FANCD2和FANCI構成的ID復合物,ID復合物激活后又被招募到DNA損傷位點,與下游蛋白PLAB2、BRCA2、BRIP1以及BRCA1、RAD51等多種DNA損傷反應蛋白相互作用,從而通過FA途徑修復DNA損傷。
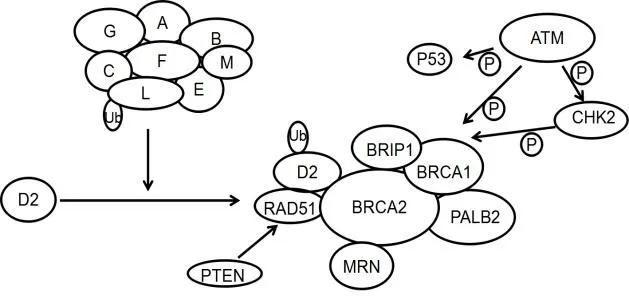
圖2 FA/BRCA信號通路作用模式圖
1.1.1 FANCD2 FANCD2是組成ID復合物的關鍵成分,FANCD2的泛素化是FA/BRCA通路的關鍵步驟,FANCD2泛素化后,在核內靶向與下游蛋白相互作用,促進乳腺癌的形成。FANCF作為一種銜接蛋白,其N端FANCC/FANCE亞單位相互作用,C端與FANCA/FANCG亞單位相互作用,發揮FA復合體的作用,可影響FANCD2的泛素化過程。研究發現,通過沉默FANCF基因,使得FANCD2表達降低,FA/BRCA通路失活,結果顯示乳腺癌細胞生長抑制、侵襲力下降,而細胞對化療藥物米托蒽醌、阿霉素、絲裂霉素的敏感性增加[6]。但研究也發現[7],在家族性乳腺癌中BRCA1蛋白的表達與FANCD2蛋白的表達差異有統計學意義,而散發性乳腺癌中,兩種蛋白表達差異無統計學意義。未來FANCD2可作為一種靶點來改變FA/BRCA通路,從而有效治療BRCA基因突變型乳腺癌。
1.1.2 FANCN(PALB2) FANCN/PALB2(BRCA2的定位和伴隨蛋白)是通過與BRCA2的相互作用而被發現的,因其二等位基因的截斷突變可導致新型的范可尼貧血(FA-N)。DNA損傷后BRCA1召集PALB2,PALB2再通過與BRCA2的相互作用促進BRCA2以及RAD51在DNA損傷點的積累,促進同源重組修復過程。在遺傳性乳腺癌中PALB2基因突變率為5.5%,甚至高于BRCA2基因突變率,而PALB2基因突變攜帶者發生乳腺癌的風險為33%~58%,提示PALB2可作為BRCA1/2之外的新型篩查基因[8]。研究發現,PALB2基因突變能導致其與BRCA2的結合作用喪失,應用PARP抑制劑能導致合成致死性[9]。
1.1.3 FANCJ(BRIP1) FANCJ/BRIP1定位于17號染色體,緊鄰BRCA1(17q21),基因編碼一種新型蛋白BACH1,可以和BRCA1中兩個BRCT結構域相互作用。BACH1屬于DEAH DNA解螺旋酶家族成員,BACH1和BRCT突變可以抑制BRCA1的DNA斷裂修復過程。研究發現,BRIP1突變能導致乳腺癌的發生,BRIP1的高突變率使得BRIP1成為一種新型的靶點,BRIP1抑制劑用于乳腺癌的治療仍處于研究中[10]。
1.1.4 CHEK2 細胞周期檢測點激酶 2(cell cycle checkpoint kinase 2,CHK2或CHEK2)是一種抑癌基因,編碼的蛋白為Chk2激酶,其結構特異性區域包含絲氨酸-谷氨酸/絲氨酸-谷氨酰胺氨基酸對(SQ/TQ)富含區,叉頭相關結構域(FHA)和靠近C端的蛋白激酶結構域(KD)。DNA損傷誘導ATM基因磷酸化后,進一步激活CHK2,與CHK2激酶N端的SQ/TQ區相互作用,使一系列位點磷酸化,包括BRCA1的Ser988,使細胞周期進程發生阻滯,同時激活修復基因的轉錄,促進細胞對損傷進行修復。此外,BRCA1能夠維持染色體的穩定性,然而只有CHK2介導的BRCA1磷酸化才能保證有絲分裂紡錘體準確的形成。CHK2的缺失會影響BRCA1對微管著絲粒的形成作用,導致染色體不穩定[11]。CHK2在有絲分裂的這種功能為癌癥治療提供了新的觀點。研究發現,CHK2抑制劑AZD7762聯合順鉑治療,有效抑制了腫瘤細胞的生長[12]。
1.1.5 BARD1 BARD1是1996年由研究人員發現和BRCA1具有相似的環指功能域,可以和BRCA1蛋白結合,并因此而命名。BARD1通過其環指區和BRCA1氨基末端的環指區相互結合,并增強BRCA1的E3連接酶活性。BARD1和BRCA1在多數組織中共表達,在小鼠中兩者基因的敲除有相似的表型,BARD1和BRCA1形成的這種穩定的復合體,由此猜想BARD1在BRCA1基因的表達過程中扮演著輔助角色[13]。此外,BARD1在散發性乳腺癌以及BRCA1突變的家族性腫瘤中突變并過度表達[14]。當BRCA1和BARD1的基因產物數量相稱時,誘導細胞存活和DNA的修復,如果BARD1產物超過BRCA1則誘導凋亡[15]。然而在BARD1突變和乳腺癌的風險評估的Meta分析中,并沒有發現BARD1突變能增加乳腺癌的風險[16],具體作用機制需要進一步研究。
1.1.6 RAD51 DNA修復蛋白Rad51是由1993年首次被Shinohara等[17]克隆,是一種DNA依賴性ATP酶。研究者把Rad51、BRCA1和BRCA2作為一個復合體研究其對乳腺癌的預后和預測的作用,發現在早期乳腺癌中Rad51/BRCA1/BRCA2復合體低表達的乳腺癌預后差,但對放療敏感。Jakubowska等[18]已證實,Rad51單核苷酸多態135G/C是BRCA1/2突變乳腺癌的重要調節因素。Rad51可通過BRCA1使細胞周期停滯在某一特定階段,再進行DNA修復。BRCA2則通過與Rad51結合,對Rad51進行功能調控。研究表明,RAD51單核苷酸多態可增加BRCA2突變的攜帶者的致病率,而對BRCA1突變者或非突變者無影響[19]。具體機制是復雜的,有待進一步研究。
1.2 PI3K/AKT通路
1.2.1 ATM ATM是引起毛細血管擴張性共濟失調癥(ataxinet-lanigestia,AT)的常染色體隱性突變基因。由Savitsky等[20]在1995年通過原位克隆技術發現。ATM屬于磷脂酰肌醇酶(PI3K)相關的蛋白家族的成員。DNA損傷后,ATM受刺激而活化,催化BRCA1基因的磷酸化,進一步激活下游通路,引起一系列的級聯反應。研究發現,ATM缺失表達是乳腺上皮細胞惡性轉化的一個早期事件,隨著乳腺癌進展,ATM缺失也隨之進展[21]。ATM抑制劑也能對于BRCA1缺陷的細胞通過累積的DNA雙鏈斷裂產生合成致死性,為BRCA1突變型的乳腺癌提供了一種新型療法[22]。
1.2.2 PTEN PTEN是一種抑癌基因,DNA損傷后,PTEN作用于染色體并上調RAD51基因的表達,減少雙鏈斷裂的發生率。PTEN在PI3K/AKT信號通路起著重要作用,PTEN基因突變,能激活PI3K/AKT通路導致細胞增殖及分化的紊亂,促進腫瘤的發生。此外,BRCA1缺陷也能夠激活AKT信號通路[23]。BRCA1和PTEN對PI3K/AKT信號通路具有類似的抑制作用,而兩者之間的相關作用機制需要我們進一步研究。研究發現,一些帶有BRCA1突變的乳腺癌有較高的PTEN突變率[24]。Martins等[25]猜測在BRCA1相關性乳腺癌中,PTEN是促進乳腺癌進展的初始因素。PTEN和BRCA1在PI3K/AKT通路類似的作用,以及乳腺癌中兩種基因共突變的發生,未來聯合應用BRCA1和PTEN抑制劑將很有可能更有效促進腫瘤的治療。
1.2.3P53P53是一種抑癌基因,在細胞周期調控和維持基因組穩定性具有重要作用,也被稱為“基因管家”。BRCA1可直接與P53結合,激活P21、Gadd45等下游靶基因,增加DNA修復能力。而且P53也可以調控BRCA2轉錄[26]。研究發現P53基因突變患者對EC(表阿霉素+環磷酰胺)、TC(紫杉醇+環磷酰胺)及TAC(多西他賽+阿霉素+環磷酰胺)方案新輔助化療并不敏感,未突變患者則對TAC方案新輔助化療有較高的敏感性,可能為指導實際臨床用藥提供一定的理論依據[27]。
1.3 其他 研究表明,除了上述基因在乳腺癌的發生中可能對BRCA1和BRCA2基因產生影響,還有其他基因也可能產生影響,如由MRE11、NBS1、RAD50組成的MRN復合物及OGG1基因也會與BRCA1和BRCA2基因發生作用[28-29]。具體機制有待進一步研究。
2 結語
BRCA1和BRCA2在乳腺癌的發生中和多種基因發生關聯,共同促進乳腺癌的發生,基因的發展是復雜的,但上述基因和BRCA基因相互作用都是直接或間接通過FA/BRCA通路,或者通過影響PI3K/AKT通路發揮作用,提示我們需更加深入研究上述兩個通路的具體作用機制。二代測序、PARP抑制劑及PI3K抑制劑的發展給BRCA突變乳腺癌的治療帶來了新的進展。我們只有深入了解BRCA基因通路各種基因的相互作用,找到更多的基因靶點,才能為BRCA基因突變型乳腺癌的靶向治療提供更多的研究方向。
[1] Chen W,Zheng R,Baade P D,et al.Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[2] Hall J M,Lee M K,Newman B,et al.Linkage of early-onset familial breast cancer to chromosome 17q21[J].Science,1990,250(4988):1684-1689.
[3] Wooster R,Neuhausen S L,Mangion J,et al.Localization of a breast cancer susceptibility gene,BRCA2,to chromosome 13q12-13[J].Science,1994,265(5181):2088-2090.
[4] 楊曉晨,胡震,吳炅,等.中國漢族人群中BRCA1和BRCA2基因突變攜帶者患乳腺癌風險的研究[J].中國癌癥雜志,2015,(4):247-252.
[5] Nielsen H R,Nilbert M,Petersen J,et al.BRCA1/BRCA2 founder mutations and cancer risks: impact in the western Danish population[J]. Fam Cancer,2016,15(4):507-512.
[6] Yu J,Zhao L,Li Y,et al.Silencing of fanconi anemia complementation group f exhibits potent chemosensitization of mitomycin C activity in breast cancer cells[J].J Breast Cancer,2013,16(3):291-299.
[7] 馮亮,李興東,陳浩,等.家族性與散發性乳腺癌BRCA1與FANCD2基因相關性的研究[J].中華腫瘤防治雜志,2011,(22):1752-1754.
[8] Janatova M,Borecka M,Soukupova J,et al.PALB2 as another candidate gene for genetic testing in patients with hereditary breast cancer in Czech republic.[J].Klin Onkol,2016,29(Suppl 1):S31-S34.
[9] Smith M A,Hampton O A,Reynolds C P,et al.Initial testing (stage 1) of the PARP inhibitor BMN 673 by the pediatric preclinical testing program:PALB2 mutation predicts exceptional in vivo response to BMN 673[J].Pediatr Blood Cancer,2015,62(1):91-98.
[10]Ouhtit A,Gupta I,Shaikh Z.BRIP1,a potential candidate gene in development of non-BRCA1/2 breast cancer[J].Front Biosci (Elite Ed),2016,(8):289-298.
[11]Stolz A,Ertych N,Bastians H.Tumor suppressor CHK2:regulator of DNA damage response and mediator of chromosomal stability[J].Clin Cancer Res,2011,17(3):401-405.
[12]Itamochi H,Nishimura M,Oumi N,et al.Checkpoint kinase inhibitor AZD7762 overcomes cisplatin resistance in clear cell carcinoma of the ovary[J].Int J Gynecol Cancer,2014,24(1):61-69.
[13]Irminger-Finger I,Ratajska M,Pilyugin M.New concepts on BARD1:Regulator of BRCA pathways and beyond[J].Int J Biochem Cell Biol,2015,72:1-17.
[14]Wu J Y,Vlastos A T,Pelte M F,et al.Aberrant expression of BARD1 in breast and ovarian cancers with poor prognosis.[J].Int J Cancer,2006,118(5):1215-1226.
[15]Feki A,Jefford C E,Berardi P,et al.BARD1 induces apoptosis by catalysing phosphorylation of p53 by DNA-damage response kinase[J].Oncogene,2005,24(23):3726-3736.
[16]Ding D P,Zhang Y,Ma W L,et al.Lack of association between BARD1 Cys557Ser variant and breast cancer risk:a meta-analysis of 11,870 cases and 7,687 controls[J].J Cancer Res Clin Oncol,2011,137(10):1463-1468.
[17]Shinohara A,Ogawa H,Matsuda Y,et al.Cloning of human,mouse and fission yeast recombination genes homologous to RAD51 and recA[J]. Nat Genet,1993,4(3):239-243.
[18]Jakubowska A,Gronwald J,Menkiszak J,et al.The RAD51 135 G>C polymorphism modifies breast cancer and ovarian cancer risk in Polish BRCA1 mutation carriers[J].Cancer Epidemiol Biomarkers Prev,2007,16(2):270-275.
[19]Kadouri L,Kote-Jarai Z,Hubert A,et al.A single-nucleotide polymorphism in the RAD51 gene modifies breast cancer risk in BRCA2 carriers,but not in BRCA1 carriers or noncarriers[J].Br J Cancer,2004,90(10):2002-2005.
[20]Savitsky K,Bar-Shira A,Gilad S,et al.A single ataxia telangiectasia gene with a product similar to PI-3 kinase[J].Science,1995,268(5218):1749-1753.
[21]Shiloh Y,Ziv Y.The ATM protein kinase:regulating the cellular response to genotoxic stress,and more[J].Nat Rev Mol Cell Biol,2013,14(4):197-210.
[22]Albarakati N,Abdel-Fatah T M,Doherty R,et al.Targeting BRCA1-BER deficient breast cancer by ATM or DNA-PKcs blockade either alone or in combination with cisplatin for personalized therapy[J].Mol Oncol,2015,9(1):204-217.
[23]Xiang T,Ohashi A,Huang Y,et al.Negative Regulation of AKT Activation by BRCA1[J].Cancer Res,2008,68(24):10040-10044.
[24]Saal L H,Gruvberger-Saal S K,Persson C,et al.Recurrent gross mutations of the PTEN tumor suppressor gene in breast cancers with deficient DSB repair[J].Nat Genet,2008,40(1):102-107.
[25]Martins F C,De S,Almendro V,et al.Evolutionary pathways in BRCA1-associated breast tumors[J].Cancer Discov,2012,2(6):503-511.
[26]Verma S,Rao B J.p53 suppresses BRCA2-stimulated ATPase and strand exchange functions of human RAD51[J].J Biochem,2013,154(3):237-248.
[27]張絲媛.p53基因突變與乳腺癌新輔助化療療效關系的研究[D].長沙:中南大學,2012.
[28]Damiola F,Pertesi M,Oliver J,et al.Rare key functional domain missense substitutions in MRE11A,RAD50,and NBN contribute to breast cancer susceptibility:results from a Breast Cancer Family Registry case-control mutation-screening study[J].Breast Cancer Res,2014,16(3):R58.
[29]Benitez-Buelga C,Vaclova T,Ferreira S,et al.Molecular insights into the OGG1 gene,a cancer risk modifier in BRCA1 and BRCA2 mutations carriers[J].Oncotarget,2016,7(18):25815-25825.
·經驗交流·
R 655.8
10.3969/j.issn.1004-437X.2017.01.024
2016-04-22)

