低水平乙型肝炎病毒表面抗原核苷類似物經治患者序貫α干擾素治療的初步研究
李 朋, 李天駒, 李子益, 秦 波
·論著·
低水平乙型肝炎病毒表面抗原核苷類似物經治患者序貫α干擾素治療的初步研究
李 朋, 李天駒, 李子益, 秦 波
目的 觀察經核苷(酸)類似物(NA)治療獲得病毒學應答,且HBsAg低水平的HBeAg陰性慢性乙型肝炎(CHB)患者序貫α干擾素(IFNα)治療的療效,并探討HBsAg消失的相關因素。方法 長期接受NA治療并獲得病毒學應答(HBV-DNA<1 000拷貝/mL,持續時間>12個月),且HBsAg低水平(HBsAg≤2 000 U/mL)的HBeAg陰性CHB患者,轉為IFNα治療48周。檢測患者治療前和治療12、24、48周時血清HBV-DNA定量,HBV血清學標志物,肝功能和血常規,停藥后隨訪24周。以HBsAg消失或血清學轉換、HBsAg<10 U/mL為療效評價指標。Logistic回歸用于分析相關因素,受試者工作特征曲線(ROC曲線)用于確定HBeAg陰轉史及HBsAg變化情況對治療后HBsAg消失的預測價值。結果 83例患者被納入研究。停藥24周時,15例(18.1 %)獲得HBsAg消失,5例(6.0 %)獲得HBsAg血清學轉換,9例(10.8 %)達到HBsAg<10 U/mL。HBsAg消失組中HBeAg自發陰轉的患者比例高于HBsAg未消失組,差異有統計學意義(χ2=9.527,P=0.002)。治療12周時HBsAg水平較基線下降≥0.5 log U/mL者治療后更易實現HBsAg消失(χ2=16.576,P<0.001),其預測HBsAg消失的曲線下面積(AUC)為0.810(95 % CI:0.686~0.935, P<0.001)。結論 經NA治療獲得病毒學應答,且HBsAg低水平的HBeAg陰性CHB患者,序貫IFNα治療可獲得較高HBsAg消失率;HBeAg陰轉史及治療早期HBsAg變化情況可用于預測及指導治療。
肝炎,乙型,慢性; 肝炎表面抗原,乙型; α干擾素; 核苷(酸)類似物
慢性乙型肝炎(CHB)抗病毒治療藥物主要分為核苷(酸)類似物[nucleos(t)ide analogues,NA]和α干擾素(interferon alpha,IFNα)兩類。NA能直接抑制HBV復制,快速降低HBV DNA載量,但其誘導的應答不持久且停藥后易復發[1];IFNα具有抗病毒和免疫調節雙重作用,可實現停藥后持久應答,然而僅有部分患者獲得應答[2]。HBsAg消失是CHB抗病毒治療的理想終點[3],近年來一些探索性研究發現,長期接受NA治療的CHB患者序貫干擾素治療可獲得更高治療目標,其中HBsAg低水平者更易實現HBsAg消失或血清學轉換[4-5]。本研究旨在評價經NA治療獲得病毒學應答,且HBsAg低水平的HBeAg陰性患者序貫干擾素治療療效,并探討HBsAg消失的相關因素。
1 材料與方法
1.1 資料來源
2008年7月至2014年3月于重慶醫科大學附屬第一醫院感染科門診就診,符合“慢性乙型肝炎防治指南(2010年版)”[6]診斷標準的HBeAg陰性CHB患者中,入選經NA治療獲得病毒學應答(HBV DNA<1 000拷貝/mL,持續時間>12個月),且HBsAg≤2 000 U/mL者,序貫IFN α治療48周(干擾素α-1b,500萬U,隔日1次,或聚乙二醇干擾素α-2a,180 μg,每周1次,皮下注射,根據患者經濟情況選用)。序貫治療前8周采用NA加干擾素聯合治療,聯合治療8周后使用干擾素單藥治療。排除標準:同時感染其他類型肝炎病毒、HIV等,合并肝硬化、肝細胞癌、 自身免疫性肝炎等肝病,酗酒、吸毒、精神疾病史等。
1.2 方法
1.2.1 觀察指標 IFNα治療前檢測患者基線HBV DNA定量、HBV血清學標志物、肝功能和血常規。治療期間,每12周檢測血清HBV DNA定量、HBV血清學標志物、肝功能和血常規;前12周,每4周復查肝功能和血常規,治療結束后隨訪24周。以停藥24周時HBsAg消失或血清學轉換、HBsAg<10 U/mL為療效評價指標。
1.2.2 實驗室測量 HBV DNA定量采用上海羅氏公司全自動實時熒光定量PCR檢測,檢測下限為1 000 拷貝/mL,HBV血清學標志物采用雅培公司Abbott Architecti 2000試劑檢測。
1.2.3 統計學處理 所有統計分析采用SPSS 19.0軟件處理。連續性變量以中位數表示,分類變量以構成比表示,采用 χ2檢驗;相關因素分析采用Logistic回歸分析。受試者工作特征曲線(ROC曲線)曲線下面積(AUC)用于評估HBeAg陰轉史及治療過程中HBsAg變化情況對治療后HBsAg消失的預測意義。雙側檢驗P<0.05為差異有統計學意義。
2 結果
2.1 患者一般情況
96例患者接受IFNα序貫治療,其中8例IFNα治療療程大于48周,5例在治療早期因難以耐受不良反應而終止,最終有83例患者被納入分析。男37例,女46例;中位年齡35(22~59)歲;CHB病程中位時間為9(3~59)年;NA治療中位時間為3(1~5)年;接受干擾素α-1b治療65例,聚乙二醇干擾素α-2a治療18例。IFNα治療前,接受拉米夫定治療29例、阿德福韋酯治療25例、恩替卡韋治療21例、拉米夫定耐藥后聯合阿德福韋酯治療8例;HBsAg水平中位數為
2.97 (1.26~3.30)log U/mL;ALT水平中位數為25(11~40)U/L。NA治療前,HBsAg水平中位數為3.32(2.63~3.88)log U/mL;ALT水平中位數為105(46~349)U/L;HBV DNA定量水平中位數為5.50(3.84~8.27)log U/mL。HBeAg陰轉史:根據患者CHB病史,未經抗病毒治療HBeAg自發陰轉的患者42例(自發陰轉);經抗病毒治療HBeAg陰轉,停藥后病毒復發的患者41例(經治療陰轉)。
2.2 停藥后應答情況
停藥24周時,共15例(15/83,18.1 %)患者獲得HBsAg消失,其中5例(5/83,6.0 %)獲得HBsAg血清學轉換;另有9例(9/83,10.8 %)達到HBsAg<10 U/mL。
2.3 HBsAg消失與未消失患者的基線比較
HBsAg消失組基線年齡及HBsAg水平均低于HBsAg未消失組,差異有統計學意義(t=2.027, P=0.046;t=2.389,P=0.030)。HBsAg消 失 組 中HBeAg自發陰轉的患者比例高于HBsAg未消失組,差異有統計學意義(χ2=9.527,P=0.002)。兩組其他基線因素差異無統計學意義(均P>0.05)。見表1。Logistic回歸分析顯示,HBeAg陰轉史是治療后HBsAg消失的獨立相關因素(OR:0.150,95 % CI:0.030~0.749,P=0.021)。ROC曲 線 結果顯示HBeAg陰轉史預測治療后HBsAg消失的AUC為0.720(95 % CI:0.590~0.850,P=0.008)。
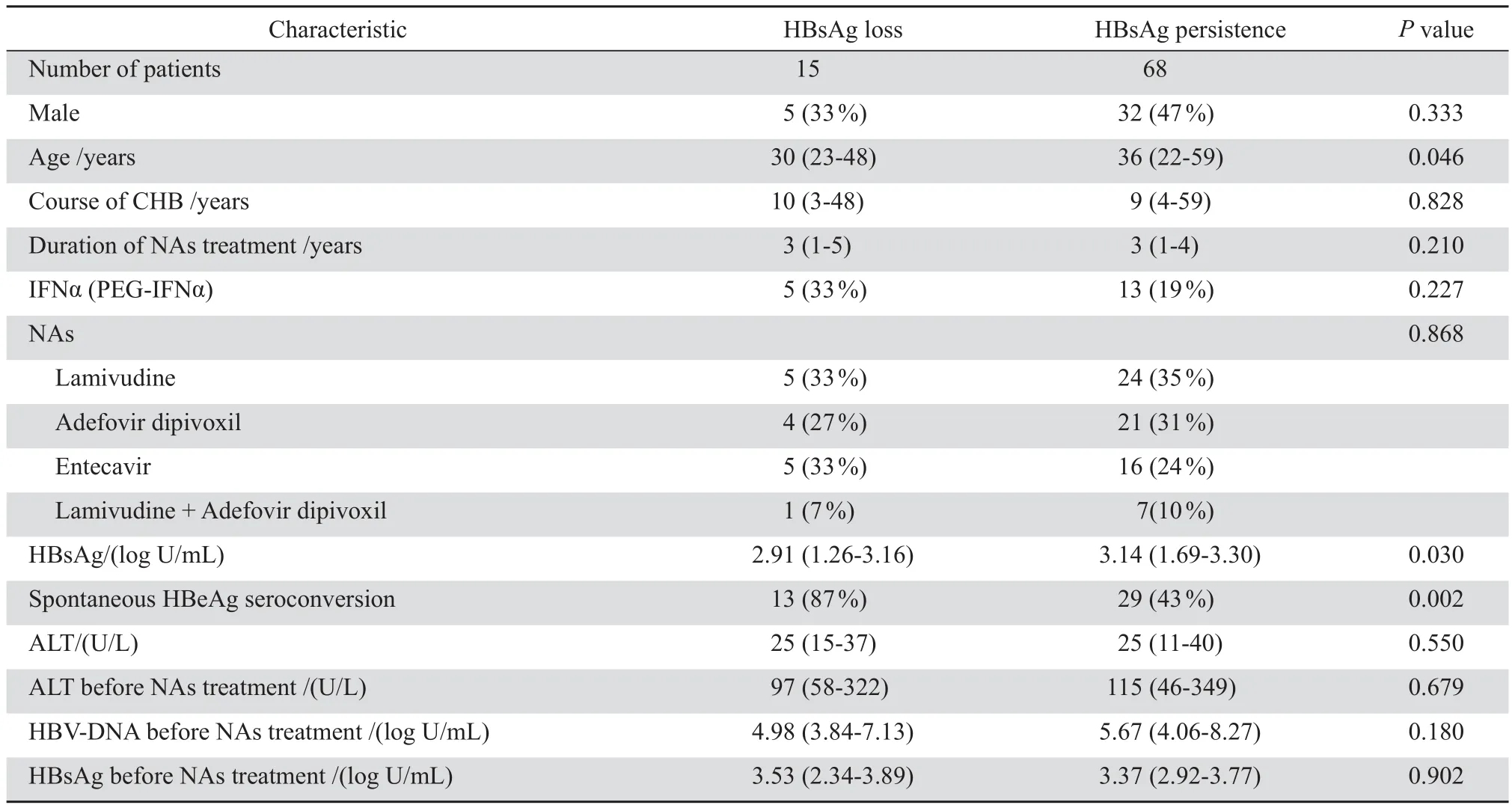
表1 HBsAg消失組與未消失組患者的基線特征比較Table 1 Baseline patient characteristics in terms of HBsAg status
2.4 治療過程中HBsAg變化情況與HBsAAgg消失關系
在治療12、24、48周時,HBsAg消失組的HBsAg水平較基線下降幅度均明顯大于未消失組,兩組比較差異有統計學意義(P=0.002,0.001,<0.001)。見圖1。ROC曲線分析認為,治療12周和24周時HBsAg變化情況與治療后HBsAg消失具有相關性,其預測治療后HBsAg消失的AUC分別為0.810(95 % CI:0.686~0.935,P<0.001)和0.842(95 % CI:0.736~0.947,P<0.001)。治療12周時,HBsAg水平較基線下降≥0.5 log U/mL者治療后更易獲得HBsAg消失(47.6 %比8.1 %,χ2=16.576,P<0.001)。

圖1 治療過程中兩組患者HBsAg水平變化情況Figure 1 HBsAg dynamics during IFNα treatment in chronic hepatitis B patients
HBeAg自發陰轉者,治療12周時有11例HBsAg水平較基線下降≥0.5 log U/mL,其中8例治療后HBsAg消失,陽性預測值(positive predictive value,PPV)為72.7 %;治療24周時,HBsAg水平較基線下降≥0.9 log U/mL的PPV為
87.5 %。HBeAg經治療陰轉者,治療12周時有31例HBsAg水平較基線下降<0.5 log U/mL,治療后均未獲得HBsAg消失,陰性預測值(negative predictive value,NPV)為100 %;治療24周時,HBsAg水平較基線下降<0.9 log U/mL的NPV同樣為100 %。見表2。

表2 基線因素及治療過程中HBsAg變化情況預測HBsAg消失Table 2 Role of baseline factors and on-treatment HBsAg dynamics in prediction of subsequent HBsAg loss
3 討論
隨著NA抗病毒治療廣泛普及,越來越多的HBeAg陰性CHB患者經過治療獲得有效應答。但其具體療程不確定,且停藥后肝炎復發率高,因此治療療程宜長,以到達理想的治療終點即HBsAg消失[7]。然而Chevaliez等[8]研究顯示,NA治療實現HBsAg消失平均需要52.5年,如此漫長的療程致使越來越顯著耐藥、依從性欠佳、經濟負擔等問題逐步顯現,大多數患者不能堅持長期用藥,隨意停藥甚至會導致暴發性肝炎[9]。Li等[10]一項回顧性研究顯示,長期NA治療的CHB患者序貫聯合干擾素治療療效優于繼續NA治療,基線HBsAg<1 000 U/mL者,治療后可獲得更高HBsAg消失率。NEW SWITCH[11]研究結果顯示,NA經治患者如已獲得部分應答且HBsAg水平下降至較低水平,接受干擾素序貫治療HBsAg清除率較高,基線HBsAg定量<1 500 U/mL者序貫干擾素治療48周,HBsAg清除率達31.2 %。這些研究結果提示,經NA治療獲得部分應答且HBsAg低水平的患者,序貫干擾素治療能獲得較高HBsAg消失率。
本研究回顧性分析83例HBeAg陰性,接受NA治療獲得病毒學應答且HBsAg低水平,再轉為IFNα治療的CHB患者。治療后HBsAg消失率為18.1 %,略低于其他研究報道[4,11],分析其原因可能為:①本研究入選患者均為HBeAg陰性CHB患者,其干擾素治療應答率可能相對較低;②78 %的患者為序貫普通IFNα治療,相比于聚乙二醇干擾素α-2a療效略低。研究發現,干擾素治療結束時HBsAg水平與其治療后HBsAg消失率密切相關,HBsAg<10 U/mL者治療后更易獲得HBsAg消失[12-13]。本研究中,停藥24周時有
10.8 %患者達到HBsAg<10 U/mL,其可能會有更多患者實現HBsAg消失。
我們對HBsAg消失和未消失患者基線情況進行比較分析發現,基線HBeAg陰轉史與治療后HBsAg消失具有相關性。經抗病毒治療陰轉的HBeAg陰性CHB患者,NA治療后序貫IFNα不易實現HBsAg消失,可能原因為:①停藥后病毒復發,其本身也表明患者免疫狀況欠佳;②研究認為HBV突變能影響干擾素治療應答[14],HBeAg自發陰轉和經治療陰轉患者的HBV變異可能存在差異,從而影響干擾素治療應答率。
治療過程中HBsAg變化情況也是預測療效的一個重要指標。Peng等[15]的薈萃分析認為對于HBeAg陰性CHB患者,治療過程中HBsAg變化情況能有效指導干擾素治療。本研究結果顯示,序貫治療12周時HBsAg水平較基線下降≥0.5 log U/mL者治療后更易獲得HBsAg消失(47.6 %比
8.1 %, χ2=16.576,P<0.001)。ROC曲線分析認為,治療12周時HBsAg變化情況對治療后HBsAg消失具有預測價值(AUC=0.810)。HBeAg自發陰轉者,若在治療12周時HBsAg水平較基線下降≥0.5 log U/mL,則有72.7 %的患者治療后獲得HBsAg消失;HBeAg經治療陰轉者,若治療12周HBsAg較基線下降<0.5 log U/mL,其陰性預測值為100 %,因此,對于此類患者建議終止干擾素治療,盡早調整治療方案。
本研究還存在以下幾點不足:①樣本量較少,沒有對基線HBsAg水平進行分層分析;②由于本研究為回顧性分析,研究中存在混雜因素,沒有對普通干擾素和聚乙二醇干擾素治療患者進行比較分析;③雖然根據患者CHB病史,HBeAg自發陰轉者均為未經治療HBeAg自發轉陰性,但由于未檢測其病毒基因,不能完全排除其中存在病毒為野生型的患者,有待設計隨機對照研究,進一步闡明影響序貫治療療效的相關因素;④對獲得HBsAg消失或血清轉換的患者還應進行長期隨訪觀察。
綜上所述,經NA治療獲得病毒學應答,且HBsAg低水平的HBeAg陰性CHB患者,序貫IFNα治療可獲得較高HBsAg消失率。基線HBeAg陰轉史及治療早期HBsAg變化情況可作為HBsAg消失的預測指標。
[1] KIM SS, CHEONG JY, CHO SW. Current nucleos(t)ide analogue therapy for chronic hepatitis B [J]. Gut Liver, 2011, 5(3):278-287.
[2] LIAW YF. Impact of therapy on the outcome of chronic hepatitis B[J]. Liver Int, 2013, 33(Suppl 1):111-115.
[3] European Association For The Study Of The Liver. EASL Clinical Practice Guidelines: management of chronic hepatitis B virus infection[J]. J Hepatol, 2012, 57(1):167-185.
[4] NING Q, HAN M, SUN YT, et al. Switching from entecavir to PegIFN alfa-2a in patients with HBeAg-positive chronic hepatitis B: a randomized open-label trial (OSST trial)[J]. J Hepatol,2014, 61(4):777-784.
[5] BROUWER WP, XIE Q, SONNEVELD MJ, et al. Adding pegylated interferon to entecavir for hepatitis B e antigenpositive chronic hepatitis B:A multicenter randomized trial(ARES study) [J]. Hepatology, 2015, 61(5):1512-1522.
[6] 中華醫學會肝病學分會,中華醫學會感染病學分會.慢性乙型肝炎防治指南(2010年版)[J]. 中華傳染病雜志, 2011, 29(2):65-80.
[7] SETO WK, HUI AJ, WONG VW, et al. Treatment cessation of entecavir in Asian patients with hepatitis B e antigen negative chronic hepatitis B: a multicentre prospective study [J]. Gut,2015, 64(4):667-672.
[8] CHEVALIEZ S, HéZODE C, BAHRAMI S, et al. Long-term hepatitis B surface antigen (HBsAg) kinetics during nucleoside/ nucleotide analogue therapy: f nite treatment duration unlikely [J]. J Hepatol, 2013, 58(4):676-683.
[9] LIM SG, WAI CT, RAJNAKOVA A, et al. Fatal hepatitis B reactivation following discontinuation of nucleoside analogues for chronic hepatitis B[J]. Gut, 2002, 51(4):597-599.
[10] LI GJ, YU YQ, CHEN SL, et al. Sequential combination therapy with pegylated interferon leads to loss of hepatitis B surface antigen and hepatitis B e antigen(HBeAg)seroconversion in HBeAg-positive chronic hepatitis B patients receiving long-term entecavir treatment[J]. Antimicrob Agents Chemother, 2015, 59(7):4121-4128.
[11] HU P, JIA S, ZHANG W, et al. A multi-center randomized study on the eff cacy and safety of switching to peginterferonα-2a (40KD) for 48 or 96 weeks in HBeAg positive CHB patients with a prior NUC history for 1 to 3 years: an interim analysis of NEW SWITCH study [J]. Hepatology, 2014,60(Suppl 6):1273a-1274a.
[12] MARCELLIN P, BONINO F, YURDAYDIN C, et al. Hepatitis B surface antigen levels: association with 5-year response to peginterferon alfa-2a in hepatitis B e-antigen-negative patients[J]. Hepatol Int, 2013, 7(1):88-97.
[13] BRUNETTO MR, MORICONI F, BONINO F, et al. Hepatitis B virus surface antigen levels: a guide to sustained response to peginterferon alfa-2a in HBeAg-negative chronic hepatitis B[J]. Hepatology, 2009, 49(4):1141-1150.
[14] YANG HC, CHEN CL, SHEN YC, et al. Distinct evolution and predictive value of hepatitis B virus precore and basal core promoter mutations in interferon-induced hepatitis B e antigen seroconversion [J]. Hepatology, 2013, 57(3):934-943.
[15] PENG H, WEI F, LIU JY, et al. Response-guided therapy of regimens based on PEG-interferon for chronic hepatitis B using on-treatment hepatitis B surface antigen quantif cation: a metaanalysis[J]. Hepatol Int, 2015, 9(4):543-557.
Preliminary study on the eff cacy of sequential therapy with nucleotide analogues followed by interferon alpha in chronic hepatitis B patients with low HBsAg level
LI Peng, LI Tianju, LI Ziyi, QIN Bo. (Department of Infectious Diseases, First Aff liated Hospital of Chongqing Medical University, Chongqing 400016, China)
Objective To investigate the eff cacy of interferon alpha (IFNα) followed by nucleotide analogues (NAs) treatment in patients with negative hepatitis B e antigen (HBeAg), undetectable serum HBV-DNA and low hepatitis B surface antigen (HBsAg) levels. Methods The enrolled HBeAg-negative chronic hepatitis B patients had undetectable HBV-DNA level (HBV-DNA<1 000 copies/mL for at least 12 months) and low HBsAg level (HBsAg≤2 000 U/mL) with long-term NAs treatment. These patients switched their therapy sequentially from NAs regimens to IFNα for 48 weeks. The treatment response was evaluated in terms of serum HBV DNA load, serological HBV markers, liver function tests and routine blood test before treatment and 12, 24 and 48 weeks of treatment. The patients were followed up for 24 weeks after treatment. The primary endpoint was HBsAg loss or seroconversion and HBsAg<10 U/mL. Logistic regression analysis was conducted to examine relevant predictive factors. Receiver operating characteristic curve was used to evaluate the value of prior HBeAg seroconversion and on-treatment HBsAg dynamics in predicting HBsAg loss. Results A total of 83 patients were included in the study. At 24 weeks after the end of treatment, HBsAg loss was found in 15 (18.1 %) patients, HBsAg seroconversion in 5 (6.0 %) patients, and HBsAg<10 U/mL in 9 (10.8 %) patients. More patients in HBsAg loss group showed spontaneousHBeAg seroconversion than in HBsAg persistence group (χ2=9.527, P=0.002). HBsAg loss was more likely in the patients who had HBsAg decline at least 0.5 log U/mL from baseline at week 12 of treatment (χ2=16.576, P<0.001). The area under the ROC curve for prediction of HBsAg loss was 0.810 (95 % CI, 0.686 to 0.935, P<0.001). Conclusions The HBeAg-negative chronic hepatitis B patients with positive virological response and low HBsAg level after NAs treatment are more likely to achieve HBsAg clearance when switched to IFNα treatment. Prior HBeAg seroconversion and on-treatment HBsAg dynamics are useful in predicting and guiding IFNα sequential therapy.
chronic hepatitis B; hepatitis B surface antigen; interferon-alpha; nucleotide analogue
R512.62
A
1009-7708 ( 2017 ) 01-0024-05
10.16718/j.1009-7708.2017.01.004
2016-05-26
2016-06-20
國家自然科學基金(81271838)。
重慶醫科大學附屬第一醫院感染科,重慶 400016。
李朋(1989—),男,碩士研究生,主要從事病毒性肝炎的研究和治療。
秦波,E-mail:cqqinbo@126.com。

