金霉素生物合成基因ctcK的研究
林龍鎮,萬云鳳,洪文榮
(福州大學生物科學與工程學院,中國 福州 350108)
金霉素生物合成基因ctcK的研究
林龍鎮,萬云鳳,洪文榮
(福州大學生物科學與工程學院,中國 福州 350108)
為檢測ctcK基因的功能,利用基因工程技術在金色鏈霉菌J13(StreptomycesaureofaciensJ13)上構建ctcK基因缺失工程菌SK12(ΔctcK),并分析了其次級代謝產物的變化.經質譜分析顯示,工程菌SK12代謝物中檢測到去甲基金霉素m/z=465.10 [M+H]+的分子離子峰,但未檢測到金霉素m/z=479.12 [M+H]+的分子離子峰,這與出發菌J13代謝物的檢測結果相反.結果表明,ctcK基因的失活阻斷了金霉素的生物合成代謝流,使工程菌SK12主要積累去甲基金霉素,顯示ctcK基因參與金霉素C-6位甲基化.本研究初步闡明了ctcK基因的功能,同時獲得了一株主產去甲基金霉素的工程菌.
ctcK基因;去甲基金霉素;甲基化;生物合成;金色鏈霉菌
金霉素(CTC)是一類臨床上主要用于治療革蘭氏陽性球菌,特別是葡萄球菌(Staphylococcus)、肺炎球菌(Streptococuspneumoniae)的四環類廣譜抗生素.除了抗生和抗炎功效之外[1-3],自20世紀80年代以來,科學家還陸續發現金霉素具有抗腫瘤活性[4]、非抗菌作用[5]及非抗感染用途[6].去甲基金霉素(DMCTC),亦屬于四環類抗生素,與金霉素相比在C-6位少了一個甲基.去甲基金霉素不僅對革蘭氏陽性和陰性菌有抑菌活性,對衣原體(Chlamydia)、立克次體(Rickettsia)、肺炎支原體(Mycoplasmapneumonia)等致病性病毒亦有很好的抑制效果.與金霉素相比,去甲基金霉素不僅抗菌活力更強、結構更穩定、還因具有易被人體吸收、排泄快、長效性和高效性等優點而被廣泛應用.此外,它還是合成米諾環素和替加環素的重要母體[7].
金霉素生物合成途徑和生物合成基因的相關研究不多[8-10].2013年,鄧子新團隊報道了金霉素生物合成基因簇并確定了鹵化酶基因,同時還推測ctcK基因可能是金霉素C-6位甲基化酶基因,但至今仍未經生物學實驗證明(GenBank:HM627755)[11].基于本實驗室已建立的大腸桿菌(Escherichiacoli)與金色鏈霉菌接合轉移體系[12-13],本研究采用基因框內敲除方法,特異性滅活ctcK基因,分析ctcK基因失活突變株代謝產物的變化,旨在闡明ctcK基因在金霉素pretetramid到6-methylpretetramid生物轉化中的作用,進而驗證ctcK基因是否為金霉素C-6位甲基化酶基因.研究結果可間接獲得主產去甲基金霉素的工程菌,為開發去甲基金霉素等系列藥物奠定基礎.
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 金色鏈霉菌J13,大腸桿菌top10,大腸桿菌ET12567(pUZ8002),大腸桿菌-鏈霉菌穿梭質粒pKC1139及pJTU412均為本實驗室保藏;克隆載體pMD19-T購自TaKaRa公司.
1.1.2 培養基與抗生素 金色鏈霉菌斜面培養基及預萌發培養基見文獻[13],種子培養基及發酵培養基見文獻[14];大腸桿菌生長培養基為LB培養基[15].本研究中使用的抗生素及其終濃度分別為:氨芐青霉素 100 mg/L,安普霉素 50 mg/L,氯霉素 25 mg/L,卡那霉素 50 mg/L,萘啶酮酸 25 mg/L.
1.1.3 主要試劑 限制性內切酶、TaqDNA聚合酶和T4 DNA連接酶均購自TaKaRa公司;溶菌酶,RNase A酶,Proteinase K和DNA凝膠回收試劑盒均購自上海生工公司;其他常規試劑見文獻[16].
1.2 方法
1.2.1 引物設計 以金霉素生物合成基因簇(GenBank:HM627755)為模板,設計兩對引物K1/K2和K3/K4,分別用于擴增ctcK基因上游交換臂KB1和下游交換臂KB2;再根據同源重組原理,設計兩對篩選單交換和雙交換的鑒定引物K5/K6和K7/K8;引物序列及其限制酶見表1.

表1 本研究所用引物
1.2.2 分子克隆 PCR、酶切、酶連、大腸桿菌感受態細胞制備及其轉化、小量質粒DNA提取,方法參見實驗手冊[17];金色鏈霉菌染色體DNA提取參見鏈霉菌遺傳操作手冊[16];DNA測序委托上海生工公司.
1.2.3 單交換突變株篩選 將重組質粒轉化大腸桿菌ET12567(pUZ8002),再通過接合轉移方法將其導入金色鏈霉菌J13.35 ℃培養16~20 h后,覆蓋30 mg/L安普霉素和25 mg/L萘啶酮酸,繼續在35 ℃培養,4 d后長出接合子.挑取其中一株命名為金色鏈霉菌SK11,簡稱SK11,提取其基因組DNA作為模板,進行PCR驗證.接合轉移具體方法見文獻[14].
1.2.4 雙交換突變株篩選 將單交換工程菌在斜面培養基上松弛培養5代,然后分離單菌落,將單菌落影印至含安普霉素的抗性平板和不含抗生素的普通平板上.培養5 d后,從887株菌中篩選得到1株安普霉素敏感菌株,命名為金色鏈霉菌SK12,簡稱SK12,提取其基因組DNA,進行PCR驗證.
1.2.5 發酵及代謝產物組分檢測 對菌株進行分離純化,獲得長勢較好的單菌落,轉接斜面35 ℃培養5~7 d,待斜面孢子豐滿.刮取適量的孢子接種于種子培養基中,32 ℃,280 r/min振蕩培養18~22 h,使菌體處于對數生長期.再按照10%的接種量接種于發酵培養基中,29 ℃,265 r/min,發酵72 h.放瓶后,將發酵液用草酸酸化至pH 1.2~1.5,并于4 ℃靜置30 min,以釋放效價.再依次加入0.1%~0.2%的黃血鹽及0.1%~0.2%的硫酸鋅,不斷攪拌10 min,以除去蛋白.然后4 ℃,12 000 r/min,離心5 min,取上清,經甲醇稀釋5倍,過0.22 μm濾膜,所得樣品直接用于高效液相色譜分析.樣品經甲醇稀釋至適當濃度,再過0.22 μm濾膜,用于質譜分析.
1.2.6 高效液相色譜條件及質譜方法 液相色譜條件:采用島津液相色譜儀LC-20A和SinoChrom ODS-BP色譜柱 (4.6 mm×250 mm,5 μm)進行分析;流動相中V(甲醇)∶V(10 mol/L甲酸)=20∶80;流速:1 mL/min;柱溫40 ℃;檢測波長360 nm;進樣量:10 μL.
質譜掃描條件:采用Exactive Plus高分辨質譜儀和電噴霧離子化源(ESI源)進行測定;極性檢出模式:正模式(MS+);毛細管電壓:3 800 V;干燥氣:N2;流速:6 L/min;干燥氣溫度:320 ℃;檢測方式:一級全掃描.
2 結果與分析
2.1 CtcK蛋白序列基本性質分析
通過生物信息學軟件Vector.NTI 11.5查找已公布的金霉素生物合成基因簇(GenBank:HM627755)并將ctcK基因序列翻譯成CtcK蛋白氨基酸序列.使用瑞士生物信息中心引擎(http://web.expasy.org/cgi-bin/protscale/protscale.pl)及蛋白質二級結構在線分析軟件TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析此蛋白氨基酸的親疏水性和跨膜區,可知CtcK蛋白以疏水性氨基酸為主,且CtcK蛋白不具有跨膜區,蛋白全部在膜外.
2.2 CtcK蛋白三維結構及功能分析

圖1 CtcK蛋白三維結構示意圖Fig.1 Tertiary structure of CtcK
將CtcK蛋白氨基酸序列通過SWISS-MODEL(http://swissmodel.expasy.org/)進行同源建模,經Rasmol軟件進行顯示和分析,結果如圖1(彩圖見封三).該蛋白含有兩條肽鏈,二級結構以α-螺旋為主.再經蛋白保守結構域在線分析(http://www.ncbi.nlm.nih.gov/structure/cdd/wrpsb.cgi)表明CtcK中76 aa~317 aa組成SAM依賴型甲基轉移酶結構域.因此推測ctcK基因可能是負責催化金霉素C-6位甲基化酶的基因.
2.3 重組質粒pJTK2的構建
以J13的染色體DNA為模板,用兩對引物K1/K2和K3/K4分別擴增上游交換臂KB1(2 033 bp)和下游交換臂KB2(2 051 bp).PCR樣品經電泳檢測后,回收目標條帶并進行TA克隆,得到中間質粒pTK1和pTK2.質粒pTK1和pTK2分別經XbaⅠ/EcoRⅤ和EcoRⅤ/EcoRⅠ雙酶切后,回收KB1和KB2片段;質粒pJTU412經XbaⅠ/EcoRⅠ雙酶切,回收7 879 bp的片段并與KB1和KB2片段進行酶連,構建質粒pJTK1;最后,用EcoR Ⅰ對質粒pJTK1和puc30-apr分別進行單酶切,分別回收11 951 bp和1 168 bp的片段,再次酶連,經篩選得到最終質粒pJTK2(pJTU412∶∶KB1∶∶KB2∶∶apr),其酶切驗證見圖2-B.該質粒以KpnⅠ/BglⅡ雙酶切,得到5 234,3 766,2 978和1 141 bp四條帶;用EcoR Ⅰ/XbaⅠ雙酶切,得到7 879,4 072,1 141和27 bp四條帶;用EcoR Ⅴ/HindⅢ雙酶切,得到9 289,2 855和975 bp三條帶;pJTK2經以上3種方式酶切,電泳條帶大小均與理論預測一致,克隆系列經測序與預測吻合.由此,重組質粒pJTK2構建完畢.

圖2 質粒pJTK2的物理圖譜(A)及其酶切鑒定圖(B)
Fig.2 Schematic diagram of plasmid pJTK2 (A),and validation of pJTK2 by endonuclease (B)
2.4 金色鏈霉菌SK12重組菌株的構建
接合轉移得到的突變株SK11,用引物K5/K6擴增到1 559 bp和2 300 bp片段,PCR產物電泳檢測結果與理論預測大小一致,初步確定為單交換菌株,電泳結果見圖3-B泳道2.
影印篩選得到的突變株SK12,用引物K5/K6和K7/K8分別擴增到1 559 bp和2 454 bp片段,與親株相比均缺失了741 bp片段,電泳結果見圖3-B泳道3和6.經測序分析,證明SK12確實為ctcK基因框內缺失工程菌.
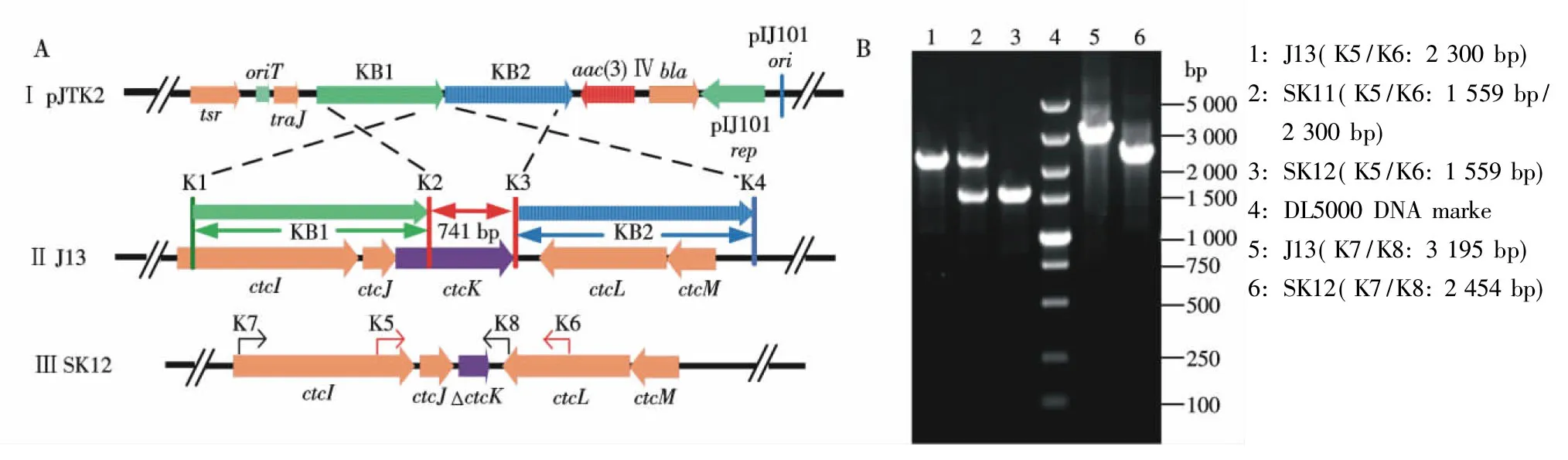
圖3 pJTK2質粒與J13染色體DNA同源重組示意圖(A)及其突變株PCR鑒定電泳圖(B)
Fig.3 Diagram showing the homologous recombination of plasmid pJTK2 and J13 chromosomal DNA (A),and PCR assay for the verification of the mutants (B)
2.5 工程菌SK12的菌落形態及代謝產物分析
ctcK基因缺失工程菌SK12的基內菌絲體為棕紅色,而親株J13為棕黃色.除此之外,工程菌SK12與親株J13的孢子顏色均為棕灰色,且生長周期相同,這與程惠芳所報道的去甲基金霉素突變株的菌落形態相符[18].繼續用傳代方法將SK12傳5代后,其菌落形態依舊保持穩定.將SK12和J13按1.2.5方法進行發酵及代謝產物組分分析,經高效液相色譜檢測,結果如圖4.J13樣品(圖4,c)與金霉素標準品(圖4,a)主峰保留時間基本相近,分別為31.193 min和32.184 min,因此認為31.193 min的峰為金霉素峰.SK12樣品(圖4,d)與去甲基金霉素標準品(圖4,b)主峰保留時間也基本相近,分別為20.260 min和19.712 min,因此認為20.260 min的峰為去甲基金霉素峰.據此可知,與親株J13(圖4,c)相比,工程菌SK12(圖4,d)不再合成金霉素,而主產去甲基金霉素,說明ctcK基因的缺失阻斷了金霉素的合成,使金霉素合成代謝積累在去甲基金霉素,顯示ctcK基因參與C-6位甲基化.

(a) 0.5 g/L金霉素標準品; (b) 0.5 g/L去甲基金霉素標準品; (c) 出發菌J13樣品; (d) 工程菌SK12樣品圖4 J13和SK12代謝產物高效液相色譜分析圖Fig.4 HPLC analysis of metabolites from J13 and SK12
由于金霉素及去甲基金霉素含有氯原子,因此有典型的[A+2]同位素峰,且[A]∶[A+2]≈3∶1.而四環素不含氯原子,所以沒有[A+2]同位素峰.質譜檢測結果顯示,出發菌J13代謝產物中檢測到金霉素m/z=479.12 [M+H]+的準分子離子峰及其[A+2]的同位素峰m/z=481.12 [M+H]+,且兩者豐度比約為3∶1,與理論相符,檢測結果見圖5.此外,J13代謝產物中還檢測到四環素的準分子離子峰m/z=445.16 [M+H]+,但未檢測到去甲基金霉素的離子峰,這可能是由于去甲基金霉素相對含量較低,因此未能檢測出來.另外,質譜圖中的離子峰m/z=146.08 [M+H]+,m/z=161.09 [M+H]+,m/z=282.28 [M+H]+,m/z=338.34 [M+H]+,m/z=381.08 [M+H]+,m/z=527.16 [M+H]+可能是碎片峰或雜質峰,因為在金霉素生物合成途徑中均沒有相應質量數的中間代謝產物.與親株J13相反,工程菌SK12代謝產物中檢測到了去甲基金霉素m/z=465.10 [M+H]+的準分子離子峰及其[A+2]的同位素峰m/z=467.10 [M+H]+,但未檢測到金霉素和四環素的離子峰.質譜結果進一步說明ctcK基因的缺失阻斷了金霉素的合成,使金霉素合成代謝積累在去甲基金霉素,初步闡明了ctcK基因負責參與催化C-6位甲基化.此外,SK12代謝產物中檢測到m/z=365.10 [M+H]+(6-Pretetramid)的離子峰,但未檢測到m/z=351 [M+H]+(Pretetramid)的離子峰,這可能是因為ctcK基因的缺失不能完全阻斷Pretetramid到6-Pretetramid 的代謝流.當然,也有可能是因為m/z=365.10 [M+H]+不是6-Pretetramid的離子峰,而是碎片峰或雜質峰.
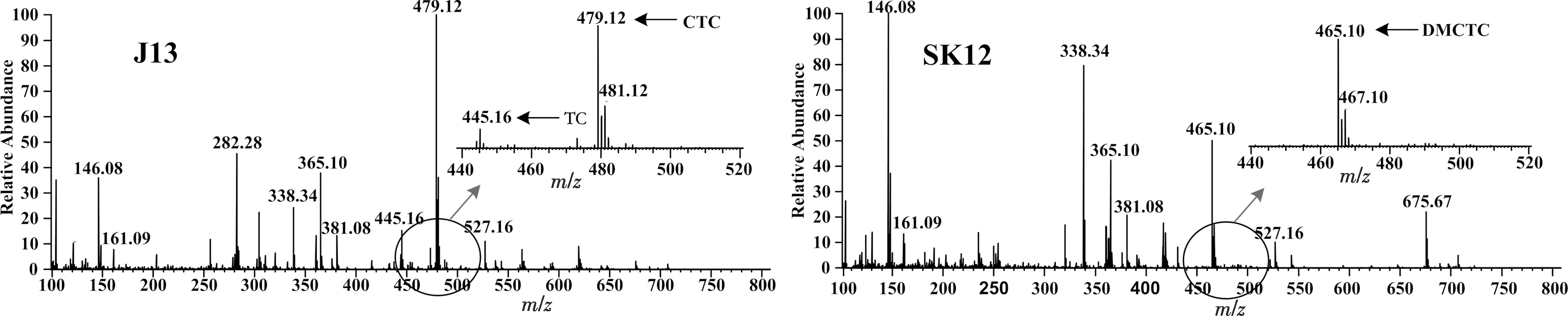
圖5 J13和SK12代謝產物質譜分析圖Fig.5 MS analysis of metabolites from J13 and SK12
2.6ctcK基因回補實驗
以金色鏈霉菌J13的基因組DNA為模板,通過K1/K4引物PCR擴增KB3片段(4 811 bp),將其克隆到pMD19-T載體,得到陽性克隆子,提取其質粒,并命名為質粒pKB11.質粒pKB11和質粒pKC1139分別用XbaⅠ/EcoRⅠ雙酶切,再經回收、酶連、轉化、篩選陽性克隆子,獲得ctcK基因回補同源重組質粒pKB12(pKC1139∶∶KB3),其酶切驗證見圖6-B.將pKB12轉入ET12567(pUZ8002),并通過接合轉移方法將其導入工程菌SK12中,篩選獲得一株pKB12質粒整合到SK12染色體上的重組菌株,命名為金色鏈霉菌SK13.由于該重組菌株存在同源片段,容易發生二次重組.因此可通過影印篩選獲得ctcK基因回復突變株SK14(簡稱SK14),PCR電泳檢測結果見圖7-B.將SK14按照1.2.5中的方法進行搖瓶發酵并用高效液相色譜對其代謝產物進行分析.結果表明,SK14(圖8,b)重新主產金霉素,與親株J13(圖8,a)相比沒有明顯差異,進而再次證明ctcK基因是負責參與催化C-6位甲基化的基因.

圖6 質粒pKB12的物理圖譜(A)及其酶切鑒定圖(B)
Fig.6 Schematic diagram of plasmid pKB12 (A),and validation of pKB12 by endonuclease (B)

圖7 pKB12質粒與SK12染色體DNA同源重組示意圖(A)及其回復突變株PCR鑒定圖(B)
Fig.7 Diagram showing the homologous recombination of plasmid pKB12 and SK12 chromosomal DNA (A),and PCR assay for the verification of the reverse mutant (B)

圖8 J13(a)和SK14(b)代謝產物高效液相色譜分析圖Fig.8 HPLC analysis of metabolites from J13(a) and SK14(b)
3 結論與討論
四環類抗生素生物合成過程中,C-6甲基化酶基因一直是研究熱點,但至今仍未完全闡明.2007年,Zhang等將龜裂鏈霉菌(Streptomycesrimosus)oxyF基因進行異源表達,證實了OxyF為土霉素C-6位甲基化酶,負責pretetramid 到6-methylpretetramid的生物轉化過程,且表明OxyF對pretetramid底物具有高度特異性[19].本研究在此基礎上,通過序列比對發現ctcK基因與oxyF基因序列同源性高達74.4%,且經生物信息學分析再次發現CtcK蛋白中亦存在SAM依賴型甲基轉移酶結構域,因此推測ctcK基因可能參與金霉素C-6位甲基化.據此,本研究利用基因敲除技術滅活ctcK基因,獲得ctcK基因失活突變菌SK12(ΔctcK).經HPLC及MS分析顯示,工程菌SK12不再合成金霉素,主要積累去甲基金霉素,與出發菌J13主要積累金霉素明顯不同,說明ctcK基因的失活阻斷了金霉素的生物合成代謝流,使工程菌積累去甲基金霉素,初步闡明了ctcK基因參與C-6位甲基化.此外,ctcK基因的缺失并沒有使代謝積累pretetramid,而是繼續合成去甲基金霉素,這可能是由于后續的下游修飾酶對底物的特異性要求不高,使得pretetramid可以進行后續的一系列氧化、鹵化、轉氨及氨二甲基化等修飾作用,最終合成去甲基金霉素.
通過基因回補實驗,將ctcK基因重新導入工程菌SK12(ΔctcK)中,獲得回復突變株SK14,其代謝產物主要積累金霉素,與出發菌J13相同.這與Ryan等將ctc09基因(與ctcK基因序列同源性高達99.4%)克隆至pLP212281表達載體,并導入產6-去甲基四環素的金色鏈霉菌A377中,得到突變株主產四環素的研究結果相符[9].這兩個研究結果不僅表明ctcK基因可能是金霉素C-6位甲基化酶基因,還顯示CtcK可以催化四環類抗生素pretetramid到6-methylpretetramid的甲基化反應,催化途徑如圖9.然而,基因功能的最終確定還須對該基因進行體外表達等一系列研究工作.
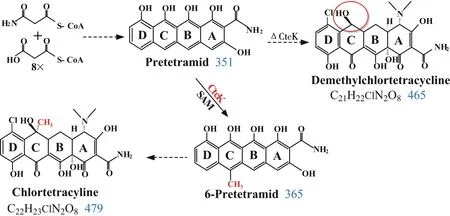
圖9 金霉素生物合成過程中ctcK基因催化途徑圖Fig.9 Catalytic pathway of the ctcK in chlortetracycline biosynthesis
[1] NGUYEN F,STAROST A L,ARENZ S,etal.Tetracycline antibiotics and resistance mechanisms[J].Biol Chem,2014,395(5):559-575.
[2] NELSON K L,BROZEL V S,GIBSON S A,etal.Influence of manure from pigs fed chlortetracycline as growth promotant on soil microbial community structure[J].World J Microb Biot,2011,27(3):659-668.
[3] WEN B,LIU Y,WANG P,etal.Toxic effects of chlortetracycline on maize growth,reactive oxygen species generation and the antioxidant response[J].J Environ Sci China,2012,24(6):1099-1105.
[4] CHOPRA I,ROBERTS M.Tetracycline antibiotics:mode of action,applications,molecular biology,and epidemiology of bacterial resistance[J].Microbiol Mol Biol R,2001,65(2):232-260.
[5] PAUTKE C,VOGT S,KREUTZER K,etal.Characterization of eight different tetracyclines:advances in fluorescence bone labeling[J].J Anat,2010,217(1):76-82.
[6] 余彥國,張 瑾.四環素類藥物的非抗菌作用機制與非抗感染臨床應用[J].中國獸藥雜志,2012,46(1):54-56.
[7] 裴立忠,王勇平,張 鵬,等.四環素類抗生素生產狀況與市場發展前景[J].中國獸藥雜志,2015,49(1):64-68.
[8] MCCORMICK J R,JENSEN E R.Biosynthesis of the Tetracyclines.VIII.1 Characterization of 4-hydroxy-6-methylpretetramid[J].J Am Chem Soc,1965,87(8):1794-1795.
[9] RYAN M J.Strain for the production of 6-dimethyltetracycline,method for producing the strain and vector for use in the method:US,5989903[P],1999-11-23[2015-12-26].http://www.dwz.cz/32xi.
[10] NAKANO T,MIYAKE K,ENDO H,etal.Identification and cloning of the gene involved in the final step of chlortetracycline biosynthesis inStreptomycesaureofaciens[J].Biosci Biotech Bioch,2004,68(6):1345-1352.
[11] ZHU T,DENG Z X,YOU D L,etal.Deciphering and engineering of the final step halogenase for improved chlortetracycline biosynthesis in industrialStreptomycesaureofaciens[J].Metab Eng,2013,19:69-78.
[12] 張南燕,洪文榮,林玉雙,等.打靶載體pIJ792的構建[J].海峽藥學,2010,20(4):164-167.
[13] 方志鍇,洪文榮,嚴凌斌,等.金色鏈霉菌接合轉移體系的構建[J].福建農林大學學報(自然科學版),2011,40(5):521-524.
[14] 陳梁軍.金霉素發酵工藝研究[J].海峽藥學,2010,22(6):23-25.
[15] 劉 慰,秦 浩,劉 霜,等.一株枯草芽胞桿菌的分離鑒定及其殺蟲活性的研究[J].湖南師范大學自然科學學報,2014,37(5):14-20.
[16] TOBIAS K,BIBB M,MARK J B,etal.Practicalstreptomycesgenetics[M].Norwich:The John Innes Foundation,2000.
[17] SAMBROOK J F,RUSSELL D W.Molecular Cloning:A Laboratory Manual[M].New York:Cold Spring Harbor Laboratory Press,2001.
[18] 程惠芳,劉金玲,啜淑英.產去甲基金霉素突變株的選育Ⅱ.金霉素鏈霉菌635突變株的選育[J].微生物學報,1974,14(1):74-76.
[19] ZHANG W J,WATANABE K,CLAY C,etal.Investigation of early tailoring reaction in the oxytetracycline biosynthetic pathway[J].J Biol Chem,2007,282(35):25717-25725.
(編輯 WJ)
Study ofctcKin Chlortetracycline Biosynthesis Gene Cluster
LINLong-zhen,WANYun-feng,HONGWen-rong*
(College of Biological Science and Technology,Fuzhou University,Fuzhou 350108,China)
In order to detect the function ofctcK,thectcKdeletion mutantS.aureofaciensSK12 (ΔctcK) was constructed inS.aureofaciensJ13 by genetic engineering.Changes of its secondary metabolites were analyzed.The molecular ion peak of demethylchlortetracycline (m/z=465.10 [M+H]+) instead of chlortetracycline (m/z=479.12 [M+H]+) was detected in the metabolites of mutant strain SK12 by MS analyses.This is in contrast to the detection result of metabolites of parent strain J13.These results indicate that the inactivation ofctcKinterdicts chlortetracycline biosynthesis flow and lead to the main accumulation of demethylchlortetracycline in mutant strain SK12,revealing the successful methylation of C-6 of chlortetracycline withctcKinvolved.In this study,the function of thectcKwas preliminarily elucidated.An engineered bacteria that mainly produces monocomponent demethylchlortetracycline has been simultaneously obtained.
ctcK; DMCTC; methylation; biosynthesis;S.aureofaciens
10.7612/j.issn.1000-2537.2017.01.006
2016-03-02
國家自然科學基金資助項目(31070093);國家“重大新藥創制”科技重大專項資助項目(2012ZX09201101-008)
* 通訊作者,E-mail:hongwr56@163.com
Q935
A
1000-2537(2017)01-0037-07

