作物硝態氮轉運利用與氮素利用效率的關系
張振華
(南方糧油作物協同創新中心/湖南農業大學資源環境學院,長沙 410128)
作物硝態氮轉運利用與氮素利用效率的關系
張振華
(南方糧油作物協同創新中心/湖南農業大學資源環境學院,長沙 410128)
【目的】銨態氮 (NH4+) 和硝態氮 (NO3–) 是作物氮素吸收利用的主要形態,旱作作物 NO3–的累積與利用是氮素營養研究的主要組成部分,關系到理解作物 NO3–的轉運和利用關系及作物體內 NO3–含量和氮素利用效率(nitrogen utilization efficiency, NUE) 高低的問題。 【主要進展】作物吸收的 NO3–分為被作物直接利用、分泌到根外、儲存在液泡和向地上部分運輸四種途徑。其中 NO3–短途分配 (液泡 NO3–分配) 和長途轉運 (地上、地下部 NO3–的轉運) 共同調控著 NO3–的利用效率,進而影響作物的 NUE。液泡 NO3–不能被作物直接利用,只有分配到液泡外細胞質中的 NO3–才能被作物迅速代謝和利用;同時有更大比例的 NO3–分配到地上部分,使得作物可以充分利用太陽光能進行 NO3–代謝和能量轉換,從而提高了作物的 NUE。此外,液泡對 NO3–起到分隔作用,儲存在液泡中的 NO3–并不能對 NO3–轉運相關基因 (如 NR、NO3–長途轉運基因 NRT1.5 和 NRT1.8) 起到誘導效果;只有分配在液泡外原生質體中的 NO3–才能對 NO3–誘導基因產生強烈的誘導。因此,作物細胞原生質體中液泡內、外 NO3–的分配不僅影響了 NO3–的同化利用,而且直接影響了 NO3–的長途轉運。 【展望】本文對植物原生質體中液泡內、外 NO3–的短途分配和地上、地下部間 NO3–的長途轉運機制進行了總結,為進一步深入研究作物地上、地下部 NO3–長途轉運和液泡 NO3–短途分配的關系,以及更好地揭示作物 NUE 對 NO3–轉運和利用的響應機理提供參考。
硝態氮;氮素利用效率;長途轉運;短途分配
我國是氮肥消費大國,氮肥年消耗量位居世界第一,但氮肥利用率卻較低,平均只有 35%,遠遠低于發達國家的40%~60%[1–2]。隨著氮肥的大量施用,許多地方出現隨氮肥施用量增加作物產量反而減少的現象[1,3]。氮肥利用率低不僅造成資源浪費和環境污染,還威脅到了人體健康[4–5]。2013 年聯合國環境規劃署全球養分管理合作伙伴 (GPNM,UNEP)組織編寫的“Our Nutrient World”就系統分析了養分在糧食安全和環境保護中的作用,明確提出了 20–20計劃,即在 20 年內提高養分利用效率 20%[6]。因此,提高氮肥利用率,充分挖掘作物高效利用氮素的遺傳潛力具有重要的生態和實際生產意義[7–9]。
NO3–是旱作作物的主要氮源,可以在植物體內大量累積和轉運[10]。光照充足時,地上部比根部的同化效率高[10–11]。因此,白天高光照條件下,植株有更多的 NO3–長途轉運到地上部分。代謝是一種“節省”代謝能量“成本”的最優方式,可在充分利用太陽光能的同時,有效提高植物的 NUE[11–13]。同時NO3–的長途轉運及其在地上、地下部的分配受到兩NO3–長途轉運基因 (NRT1.5 和 NRT1.8) 的雙重調控,且兩者表達都受到 NO3–的強烈誘導[14–18]。而植株體內液泡膜轉運系統可能通過調控液泡內、外NO3–的分配 (NO3–短途分配) 比例,影響 NO3–長途轉運基因的誘導表達和功能發揮[19–22]。
目前的研究表明,氯離子通道蛋白 CLCa 主要負責 NO3–的短途分配 (液泡 NO3–分配),是液泡 NO3–累積的主要通道[23];液泡膜質子泵 (V-ATPase 和 VPPase) 則為液泡 NO3–的累積提供能量和動力[21,24–25]。植物液泡占據了成熟細胞體積的 90% 左右,儲存在液泡中的 NO3–不能被植物代謝利用,只有分配到液泡外細胞質中的 NO3–才能被植物代謝利用,而液泡和細胞質中 NO3–的濃度通常分別為 30~50 mol/m3和 3~5 mol/m3[26],因此,液泡是植物 NO3–累積的主要部位,研究植物氮效率就不能忽視液泡 NO3–分配所起的作用[27–29]。通常情況下細胞質用于 NO3–還原的同化力在葉片中是比較充足的,只要 NO3–能分配到液泡外便能迅速同化利用,所以,液泡內、外NO3–的分配比例很大程度上決定著植物對 NO3–的利用效率[1,27–28]。
1 NO3–利用效率及其與氮效率的關系
NO3–在植物體內可大量累積,極端狀態下 NO3–累積量可超過植株鮮重的 2%,干重的 17%~24%[28,30]。NO3–作為植株體內的無機氮,如果不能得到及時同化和利用,將會明顯影響植株的氮素同化效率和生物量的形成,進而顯著影響植物的NUE[1,31]。NO3–被吸收進入根部細胞后有就地同化 (①)、外排 (②)、儲存 (③)、以及向地上部分轉運 (④) 四種命運 (圖 1)[32],大部分 NO3–會通過木質部導管進行長途轉運,到達植物地上部分后,在不同組織中進行轉運和利用。此外,有人把植物細胞中的 NO3–分成代謝庫 (液泡外原生質體中的 NO3–) 和儲存庫 (液泡中的 NO3–),前者量少但強烈影響著 NO3–誘導基因的表達 (如NR、NRT1.5 和 NRT1.8),而后者量雖大卻與 NO3–誘導基因的表達關系不強[19–20]。這些結果都表明,液泡NO3–的積累和 NO3–在地上、地下部的分配都明顯的影響著植株 NUE,并且存在著緊密的相關性,是造成植物 NUE 差異的重要生理原因。因此,研究闡明NO3–短途分配與長途轉運之間的關系及其對 NUE 的影響,有望為充分利用植物體內的 NO3–以及提高NUE 提供科學依據。
2 NO3–的短途分配及其影響因素
研究養分離子通過細胞膜或液泡膜的過程是厘清植物營養基因型差異的重要方面之一[33]。NO3–的短途分配主要指吸收的 NO3–跨液泡膜轉運的過程。NO3–在液泡膜質子泵的動力作用下,通過氯離子通道 (CLC) 蛋白進入到液泡的過程不僅與 NO3–質子泵提供的能量有關[21,24–25],而且與 CLC 蛋白的活性有密切關系[23]。從目前的研究結果來看,唯一確定對液泡NO3–起到累積效果的 NRT 家族基因是 NRT2.7,且僅在種子成熟晚期表達,起到種子中液泡 NO3–累積的作用[34];但真正影響到植株生長過程中整體液泡NO3–累積的主要因素為 CLC 家族蛋白[23]。NO3–在液泡內、外的分配狀況不僅影響植株吸收 NO3–的分隔累積和利用[21],而且可能明顯影響植物組織中 NO3–誘導基因的表達狀況和 NUE[19–20]。
2.2.1 液泡膜氯離子通道 (CLC) 的特性與調控 NO3–在細胞內有相應的獨立轉運系統。迄今為止,通過熒光標記染料和電生理技術 (如膜片鉗技術) 在液泡膜上發現的陰離子通道主要有兩類,即氯離子通道(CLC) 和蘋果酸通道,兩者均屬內向整流型通道[35–36]。CLC 主要通透 Cl–和 NO3–等陰離子,也允許蘋果酸根離子通過,但谷氨酸鹽不能通過,其受胞質 Ca2+激活[37],具體機制是通過 ATP 存在條件下 CDPK (calmodulin domain protein kinase) 的激活,受尼氟滅酸 (niflumic acid,NA) 專性抑制,與一般陰離子通道不同,不受 DIDS (4,4′-dinitrostilbene-2,2′- disulfonic acid) 抑制[38–40]。
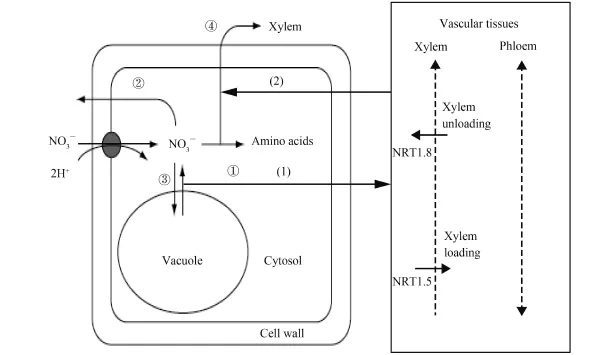
圖1 NO3–進入根部細胞后的不同去向Fig.1 The pathway for NO3–after entering into root cells
已有研究表明,AtNRT2.7 和 CLCa 是 2 個能將NO3–轉入液泡的轉運蛋白[27,35],可能具有類似功能的轉運蛋白還包括 CLCb、CLCe、AtNRT1.4[41–43]。在CLC 家族中:(1) AtCLCa 是第一個被發現編碼NO3–/2H+共轉運體的 CLC 家族蛋白,也是唯一有確切證據表明其參與液泡 NO3–累積的氯離子通道(CLC) 蛋白,其突變體液泡中的 NO3–累積量減少50% 左右,且地上、地下部分 NO3–含量均降低[23,44–45];(2) CLC 家族的另一成員 CLCb 定位于液泡膜上,并且也能轉運 NO3–,但目前還沒有直接的分子證據證明它是否參與 NO3–進出液泡[42]。在 AtNRT 家族中:(1) AtNRT 1.4 特異性表達在富含 NO3–的葉柄,實驗證據顯示它可能參與葉柄細胞中液泡 NO3–的累積,但一直缺少 AtNRT1.4 定位在液泡膜上的相關實驗證據,因此,其實際功能一直存在爭議[43];(2) AtNRT 2.7是目前為止唯一被確定參與液泡 NO3–儲存的 NRT 家族基因,其表達在種子成熟晚期,定位在液泡膜上,負責將種子的 NO3–從細胞質運往液泡中儲存,完成種子中 N 素營養積累的使命[34]。與 NRT 家族相比,CLC 家族蛋白是植物在生長過程中調控液泡NO3–累積的最主要方式,可以明顯影響植株 NO3–的利用[23,44–45]。
2.2.2 液泡膜質子泵的特性與調控 植物液泡膜上有兩類功能和物理特性完全不同的質子泵 (V-ATPase和 V-PPase),共同致力于跨膜 ?H+的建立[46]。NO3–從細胞質進入液泡主要靠液泡膜上的 H+/2NO3–逆向轉運蛋白來完成;而液泡膜上 NO3–與其它陽離子構成的同向轉運蛋白則有利于液泡中 NO3–向細胞質的轉移[21,23,47]。以往的研究表明,V-ATPase 和 V-PPase既是液泡膜質子泵的關鍵酶,也是液泡 NO3–再利用程度的決定因素;但是有關于液泡膜質子泵累積NO3–的機理及其與氮效率的關系卻研究較少[1]。因此,在研究液泡膜質子泵活性的基礎上,明確液泡NO3–的短途分配機制,對于進一步提高作物 NUE 有重要意義[48]。
Bafilomycin A1是一種具有大環內酯的抗生素,結合于液泡 H+-ATPase 的膜結合區 (V0),堵塞質子跨膜轉運通道,從而強烈抑制 V 型 H+-ATPase 的活性,為液泡膜 H+-ATPase 的專一性抑制劑,以納摩爾的濃度抑制 V-ATPase 的活性,50 nmol/L bafilomycin A1抑制了酶活性的 64%[49–50]。二環已基碳二亞胺(N,N′-dicyclohexylcarbodiimide,DCCD) 是一種質子通道抑制劑,對 V-PPase 活性有強烈的抑制作用,同時也可以較弱的抑制 V-ATPase 活性[51–52]。而 VATPase c 亞基的第四個跨膜 α 螺旋上有一個高度保守的 Glu 殘基,該殘基是質子通道抑制劑 DCCD 與V-ATPase 唯一的作用位點,硫 (Na2SO3) 引起 DCCD與 V-ATPase 結合位點的變化,使 DCCD 不能接近這一點,有效地拮抗了 DCCD 對 V-ATPase 水解的抑制,而并不保護被 Bafilomycin A1引起的抑制[50,53],因此,DCCD+Na2SO3是 V-PPase 專一性抑制劑。
3 NO3–的長途轉運及其影響因素
NO3–一旦吸收進入根中,除了通過液泡膜儲存到液泡中,還可以還原為亞硝態氮并分配到質體中進一步被同化為有機氮[54]。此外,大部分 NO3–還可以被裝載到木質部并被轉運到植物的地上部組織進行代謝[55]。NO3–在地上、地下部分的分配比例分別由向上運輸的木質部介導和向下運輸的韌皮部介導[56]。近期的研究發現擬南芥中木質部介導的 NO3–長途轉運主要由 NRT1 家族的兩個成員 NRT 1.5 和 NRT 1.8調控,并且它們的表達受到 NO3–的強烈誘導和激素的強烈調控[16–18]。根部吸收的 NO3–向木質部的裝載是向地上部運輸的關鍵環節,也是 NO3–運輸分配中的獨立控制環節[57],AtNRT1.5 就負責該功能,其功能缺失突變體木質部傷流液中 NO3–含量降低,植物向上轉運 NO3–的能力被削弱[14]。而 AtNRT1.8 通過調控 NO3–木質部的卸載也影響 NO3–從根向地上部分的運輸,通過增強地上部 NO3–的木質部卸載促進NO3–向地上部的轉運[16]。可見,AtNRT 1.5 與 AtNRT 1.8共同影響 NO3–向上運輸。而對于韌皮部介導的 NO3–向下運輸,目前只鑒定了負責根部韌皮部裝載的基因 AtNRT1.9,負責韌皮部卸載的基因尚未找到[58–59]。AtNRT1.9、AtNRT1.8 和 AtNRT1.5 可能一起協同作用,調節 NO3–從地下部分向地上部分的長途轉運以及再分配。值得注意的是,作物 NO3–在木質部中的運輸濃度通常是韌皮部中的幾十到上百倍,因此研究 NO3–在地上、地下部的分配主要關注木質部 NO3–的轉運,而不是影響很小的韌皮部 NO3–轉運[14,16,59]。目前,其他作物中對于 NRT1 與 NO3–長途轉運的關系研究主要集中在小麥和水稻中,但由于非模式植物研究的突變體材料和克隆基因技術的限制,僅僅在小麥中研究了 NRT1.5 和 NRT1.8 基因對氮脅迫的響應[60],以及水稻中 OsNRT1.5 過表達材料的氮素生理特性分析[61],基本明確了 NRT1.5 和 NRT1.8 在其它作物中同樣調控了氮素的轉運和分配,起到了與擬南芥中相似的作用。因此,有理由相信擬南芥的NO3–長途轉運與 NRT1 家族基因的關系可能也適用于其它作物,具有很重要的參考意義。
此外,作物蒸騰作用同樣強烈影響著 NO3–的長途轉運,裝載到木質部中的 NO3–通過蒸騰拉力的作用源源不斷的運輸到作物地上部分,從而促進 NO3–從地下向地上部分的轉運[15–16]。NO3–長途轉運不僅決定著 NO3–的組織分配和影響著 NO3–在不同植物組織中的同化比例及利用效率,而且也是植物響應環境變化的重要生理機制[62]。因此,闡明并調控 NO3–長途轉運系統對提高養分利用效率有重要作用[55]。在豌豆中的研究表明,蒸騰作用的抑制減少了 NO3–向地上部的轉運,使 NO3–累積于根中,從而導致鎘脅迫條件下根中有更多的 NO3–累積[15–16,63]。Chen 等[15]和 Li 等[16]的研究結果表明,除了一般認為的蒸騰作用調控著營養元素從根向地上部的轉運,逆境脅迫條件下 NRT1.5 和 NRT1.8 對根中 NO3–累積的調控可能是 NO3–分配過程中的主要調控因素,因為逆境脅迫條件下野生型擬南芥比 nrt1.8-1 突變體在根中保持了更高的 NO3–比例,表明 NRT1.8 等轉運蛋白對根/地上部 NO3–比例的調控是主動調控機制,而不是由于蒸騰作用受到抑制的被動調節機制。但不同NUE 作物基因型 NRT1.5 和 NRT1.8 的表達差異及其對 NUE 的影響,迄今研究報道較少[15]。
4 NO3–短途分配與長途轉運的關系
根部的液泡是作物吸收 NO3–的儲存庫[1],但是分配在液泡外原生質體中的 NO3–并不能迅速的裝載到木質部汁液中,從而得以運輸到地上部分高效利用。因為,細胞質中 NO3–裝載到木質部汁液中的過程是一個消耗能量的主動運輸,需要長途轉運基因(NRT1.5 和 NRT1.8) 的協同作用[14,16]。此外,NRT1.5和 NRT1.8 兩基因的表達模式相反,且 NRT1.5 的表達受到外界 NO3–的顯著誘導[14–15]。因此,有理由相信 NRT1.5 的表達同樣受到作物體內細胞質中 NO3–的誘導。最新的研究表明,氮高效作物根系中液泡NO3–儲存能力的降低可以促進 NO3–從地下部向地上部的轉運 (圖 2)。具體表現為氮高效作物根系中液泡膜質子泵和氯離子通道蛋白 (CLCa) 的活性降低,從而有更低比例的 NO3–累積到液泡中,有更高比例的NO3–分配到細胞質中,繼而誘導根部 NRT1.5 的表達,同時抑制 NRT1.8 的表達,最終導致更大比例的NO3–裝載到木質部汁液中運輸到作物的地上部分。這是作物擁有更高 NUE 的重要原因之一。
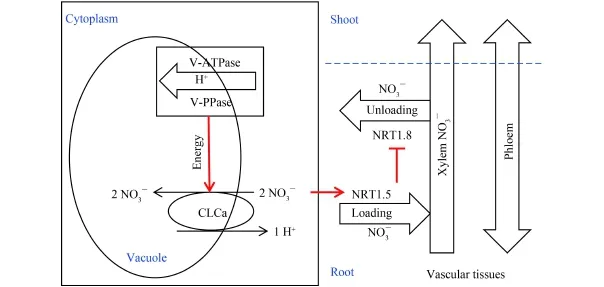
圖2 NO3–短途分配對長途轉運的調控機理Fig.2 The mechanism for the regulation of NO3–short distribution on NO3–long transportation
5 NO3–利用效率相關研究的發展趨勢分析
雖然有關于植物 NO3–利用效率的研究起步較晚,但由于在提高作物 NUE 重要意義的驅使下,通過近年的研究積累,NO3–長途轉運和短途分配總體來說已經取得了較好的研究進展,并且隨著相關機理的不斷揭示,逐漸成為國內外的熱點研究領域[14,16,59]。液泡 NO3–的分配不僅直接影響著 NO3–的分配和利用能力[21,24–25],還可能影響著受 NO3–誘導基因的表達及功能發揮[19–20,22],使短途分配和長途轉運成為一個有機整體 (圖 1),最終調控植株的 NUE[32]。因此,關于液泡 NO3–短途分配機理和長途轉運機制的研究,亟需從以下幾個方面進一步深入[8,16,64]:1) 液泡儲存的 NO3–除了調節滲透功能以外,對 NO3–誘導基因的表達和功能發揮的調節程度如何?2) 液泡 NO3–分配過程中氯離子通道 (CLC) 和質子泵對 NO3–胞內分配的貢獻差異還有待研究;3) 盡管 CLCa 主要調控NO3–從細胞質向液泡的累積分隔,但這個過程對NO3–進一步同化利用的影響到底有多大,目前也尚不清楚。
從目前的研究結果看,盡管 NRT 家族基因分別在葉柄 (NRT1.4) 和種子 (NRT2.7) 液泡 NO3–累積過程中發揮了一定的作用,但起主要調控作用的因素仍然為液泡膜上的質子泵系統和 CLC 轉運系統[34,43],液泡膜 NO3–轉運系統分布在植株組織中的各個部分,是調控 NO3–短途分配的主要過程[21,23]。負責韌皮部 NO3–裝載的 NRT1.9 以及負責木質部 NO3–裝載(NRT1.5) 和卸載 (NRT1.8) 的 NRT 家族基因共同調控著 NO3–的長途轉運;但韌皮部主要負責有機氮的轉運,無機態氮 (NO3–) 的運輸濃度通常是木質部的幾十或幾百分之一[14,16,58–59]。因此,短途分配中液泡膜CLC 和質子泵轉運系統,以及長途轉運中 NRT1.5 和NRT1.8 長距離運輸系統是 NO3–長途轉運和短途分配的主要調控因子。所以,在前人研究基礎上選取在NO3–短途分配起到主要作用的液泡膜 NO3–分配系統,以及在 NO3–長途轉運中發揮主要功能的維管束長距離運輸系統為突破口,深入研究 NO3–短途分配對其長途轉運機制的調控及其對 NUE 的影響機理,可以更好地闡述胞內 NO3–短途分配和 NO3–長途轉運的關系及其互相影響的生理機制,為提高作物NUE提供科學理論依據。
參 考 文 獻:
[1]沈其榮, 湯利, 徐陽春. 植物液泡中硝酸鹽行為的研究概況[J]. 土壤學報, 2003, 40(3): 465–470. Shen Q R, Tang L, Xu Y C. A review on the behavior of nitrate in vacuoles of plants [J]. Acta Pedologica Sinica, 2003, 40(3): 465–470.
[2]田飛. 油菜氮高效種質的篩選及高效機制[M]. 武漢: 華中農業大學碩士論文, 2011. Tian F. Screening of high nitrogen efficient rapeseed and its mechanism [D]. Wuhan: MS Thesis of Huazhong Agricultural University, 2011.
[3]Miller A J, Smith S J. Cytosolic nitrate ion homeostasis, could it have a role in sensing nitrogen status [J]. Annals of Botany, 2008, 101: 485–489.
[4]Xu G H, Fan X R, Miller A J. Plant nitrogen assimilation and use efficiency [J]. The Annual Review of Plant Biology, 2012, 63: 153–182.
[5]Chen X P, Cui Z L, Fan M S, et al. Producing more grain with lower environmental costs [J]. Nature, 2014, 514: 486–489.
[6]Sutton M A, Bleeker A, Howard C M, et al. Our nutrient word, the challenge to produce more food and energy with less pollution[D]. Beijing: Published by the Centre for Ecology and Hydrology (CEH), 2013.
[7]Zhang Z H, Song H X, Liu Q, et al. Nitrogen redistribution characteristics of oilseed rape varieties with different nitrogen use efficiencies during later growth period [J]. Communications in Soil Science and Plant Analysis, 2010, 41(14): 1693–1706.
[8]Schroeder J L, Delhaize E, Frommer W B, et al. Using membrane transporters to improve crops for sustainable food production [J]. Nature, 2013, 497: 60–66.
[9]Wang G L, Ding G D, Li L, et al. Identification and characterization of improved nitrogen efficiency in interspecific hybridized new-type Brassica napus [J]. Annals of Botany, 2014, 114(3): 549–559.
[10]Tang T F, Sun X C, Hu C X, et al. Genotypic differences in nitrate uptake, translocation and assimilation of two Chinese cabbage cultivars [Brassica campestris L. ssp. Chinesnsis (L.)] [J]. Plant Physiology and Biochemistry, 2013, 70: 14–20.
[11]Smirnoff N, Stewart G. Nitrate assimilation and translocation by higher plants: Comparative physiology and ecological consequences [J]. Physiologia Plantarum, 1985, 64: 133–140.
[12]Andrews M. The partitioning of nitrate assimilation between root and shoot of higher plants [J]. Plant Cell Environment, 1986, 9: 511–519.
[13]Tang Z, Fan X R, Li Q, et al. Knockdown of a rice stelar nitrate transporter alters long-distance translocation but not root influx [J]. Plant Physiology, 2012, 160: 2052–2063.
[14]Lin S H, Kou H F, Canivenc G, et al. Mutation of the arabidopsis NRT1.5 nitrate transporter causes defective root-to-shoot nitrate transport [J]. The Plant Cell, 2008, 20: 2514–2528.
[15]Chen C Z, Lv X F, Li J Y, et al. Arabidopsis NRT1.5 is another essential component in the regulation of nitrate reallocation and stress tolerance [J]. Plant Physiology, 2012, 159: 1582–1590.
[16]Li J Y, Fu Y L, Pike S M, et al. The arabidopsis nitrate transporter NRT1.8 functions in nitrate removal from the xylem sap and mediates cadium tolerance [J]. The Plant Cell, 2010, 22: 1633–1646.
[17]Zhang G B, Yi H Y, Gong J M. The arabidopsis ethylene/jasmonic acid-NRT signaling module coordinates nitrate reallocation and the trade-off between growth and environmental adaption [J]. The Plant Cell, 2014, 26(10): 3984–3998.
[18]Leran S, Varala K, Boyer J C, et al. Aunified nomenclature of nitrate transporter 1/peptide transporter family members in plants [J]. Trends in Plant Science, 2014, 19(1): 5–9.
[19]Glass A D M, Britto D T, Kaiser B N, et al. The regulation of nitrate and ammonium transport systems in plants [J]. Journal of Experimental Botany, 2002, 53: 855–864.
[20]Granstedt R C, Huffaker R C. Identification of the leaf vacuole as a major nitrate storage pool [J]. Plant Physiology, 1982, 70: 410–413.
[21]Krebs M, Beyhl D, Gorlich E, et al. Arabidopsis V-ATPase activity at the tonoplast is required for efficient nutrient storage but not for sodium accumulation [J]. PNAS, 2010, 107: 3251–3256.
[22]黃海濤, 榮湘民, 宋海星, 等. 外源硝酸還原酶抑制劑對油菜植株體內NR活性的影響及其與硝酸鹽含量的關系[J]. 作物學報, 2013, 39(9): 1668–1673. Huang H T, Rong X M, Song H X, et al. Effects of nitrate reductase (NR) inhibitor on NR activity in oilseed rape and its relation to nitrate content [J]. Acta Agronomica Sinica, 2013, 39(9): 1668–1673.
[23]Angeli A D, Monachello D, Ephritikhine G, et al. The nitrate/proton antiporter AtCLCa mediates nitrate accumulation in plant vacuoles [J]. Nature, 2006, 442: 939–942.
[24]Gaxiola RA, Li J S, Undurraga S, et al. Drought and salt tolerant plants result from over expression of the AVP1 H+-pump [J]. PNAS 2001, 98(20): 11444–11449.
[25]Brux A, Liu T Y, Krebs M, et al. Reduced V-ATPPase activity in the trans-Golgi network causes oxylipin-dependent hypocotyl growth inhibition in arabidopsis [J]. The Plant Cell, 2008, 20: 1088–1100.
[26]Martinoia E, Massonneau A, Frangne N. Transport processes of solutes across the vacuolar membrane of higher plants [J]. Plant Cell Physiology, 2000, 41(11): 1175–1186.
[27]Han Y L, Liao Q, Yu Y, et al. Nitrate reutilization mechanisms in the tonoplast of two Brassica napus genotypes with different nitrogen use efficiency [J]. Acta Physiologia Planturum, 2015, 37: 42.
[28]黃海濤, 張振華, 宋海星, 等.基于液泡膜質子泵的硝態氮再利用研究進展[J]. 生態學雜志, 2012, 31(3): 731–737. Huang H T, Zhang Z H, Song H X, et al. Nitrate nitrogen reutilization based on proton pump of vacuole membrane: A review [J]. Chinese Journal of Ecology, 2012, 31(3):731–737.
[29]Martinoia E, Heck U, Wiemken A. Vacuoles as storage compartments for nitrate in barley leaves [J]. Nature, 1981, 289: 292–294.
[30]黃彩變, 王朝輝, 李生秀. 植物液泡硝態氮累積的營養和生理學意義[J]. 土壤, 2006, 38(6): 820–824. Huang C B, Wang Z H, Li S X. Nutritional and physiological significance of nitrate accumulation in plant vacuolar [J]. Soils, 2006, 38(6):820–824.
[31]Koprivova A, Harper A L, Trick M, et al. Dissection of the control of anion homeostasis by associative transcriptomics in Brassica napus [J]. Plant Physiology, 2014, 166: 442–450.
[32]Crawford N M, Glass A D M. Molecular and physiological aspects of nitrate uptake in plants [J]. Trends in Plant Science, 1998, 3: 389–395.
[33]Leij M V D, Smith S J, Miller A J. Remobilisation of vacuolar stored nitrate in barley root cells [J]. Planta, 1998, 205: 64–72.
[34]Chopin F, Orsel M, Dorbe M F, et al. The arabidopsis ATNRT2.7 nitrate transporter controls nitrate content in seeds [J]. Plant Cell, 2007, 19: 1590–1602.
[35]Wissing F, Smith J A C. Vacuolar chloride transport inMesembryanthemum crystallinum L. measured using the fluorescent dye lucigenin [J]. Journal of Membrance Biology, 2000, 177: 199–208.
[36]屈婭娜, 於丙軍. 氯離子通道抑制劑對鹽脅迫下野生和栽培大豆幼苗離子含量等生理指標的影響[J]. 南京農業大學學報, 2008, 31(2): 17–21. Qu Y N, Yu B J. Effects of chloride channel blockers on ion contents and other physiological indexes of glycine soja and glycinemax seedlings under NaCl stress [J]. Journal of Nanjing Agricultural University, 2008, 31(2): 17–21.
[37]Berechi G, Varga Z, Van Duijn B, Duijn B. Anion channels in characorallina tonoplast membrane: calcium dependence and rectification [J]. Journal of Membrane Biology, 1999, 172: 159–168.
[38]White P J, Broadley M R. Chloride in soils and its uptake and movement within the plant: a review [J]. Annual Botany, 2001, 88: 967–988.
[39]於丙軍, 劉友良. 植物中的氯、氯通道和耐氯性[J]. 植物學通報2004, 21(4): 402–410. Yu B J, Liu Y L. Chlorine, chloride channel and chloride tolerance in plants [J]. Chinese Bulletin of Botany, 2004, 21(4): 402–410.
[40]Qu Y N, Zhou Q, Yu B J. Effects of Zn2+and nuflumic acid on photosynthesis in glycine soja and glycine max seedlings under NaCl stress [J]. Environmental and Experimental Botany, 2009, 65: 304–309.
[41]Barbier-Brygoo H, Angeli A D, Filleur S, et al. Anion channels/transporters in plants: from molecular bases to regulatory networks [J]. Annual Review of Plant Biology, 2011, 62: 25–51.
[42]Fecht-Bartenbach J V D, Bogner M, Dynowski M, Ludewig U. ClC-b-mediated NO3–/H+exchange across the tonoplast of arabidopsis vacuoles [J]. Plant Cell Physiology, 2010, 51(6): 960–968.
[43]Chiu C C, Lin C S, Hsia A P, et al. Mutation of a nitrate transporter, AtNRT1.4, results in a reduced petiole nitrate content and altered leaf development [J]. Plant Cell Physiology, 2004, 45: 1139–1148.
[44]Geelen D, Lurin C, Bouchez D, et al. Disruption of putative anion channel gene AtCLC-a in Arabidopsis suggests a role in the regulation of nitrate content [J]. Plant Journal, 2000, 21: 259–267.
[45]Monachello D, Allot M, Oliva S, et al. Two anion transporters AtClCa and AtClCe fulfil interconnecting but not redundant roles in nitrate assimilation pathways [J]. New Phytology, 2009, 183: 88–94.
[46]Martinoia E, Maeshima M, Neuhaus H E. Vacuolar transporters and their essential role in plant metabolism [J]. Journal of Experimental Botany, 2007, 58: 83–102.
[47]Chen X Y, Nie L L, Bao H, et al. Modified noninvasive microtest electrophysiological technology for vacuolar H+flux detection [J]. Analytical Biochemistry, 2011, 418: 295–297.
[48]Han Y L, Liu Q, Gu J D, et al. V-ATPase and V-PPase at the tonoplast affect NO3-content in Brassica napus by controlling distribution of NO3-between the cytoplasm and vacuole [J]. Journal of Plant Growth Regulation, 2014, 34: 22–34.
[49]王歡, 王廷枝, 董彩華, 王志強. 大豆液泡膜H+-ATPase的純化和重組[J]. 中國生物化學與分子生物學報, 2000, 16(1): 110–115. Wang H, Wang T Z, Dong C H, Wang Z Q. Tonoplast H+-ATPase analysis in soybean [J]. Chinese Journal of Biochemistry and Molecular Biology, 2000, 16(1): 110–115.
[50]馬挺軍, 向遠寅, 王沙生. 鹽脅迫對胡楊液泡膜H+-ATPase水解活性的影響[J]. 新疆農業大學學報, 2003, 26(2): 43–48. Ma T J, Xiang Y Y, Wang S S. Effects of salt stress on the hydrolytic activity of H+ATPase from Populus euphratica [J]. Journal of Xinjiang Agricultural University, 2003, 26(2): 43–48.
[51]Maeshima M, Hara-Nishimura I, Takeuchi Y K, Nishimura M. Accumulation of vacuolar H+-Pyrophosphatase and H+-ATPase during reformation of the central vacuole in germinating pumpkin seeds [J]. Plant Physiology, 1994, 106: 61–69.
[52]Yang S J, Jiang S S, Kuo S Y, et al. Localization of a carboxylic residue possibly involved in the inhibition of vacuolar H+-pyrophosphatase by N,N'-dicyclohexylcarbodi-imide [J]. Biochemical Journal, 1999, 342: 641–646.
[53]Dschida W J A, Bowman B J. The vacuolar ATPase: Sulfite stabilization and the mechanism of nitrate inactivation [J]. The Journal of Biological Chemistry, 1995, 270(4): 1557–1563.
[54]Zhang Z H, Wang W M, Guan C Y, et al. Mechanisms of nitrogen redistribution in response to enzyme activities and the effects on nitrogen use efficiency in Brassica napus during later growth stages [J]. Pakistan Journal of Botany, 2014, 46(5): 1789–1795.
[55]Marschner H, Kirkby E A B C, Engels C. Importance of cycling and recycling of mineral nutrients within plants for growth and development [J]. Botanica Acta, 1997, 110: 265–273.
[56]Dechorgnat J, Nguyen C T, Armengaud P, et al. From the soil to the seeds: the long journey of nitrate in plants [J]. Journal of Experimental Botany, 2011, 62: 1349–1359.
[57]Herdel K, Schmidt P, Feil R, et al. Dynamics of concentrations and nutrient fluxes in the xylem of Ricinus communis-diurnal course, impact of nutrient availability and nutrient uptake [J]. Plant Cell Environment, 2001, 24: 41–52.
[58]Fan S C, Lin C S, Hsu P K, et al. The Arabidopsis nitrate transporter NRT1.7, expressed in phloem, is responsible for source-to-sink remobilization of nitrate [J]. Plant Cell, 2009, 21: 2750–2761.
[59]Wang Y Y, Tsay Y F. Arabidopsis nitrate transporter NRT1.9 is important in phloem nitrate transport [J]. The Plant Cell, 2011, 23: 1945–1957.
[60]軒紅梅, 王永華, 魏利婷, 等. 小麥幼苗葉片中硝酸鹽轉運蛋白NRT1和NRT2家族基因對氮饑餓響應的表達分析[J]. 麥類作物學報, 2014, 34(8): 1019–1028. Xuan H M, Wang Y H, Wei L T, et al. Transcription analysis of the genes encoding nitrate transporter NRT1 and NRT2 families in response to nitrogen starvation in wheat seedling leaves [J]. Journal of Triticeae Crops, 2014, 34(8): 1019–1028.
[61]馬翠. 水稻硝酸鹽轉運蛋白基因 OsNRT1.2 和 OsNRT1.5 超量表達材料的功能鑒定[J]. 南京: 南京農業大學碩士論文, 2011. Ma C. Characteristics of over-expression for nitrate transporter genes OsNRT1.2 and OsNRT1.5 in rice[M]. Nanjing: MS Thesis of Nanjing Agricultural University, 2011.
[62]Zhang Z H, Song H X, Liu Q, et al. Distribution characters of absorption nitrogen in oilseed rape (Brassica napus L.) at different growth stages [J]. Journal of Plant Nutrition, 2014, 37: 1648–1660.
[63]Hernandez L E, Garate A, CarpenaRuiz R. Effects of cadmium on the uptake, distribution and assimilation of nitrate in Pisum sativum [J]. Plant and Soil, 1997, 189: 97–106.
[64]賈莉君. 離子選擇微電極測定植物細胞跨膜電位和液泡中硝酸根離子活度的方法研究[M]. 南京: 南京農業大學碩士論文, 2006. Jia L J. The using of microelectrode studying trans-membrane potential and nitrate activity in plant cell [M]. Nanjing: MS Thesis of Nanjing Agricultural University, 2006.
The relationship between nitrate transport and utilization in crop and nitrogen utilization efficiency
ZHANG Zhen-hua
( College of Resource & Environment, Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China/Hunan Agricultural University, Changsha 410128, China )
【Objectives】Ammonia (NH4+) and nitrate (NO3–) are the primary forms for crop nitrogen (N) absorption and utilization. NO3–accumulation and utilization in plant tissues of dry land crops are the main components of N nutrient study, which are related to the NO3–content and N utilization efficiency (NUE) in plant tissues. 【Main advances】 Absorbed NO3–in crop can be assimilated into organic N directly, secreted to the root, accumulated into vacuolar space and transported from roots to shoots. NO3–utilization efficiency and NUE were regulated by NO3–short distribution (vacuole NO3–distribution) and NO3–long transportation (between roots and shoots). Vacuole NO3–can not be assimilated into organic N, but the NO3–outside of the vacuole in protoplast can be utilized by crop directly. The higher proportion of NO3–in shoots has higher NUE, because the NO3–assimilation in shoots will take full advantage of the solar energy. In addition, NO3–is separated by vacuole, NO3–assimilation genes (NR) and transportation genes (NRT1.5 and NRT1.8 for long transport of NO3–) can not be induced by vacuole NO3–, but can be stimulated by the cytosolic NO3–. Consequently, not only NO3–assimilation is regulated by NO3–short distribution, but also affected the NO3–long transport between roots and shoots.【Prospective】We summarized the mechanisms of NO3–short distribution and long transportation in thisreview, and provided some implications for further study on the relationship between NO3–long transportation and vacuole NO3–short distribution, and the response of crop NUE to NO3–transportation and utilization.
nitrate; nitrogen utilization efficiency; long transportation; short distribution
2015–08–17接受日期:2015–11–07
國家自然科學基金項目(31101596);湖南省高校創新平臺開放基金項目(13K062);湖南省百人計劃項目資助。
張振華(1982—),男,湖南懷化人,博士,副教授,主要從事植物營養生理研究。E-mail:zhzh1468@163.com

