布洛芬氯化鈉注射液細菌內毒素檢查方法的建立
詹曉亮,郭 健,苑新星,馬軍芳(.沈陽格仕特醫藥科技有限公司,遼寧本溪 7004;.沈陽興齊眼藥股份有限公司,沈陽 063)
布洛芬氯化鈉注射液細菌內毒素檢查方法的建立
詹曉亮1*,郭 健2,苑新星1,馬軍芳1(1.沈陽格仕特醫藥科技有限公司,遼寧本溪 117004;2.沈陽興齊眼藥股份有限公司,沈陽 110163)
目的:建立布洛芬氯化鈉注射液細菌內毒素的檢查方法。方法:按2015年版《中國藥典》(四部)通則1143“細菌內毒素檢查法”項下凝膠法的要求,通過干擾試驗確定樣品主成分最大無干擾質量濃度,并進行方法學驗證。結果:樣品稀釋至含布洛芬質量濃度為1 mg/mL及以下時對細菌內毒素檢查無干擾作用。結論:所建立的方法可用于布洛芬氯化鈉注射液的細菌內毒素檢查,其細菌內毒素限值確定為0.5 EU/mL。
布洛芬氯化鈉注射液;細菌內毒素檢查;干擾試驗
布洛芬為非甾體類解熱鎮痛抗炎藥,具有較強的抗炎、抗風濕及解熱鎮痛作用,且胃腸道不良反應較輕,耐受性好,目前在臨床中被廣泛使用,主要應用的是其口服制劑。布洛芬氯化鈉注射液是新近開發的注射制劑,能夠進一步擴大該藥的臨床應用范圍,更好地滿足患者的治療需求[1]。本研究參考2015年版《中國藥典》(四部)通則1143“細菌內毒素檢查法”項下凝膠法的要求[2],建立了布洛芬氯化鈉注射液細菌內毒素的檢查方法。
1 材料
1.1 儀器
BET-32型細菌內毒素測定儀(天津市天大天發科技有限公司);XK96型快速混勻器(江蘇新康醫療器械有限公司)。試驗用試管、刻度吸管等玻璃器材按規定清洗,于250℃干烤1 h除去外源性內毒素。
1.2 藥品與試劑
布洛芬氯化鈉注射液(浙江省某制藥企業,批號:13122321、13122421、13122422,規格:每100 mL含布洛芬0.4 g和氯化鈉0.8 g);鱟試劑[TAL,福州新北生化工業有限公司,批號:13090812,標示靈敏度(λ):0.125 EU/mL;湛江安度斯生物有限公司,批號:1202171,λ:0.125 EU/ mL,規格均為每支0.1 mL];細菌內毒素工作標準品(CSE,批號:130531,規格:每支10 EU)、細菌內毒素檢查用水(BET水,批號:13091402,規格:每支2 mL)均購自福州新北生化工業有限公司。
2 方法與結果
2.1 樣品細菌內毒素限值(L)的確定
L按2015年版《中國藥典》(四部)通則1143“細菌內毒素檢查法”規定的公式L=K/M計算。式中,K為人每1 kg體質量每1 h最大可接受的內毒素劑量,注射劑K=5 EU/(kg·h)。M為人用每1 kg體質量每1 h的最大樣品劑量,我國人均體質量按60 kg計算,該制劑用于鎮痛時每次給藥400~800 mg,每6 h一次,每次輸注時間不少于30 min;用于發燒時每次給藥400 mg,每4~6 h一次,或每次給藥100~200 mg,每4 h一次,每次輸注時間不少于30 min,即該制劑臨床最大劑量為1 h使用800 mg(200 mL),故M=200 mL/(60 kg·1 h)=3.33 mL/(kg·h)。則L=K/M=5 EU/(kg·h)/3.33 mL/(kg· h)=1.5 EU/mL。
按照2015年版《中國藥典》(四部)通則9301“注射劑安全性檢查法應用指導原則”中的建議[2],限值要求可適當嚴格,提高至計算值的1/3~1/2,以保證用藥安全。本試驗安全系數定為3,故L=1.5(EU/mL)/3=0.5 EU/mL。
2.2 TAL靈敏度復核
按照2015年版《中國藥典》(四部)通則1143“細菌內毒素檢查法”規定,進行TAL的靈敏度復核。根據TAL的λ=0.125 EU/mL,用BET水溶解CSE,并配制成含細菌內毒素2.0λ、1.0λ、0.5λ、0.25λ(0.25、0.125、0.062 5、0.031 25 EU/mL)的系列濃度溶液。取復溶后的規格為每支0.1 mL的TAL原安瓿18管,其中16管分別加入0.1 mL不同濃度的細菌內毒素標準溶液,每個濃度平行4管;另外2管加入0.1 mL BET水作為陰性對照。取2批不同廠家的TAL分別進行試驗,結果TAL靈敏度測試值(λC)均在0.5λ~2.0λ之間,表明2批TAL的靈敏度均與λ相符,可以用于細菌內毒素檢查試驗,結果見表1(注:“+”表示試劑形成凝膠且倒轉不變形或滑落,即反應呈陽性;“-”表示未形成凝膠或凝膠不結實、變形并脫落,即反應呈陰性。以下各表同)。
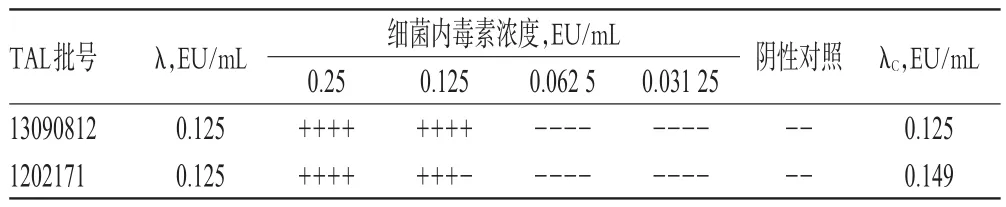
表1 TAL的靈敏度復核試驗結果Tab 1 Results of TALsensitivity recheck
2.3 干擾預試驗
目前市售TAL的λ通常為0.5~0.03 EU/mL,根據公式MVD=cL/λ計算,則供試品最終對應有效稀釋倍數范圍為1~16倍。取樣品(批號:13122321)適量,使用BET水稀釋制成布洛芬質量濃度分別為4、2、1、0.5、0.25 mg/mL的系列溶液,標記為供試品陰性對照系列溶液(NPC系列,各2管);用上述系列溶液作為溶劑,分別溶解并稀釋CSE,制得細菌內毒素含量均為2.0λ的供試品陽性對照系列溶液(PPC系列,各2管);同時做細菌內毒素陽性對照溶液(PC)和BET水陰性對照溶液(NC)各2管,然后按“細菌內毒素檢查法”操作,進行干擾預試驗,結果見表2。由表2可知,樣品在稀釋4倍及以上,即布洛芬質量濃度為1 mg/mL及以下時,2批TAL對細菌內毒素檢查試驗均沒有干擾作用。
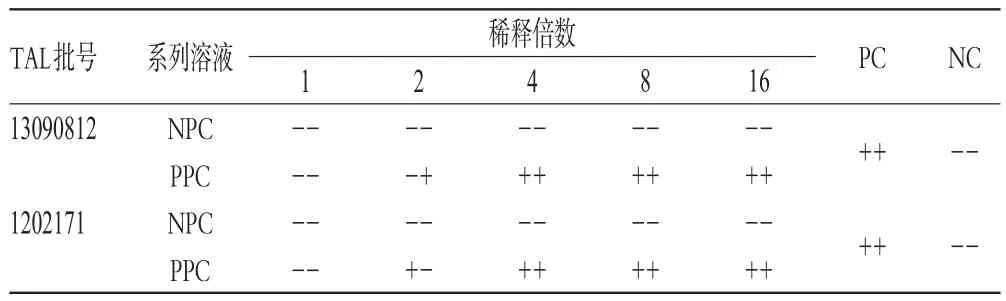
表2 樣品干擾預試驗結果Tab 2 Results of preliminary interference test
2.4 干擾試驗
根據干擾預試驗結果,將3批樣品均照干擾預試驗稀釋方法制成含布洛芬質量濃度為1 mg/mL的供試品溶液,將CSE稀釋制成含細菌內毒素2.0λ、1.0λ、0.5λ、0.25λ的系列溶液,每個濃度平行4管,然后分別用λ=0.125 EU/mL的2個廠家的TAL,按2015年版《中國藥典》(四部)通則1143“細菌內毒素檢查法”項下的規定進行干擾試驗。結果顯示,用BET水制成的細菌內毒素標準溶液反應終點濃度的幾何平均值(Es)均在0.5λ~2.0λ之間,用供試品溶液制成的細菌內毒素標準溶液反應終點濃度的幾何平均值(Et)均在0.5Es~2.0Es之間[2-3]。表明在此試驗條件下,樣品對TAL與細菌內素素的凝集反應無干擾作用,詳見表3。
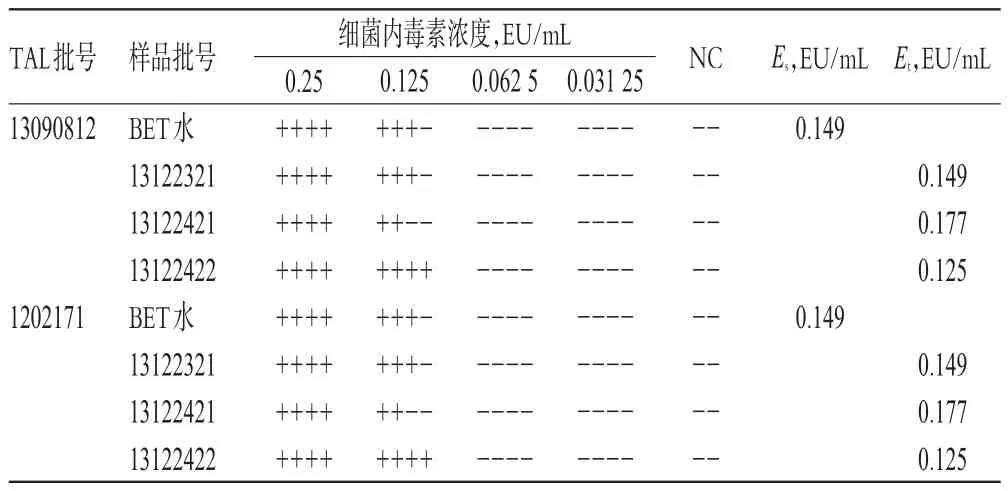
表3 樣品干擾試驗結果Tab 3 Results of interference test
2.5 樣品細菌內毒素檢查
取3批樣品各適量,照干擾預試驗稀釋方法制成含布洛芬質量濃度為1 mg/mL的供試品溶液,分別用λ=0.125 EU/mL的TAL(批號:13090812),按照2015年版《中國藥典》(四部)通則1143“細菌內毒素檢查法”進行操作和結果判斷,結果3批樣品每1 mL中含細菌內毒素的量均小于0.5 EU,詳見表4。
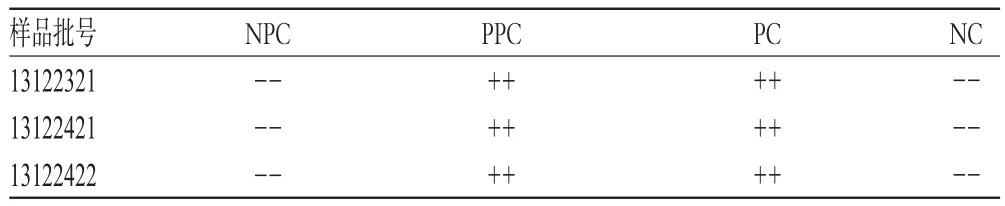
表4 樣品細菌內毒素檢查結果Tab 4 Results of bacterial endotoxin test of sample
3 討論
布洛芬氯化鈉注射液作為靜脈用注射制劑,應設立細菌內毒素或熱原檢查項。一般利用TAL法或家兔法檢查樣品所含的細菌內毒素或熱原是否符合限量規定,如果不合格,在臨床應用時可能產生熱原反應而造成嚴重的不良后果。鑒于布洛芬氯化鈉注射液具有解熱鎮痛作用,若采用家兔熱原檢查法可能會因其藥效學作用而出現假陰性結果[4];而TAL細菌內毒素檢查法具有方法簡單、結果準確、成本低等優點,適用于該制劑的細菌內毒素檢查,并且該方法已被廣泛用于具有解熱作用的注射劑及其原料藥和臨床醫療器具中的致熱物質的檢查[5-7]。本試驗初步建立了布洛芬氯化鈉注射液的細菌內毒素檢查法,并將其細菌內毒素限值確定為:取本品,依法檢查(2015年版《中國藥典》四部通則1143),每1 mL中含細菌內毒素應小于0.5 EU。
[1] 李健和,曹俊華,易利丹,等.布洛芬靜脈注射制劑的開發與臨床應用[J].中國新藥與臨床雜志,2011,30(8):584-587.
[2] 國家藥典委員會.中華人民共和國藥典:四部[S].2015年版.北京:中國醫藥科技出版社,2015:154-157、400-402.
[3] 中國藥品生物制品檢定所.中國藥品檢驗標準操作規范:2010年版[M].北京:中國醫藥科技出版社,2010:310-321.
[4] 程春雷,高天勤,曹珍艷.注射用鹽酸丙帕他莫的細菌內毒素檢查[J].中國醫藥工業雜志,2011,42(3):219-221.
[5] 施敬云.對乙酰氨基酚注射液細菌內毒素檢查法建立及方法學研究[J].海峽藥學,2009,21(10):35-37.
[6] 周繼春.雙氯芬酸鈉注射液細菌內毒素檢查法的建立[J].醫藥論壇雜志,2015,36(4):44-49.
[7] 周筱莉.我國細菌內毒素檢查法的應用進展[J].中國醫藥導報,2010,7(23):14-16.
(編輯:周 箐)
Establishment of Bacterial Endotoxin Test Method of Ibuprofen Sodium Chloride Injection
ZHAN Xiaoliang1,GUO Jian2,YUAN Xinxing1,MA Junfang1(1.Shenyang Greatest Pharmaceutical Tech.Co.,Ltd.,Liaoning Benxi 117004,China;2.Shenyang Sinqi Pharmaceutical Co.,Ltd.,Shenyang 110163,China)
OBJECTIVE:To establish a method for the bacterial endotoxin test of Ibuprofen sodium chloride injection.METHODS:Maximum noninterference concentration of sample was determined by interference test according to bacterial endotoxins gelclot test stated in the general principles 1143 of Chinese Pharmacopoeia 2015 edition(four).And then methodology validation was conducted.RESULTS:Samples were diluted to 1 mg/mL,which did not interfere with bacterial endotoxin test.CONCLUSIONS:The established method can be used for the bacterial endotoxin test of Ibuprofen sodium chloride injection,and the limitation of bacterial endotoxin was 0.5 EU/mL.
Ibuprofen sodium chloride injection;Bacterial endotoxin test;Interference test
R927
A
1001-0408(2017)03-0419-03
2016-01-31
2016-12-14)
*中級工程師。研究方向:藥物制劑。電話:024-45595201。E-mail:zhanxiaoliang@gmail.com
DOI10.6039/j.issn.1001-0408.2017.03.37

