異養硝化菌的分離及在養殖廢水處理中的應用
錢春園,郭曉澤,高 鋒,陶 瓊,鄭 舟,薛 彬,郭遠明
(1.浙江海洋大學海洋科學與技術學院,浙江舟山 316022;2.浙江海洋大學海洋與漁業研究所,浙江省海洋水產研究所,浙江舟山 316021)
近年來隨著人們消費水平的提高,對于水產品的需求日益增加,國內水產養殖業快速發展。水產養殖行業日益向集約化、高密度養殖模式發展[1-4]。在養殖過程中,為了滿足養殖生物的生長需求,需要大量投放餌料,由于餌料的吸收和利用率較低,大部分都以殘餌糞便的形式存在于養殖水體中[4],造成養殖水體中氨氮、亞硝酸鹽以及有機物等污染物的含量嚴重超標,水質逐步惡化,養殖水體的環境遭到嚴重破壞,養殖生物受到毒害,引起病害的頻繁發生[5-11]。為了滿足養殖生物的生長需求,養殖場通過頻繁更換水的辦法來改善水質。未經處理的養殖廢水排放到環境中,增加了水體的化學耗氧量,并造成水體富營養化,有害藻類大量繁殖,導致赤潮和水華現象發生,破壞了生物的棲息地,使生物多樣性和生態平衡遭到破壞[12-15]。
目前對養殖廢水的凈化處理大多都是利用傳統的污水處理方法如活性污泥法和生物膜法等,專門針對養殖廢水的凈化處理技術較少。人們一直以為在污水處理系統中執行硝化功能的是自養型的微生物,硝化過程一般定義為微生物在有氧的條件下將氨氮氧化為亞硝酸鹽氮,再進一步氧化為硝酸鹽氮,因此脫氮工藝是按照自養硝化菌的特性來設計的[16-18]。在實踐應用中,人們發現自養硝化菌增長速度比較緩慢,對環境條件要求嚴格,其最佳溫度為35~42℃,在低溫時(尤其是冬季)硝化速率低,硝化過程需要較高的溶解氧濃度(>3 mg/L),中性偏堿(7.0~8.0)的pH條件以及非常低的C/N值[19],為了提高硝化速率,往往需要更長的水力停留時間,這些條件增加了生物脫氮的難度與成本,限制了自養硝化菌的應用。
與自養硝化菌相比,異養硝化菌具有生長速度快,環境適應能力強等特點,近年來受到了國內外研究人員的廣泛關注。KILLHAM[20]總結了以前關于異養硝化的研究進展,指出在某些環境中,異養菌可以將有機氮氧化為硝酸鹽氮,而這個硝化過程是由異養硝化控制的。CASTIGNETTI,et al[21]初次報道了土壤中常見的反硝化菌能夠產生異養硝化的現象。經過實驗證明,與自養硝化菌相比,異養硝化菌的數量和生長速率高,環境適應性強,能耐受酸性環境,需要的溶解氧濃度低,活性高,而且許多異養硝化菌如假單胞菌Pseudomonas spp與糞產堿菌Alcaligenes faecalis[22],具有硝化-反硝化能力[19,23-24],大大的降低了工程應用的成本。將其投加在常規的廢水中或者應用于生物修復某些特定污染水域,具有重要的價值和意義。
對于異養硝化菌的研究起步較晚,將其應用于高濃度氨氮廢水處理的研究比較少,能夠將其應用于實際廢水處理的研究更少。因此,篩選出一株具有較高脫氮能力的異養硝化菌,并將其應用到氨氮濃度較高的養殖廢水中,對水產養殖行業的廢水處理具有重要的意義。針對以上問題,本文從土壤中篩選出一株高效異養硝化菌,并將該菌株應用于高氨氮濃度的甲魚養殖廢水凈化中,旨在為高氨氮養殖廢水的生物脫氮處理提供一種有效的方法。
1 材料與方法
1.1 材料
1.1.1 菌株來源
農田土壤中有機質和氮元素的含量較為豐富,符合異養硝化菌對于環境的要求,在本實驗中菌株分離自農田土壤,土壤樣品取自浙江省舟山市長峙島馬鞍村。
1.1.2 培養基
富集馴化培養基:(NH4)2SO42.0 g,丁二酸鈉23.85 g,維氏鹽溶液50 mL(維氏鹽溶液組成:K2HPO45.0 g/L;MgSO4·7H2O 2.5 g/L;NaCl 2.5 g/L;FeSO4·7H2O 0.05 g/L;MnSO4·4H2O 0.05 g/L),加水進行溶解,補充蒸餾水至1 L;固體培養基:瓊脂粉20 g,其他成分同馴化培養基。異養硝化培養基:同馴化培養基。各培養基在高壓滅菌鍋中滅菌后使用。
1.2 高效異養硝化菌株的分離純化
1.2.1 異養硝化菌的馴化、富集
取1 g的土樣放入盛有200 mL馴化培養基的500 mL錐形瓶中,30°C,180 r/min條件下進行搖床培養,馴化以3 d為一個周期。每一周期結束后將培養液靜置片刻,取部分菌液至另外一個錐形瓶中,將新鮮的馴化培養基加入原來的培養液中,補足至200 mL。取出的菌液按馴化的周期依次從50 mL降至10 mL,補充的培養基也從開始150 mL升至190 mL,定期檢測氨氮去除情況。當將氨試劑滴加在馴化的菌液后,呈現無色時,表示馴化完成。
1.2.2 菌株的分離純化
將馴化好的溶液進行10倍濃度梯度稀釋至10-5。在制備好的固體培養基上,從各個稀釋梯度溶液中取0.1 mL進行稀釋涂布(每個稀釋度做3個平行),在生化培養箱中30°C恒溫培養3 d。在形成菌落的平板上挑取圓形規則的單個菌落,劃線分離,等到形成菌落后再用接種環將其接種到固體培養基上,放在30°C生化培養箱中進行恒溫培養3 d。然后挑取一接種環的細菌與無菌水中,充分震蕩,以此為細菌懸液。將細菌懸液按照活菌數測定的辦法在平板上涂布,使其在培養皿上形成20~30個單菌落,然后將單菌落按以上的方法再挑菌一次[25]。經分離純化得到15株菌。
1.2.3 高效異養硝化菌篩選
將篩選得到的15株菌分別接入已滅菌的裝有100 mL異養硝化培養基的錐形瓶中,30°C,180 r/min條件下進行恒溫搖床培養。3 d后檢測OD600、pH、氨氮、亞硝酸鹽氮、硝酸鹽氮。選出一株脫氮效率高且培養過程中亞硝酸鹽氮和硝酸鹽氮生成較少的菌株。
1.3 菌株的硝化特性研究
在裝有200 mL培養基的500 mL錐形瓶(已滅菌)中接入菌株,30°C,180 r/min條件下進行恒溫搖床培養。每隔12 h檢測異養硝化培養基中的OD600、pH、氨氮、亞硝酸鹽氮、硝酸鹽氮,制作菌株生長曲線和脫氮速率曲線。
1.4 異養硝化菌株對養殖廢水的脫氮效果
1.4.1 養殖廢水
養殖廢水取自浙江省桐廬溫室大棚甲魚養殖基地,水體有惡臭味,呈暗黃色,有黑色沉淀物。養殖廢水水質指標見表1。

表1 養殖廢水水質指標Tab.1 Characteristics of aquaculture wastewater
1.4.2 菌株在養殖廢水中的異養硝化作用研究
將在250 mL錐形瓶中裝有200 mL的養殖廢水滅菌后接入菌株,30℃,180 r/min條件下進行恒溫搖床培養,每隔24 h檢測氨氮、亞硝酸鹽氮、硝酸鹽氮的濃度。在250 mL的錐形瓶中加入200 mL養殖廢水,滅菌,不接種菌株,以此為對照試驗。
1.4.3 接種量對養殖廢水氨氮去除效果的影響
將菌株的細菌懸液OD600調至1.0,接種至6個裝有200 mL養殖廢水的250 mL錐形瓶中,接種的體積分別占廢水體積的1%、3%、5%、7%、9%和11%。在30℃,180 r/min條件下進行恒溫搖床培養,每隔24 h檢測氨氮濃度。
1.4.4 溫度對養殖廢水氨氮去除效果的影響
將菌株接種于已滅菌過的裝有200 mL養殖廢水的250 mL的錐形瓶中,分別在不同溫度(10、20、30、35、40℃)下以180 r/min進行恒溫搖床培養。每隔24 h檢測檢測氨氮濃度。
1.5 分析方法
NH4+-N:納氏試劑光度法;NO3--N:酚二磺酸光度法;NO2--N:(1-萘基)-乙二胺光度法;NO3--N:紫外分光光度法;菌體生長密度的測定采用濁度法(OD600);TN:堿性過硫酸鉀消解紫外分光光度法;COD:重鉻酸鉀法。異養硝化菌胞內氮:凱氏定氮法,pH值直接采用pH計測定。
2 結果與分析
2.1 菌株的分離純化和篩選
經過約4個月的馴化、富集和3輪劃線分離,得到能夠在異養硝化固體培養基上生長的15株菌株。將15株菌株依次接入異養硝化液體培養基中,以未接種菌株的異養硝化液體培養基(原水)為空白對照,檢測其濁度(OD600)以及NH4+-N、NO2--N和NO3--N的濃度。從圖1中可以看出,15株菌株對于異養硝化培養基中的氨氮都有一定的降解能力,1號菌株和13號菌株生長較為旺盛,13號菌株的氨氮去除能力最強。并且這15株菌株在培養結束后,培養液中NO2--N和NO3--N的濃度均較低,因此,經過對比分析,將13號菌株作為本研究的對象,將其命名為HY13。
2.2 菌株HY13在異養硝化培養基中的生長
菌株在培養基中的生長曲線及pH的變化如圖2所示。菌株生長呈現4個時期:適應期、對數增長期、穩定期、衰亡期。菌株在12 h之前生長緩慢,可以看作適應期。12 h之后進入對數增長期,在對數增長期,菌株HY13生長迅速,之后菌株的生長進入穩定期和衰亡期。另外,從圖2中可以觀察到,隨著菌株的生長,液體培養基的pH值呈上升的趨勢,pH值從培養開始時的6.95上升至培養結束時的9.15。傳統的自養硝化反應是將堿性物質氨轉化為酸性物質亞硝酸和硝酸的過程,通常會導致培養過程pH值的下降。本實驗過程觀察到的pH變化明顯不同于自養硝化過程,間接說明了菌株HY13的異養硝化能力。實驗中pH值升高的原因可能是由于培養基內丁二酸鈉被大量利用后Na+濃度升高所致。
2.3 菌株HY13的脫氮特性
菌株在培養基中的氨氮降解速率特征如圖所示。從圖3可以看出,氨氮濃度在12 h之前降解緩慢,12 h之后下降迅速,96 h氨氮濃度降到最低,氨氮降解速率為61.8%,氨氮濃度降低迅速發生在菌株的對數增長期和穩定期。另外從圖中可以看出,菌株HY13培養過程中在氨氮濃度不斷降低的同時,硝酸鹽氮和亞硝酸鹽氮濃度沒有明顯的上升,而是維持在較低的濃度水平,表明菌株HY13去除水中氨氮的過程與傳統自養硝化過程不同,本實驗篩選的菌株HY13具有異養硝化能力。
2.4 菌株HY13在養殖廢水中的硝化特性
將異養硝化菌株HY13接種至高氨氮含量的養殖廢水中進行震蕩培養,培養過程中養殖廢水中NH4+-N、NO2--N、NO3--N濃度隨培養時間的變化如圖4所示。從圖4可以看出,隨著培養的進行,養殖廢水中的NH4+-N濃度出現了明顯的降低,從培養開始時的634.28 mg/L降低至培養結束時的226.13 mg/L,去除率達到64.3%,說明菌株HY13對于高濃度的養殖廢水,具有較好的脫氮效果。對于養殖場廢水處理的實際應用,具有很大的潛能。并且由圖4可見,在整個培養過程中廢水中NO2--N和NO3--N的濃度穩定維持在較低的水平,沒有出現明顯的上升。培養結束和培養開始時NO2--N的濃度分別為0.051 mg/L和0.057 mg/L,NO3--N的濃度分別為0.377 mg/L和0.378 mg/L,培養結束后測定得到培養液中胞內氮的濃度為236.73 mg/L(表2)。這表明在培養過程中廢水中的銨鹽沒有被氧化成亞硝酸鹽和硝酸鹽,而是大部分被轉化成了菌體內的胞內氮。這明顯不同于傳統硝化細菌的硝化反應,培養結束后廢水中的NO2--N和NO3--N濃度均很低,無需在通過反硝化反應進行脫除。可見采用異養硝化方法進行高氨氮含量養殖廢水的脫氮處理,可以使處理工藝變得更為簡單,具有明顯的優勢。

圖1 異養硝化菌菌株的篩選Fig.1 Screening of heterotrophic nitrifying bacteria

圖2 菌株HY13的生長曲線以及pH變化Fig.2 Growth curve of strain HY13 and the changes of pH during cultivation

圖3 菌株HY13氨氮降解速率特征曲線Fig.3 Denitrification rate characteristiccurve of the strain HY13

圖4 菌株HY13在養殖廢水中的脫氮速率特征曲線Fig.4 Curves of nitrogen removal of strain HY13 in aquaculture wastewater

表2 菌株HY13的硝化功能Tab.2 Nitrification of strain HY13
2.5 接種量對養殖廢水氨氮去除效果的影響
接種量的大小會影響到菌株的繁殖速度。高濃度的接種量可以提高脫氮的效率[28],在較短時間內達到比較好的效果。接種量過低,菌株的適應期會延長,培養時間則會增加,影響實驗的進行。從圖6可以看出,當在養殖廢水中接入不同濃度的菌株時,經過24 h的培養,氨氮濃度都有不同程度的降解,接種量為5%的降解量最多。經過一段時間培養后,發現在相同的培養時間內,適當的增加接種量,會提高氨氮的轉化率。當接種量為5%時,菌株對養殖廢水的氨氮去除效果最好。當接種量大于5%時,菌株對營養物質的需求增加,但是養殖廢水的底物和營養物質有限,隨著培養時間的增加,營養物質逐漸被消耗,底物與供氧不足,使菌株HY13大量死亡,氨氮降解率降低。
2.6 溫度對養殖廢水氨氮去除效果的影響
對于微生物的生長來說,溫度是一個重要的因素,每個微生物的最適溫度不同。過高或者過低的溫度都會影響菌株的酶活性,導致微生物的生長代謝緩慢或者停滯,從而影響對氨氮的去除能力[29-31]。養殖水體溫度季節變化幅度較大,要找到菌株HY13在養殖廢水中適應生長的溫度,一般通過設置溫度梯度來判斷。從圖7可以看出,菌株HY13在不同的溫度條件下對養殖廢水的氨氮都有一定的去除能力,進一步說明異養硝化菌對環境的要求不高,能夠應用于各種環境。當溫度為10℃時,菌株HY13對養殖廢水的氨氮去除能力最弱,溫度逐漸升高,氨氮去除能力逐漸提高。當溫度為35℃時,菌株對養殖廢水氨氮去除效果最好。當溫度高于35℃時,菌株的氨氮降解能力又變弱。實驗證明,過高或過低的溫度都不適宜菌株HY13的生長。

圖6 接種量對菌株去除養殖廢水中氨氮的影響Fig.6 Influence of inoculation amount of HY13 on ammonia nitrogen removal from aquaculture wastewater
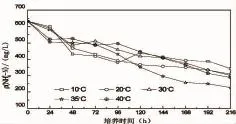
圖7 溫度對菌株氨氮去除特性的影響Fig.7 Influence of temperature on ammonia nitrogen removal from aquaculture wastewater by HY13
3 討論
本實驗篩選的菌株HY13接種于高氨氮濃度的水產養殖廢水,實現了對廢水中氨氮的異養硝化脫除,經216 h培養,去除率達到64.3%。并且出水中NO2--N和NO3--N的濃度均很低。氨、亞硝酸鹽和硝酸鹽均為廢水中的氮素污染物,在水體中三者還能互相轉化。傳統的生物硝化反應僅將氨氧化為硝酸鹽或亞硝酸鹽,往往還需要后續在厭氧環境及有機物存在的情況下進行反硝化反應才能徹底去除廢水中的氮素污染物,達到真正脫氮的目的。本實驗中HY13未將氨氧化為亞硝酸鹽或硝酸鹽,根據實驗中菌株胞內氮含量的測定,大部分被去除的氨轉化為了菌株細胞體內的氮。在實際的污水處理過程中,這部分的氮將轉移至剩余污泥中,從而提高了剩余污泥中氮的含量及肥效,有利于通過堆肥等過程將養殖場廢水處理產生的污泥開發成作物肥料。
另外,值得注意的是本實驗經菌株HY13處理后,養殖廢水中NH4+-N的含量仍然達到200 mg/L以上,這主要與原水中NH4+-N濃度較高有關。在之前文獻中的一些關于異養硝化菌的研究中,培養液中NH4+-N濃度約在90~180 mg/L[23,32],均低于本實驗所用廢水中的NH4+-N濃度。廢水中較高的NH4+-N濃度或許對異養硝化菌的生長起到了一定的抑制作用,這方面有待于后續的進一步研究。
本研究通過異養硝化菌篩選及廢水處理實驗,初步證明了異養硝化菌能有效應用于高氨氮濃度的水產養殖廢水的脫氮處理,但由于實驗中采用的甲魚養殖場廢水中氨氮濃度較高,實驗中未能將廢水中的氨氮降低至排放標準以下,這有待于后續通過進一步改進培養及研究方案,從而實現廢水中氨氮較徹底的去除。
4 結論
(1)本文以丁二酸鈉為唯一碳源,從土壤中篩選出一株能夠高效去除氨氮的菌株,并且在培養過程中只有少量的硝酸鹽氮和亞硝酸鹽氮產生,命名為HY13。
(2)將菌株接種與初始氨氮濃度為634.28 mg/L的甲魚養殖廢水中,經過216 h培養,氨氮濃度降為226.13 mg/L,氨氮降解率達到64.3%。
(3)養殖水體中,生態因子如溫度、接種量等都會對水體氨氮的降解產生一定的影響。實驗證明,當菌株HY13接種于養殖廢水中,接種量為5%,溫度為35℃時,氨氮降解率較高。
[1]張小玲,梁運祥.一株反硝化細菌的篩選及其反硝化特性的研究[J].淡水漁業,2006,36(5):28-32.
[2]胡家文,姚維志.養殖水體富營養化及其防治[J].水利漁業,2005,25(6):74-76.
[3]魏泰麗,余瑞蘭,聶向平,等.水中亞硝酸鹽對彭澤鯽血紅蛋白及高鐵血紅蛋白的影響[J].大連水產學院學報,2001,16(1):67-71.
[4]蔣路平,朱建龍,羅金飛,等.水產養殖廢水污染危害及其處理技術研究[J].現代農業技,2017(3):171-172.
[5]張曉栓,李 楠,蔡文貴,等.我國水產養殖水污染成因及其對策研究[J].中國漁業經濟,2007(5):30-33.
[6]王建平,陳吉剛,斯烈鋼,等.水產養殖自身污染及其防治的探討[J].浙江海洋學院學報:自然科學版,2008,27(2):192-196.
[7]鄭佳佳,沈 濤,傅羅琴,等.一株硝化反硝化菌的篩選鑒定及反硝化特性研究[J].水生生物學報,2012,36(1):161-167.
[8]張慶華,封永輝,王 娟,等.地衣芽孢桿菌對養殖水體氨氮、殘餌降解特性研究[J].水生生物學報,2011,35(3):498-503.
[9]李 帆,莢 榮,查 誠.脫氮菌株P6的分離鑒定及其處理氨氮廢水的試驗研究[J].生物技術,2007,17(5):64-68.
[10]江 云.水產養殖廢水生物凈化技術研究[D].揚州:揚州大學,2013.
[11]黃 歡,汪小泉,韋 肖,等.杭嘉湖地區淡水水產養殖污染物排放總量的研究[J].中國環境監測,2007,23(2):94-97.
[12]劉靜宇,夏宏彩.水體富營養化及污水脫氮除磷技術分析[J].技術開發,2015,22(8):216.
[13]胡海燕.水產養殖廢水氨氮處理研究[D].青島:中國海洋大學,2007.
[14]楊小琴,郭正富,胡玉國.水產養殖與農業面源污染研究[J].北京農業,2008(27):41-43.
[15]陳冬林,周慧芳.水產養殖廢水凈化與循環應用技術研究[J].中國水產,2016(5):91-93.
[16]秦源麟.廢水生物處理[M].上海:同濟大學出版社,1989.
[17]溫東輝,唐孝炎.異養硝化及其在污水脫氮中的作用[J].環境污染與防治,2003,25(5):283-285.
[18]鄭興燦,李亞新.污水除磷脫氮技術[M].北京:中國建筑工業出版社,1998.
[19]趙 詣.三株異養硝化細菌的分離、特征及其對水產養殖廢水脫氮作用研究[D].杭州:浙江大學,2010.
[20]KILLHAM K.Nitrification in coniferous forest soils[J].Plant and soil,1990,128:31-44.
[21]CASTIGNETII D,HOLLOCHCE T C.Hctcrtrophic nitrification among denitrifiers[J].Applied and Environmental Microbiology,1984,47(4):620-623.
[22]ZHAO Bin,AN Qiang,HE Yiliang,et al.N2O and N2production during heterophic nitrification by Alcaligenes faecalis strain NR[J].Bioresource Technology,2012,116:379-385.
[23]郝明輝,于魯冀,李廷梅,等.一株異養硝化菌的篩選及生長特性研究[J].生物技術通報,2016,32(4):168-174.
[24]ISIAM A,CHEN D,WHITE R E.Heterotrophic and autotrophic nitrification in two acid pasturesoils[J].Soil Biology and Biochenmistry,2007,39(4):972-975.
[25]LIN Yan,KONG Hainan,HE Yiling,et al.Isolation and characterization of heterotrophic nitrifying bacteria[J].Environmental Science,2006,27(2):324-328.
[26]GAO Feng,YANG Zhaohui,LI Chen,et al.Concentrated microalgae cultivation in treated sewage by membrane photobioreactor operated in batch flow mode[J].Bioresource Technology,2014,167:441-446.
[27]李雨陽,文湘華.污水處理系統中氨氧化古菌的富集培養以及性質[J].微生物學報,2015,55(7):882-891.
[28]芮傳芳,吳 涓,李玉成.異養硝化細菌的篩選、鑒定及其氨氮轉化特性的研究[J].生物學雜志,2012,29(1):37-41.
[29]GONG Wenxin,WANG Shuguang,SUN Xuefei,et al.Biofiocculant production by culture of Serratia ficaria and its application in wastewater treatment[J].Bioresource Technology,2008,99(11):4 668-4 674.
[30]楊代金,張 穗,王玉軍,等.一株氨氮降解菌的篩選及其降解特性的初步研究[J].山東農業科學,2009(3):87-90.
[31]閆志英,廖銀章,李旭東.新型廢水生物脫氮的微生物學研究進展[J].應用與環境生物學報,2006,12(2):292-296.
[32]曾慶梅,司文攻,李志強,等.一株高效異養硝化菌的選育、鑒定及其硝化條件[J].微生物學報,2010,50(6):803-810.

