探討肺炎支原體感染與兒童喘息發作的關系及機制
陳靈紅 林紅霞 楊德華
·論著·
探討肺炎支原體感染與兒童喘息發作的關系及機制
陳靈紅 林紅霞 楊德華
目的 比較肺炎支原體肺炎(MPP)、非肺炎支原體肺炎(非MPP)與健康兒童的免疫功能,以探討肺炎支原體感染對兒童喘息發作的影響機制。方法 分別檢測和比較279例肺炎支原體肺炎患兒、318例非肺炎支原體肺炎和50例健康兒童的體液免疫和T淋巴細胞亞群的表達水平,并比較肺炎支原體肺炎與非肺炎支原體肺炎患兒咳嗽、發熱、喘息等臨床癥狀出現的比例。結果 肺炎支原體肺炎患兒咳嗽發熱的發生率與非肺炎支原體肺炎差異無統計學意義。肺炎支原體肺炎患兒的喘息發生率明顯高于非肺炎支原體肺炎。體液免疫方面,肺炎支原體肺炎組血清IgA、IgM、IgE明顯高于非肺炎支原體肺炎組和健康兒童組(P<0.05)。T淋巴細胞亞群的表達水平方面,肺炎支原體肺炎組的CD3+、CD4+、CD4+/CD8+值明顯少于非肺炎支原體肺炎組和健康兒童組(P<0.05),肺炎支原體肺炎組CD8+值明顯高于非肺炎支原體肺炎組和健康兒童組(P<0.01)。結論 與非肺炎支原體肺炎和健康兒童比較,肺炎支原體肺炎患兒存在明顯體液免疫和T淋巴細胞亞群的表達水平異常,更易誘發喘息。
肺炎支原體肺炎 喘息 體液免疫 T淋巴細胞亞群
肺炎支原體(MP)是兒童呼吸道感染的重要病原體之一,10%~40%的兒童社區獲得性肺炎(CAP)由MP引起。有研究發現MP感染易出現病情遷延,甚至與反復喘息發作、兒童慢性咳嗽以及支氣管哮喘的發生密切相關[1]。在青少年與成人中,急性MP感染能誘發無癥狀患者哮喘的首次發作[2-3],研究報道20%的哮喘急性加重與MP感染相關[4-5]。肺炎支原體肺炎(MPP)的發病機制迄今尚未明確,目前認為免疫紊亂在MPP發病中起著重要作用。Atkinson等[6]研究發現,兒童感染MP后,有細胞免疫和體液免疫缺陷。本文探討MP感染對兒童喘息發作的影響,為預防MPP引起喘息提供臨床依據。
1 臨床資料
1.1 一般資料 2010年1月至2015年12月本院收治MPP患兒279例,非MPP患兒318,另選取同時期體檢健康兒童50例為對照組。MPP組男154例,女125例;年齡(3.55±1.90)歲。非MPP組男173例,女145例;年齡(3.70±2.08)歲。對照組男26例,女24例;年齡(3.65±2.77)歲。在性別和年齡上,三組比較差異無統計學意義(P>0.05)。所有入組兒童既往均無免疫性疾病,近1個月無任何感染癥狀,包括呼吸道、消化道、泌尿系統等。近期未使用激素、免疫蛋白、干擾素等。MPP患兒納入標準:(1)肺炎標準:根據第八版《諸福棠實用兒科學》診斷標準,具有呼吸道癥狀、伴或不伴發熱等表現,胸部影像學提示肺部有實質性浸潤[7]。(2)MP感染標準:以血清MP特異性抗體IgM陽性和鼻咽吸出物和/或灌洗液經PCR熒光探針法測定MP-DNA陽性。(3)排除合并其他病原菌感染者。
1.2 方法 所有肺炎患兒均在入院當天采集靜脈血,采用明膠凝集法檢測血清學抗體(檢測MP、肺炎衣原體、沙眼衣原體、嗜肺軍團菌),采用速率散射比濁法檢測IgG、IgA、IgM,采用酶聯免疫吸附方法檢測IgE,采用流式細胞儀檢測樣本的T淋巴細胞亞群的表達水平(CD3+、CD4+、CD8+、CD4+/CD8+)的比值。采集鼻咽部標本,熒光定量PCR檢測肺炎支原體、肺炎衣原體、沙眼衣原體、EB病毒的DNA,免疫熒光法檢測呼吸道合胞病毒、腺病毒、流感病毒(A、B型)、副流感病毒(Ⅰ、Ⅱ、Ⅲ型)的抗原。采集痰液行痰培養。并進行肺部影像學檢查。對照組兒童采集靜脈血,進行IgG、IgA、IgM、IgE、T淋巴細胞亞群的表達水平(CD3+、CD4+、CD8+、CD4+/CD8+的比值)等檢測。
1.3 統計學處理 采用SPSS 18.0統計軟件。計量資料進行正態性檢驗,正態分布資料以(x±s)表示,組間比較用獨立樣本t檢驗;非正態分布資料以中位數表示,用秩和檢驗。計數資料采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組臨床癥狀比較 MPP組96.77%出現咳嗽,89.96%出現發熱,非MPP組94.98%出現咳嗽,90.88%出現發熱,兩組比較差異無統計學意義(P>0.05)。MPP組12.90%出現喘息,非MP肺炎6.92%出現喘息,兩組比較(χ2=6.069,P=0.014)差異有統計學意義。根據不同年齡段分成3組進行比較,≤3歲組和3~6歲組,MP肺炎患兒喘息的發生率明顯高于非MP肺炎患兒(P<0.05),>6歲組,MP肺炎患兒喘息的發生率與非MP肺炎患兒比較差異無統計學意義(P=0.554)。見表1。

表1 不同年齡組MP肺炎和非MP肺炎喘息發生率比較
2.2 三組體液免疫結果比較 IgG三組比較差異無統計學意義(P>0.05)。IgA比較,MP肺炎組明顯大于非MP肺炎和對照組(P<0.05),非MP肺炎組與對照組比較差異無統計學意義(P=0.051)。IgM比較,MP肺炎組大于非MP肺炎和對照組(P<0.05),非MP肺炎組和對照組比較差異無統計學意義(P=0.784)。IgE三組比較,MP肺炎組明顯大于非MP肺炎和對照組(P<0.05),非MP肺炎組和對照組比較差異無統計學意義(P=0.621)。見表2。

表2 MP肺炎組、非MP肺炎組和空白對照組三組體液免疫結果比較(x±s)
2.3 三組細胞免疫結果比較 細胞免疫結果三組比較,CD3值三組兩兩比較,MP肺炎組和非MP肺炎組比較差異無統計學意義(P=0.722),MP肺炎組明顯少于對照組(P=0.038),非MP肺炎組明顯少于對照組(P=0.022)。CD4值三組兩兩比較,MP肺炎組明顯少于非MP肺炎組(P<0.01),非MP肺炎組明顯少于對照組(P=0.011)。CD8值三組兩兩比較,MP肺炎組明顯高于非MP肺炎組和對照組(P均<0.01),非MP肺炎組與對照組比較差異無統計學意義(P=0.232)。CD4/CD8值三組兩兩比較,MP肺炎組明顯少于非MP肺炎組和對照組(P均<0.01),非MP肺炎組與對照組比較差異無統計學意義(P=0.137)。見表3。
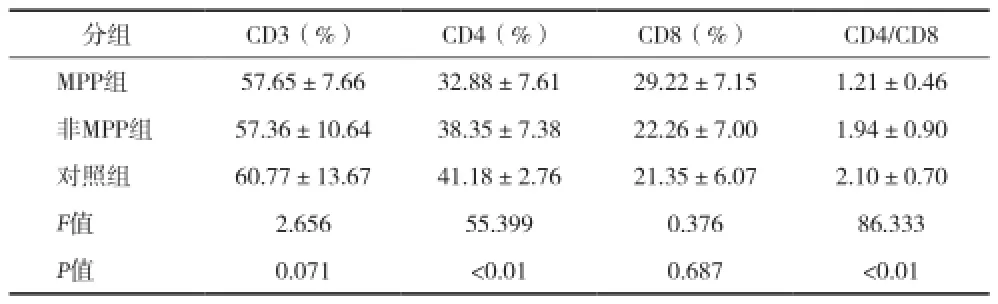
表3 MP肺炎組、非MP肺炎組和空白對照組三組細胞免疫結果比較(x±s)
3 討論
MP是小兒社區獲得性呼吸道感染病原菌,特別是社區獲得性肺炎的重要病原菌。有文獻報道MP的感染可引起氣道可逆性阻塞和氣道高反應[8-9],引起慢性咳嗽,反復喘息發作,甚至與哮喘的發病密切相關。據國外文獻報道,哮喘急性發作期患兒進行MP檢測,發現哮喘初發患兒中MP感染率達50%左右,復發兒童中>20%[10]。喘息是支氣管哮喘的一種常見的臨床表現,趙彩虹[11]等報道MPP較非MPP更易引起的喘息,本資料中也發現類似情況。且通過不同年齡組的比較,≤6歲的患兒中MPP較非MPP更易引起的喘息,而在>6歲的患兒中兩組比較差異無統計學意義。MP引起喘息的原因尚不明確,目前有呼吸道直接損傷以及呼吸道高反應和免疫功能紊亂兩種學說。
在MP對呼吸道直接損傷及呼吸道高反應方面,有研究發現,MP可直接破壞呼吸道上皮纖毛的結構和功能,影響纖毛細胞的代謝,從而引起呼吸道慢性炎癥反應[12]。同時,MP可引起呼吸道平滑肌收縮過強,腺體分泌增加,導致氣道高反應[13]。Waites等[14]研究發現,MP感染可直接上調呼吸道興奮性非腎上腺素能非膽堿能神經肽P物質及P物質相應神經激肽受體NK1,非腎上腺素能非膽堿能神經為松弛呼吸道平滑肌的主要支配神經,非腎上腺素能非膽堿能神經功能發生障礙,進一步加重呼吸道高反應。此外,Kraft 等[15]研究發現MP感染明顯增加哮喘患者呼吸道上皮細胞MUC5AC的表達,而黏蛋白過度表達能引起哮喘患者急性發作。由此,MP可通過局部的呼吸道損傷和引起呼吸道高反應來誘發或加重支氣管哮喘。
除上述呼吸道直接損傷及呼吸道高反應學說外,免疫功能紊亂學說也越來越受重視,許多研究[16-20]發現MP感染引起的免疫紊亂與哮喘也有一定的關系。本資料顯示,MP感染組的IgA、IgM、IgE明顯高于非MP感染者和正常同齡兒童,這與Atkinson等[16]研究報道兒童MP感染后,出現體液免疫缺陷相一致。石慧芳等[17]研究發現其在體液免疫方面存在紊亂,表現為IgE、IgM水平明顯高于正常,與本資料結果相似。Choi等[18]研究發現MP感染后T淋巴細胞大量激活,Th淋巴細胞表面CD40L的表達顯著增高,提示MP感染后T淋巴細胞激活異常增多,并通過CD40-CD40L的相互作用促進B淋巴細胞活化及抗體類型轉換,使各種抗體包括IgE的生成增加,誘導支氣管哮喘的發作或病情加重。本資料中,MP感染組CD4值、CD4/ CD8的比值明顯低于非MP感染組和對照組,這與韓曉華等[19]報道MP感染導致T淋巴細胞免疫功能失常即:Th1/Th2失衡(Th2細胞功能亢進,Th1功能不足,Th1/Th2比值低于正常)相一致,而這與哮喘呼吸道的變態反應性炎癥也有密切的關系。Hassan等[20]發現MP呼吸道感染的患兒Th2型細胞因子白細胞介素(interleukin,IL)-4,IL-10因子明顯增高,而Thl型細胞因子如IL-2、IL-12在正常水平,這些Th2細胞因子能刺激B淋巴細胞產生IgE,并促進嗜酸性粒細胞的分化、增殖以及向呼吸道浸潤,導致呼吸道炎癥的發生,最終啟動支氣管哮喘的發作,從而加速哮喘的發生和惡化。
越來越多的研究證實MP感染是發生兒童支氣管哮喘的危險因素,MP感染可導致呼吸道慢性炎癥和免疫功能紊亂,進而改變呼吸道反應性。因此,在臨床中對MP感染伴隨免疫功能紊亂的患兒在應用抗MP藥物的基礎上,可加用免疫增強劑來調節和恢復紊亂的免疫功能,進而降低支氣管哮喘的發生率。
[1] 盛文彬,張藝.兒童肺炎支原體肺炎誘發支氣管哮喘的研究.浙江臨床醫學,2004,6(6):512.
[2] Chang YT, Yang YH, Chiang BL. The significance of a rapid cold hemagglutination test for detecting mycoplasma infections in children with asthma exacerbation. J Microbiol Immunol Infect, 2006, 39(1):28-32.
[3] Biscardi S, Lorrot M, Marc E, et al. Mycoplasma pneumoniae and asthma in children. Clin Infect Dis,2004,38(10):1341-1346.
[4] Esposito S, Droghetti R, Bosis S, et al. Cytokine secretion in children with acute Mycoplasma pneumoniae infection and wheeze. Pediatr Pulmonol,2002,34(2):122-127.
[5] Fonseca-Aten M, Okada PJ, Bowlware KL, et al. Effect of clarithromycin on cytokines and chemokines in children with an acute exacerbation of recurrent wheezing: a double-blind, randomized, placebo-controlled trial. Ann Allergy Asthma Immunol, 2006, 97(4):457-463.
[6] Atkinson TP, Waites KB. Mycoplasma pneumoniae Infections in Childhood. Pediatr Infect Dis J,2014,33(1):92-94.
[7] 胡亞美,江載芳.諸福棠實用兒科學(8版).北京:人民衛生出版社,2015:1280-1282.
[8] Chu HW, Honour JM, Rawlinson CA, et al. Effects of respiratory Mycoplasma pneumoniae infection on allergen-induced bronchial hyperresponsiveness and lung inflammation in mice. Infect Immun, 2003, 71(3):1520-1526.
[9] Medina JL, Coalson JJ, Brooks EG, et al. Mycoplasma pneumoniae CARDS toxin induces pulmonary eosinophilic and lymphocytic inflammation. Am J Respir Cell Mol Biol,2012,46(6):815-822.
[10] Gendrel D, Biscardi S, Marc E, et al. Mycoplasma pneumoniae, community-acquired pneumonia and asthma. Arch Pediatr,2005, 12 Suppl 1:S7-11.
[11] 趙彩虹.肺炎支原體感染與小兒支氣管哮喘的關系.中國誤診學雜志,2005,5(7):1260-1261.
[12] Hickman-Davis JM. Role of innate immunity in respiratory mycoplasma infection. Front Biosci,2002,1(7):1347-1355.
[13] Romero-Rojas A, Reyes-Esparza J, Estrada-Parra S, et al. Immunomodulatory properties of Mycoplasma pulmonis. III. Lymphocyte stimulation and cytokine production by Mycoplasma pulmonis products. Int Immunopharmacol,2001, 1(9-10):1699-1707.
[14] Waites KB, Talkington DF. Mycoplasma pneumoniae and its role as a human pathogen. Clin Microbiol Rev,2004,17(4):697-728.
[15] Kraft M, Adler KB, Ingram JL, et al. Mycoplasma pneumoniae induces airway epithelial cell expression of MUC5AC in asthma. Eur Respir J,2008,31(1):43-46.
[16] Atkinson TP, Duffy LB, Pendley D, et al. Deficient immune response to Mycoplasma pneumoniae in childhood asthma. Allergy Asthma Proc, 2009, 30(2):158-165.
[17] 石慧芳,丁毅鵬,許少英,等.支氣管哮喘患者治療前后3項免疫學指標的變化-T淋巴細胞亞群、紅細胞免疫功能、血清免疫球蛋白水平的初步觀察.海南醫學院學報,2000,6(3):145-147.
[18] Choi IS, Byeon JH, Yoo Y, et al. Increased serum interleukin-5 and vascular endothelial growth factor in children with acute mycoplasma pneumonia and wheeze. Pediatr Pulmonol, 2009, 44(5): 423-428.
[19] 韓曉華,王俊,蘇力,等.肺炎支原體肺炎患兒誘導痰液Th1/Th2類細胞因子的動態變化.實用兒科臨床雜志,2005,20(10):965-967.
[20] Hassan J, Irwin F, Dooley S, et al. Mycoplasma pneumoniae infection in a pediatric population: analysis of soluble immune markers as risk factors for asthma. Hum Immunol,2008,69(12):851-855.
Objective To determine the relationship between MP infection and immunoglobulins,and to clarify the associated mechanisms of inflammatory response. Methods A prospective study was performed among 279 children with MPP,318 children with non-MPP and 50 healthy children. The levels of serum immunoglobutins(IgG,IgA,IgM and IgE)and T cell subgroup(CD3+,CD4+,CD8,CD4/CD8)were detected. Results Serum IgA,IgM and IgE levels for MPP patients were obviously higher than those in the other groups(P<0.01). The proportion of CD3+,CD4+T cells and the ratio of CD4/CD8 for MPP patients were significantly lower than those in the other group(P<0.01). The proportion of CD8+T cells for MPP patients were obviously higher than those in the other groups(P<0.01). Conclusions Immune function disturbance may exist in children with MPP. An infection with MP may precede the onset of wheeze.
Mycoplasma pneumonia Wheeze Humoral immunity T cell subgroup
浙江省溫嶺市科技計劃項目(2012WLCA0057)
317500 浙江省溫嶺市第一人民醫院(陳靈紅 林紅霞)
310058 浙江大學醫學院(楊德華)

