堿性成纖維生長因子及其受體、血管內皮因子及其受體在宮頸鱗狀細胞癌中的表達及臨床意義
劉衛梅
(河南省焦作市第二人民醫院 病理科,河南 焦作 454001)
宮頸鱗狀上皮內瘤變(cervical intraepithelial neoplasia, CIN)屬于癌前病變,按其累及上皮程度的不同分為3級:上皮內瘤變I級(CIN I)﹑上皮內瘤變II級(CIN II)及上皮內瘤變III級(CIN III),CIN分級越高,發展為浸潤性癌的機會越多。宮頸癌是目前危害婦女健康的常見病,占所有女性惡性腫瘤的12%左右,在女性生殖道腫瘤中發病率最高,一般與早婚﹑多產﹑性紊亂﹑人乳頭狀瘤病毒病毒(human papilloma virus, HPV)感染和地理環境等因素有關。任何腫瘤的生長及轉移都需要有新生血管的形成,而血管形成又依賴于血管生長因子[1]。目前已證明許多腫瘤細胞分泌血管生長因子。與宮頸癌血管生成相關的血管因子主要有堿性成纖維生長因子(basic fibroblast growth factor, bFGF),血管內皮因子(vascular endothelial growth factor, VEGF)等。本文應用免疫組織化學技術研究浸潤性和非浸潤性宮頸癌bFGF及其受體(flg)﹑VEGF及其受體(flt;flk)的表達,并探討其臨床意義,現報道如下。
1 材料與方法
1.1 一般資料
收集本院2010年‐2015年經病理診斷的68 例宮頸癌標本,年齡最小38歲,最大76歲,中位年齡為58.2歲。將其分為兩組:一組為浸潤性癌44例,另一組為非浸潤癌(CIN III)24例。標本來源為宮頸活檢或手術切除病理標本。其中手術切除33例,活檢35例。
1.2 試劑
兔抗人VEGF多克隆抗體和兔抗人bFGF多克隆抗體﹑DAB顯色劑﹑S-P試劑盒均購于武漢博士德生物工程有限公司。
1.3 方法
腫瘤組織標本經10%中性福爾馬林固定,常規石蠟包埋,切片厚度為3 μm,脫蠟﹑水洗,滴加一抗﹑二抗,用已知陽性結腸癌切片作陽性對照,用PBS緩沖液做陰性對照,滅活內源性酶用3%雙氧水,滴加復合消化液,山羊血清封閉,一抗孵化切片(置于濕盒中,4℃冰箱內過夜),二抗孵化切片滴加試劑,DAB顯色,蘇木素復染,中性樹膠封片,顯微鏡觀察。
1.4 結果判斷
腫瘤細胞胞漿內含有棕黃色或棕褐色顆粒的為陽性,每張切片在10×20倍視野下連續計數200個細胞,陽性細胞數<5%為弱陽性(±),6%~40%為陽性(+),>40%為強陽性(++),沒著色為陰性(-)。
1.5 統計學方法
采用SPSS 20.0軟件進行統計分析。計數資料以百分比(%)表示,采用χ2檢驗,P <0.05為差異有統計學意義。
2 結果
2.1 CIN III患者bFGF及其受體、VEGF及其受體的表達
24例宮頸CIN III患者中VEGF陰性(-)5例,弱陽性(±)7例,陽性(+)6例,強陽性(++)6例;flt陰性(-)5例,弱陽性(±)11例,陽性(+)4例,強陽性(++)4例;flk陰性(-)10例,弱陽性(±)4例,陽性(+)8例,強陽性(++)2例;bFGF陰性(-)4例,弱陽性(±)9例,陽性(+)9例,強陽性(++)2例;flg陰性(-)14例,弱陽性(±)5例,陽性(+)5例,強陽性(++)無。見表1。
2.2 宮頸鱗狀細胞癌患者bFGF及其受體、VEGF及其受體的表達
24例CIN III患者中15例進行隨訪,隨訪時間為6個月~54年不等,平均2.9年,其中5項指標都陽性的6例,術后均有復發,復發時間8個月~3.1年,平均12.6個月,占25.0%,其余19例5項指標均有一項或一項以上陰性,且陽性指標多為弱陽性。
44例宮頸癌患者中VEGF陰性(-)2例,弱陽性(±)3例,陽性(+)13例,強陽性(++)26例;flt陰性(-)2例,弱陽性(±)4例,陽性(+)16例,強陽性(++)22例;flk陰性(-)2例,弱陽性(±)7例,陽性(+)21例,強陽性(++)14例;bFGF陰性(-)2例,弱陽性(±)2例,陽性(+)11例,強陽性(++)29例;flg陰性(-)3例,弱陽性(±)12例,陽性(+)22例,強陽性(++)7例。見表1。44例宮頸癌患者中僅有6 例1﹑2項陰性表達,占13.6%,其余38例均有不同程度的陽性表達,且多數為陽性或強陽性,占86.4%。
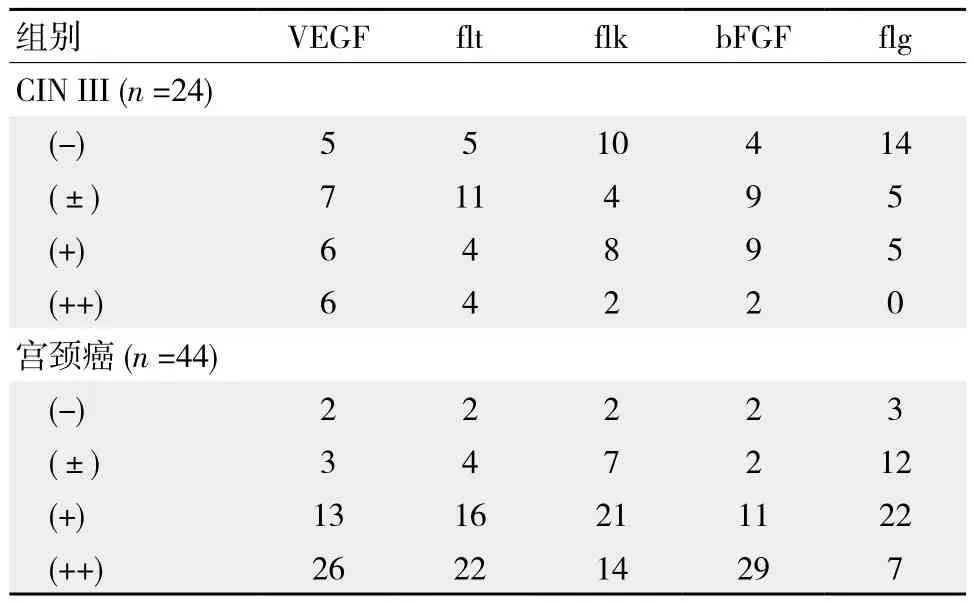
表1 CIN III和宮頸癌患者中bFGF及其受體、VEGF及其受體的表達 例
3 討論
早期腫瘤生長比較緩慢,主要靠周圍組織的彌散作用提供營養,伴隨著毛細血管的生成,腫瘤能夠獲得足夠的營養物質而迅速生長,并通過血管發生轉移,表明腫瘤的生物學行為在一定程度上依賴新血管的形成。VEGF是一種重要的選擇性促血管生成因子,以旁分泌方式作用于血管內皮細胞,具有刺激血管內皮細胞分裂﹑增殖而促進腫瘤血管生成,并誘導產生蛋白水解酶﹑間質膠原酶和組織因子來促進血管形成的作用;同時還可提高血管通透性,導致腫瘤間質水腫,引起細胞外基質改變,從而為腫瘤細胞的浸潤及轉移提供合適的基礎。Bamias等[1]研究認為腫瘤細胞因缺氧﹑基因突變及細胞因子的作用促進VEGF的分泌增加致使腫瘤微血管過度增長。Chen等[2]研究發現,腫瘤的血管生成是腫瘤細胞生長及轉移所必需的,VEGF可誘導腫瘤組織周圍血管網的形成。血管內皮生長因子(VEGF)與各種腫瘤新生血管生成之間的關系已得到廣泛認可,近幾年來,陸續發現了一些特異性作用于淋巴管內皮的生長因子及其受體,為探討淋巴結轉移開辟了新的途徑[2]。既往研究[4]結果表明:VEGF的分泌增加可促進腫瘤微血管增長,腫瘤的血管生成是腫瘤細胞生長及轉移所必需的,微血管密度作為衡量血管生成的定量指標,與腫瘤的發展和預后密切相關。bFGF是一種具有廣泛生物學活性的多肽,通過細胞表面的受體對來源于外胚層和中胚層的細胞發揮促進細胞分裂增殖﹑細胞遷移和新生血管生成等作用。近年研究發現,bFGF在多種惡性腫瘤細胞中過度表達,特別是對腫瘤新生血管生成起著重要作用,進而影響腫瘤的發生和發展﹑浸潤和轉移[5-6]。bFGF不僅可促進血管內皮細胞的增殖,還可調節細胞外基質和基質金屬蛋白酶(MMPs)的表達,從而影響血管內皮細胞的黏附遷移及成管過程。除此之外bFGF還與VEGF﹑血小板衍生因子(platelet derived growth factor, PDGF)等細胞因子相互協同,組成血管新生的調節網絡[7-8]。作為促進血管生成的最重要的因子——血管內皮生長因子,在宮頸癌的血管生成中起重要的作用,bFGF也是宮頸癌血管新生的重要而關鍵的因子,實體腫瘤生長﹑轉移的基礎是血管新生[4-5]。有學者[5]研究表明,宮頸CIN III和浸潤性宮頸癌的腫瘤血管生成是通過不同的作用途徑的,宮頸CIN III的血管生成主要是通過VEGF,VEGF在宮頸CIN III中表達率高,VEGFm RNA可以作為宮頸癌的預后因子。有學者[6]報道,在凋亡抑制基因bcl-2中bFGF高表達的宮頸癌組織中含量明顯增多,是宮頸癌局部復發的早期預后指標。本組研究結果顯示:①血管內皮生長因子(VEGF)及其受體不但在宮頸CIN III中有陽性表達,在浸潤性癌中也有陽性表達,并且在宮頸浸潤性癌中的陽性表達率明顯高于宮頸CIN III(P <0.05)。②bFGF與VEGF在宮頸腫瘤的促血管生成中可能有相互促進作用,共同檢測bFGF及其受體flg,VEGF及其受體flt﹑flk對判斷宮頸癌的預后有非常重要的意義。③宮頸浸潤性癌與宮頸CIN III 5項指標陽性表達間非常差異有統計學意義(P <0.01),表明5項指標的共同表達情況與宮頸癌的浸潤與生長密切相關。④隨訪結果顯示:5項指標在宮頸浸潤性癌中的共同表達或高表達,提示預后較差,而5項指標在宮頸CIN III患者中的共同表達可以作為評估宮頸CIN III早期復發的指標。轉移和浸潤是惡性腫瘤的共性,也是宮頸腫瘤生物學行為特征。筆者通過免疫組織化學方法(S-P法)探討宮頸浸潤性癌與bFGF及其受體﹑VEGF及其受體的表達及其臨床意義,發現44例浸潤性癌的表達5項指標均為陽性38例,占86.4%,其中僅6例1﹑2項指標為陰性表達,占13.6%。24例非浸潤性癌患者中5項指標均陽性6 例(為術后復發病例),占25.0%,浸潤性宮頸癌與宮頸CIN III表達差異有統計學意義(P <0.01)。有研究顯示,由細胞外基質或由腫瘤細胞分泌,啟動的血管生成活性因子如bFGF﹑轉化生長因子-β﹑VEGF和促血管生長素等在腫瘤血管新生中有十分重要作用,其中bFGF和VEGF特異性高且最為關鍵,與腫瘤浸潤﹑轉移有關[7]。本組檢測bFGF及其受體﹑VEGF及其受體等5項指標有利于評估腫瘤預后。
腫瘤的轉移﹑復發與浸潤密切相關。通過本次實驗顯示:①宮頸浸潤性癌組bFGF及其受體﹑VEGF及其受體表達明顯高于非浸潤性癌(宮頸CIN III)組,提示5項指標高表達和宮頸癌組織浸潤能力密切相關。②非浸潤性癌(宮頸CIN III)組中bFGF及其受體﹑VEGF及其受體高表達可作為評判腫瘤是否有復發傾向及浸潤的重要指標。③密切隨訪,定期檢查(如3~6個月復查一次宮頸液基薄層細胞檢測),以早期發現復發病例,采取更為有效措施。臨床醫師對此類非浸潤性癌(宮頸CIN III)的患者應高度重視,對VEGF及其受體﹑bFGF及其受體高表達者應采取更為積極的措施,選擇適當的手術方式。④病理醫生肩負的責任重大,不應滿足于腫瘤分化程度和有無浸潤的診斷,而應檢測多項血管生成因子及其受體,以對臨床更有指導意義。
[1]Bamias A, Dimopoulos MA. Angiogenesis in human cancer:implications in cancer therapy[J]. European J Internal Medicine,2003, 14(8): 459.
[2]Chen CA, Cheng WF, Lee CN, et al. Cytosol vascular endothetial growth factor in endometrial carcinoma: correlation with diseasefree survival[J]. Gynecologic Oncology, 2001, 80(2): 207-212.
[3]Nathanson SD. Insights into the mechanisms of lymph node metastasis[J]. Cancer, 2003, 98(2): 413-423.
[4]哈建利, 張澤波. 卵巢癌組織中VEGF的表達及其與MVD的關系[J]. 咸寧學院學報(醫學版), 2011, 25(4): 296-298.
[5]Dow JK, deVere White RW. Fibroblast growth factor 2 its structure and property, paracrine function, tumor angiogenesis, and prostaterelated mitogenic and oncogenic functions[J]. Urology, 2000, 55:800-806.
[6]Cucina A, BorrelliV, Lucarelli M, et al. Autocrine production of basic fibroblast growth factor translated from novel synthesized mRNA mediates thrombin-induced mitogenesis in smooth muscle cells [J]. Cell Biochem Funct, 2002, 20(1): 39-46.
[7]Kuhn H, Konrad J, Holtz S, et al. Enhanced expression of VEGF following bFGF inhibition in non small cell lung cancer cell lines[J].Lung Cancer, 2006, 54(2): 149-153.
[8]Giavazzi R, Senninno B, Coltrini D, et al. Distinct role of fibroblast growth factor 2 and vascular endothelial growth factor on tumor growth and angiogenesis[J]. Am J Pathol, 2003, 162(6): 1913-1926.

