大腦皮質神經元及其網絡的興奮
鄧穗馨,舒友生
(1.北京師范大學認知神經科學與學習國家重點實驗室,2.IDG/麥戈文腦科學研究院,北京 100875)
大腦皮質中數量龐大的神經元作為神經系統基本單元,通過突觸彼此連接,形成了能實現感覺、運動、學習、語言和決策等各種功能的復雜神經網絡[1]。皮質的網絡活動主要由釋放谷氨酸的興奮性神經元和釋放γ-氨基丁酸(gamma aminobutyric acid,GABA)的抑制性神經元共同介導。這些神經元介導的興奮性和抑制性信號相輔相成,共同維持大腦功能正常行使所必需的興奮和抑制平衡。無論是在清醒狀態下感覺引發的皮質網絡活動中,亦或是在睡眠或麻醉狀態下自發的網絡振蕩中,興奮和抑制呈比例變化[2]。因此,研究興奮性神經元和抑制性神經元產生電信號的基本原理、突觸傳遞特性、基本環路結構以及興奮-抑制平衡網絡的調控機制,對于理解認知加工的過程十分重要。此外,皮質功能的紊亂、興奮抑制的失衡常與神經性或精神性疾病有關,這些研究對了解腦疾病的發生機制也有重要意義[3-4]。本綜述將圍繞神經網絡的興奮-抑制平衡機制,分別從單細胞興奮性、突觸傳遞特性、抑制性微環路特異性及其動態變化特征等進行闡述。
1 皮質神經元的分類
大腦皮質的主體神經元是投射型谷氨酸能錐體細胞(pyramid cells,PC),占皮質神經元總數的70%~80%[5]。另一類神經元是非投射型谷氨酸能神經元多棘星型細胞,其樹突較短呈星形放射狀[6]。興奮性神經元在皮質排列井然有序,分層聚集,根據其形態結構和電生理特征可分為最終投射終結于端腦內側束神經元,具有離皮質投射能力投向腦干、脊髓和基底神經節等皮質下腦組織的錐體束神經元和特異性投向丘腦的皮質丘腦神經元[7-8]。皮質的抑制性神經元種類多樣,一般僅在局部網絡形成突觸連接,因此常被稱為中間神經元。可根據其形態結構、電生理學特征或特異性表達的分子等進行分類[5],如小清蛋白(parvalbumin,PV)和生長抑素(somatostatin,SST)陽性神經元占中間神經元總數的約70%[9]。特定類型中間神經元按照不同分類方式有較高的重合率。例如,PV神經元常為胞體和近端樹突投射型中間神經元,其軸突一般呈籃狀包裹PC胞體,電生理特征常呈快速放電模式[5,9];吊燈細胞是一類特殊的大多表達PV的神經元,其軸突主要支配PC的軸突始段[10]。又如,SST神經元多是遠端樹突投射型中間神經元,又稱Martinotti細胞,且電生理特征常呈低閾值放電模式[5,9,11]。
靈長類大腦皮質中存在一些獨特的神經元類型,如梭形神經元和持續放電神經元。梭形神經元是一類胞體較大且呈紡錘形的投射型興奮性神經元,主要存在于前扣帶回和前腦島皮質的5b層[12],其異常被認為與孤獨癥[13]、精神分裂癥[14]和額顳葉癡呆[15]相關。持續放電神經元在人腦皮質的非錐體細胞中所占比例約為9%,誘發單個動作電位(action potential,AP)的短暫刺激可引起持續去極化平臺電位,并導致持續AP的發放;誘發高頻AP發放的較強刺激則會抑制這種平臺電位和AP的持續發放[16]。豐富的神經元類型及獨特的突觸連接方式可能對靈長類大腦皮質高級認知功能的實現具有重要貢獻。
2 神經元的興奮性
神經元通過產生AP對信息進行編碼,參與大腦皮質的信息處理[17],同時產生AP的能力也反映了神經元的興奮性。因此,對皮質網絡的興奮和抑制平衡機制的探討,首先需要對網絡中單個神經元的興奮性決定機制進行研究。神經元去極化到特定的閾電位是AP爆發的關鍵,一旦去極化達到閾電位,神經元將不可逆地在軸突始段爆發AP,膜電位超射至約30 mV,此時更大的閾上電流刺激也不能使AP超射幅值發生太大變化;而閾下膜電位的波動將在軸突上產生電緊張性擴佈,最終衰減而無法傳導至下一級神經元。因此,AP是“全或無”的信息編碼模式,即1和0的數字信號,并通過時間和頻率編碼來主導大腦中神經信號的傳導。近期研究顯示,神經元閾下膜電位的波動通過影響AP介導突觸傳遞[18-19]。具體表現為突觸前閾下膜電位去極化程度越高,AP觸發的突觸后電位幅值越大。突觸前這種膜電位波動不是“全或無”的,而是連續的,即模擬信號編碼模式。因此,在大腦皮質中,神經元以數字信號與模擬信號相結合的方式共同編碼神經信息,并決定下級神經元的興奮。
2.1 谷氨酸能神經元興奮性的決定機制及其調節
關于中樞神經系統中神經元興奮性的早期研究,主要集中在各腦區的主體細胞。在錐體細胞上,一般認為軸突始段擁有的高密度的鈉通道是決定AP首先在此爆發的原因[20]。更細致的工作發現,鈉通道在PC的軸突始段胞體近端和遠端雖均高密度分布,但AP首先在距離胞體約40 μm的遠端爆發[21]。因此,除了高密度的鈉通道,AP偏好于軸突始段遠端爆發應該還存在其他機制。
AP發生機制的探討著重于軸突膜上離子通道的生物物理性質的研究。由于大部分中樞神經元的軸突直徑<1 μm,以往對軸突的記錄僅局限于某些特殊的巨大軸突終末,如腦干花萼突觸[22]和海馬苔蘚纖維突觸節[23]。近期,一種新穎的軸突泡記錄方法突破了以往的技術限制[19,24-26]。該方法是在腦薄片上用比正常更細的膜片鉗電極直接記錄軸突小泡,這一泡狀結構是在制備腦薄片的過程中由軸突切斷處的細胞膜重新愈合而形成的。通過對軸突小泡進行記錄或對胞體和軸突小泡同時進行雙電極膜片鉗記錄,可測量軸突上特定離子通道的密度、通道亞型電生理特性、AP波形及傳導速度等。利用這種技術并結合改良的免疫熒光染色方法發現,在PC的軸突始段遠端大量聚集的低閾值電位開放的Nav 1.6決定了AP首先在此爆發;而在軸突始段近端大量聚集的高閾值電位激活的Nav1.2則可進一步開放并促進AP回傳至胞體,并決定胞體-樹突區域AP爆發的閾值[27]。在人腦皮質的PC上,免疫熒光顯示出相似的鈉通道亞型分布模式[28],提示具有相似的AP產生機制。
神經調質或遞質可調控軸突上的AP發生和傳導。有文獻報道,5-羥色胺1A受體(5-hydroxy tryptamine 1A receptor,5-HT1AR)在軸突始段的近端高密度分布[29]。激活5-HT1AR不影響軸突始段上Nav 1.6介導的鈉電流,但會強烈抑制Nav1.2介導的鈉電流,并阻礙AP向胞體的回傳。這種對Nav1.2亞型的選擇性調節,可能在神經元和神經環路信號處理以及相關腦區功能的調控方面具重要意義[30]。PC軸突上另一種重要的電壓門控型離子通道——鉀通道,可受到多巴胺受體D1和D2的調節,D1受體的激活可下調軸突上的鉀電流,反之D2受體的激活則上調鉀電流。因此,神經調質多巴胺可通過調節軸突鉀電流來影響AP波形進而影響神經信號的傳遞[31]。另外,PC軸突上還存在GABAA受體,其開放主要使得軸突膜電位超極化,同時可能通過增加軸突局部的電導產生分流抑制效應,從而影響AP的幅度、寬度和AP引起的細胞內鈣水平[32]。在人腦皮質組織中,PV陽性的吊燈細胞突觸終末選擇性地支配富含Nav 1.6的軸突始段遠端,而在Nav1.2分布的軸突始近端上形成的突觸較少,提示這類吊燈細胞釋放的GABA作用于軸突受體,對PC的興奮性發揮重要的調節作用[28]。
2.2 皮質抑制性神經元興奮性的決定機制及其調節
抑制性中間神經元的電活動對皮質興奮-抑制平衡以及信息處理具有十分關鍵的意義。抑制性環路功能的下調或中間神經元數目的減少常與各種腦疾病相關[33]。由于中樞神經系統中抑制性神經元的軸突比PC的更細,早期限于軸突記錄技術難度,人們對AP在各類中間神經元上的起始和傳播特征所知甚少。軸突小泡記錄方法在抑制性神經元的研究中仍具巨大優勢[24]。利用這一方法并結合免疫熒光染色技術研究發現,PV和SST神經元與PC相似,AP起始點也在富含Nav 1.6的軸突始段遠端;但不同的是兩類抑制性神經元的軸突始段均表達Nav1.1[34]。進一步實驗發現,相較于SST神經元,PV神經元軸突鈉通道的激活和失活曲線均向超極化方向移動了近7 mV,與兩者的AP電壓閾值差異一致。免疫熒光染色顯示,這種差異可能源于SST神經元軸突始段上的表達更多的高閾值鈉通道(Nav 1.1和Nav1.2)[34]。后續藥理學實驗表明,抑制Nav1.2電流可阻斷SST神經元AP的自主發放,降低其對所介導的網絡環路的抑制,從而提高癲癇樣放電的頻率[34]。
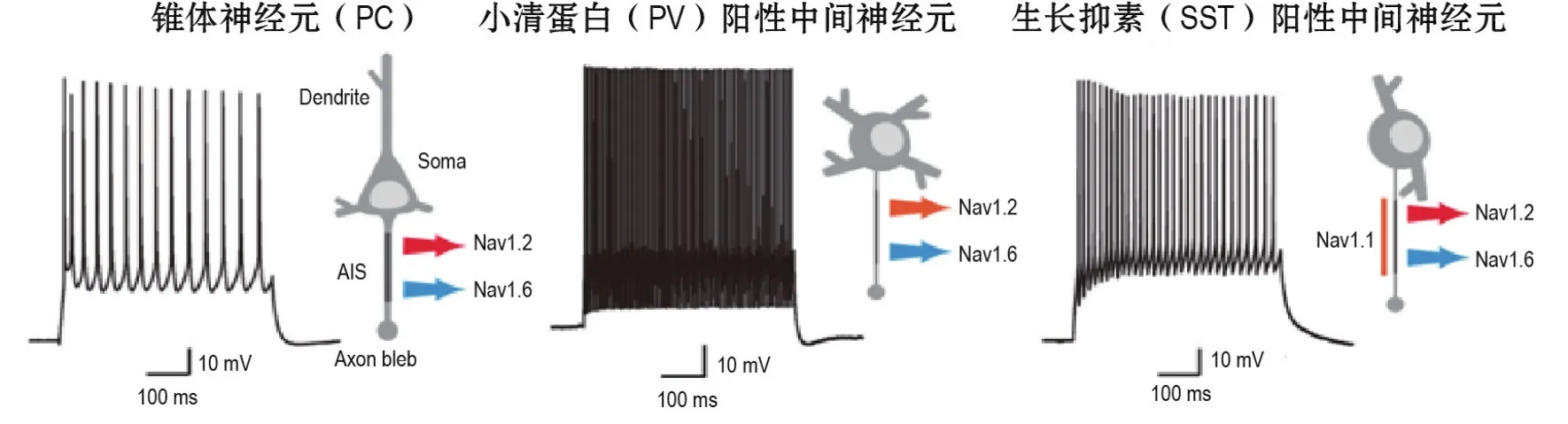
圖1 大腦皮質各類神經元的電生理學特征及軸突始段鈉通道表達模式.圖片修改自Hu等[27]和Tian等[28].
以上研究結果闡明了皮質PC和2類抑制性中間神經元上軸突鈉通道的組成(圖1)以及各自興奮性的決定機制,和各種神經調質或遞質在控制AP爆發和傳播中的重要作用。這些發現有助于了解離子通道疾病的病理基礎,為控制細胞興奮性的藥物研發提供分子靶標。
3 突觸傳遞模式
AP的爆發是細胞內在的生物物理特性與突觸活動相互作用的結果。化學突觸的突觸間隙一般約20 nm,其間神經遞質的濃度在突觸活動中最大可達毫摩爾級別[35],從而實現2神經元之間特異性的突觸傳遞。化學突觸中,依賴突觸前AP爆發的信號傳遞主要有2種模式,即同步化釋放和非同步化釋放[36]。
3.1 同步化遞質釋放
在多數情況下,AP爆發后沿軸突傳導至軸突終末,激活電壓門控鈣離子通道并引發大量鈣離子內流,促使囊泡內神經遞質釋放。此過程受到眾多分子的復雜調控[37]。但從時間上來講,突觸前AP的爆發到突觸后反應開始的時間間隔非常短暫(1~2 ms),在此極短時間窗內,大量囊泡釋放,即遞質的同步化釋放[36]。突觸結合蛋白(synaptotagmin,Syt)是突觸前膜內最常見的鈣感受器,敲除其亞型Syt-1基因將嚴重影響突觸傳遞中的同步化遞質釋放[38]。
不同類型的突觸由于其相關突觸蛋白表達量或種類不同,其同步化釋放有一定的短時可塑性。當突觸前神經元受到一串刺激時,突觸后反應大小會發生短時程的改變。第一個刺激引起的囊泡釋放率被用來表征不同類型突觸對AP信號的敏感性。囊泡釋放率往往與雙脈沖比率呈負相關。在錐體細胞分別與SST和PV神經元形成的突觸上,囊泡釋放率差異較大。表現為PC-SST突觸擁有較低的囊泡釋放率,而PC-PV突觸擁有較高的囊泡釋放率[39]。因此,當給予PC一串刺激后,在SST神經元上記錄到的是隨刺激數目增加而逐漸增大的短時程易化突觸反應,而在PV神經元上得到逐漸減小的短時程抑制突觸反應[40-41]。
PC不同突觸的短時程可塑性差異可能與其突觸相關蛋白表達的特異性有關。但即使突觸前神經元是同一個錐體細胞,在PC對SST和PV神經元分別形成的突觸中也能檢測到不同的短時程可塑性[42],提示其突觸相關蛋白表達的特異性只局部體現在其不同軸突終末上。因此,這種局部特異性的突觸相關蛋白的表達,可能依賴于突觸后神經元特異性的逆向跨突觸分子信號。Elfn1是其中一類可能具逆向跨突觸調控作用的蛋白,這種蛋白被發現特異性表達在SST神經元上。當敲除SST神經元中此蛋白的編碼基因,可發現PC-SST突觸的短時程易化特征受到抑制;而在無這種蛋白表達的PV神經元上外源過表達此蛋白,可導致原先突觸前PC-PV神經元的短時程抑制轉化成易化模式[43]。此外,SST神經元還特異性地表達代謝型谷氨酸受體1(metabotropic glutamate receptor 1,mGluR1),與其相對應的突觸前神經元則特異性表達mGluR7[44]。研究發現,含有mGluR7蛋白的突觸前神經元與含有Elfn1蛋白的突觸后在空間上的耦合度非常高,敲除Elfn1將導致其突觸前神經元mGluR7的聚集程度下降,并且敲除Elfn1的小鼠與敲除mGluR7的小鼠擁有較為相似的疾病表型,提示SST神經元表達的Elfn1可能提供了某種逆向跨突觸信號,來調控其突觸前mGluR7蛋白的表達與分布[45]。此外,近期研究結果表明,鈣感受器Syt-7在調節囊泡釋放模式方面有較強作用,在具有短時程易化可塑性的突觸中特異性地敲除Syt-7,可檢測到短時程易化的消失[46]。
3.2 非同步化遞質釋放
如上所述,一般AP誘導的突觸前囊泡遞質釋放與AP爆發時間耦合較好,并能在2 ms時間窗內記錄到相應的突觸后電位。在某些特定的突觸中,當AP結束后較長的時間窗(幾十至幾百毫秒)內仍能檢測到連續不斷的遞質釋放事件,這種時間上比AP發生延遲許多的遞質釋放稱為非同步化釋放[47]。研究認為,AP強烈發放后,軸突終末累積的殘余鈣信號觸發了囊泡的非同步化釋放,因此非同步化釋放水平一般與刺激強度(AP頻率或數目)呈正相關[36,47]。
中樞神經系統內的非同步化遞質釋放模式,主要存在于抑制性神經元快速放電的GABA釋放中[48-50]。這種GABA的非同步化釋放,隨著動物發育至成年有逐漸減少的趨勢,提示環路對這種非同步化GABA釋放產生的抑制的需求隨發育而發生變化[50]。關于非同步化GABA釋放機制的探討,則在海馬中更為具體。海馬齒狀回中,非同步化GABA釋放也在一類抑制性神經元的輸出突觸中存在,但不是PV神經元,而是另一種分子標簽為膽囊收縮素的中間神經元[47]。膽囊收縮素神經元和PV神經元的軸突雖都偏好于呈籃狀包裹PC胞體[51],但它們的軸突終末蛋白在表達和功能上有很大區別,可能引發其非同步化釋放水平上的差異。首先,其突觸終末介導鈣離子內流電壓門控鈣離子通道的亞型不同,膽囊收縮素神經元表達N型,而PV神經元則表達P/Q型。不同亞型電壓門控鈣離子通道與鈣感受器之間的距離可能導致囊泡釋放速率的差異。實驗中,用慢鈣螯合劑乙二醇雙(2-氨基乙基醚)四乙酸(EGTA)可阻斷膽囊收縮素神經元的GABA釋放,提示電壓門控鈣離子通道與鈣感受器的距離較遠,屬于微米級偶聯(距離>100 nm),即鈣離子需要擴散較遠的距離才能抵達鈣感受器,并導致囊泡釋放在時間上的延遲;而PV神經元GABA的釋放需要用快鈣螯合劑BAPTA才能阻斷,提示軸突終末上兩者的距離較近,為納米級偶聯(<100 nm),因此囊泡釋放時間較為精準[47]。其次,膽囊收縮素神經元和PV神經元的突觸后膜表達的受體類型不一致。膽囊收縮素神經元的突觸末端表達大麻素1型受體,而PV神經元的突觸末端表達乙酰膽堿和腦啡肽受體,這使得PV神經元在突觸活動中易受到其配體的特異性調控[51]。第三,分子標志物PV是一種強有效的鈣結合蛋白,可與鈣離子結合并影響軸突終末的游離鈣濃度,從而調節突觸活動,如減弱突觸囊泡的非同步化釋放水平或降低同步化釋放的短時程抑制程度[48]。
此外,上文提到的支撐短時程易化的鈣感受器Syt-7,在早期斑馬魚神經肌肉接頭的研究中被認為是特異性的非同步化釋放的鈣感受器[52]。后續在嚙齒類動物神經元上的實驗發現,只有在敲除了介導同步化釋放的鈣感受器Syt-1的前提下,Syt-7才能體現出其在非同步化釋放過程中的重要作用,而僅僅單敲Syt-7對突觸傳遞影響不大[53-54]。進一步研究發現,單敲Syt-7雖無法檢測到明顯的突觸傳遞變化,但同步化釋放過程中的一種較慢的突觸后基電流大大降低,最終可導致突觸后神經元上AP發放的減少與發放時間精準性的下調[55]。可見,Syt-7雖不如Syt-1對突觸傳遞的貢獻大,但其支撐的非同步化釋放對突觸后神經元的興奮性仍有較強調控作用,從而可能影響整個網絡的電活動。
4 皮質交互式微環路的特征
神經元的突觸輸入主要來自外界刺激和交互式網絡活動。在感受外界刺激時,大腦皮質主要接收并加工來自丘腦的信息輸入。視皮質的研究發現,丘腦的輸入可在視覺刺激40 ms后激活皮質內部的交互式微環路,而此微環路的興奮性強度遠超于從丘腦直接輸入的刺激興奮;但若切斷丘腦輸入,此交互式興奮將迅速消失,說明丘腦輸入的信號是維持視覺刺激誘發的皮質興奮的必要條件,而此丘腦信號在皮質內可被局部交互式微環路的興奮放大[56]。大腦皮質中各種抑制性神經元也參與到功能相關的交互式網絡構建中,并與興奮性神經元通過突觸連接形成特定的交互抑制微環路,從而調控網絡活動的輸入和輸出。交互抑制微環路除了在動物清醒時通過丘腦的信號輸入而被激活,在麻醉或睡眠狀態下也可被自發網絡振蕩活動所驅動。
不同抑制性神經元在接受谷氨酸遞質同步化釋放所展現出的短時程可塑性差異,決定了它們所介導的抑制性信號在交互微環路中功能的特異性[40]。在PC-快速放電神經元-PC組成的皮質交互抑制微環路中,快速放電神經元一般僅在其突觸前PC刺激串輸入的前期發放AP,并在其突觸后PC上產生一個快相的抑制;而在PC-低閾值放電神經元-PC組成的微環路中,低閾值放電神經元一般在刺激串輸入的后期才發放AP,隨后在其突觸后PC上產生一個慢相的抑制[40]。此外,皮質中血管活性腸肽陽性中間神經元,易受到其他高級腦區自上而下信息的調節,或皮質下結構投射來的神經調質纖維的作用,如乙酰膽堿[57]。這類細胞的激活主要通過抑制SST神經元從而在鄰近的PC上引起去抑制效應,對網絡活動的產生具有重要的調控作用[57-58]。
4.1 快相交互抑制微環路
雙電極膜片鉗記錄發現,快速放電神經元易與鄰近PC形成雙向突觸;而當同時記錄2個PC并對其中一個進行串刺激時,卻很少能在另一個PC上檢測到快相的跨雙突觸抑制反應(<1%)[59-60]。此現象提示2種可能:①由快速放電神經元所介導的快相交互抑制微環路主要由有雙向突觸聯系的PC和快速放電神經元組成,只負責反饋抑制;②快速放電神經元也介導側抑制(surround suppression),但在雙電極膜片鉗記錄條件限制下,僅單個突觸前PC的活動并不足以激活快速放電中間神經元介導的快相交互抑制微環路。實驗發現,快速放電神經元常被報道參與同步化的網絡活動中[61],即網絡中大量PC同步化爆發的AP才能更有效地激活快相交互抑制微環路。因此,快速放電神經元又常被認為是環路中的“同步探測器”[62]。在環路功能上,這樣的抑制信號能維持網絡活動中的興奮-抑制平衡,保護網絡不致過于興奮而引發癲癇或其他腦疾病[63-64]。此外,快相交互抑制微環路還大量被招募到前饋式抑制活動中[65]。在皮質的第4層,當興奮性神經元接受大量來自丘腦的輸入時,這份興奮也同樣被抄送給了快速放電神經元,由快速放電神經元所介導的前饋抑制使得興奮性神經元接受丘腦的輸入后立刻受到抑制。這樣的前饋抑制,即快速放電所介導的快相交互抑制能縮小目標興奮性神經元的興奮性整合的時間窗,壓縮目標興奮性神經元群發放AP的時間窗,并提高發放時間的精確性,促進興奮性神經元群的同步化活動。同樣的前饋抑制還發生在第4層興奮性神經元向第2/3層投射的過程中,并且第4層的興奮性神經元偏好性地投射給2/3層中互相投射的PC和PV神經元,從而進一步加強交互式環路中的反饋抑制[66]。2/3層的PV神經元是保持網絡中興奮-抑制平衡的重要組成,通過動態調整PC的興奮性,從而改變其突觸前PV神經元的抑制性輸入大小[67]。可見快速放電神經元介導的快相交互抑制微環路,不論是產生反饋式抑制還是前饋式抑制,均通過隨網絡興奮增高而抑制增強的模式,貢獻于正常生理活動中的興奮-抑制平衡,保護神經系統不至于過興奮。此外,快速放電神經元特異性投射到PC的胞體或近端樹突上,因而能更加快速而有效地保證其行使抑制功能[51]。
4.2 慢相交互抑制微環路
較之快相交互抑制微環路,當給予同樣的串刺激條件,PC-低閾值放電神經元-錐體細胞這種慢相交互抑制微環路所介導的跨突觸抑制反應在雙PC膜片鉗記錄中較易得到;PC-低閾值放電神經元的單突觸聯系中,低閾值放電神經元上能得到AP的概率高達27%[59-60]。這說明低閾值放電中間神經元較易被單個PC所激活,從而產生AP并形成對下一級PC的抑制。但由于PC對低閾值放電神經元突觸輸入的短時程易化效應,單PC的低強度輸入并不能有效激活慢相交互抑制微環路。實驗發現,低閾值放電神經元介導的跨突觸抑制效果隨突觸前刺激頻率和數目增加而增強[59],因此低閾值放電神經元又可被稱作“簇狀發放探測器”。另外,3個PC膜片鉗記錄發現,同時激活2個PC在第3個PC上得到的跨突觸抑制反應比分別單獨激活得到的反應的數學加和要大得多。這種跨突觸抑制反應的超線性增強的現象表明,少量PC的簇狀發放即可強烈激活由低閾值放電介導的慢相交互抑制微環路。因此,在某些特定網絡中,只需激活極少量的PC就能達到對整個網絡活動的調控[68]。在多個SST神經元上分別用解籠鎖谷氨酸(uncage glutamate)進行刺激,在同一個突觸后PC上可高概率檢測到抑制性反應,并且在鄰近的其他PC上有相似的結果[69]。可見這種SST神經元抑制性的投射缺乏選擇性。綜上,1個PC可在大范圍內接受多個突觸前SST神經元的密集投射,同時,突觸前的SST神經元也可能同時投射給其他PC;1個SST神經元能接受多個突觸前PC興奮性的輸入,同時又給多個下游PC提供抑制性。此外,PC與SST神經元還存在相互投射,從而形成一龐大而復雜的慢相交互抑制大網絡,來提供大范圍內相對長時程的皮質交互性抑制,特別是側抑制[66],從而調控整個皮質的興奮-抑制平衡。
實際上,在高等動物或正常清醒狀態的低等動物中,這種交互式抑制在感覺信息處理過程中的作用更為強大。近年來,人們提出一種新型神經網絡動態興奮的理論模型抑制穩定網絡(inhibition stabilized network,ISN)[70-71]來解析抑制性在其中的重要作用。由于這個ISN模型需要非常強大的交互式網絡存在,所以最先在猴、貓等有明顯功能柱結構的視皮質被證明,近期才在清醒小鼠的聽、視皮質被相應證實[72-73]。這些研究表明,ISN的主要貢獻者是SST神經元,它們可通過其不論水平還是垂直方向均廣泛的側抑制[66,72-73]來主導這個網絡的穩態。這種大范圍抑制的產生可能得益于SST神經元聚集于第一層豐富的軸突分支。SST神經元通過其分支廣泛的軸突、無選擇性地抑制大量PC的頂樹突,減弱PC樹突鈣電位的發生,從而抑制PC的AP發放[74-75]。此外,這種對頂樹突的抑制還主要體現在減弱PC的簇狀發放上[76-77],對感覺信息的編碼與傳遞、知覺的形成等有重要調節作用。
5 抑制性微環路的功能與動態變化
皮質神經元組成了復雜的動態變化的交互型神經網絡,并通過發放AP來參與不同的生理功能或病理活動[78]。在大部分網絡活動中,交互式興奮和抑制往往是相輔相成的,兩者之間維持著適當的興奮-抑制平衡[79-81]。抑制性微環路在平衡的維持中發揮重要作用,不同類型抑制性中間神經元在時間和空間上,可能貢獻于不同的動態網絡信息編碼過程,從而精細調控不同的生理或病理過程[82]。
5.1 網絡電活動與膜電位依賴的交互抑制調控
大腦皮質行使正常生理功能時,皮質神經元的膜電位由于受到突觸前各種興奮性、抑制性輸入的影響,除了爆發AP,還常常產生呈一定規律波動的膜電位振蕩[79,83]。在麻醉或睡眠動物的胞外或胞內電生理記錄過程中,均能記錄到神經元交互呈現的兩種不同但相對穩定的膜電位狀態。一種是平均10~20 mV的去極化膜電位,常伴有AP發生,稱為高電位狀態(up state);一種是膜電位接近于靜息膜電位,幾乎無突觸輸入和AP產生,稱為低電位狀態(down state)[79,84]。此外,若在改良的人工腦脊液(鈣、鎂離子濃度降至1~1.2 mmol·L-1或給予乙酰膽堿受體激動劑)中對腦片進行記錄,也常得到這種高電位狀態和低電位狀態[79,83,85]。在神經元處于高電位狀態時,可明顯檢測到其興奮性的增加,以及對微小輸入敏感性的增強,從而引發AP發放增多并縮短AP爆發的延遲時間,提示這種高電位狀態的膜電位對信息的編碼有重要作用[79,86]。這種交互式網絡振蕩機制和調節方式迄今尚不清楚,有研究表示抑制性神經元在其中發揮重要作用[83]。
越來越多的工作表明,突觸前細胞膜電位依賴的突觸傳遞是AP編碼信息的另一種模式,即模擬信號編碼模式[19,60]。此模式主要表現為,在突觸前神經元處于去極化狀態時給予刺激使其爆發AP,其遞質釋放量將增多,從而導致突觸后神經元上突觸反應的增大。因此,這種模式可導致突觸后神經元更易達到AP的閾值,根據突觸后神經元類型及特性來調控交互式神經環路中信號的傳遞。研究表明,不論是快相交互式抑制還是慢相交互式抑制,在突觸前膜電位去極化狀態下都被增強[60](圖2)。這種膜電位依賴的突觸調控主要依靠突觸前PC軸突上電壓門控鉀離子通道Kv1的參與[26,60]。此外,研究發現利用神經元胞體和軸突泡同時記錄的方法,當神經元膜電位處于去極化15~20 mV的狀態時,從軸突始段傳導至遠端軸突的AP波形比在靜息膜電位狀態下更寬,但在胞體處記錄到的波形變化不明顯[19]。除了AP沿著軸突傳導外,胞體的膜電位波動也會通過電緊張擴佈方式傳導至軸突遠端。在前額葉皮質第5層PC軸突上,擴佈的長度常數>400 μm[19]。因此,對于一個特定的突觸來說,胞體去極化可能通過傳播到達突觸前膜并導致Kv1通道的失活、AP寬度和鈣內流的增加,引起遞質釋放量的增多和突觸后反應的增強,最終導致突觸后神經元AP發放概率的上升和數目的增多。這些研究均指示,模擬信號對皮質微環路的功能具有重要的調控功能。
5.2 刺激強度依賴的非同步化GABA釋放與癲癇
如上所述,皮質快速放電神經元的輸出突觸上存在GABA的同步化釋放和非同步化釋放。后者的強度依賴快速放電神經元上AP產生的頻率和數目,當刺激強度增強產生高頻簇狀AP時,非同步化釋放增多。因此,皮質網絡可能利用此機制動態調控網絡的興奮-抑制的平衡。研究發現,在癲癇患者的腦片中,快速放電神經元的非同步化遞質釋放較非癲癇患者的更為強烈(圖3)。這種增強的非同步化GABA釋放,不論是在快速放電神經元的自突觸還是在其投向PC的抑制性突觸中均存在,但其GABA的同步化釋放水平卻無太大差異[49]。因此,快速放電神經元的GABA非同步化釋放將在突觸后神經元上產生一個長時間的抑制,在不同突觸中,這種抑制會影響不同的突觸后神經元AP的發放率與發放時間精確性[48],從而改變神經網絡中的興奮-抑制平衡,可能使得神經網絡活動去同步化來調節癲癇的爆發和維持[49]。綜上,快速放電神經元的非同步化GABA釋放的改變可能調控癲癇的發作和維持,這些研究可為抗癲癇藥物的研發提供新的思路。
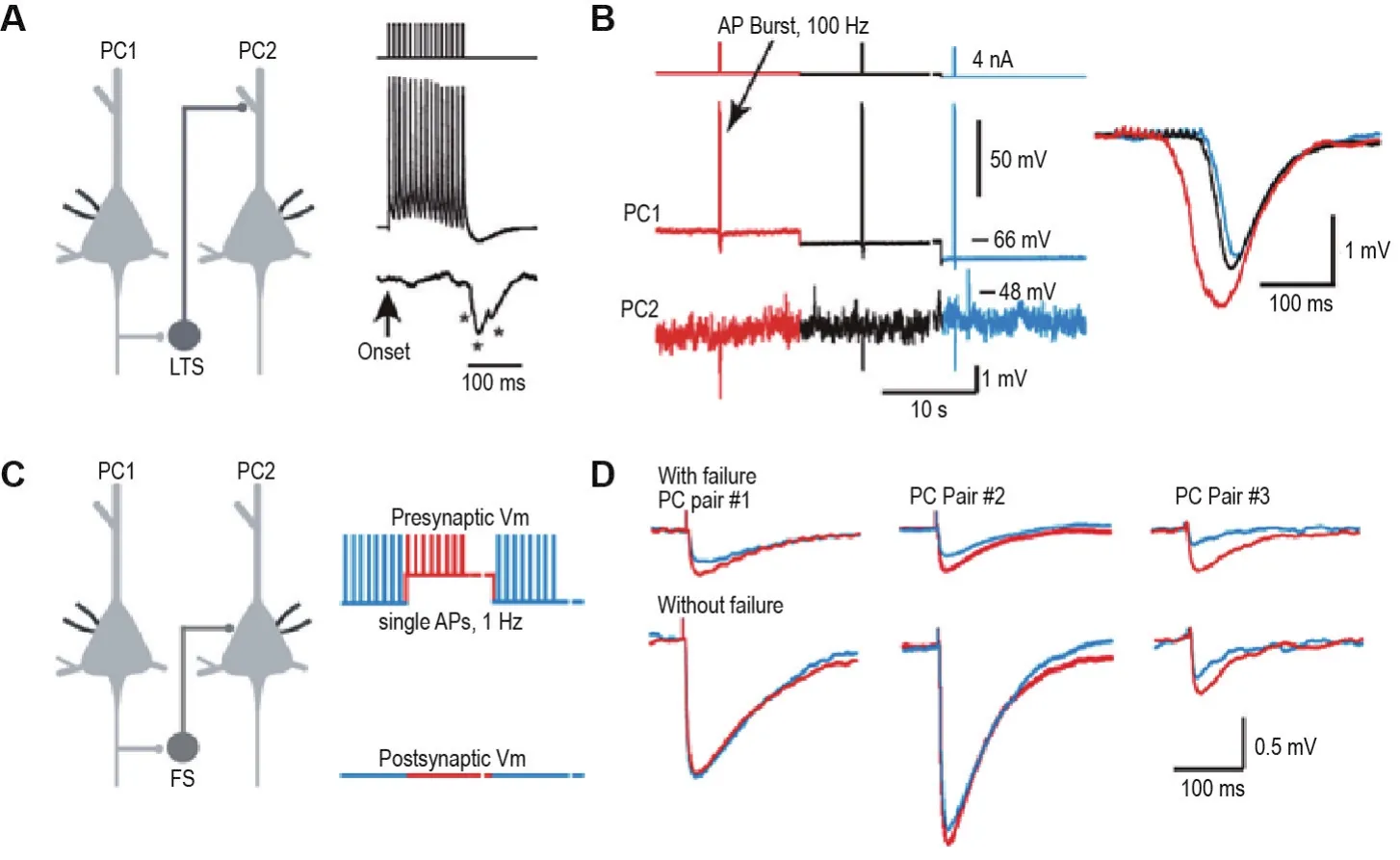
圖2 膜電位依賴的交互抑制調控.A:利用雙電極膜片鉗技術同時記錄2個PC,當給予PC1一串刺激(100 Hz,15個AP),可在PC2上檢測到由低閾值放電神經元介導的慢相跨雙突觸抑制性電位;B:PC1膜電位的去極化水平與PC2記錄得到的跨雙突觸抑制性電位大小緊密相關;C:雙電極膜片鉗技術同時記錄2個PC,將PC1鉗制在不同膜電位水平并給予持續的1 Hz刺激產生AP;D:3例展示檢測到的快相跨雙突觸抑制性電位在PC1膜電位去極化狀態下更大(紅色指示PC1膜電位處于去極化狀態下的記錄;藍色指示靜息膜電位狀態下的記錄).AP:動作電位.圖片修改自Zhu等[60].

圖3 皮質快速放電中間神經元的非同步化GABA釋放與癲癇.A:來自神經膠質瘤患者的腦部核磁共振成像圖片,此患者伴有嚴重的癲癇癥狀,紅框指示其位于大腦顳葉的膠質瘤病灶區.利用膜片鉗技術得到的膠質瘤病灶旁組織的腦切片中的神經元電生理記錄個例.放電頻率分析指示其為典型的快速放電中間神經元,并且在刺激結束后還能檢測GABA非同步化釋放所引起的突觸后反應(藍框).B:癲癇患者和非癲癇患者腦切片中快速放電神經元在刺激串后GABA非同步化釋放持續時間的比較.圖片修改自Jiang等[49].
6 總結
大腦皮質網絡由豐富多樣的神經元類型通過突觸連接形成功能微環路,各種細胞類型分別表達特異性功能蛋白(如離子通道、突觸相關蛋白等),它們的組合決定了各類神經元的興奮性及其介導的微環路結構和功能,從而貢獻于復雜多變的神經網絡活動。綜述主要從單細胞水平、突觸水平和微環路水平闡述了神經元及其網絡興奮性的決定機制,及交互抑制性微環路如何動態調控網絡中興奮-抑制平衡,其中重點介紹了快速放電和低閾值放電的2類抑制性中間神經元所介導的微環路及其功能。隨著基因組學、電生理學、病毒學和光遺傳學等技術的日益成熟和應用[87],更多關于腦網絡興奮-抑制平衡機制的科學問題將得到深入研究。
除了梭形神經元和持續放電神經元,皮質中是否存在未被發現的新型神經元種類,不同的神經遞質或調質如何特異性地調控這些神經元亞類,在整體動物生理情況下,PV和SST 2類中間神經元是如何被有效激活的,是否存在特殊的分子靶點來有效激活或調控這2類中間神經元所介導的交互抑制,從而影響網絡活動功能,數字信號和模擬信號結合的信號傳遞模式在網絡活動中又如何被精準的調控,這些問題仍亟待研究。針對這些問題的研究將為腦網絡中興奮-抑制平衡的調控提供新策略,為相關腦疾病的治療提供新思路。
[1 ]Schüz A.Cortex:statistics and geometry of neuronal connectivity[J].J Anat,1999,194(pt1):153-157.
[2]Okun M,Lampl I.Instantaneous correlation of excitation and inhibition during ongoing and sensoryevoked activities[J].Nat Neurosci,2008,11(5):535-537.
[3 ]Cobos I,Calcagnotto ME,Vilaythong AJ,Thwin MT,Noebels JL,Baraban SC,et al.Mice lacking Dlx1 show subtype-specific loss of interneurons,reduced inhibition and epilepsy[J].Nat Neurosci,2005,8(8):1059-1068.
[4]Lewis DA,Hashimoto T,Volk DW.Cortical inhibitory neurons and schizophrenia[J].Nat Rev Neurosci,2005,6(4):312-324.
[5]Markram H,Toledo-Rodriguez M,Wang Y,Gupta A,Silberberg G,Wu C.Interneurons of the neocortical inhibitory system[J].Nat Rev Neurosci,2004,5(10):793-807.
[6 ]Petersen CC,Crochet S.Synaptic computation and sensory processing in neocortical layer 2/3[J].Neuron,2013,78(1):28-48.
[7]Harris KD,Shepherd GM.The neocortical circuit:themes and variations[J].Nat Neurosci,2015,18(2):170-181.
[8 ]Naka A,Adesnik H.Inhibitory circuits in cortical layer 5[J].Front Neural Circuits,2016,10:35.
[9]Tremblay R,Lee S,Rudy B.GABAergic interneurons in the neocortex:from cellular properties to circuits[J].Neuron,2016,91(2):260-292.
[10]Taniguchi H,Lu J,Huang ZJ.The spatial and temporal origin of chandelier cells in mouse neocortex[J].Science,2013,339(6115):70-74.
[11 ]McGarry LM,Packer AM,Fino E,Nikolenko V,Sippy T,Yuste R.Quantitative classification of somatostatin-positive neocortical interneurons identifies three interneuron subtypes[J].Front Neural Circuits,2010,4:12.
[12]Nimchinsky EA,Gilissen E,Allman JM,Perl DP,Erwin JM,Hof PR.A neuronal morphologic type unique to humans and great apes[J].Proc Natl Acad Sci USA,1999,96(9):5268-5273.
[13]Allman JM,Watson KK,Tetreault NA,Hakeem AY.Intuition and autism:a possible role for Von Economo neurons[J].Trends Cogn Sci,2005,9(8):367-373.
[14 ]Krause M,Theiss C,Brüne M.Ultrastructural alterations of Von Economo neurons in the anterior cingulate cortexin schizophrenia [J].AnatRec(Hoboken),2017,300(11):2017-2024.
[15]Seeley WW,Carlin DA,Allman JM,Macedo MN,Bush C,Miller BL,et al.Early frontotemporal dementia targets neurons unique to apes and humans[J].Ann Neurol,2006,60(6):660-667.
[16]Wang B,Yin L,Zou X,Ye M,Liu Y,He T,et al.A subtype of inhibitory interneuron with intrinsic persistent activity in human and monkey neocortex[J].Cell Rep,2015,10(9):1450-1458.
[17 ]Bean BP.The action potential in mammalian central neurons[J].Nat Rev Neurosci,2007,8(6):451-465.
[18 ]Alle H,Geiger JR.Combined analog and action potential coding in hippocampal mossy fibers[J].Science,2006,311(5765):1290-1293.
[19]Shu Y,Hasenstaub A,Duque A,Yu Y,McCormick DA.Modulation of intracortical synaptic potentials by presynaptic somatic membrane potential[J].Nature,2006,441(7094):761-765.
[20]Kole MH,Ilschner SU,Kampa BM,Williams SR,Ruben PC,Stuart GJ.Action potential generation requires a high sodium channel density in the axon initial segment[J].Nat Neurosci,2008,11(2):178-186.
[21]Palmer LM,Stuart GJ.Site of action potential initiation in layer 5 pyramidal neurons[J].J Neurosci,2006,26(6):1854-1863.
[22 ]Schneggenburger R,Meyer AC,Neher E.Released fraction and total size of a pool of immediately available transmitter quanta at a calyx synapse[J].Neuron,1999,23(2):399-409.
[23 ]Geiger JR,Jonas P.Dynamic control of presynaptic Ca2+inflow by fast-inactivating K+channels in hippocampal mossy fiber boutons[J].Neuron,2000,28(3):927-939.
[24 ]Hu W,Shu Y.Axonal bleb recording[J].Neurosci Bull,2012,28(4):342-350.
[25 ]Shu Y,Duque A,Yu Y,Haider B,McCormick DA.Properties of action-potential initiation in neocortical pyramidal cells:evidence from whole cell axon recordings[J].J Neurophysiol,2007,97(1):746-760.
[26 ]Shu Y,Yu Y,Yang J,McCormick DA.Selective control of cortical axonal spikes by a slowly inactivating K+current[J].Proc Natl Acad Sci USA,2007,104(27):11453-11458.
[27]Hu W,Tian C,Li T,Yang M,Hou H,Shu Y.Distinct contributions of Nav1.6 and Nav1.2 in action potential initiation and backpropagation[J].Nat Neurosci,2009,12(8):996-1002.
[28 ]Tian C,Wang K,Ke W,Guo H,Shu Y.Molecular identity of axonal sodium channels in human cortical pyramidal cells[J].Front Cell Neurosci,2014,8:297.
[29 ]Cruz DA,Eggan SM,Azmitia EC,Lewis DA.Serotonin1A receptors at the axon initial segment of prefrontal pyramidal neurons in schizophrenia[J].Am J Psychiatry,2004,161(4):739-742.
[30 ]Yin L,Rasch MJ,He Q,Wu S,Dou F,Shu Y.Selective modulation of axonal sodium channel subtypes by 5-HT1A receptor in cortical pyramidal neuron[J].Cereb Cortex,2017,27(1):509-521.
[31]Yang J,Ye M,Tian C,Yang M,Wang Y,Shu Y.Dopaminergicmodulationofaxonalpotassium channels and action potential waveform in pyramidal neurons of prefrontal cortex[J].J Physiol,2013,591(13):3233-3251.
[32]Xia Y,Zhao Y,Yang M,Zeng S,Shu Y.Regulation of action potential waveforms by axonal GABAA receptors in cortical pyramidal neurons[J].PLoS One,2014,9(6):e100968.
[33]Knopp A,Frahm C,Fidzinski P,Witte OW,Behr J.Loss of GABAergic neurons in the subiculum and its functional implications in temporal lobe epilepsy[J].Brain,2008,131(Pt 6):1516-1527.
[34]Li T,Tian C,Scalmani P,Frassoni C,Mantegazza M,Wang Y,et al.Action potential initiation in neocortical inhibitory interneurons[J].PLoS Biol,2014,12(9):e1001944.
[35]Mozrzymas JW.Dynamism of GABAAreceptor activation shapes the"personality"of inhibitory synapses[J].Neuropharmacology,2004,47(7):945-960.
[36 ]Kaeser PS,Regehr WG.Molecular mechanisms for synchronous,asynchronous,and spontaneous neurotransmitter release[J].Annu Rev Physiol,2014,76:333-363.
[37]Südhof TC.Neurotransmitter release:the last millisecond in the life of a synaptic vesicle[J].Neuron,2013,80(3):675-690.
[38 ]Südhof TC.Calcium control of neurotransmitter release [J].ColdSpringHarbPerspectBiol,2012,4(1):a011353.
[39 ]Koester HJ,Johnston D.Target cell-dependent normalization of transmitter release at neocortical synapses[J].Science,2005,308(5723):863-866.
[40 ]Silberberg G.Polysynaptic subcircuits in the neocortex:spatial and temporal diversity[J].Curr Opin Neurobiol,2008,18(3):332-337.
[41 ]Jackman SL,Regehr WG.The mechanisms and functions ofsynaptic facilitation [J].Neuron,2017,94(3):447-464.
[42]Rozov A,Burnashev N,Sakmann B,Neher E.Transmitter release modulation by intracellular Ca2+buffers in facilitating and depressing nerve terminals of pyramidal cells in layer 2/3 of the rat neocortex indicates a target cell-specific difference in presynaptic calcium dynamics[J].J Physiol,2001,531(Pt 3):807-826.
[43 ]Sylwestrak EL,Ghosh A.Elfn1 regulates targetspecific release probability at CA1-interneuron synapses[J].Science,2012,338(6106):536-540.
[44 ]Somogyi P,Dalezios Y,Luján R,Roberts JD,Watanabe M,Shigemoto R.High level of mGluR7 in the presynaptic active zones of select populations of GABAergic terminals innervating interneurons in the rat hippocampus[J].Eur J Neurosci,2003,17(12):2503-2520.
[45]Tomioka NH,Yasuda H,Miyamoto H,Hatayama M,Morimura N,Matsumoto Y,et al.Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures[J].Nat Commun,2014,5:4501.
[46 ]Jackman SL,Turecek J,Belinsky JE,Regehr WG.The calcium sensor synaptotagmin 7 is required for synaptic facilitation[J].Nature,2016,529(7584):88-91.
[47]Hefft S,Jonas P.Asynchronous GABA release generates long-lasting inhibition at a hippocampal interneuron-principal neuron synapse[J].Nat Neurosci,2005,8(10):1319-1328.
[48 ]Manseau F,Marinelli S,Méndez P,Schwaller B,Prince DA,Huguenard JR,et al.Desynchronization of neocortical networks by asynchronous release of GABA at autaptic and synaptic contacts from fast-spiking interneurons[J].PLoS Biol,2010,8(9):e1000492.
[49 ]Jiang M,Zhu J,Liu YP,Yang MP,Tian CP,Jiang S,et al.Enhancement of asynchronous release from fast-spiking interneuron in human and rat epileptic neocortex[J].PLoS Biol,2012,10(5):e1001324.
[50]Jiang M,Yang M,Yin L,Zhang X,Shu Y.Developmental reduction of asynchronous GABA release from neocortical fast-spiking neurons[J].Cereb Cortex,2015,25(1):258-270.
[51 ]Freund TF,Katona I.Perisomatic inhibition[J].Neuron,2007,56(1):33-42.
[52]Wen H,Linhoff MW,McGinley MJ,Li GL,Corson GM,Mandel G,et al.Distinct roles for two synaptotagmin isoforms in synchronous and asynchronous transmitter release at zebrafish neuromuscular junction[J].Proc Natl Acad Sci USA,2010,107(31):13906-13911.
[53 ]Maximov A,Lao Y,Li H,Chen X,Rizo J,S?rensen JB,et al.Genetic analysis of synaptotagmin-7 function in synaptic vesicle exocytosis[J].Proc Natl Acad Sci USA,2008,105(10):3986-3991.
[54 ]Bacaj T,Wu D,Yang X,Morishita W,Zhou P,Xu W,et al.Synaptotagmin-1 and synaptotagmin-7 trigger synchronous and asynchronous phases of neurotransmitter release[J].Neuron,2013,80(4):947-959.
[55 ]Luo F,Südhof TC.Synaptotagmin-7-mediated asynchronous release boosts high-fidelity synchronous transmission at a central synapse[J].Neuron,2017,94(4):826-839.e3.
[56 ]Reinhold K,Lien AD,Scanziani M.Distinct recurrent versus afferent dynamics in cortical visual processing[J].Nat Neurosci,2015,18(12):1789-1797.
[57 ]Zhang S,Xu M,Kamigaki T,Hoang Do JP,Chang WC,Jenvay S,et al.Selective attention.Long-range and local circuits for top-down modulation of visual cortex processing[J].Science,2014,345(6197):660-665.
[58]Pfeffer CK,Xue M,He M,Huang ZJ,Scanziani M.Inhibition of inhibition in visual cortex:the logic of connections between molecularly distinct interneurons[J].Nat Neurosci,2013,16(8):1068-1076.
[59 ]Silberberg G,Markram H.Disynaptic inhibition between neocortical pyramidal cells mediated by Martinotti cells[J].Neuron,2007,53(5):735-746.
[60]Zhu J,Jiang M,Yang M,Hou H,Shu Y.Membrane potential-dependent modulation of recurrent inhibition in rat neocortex[J].PLoS Biol,2011,9(3):e1001032.
[61 ]Bartos M,Vida I,Jonas P.Synaptic mechanisms of synchronized gamma oscillations in inhibitory interneuron networks [J].NatRev Neurosci,2007,8(1):45-56.
[62 ]Pouille F,Scanziani M.Routing of spike series by dynamic circuits in the hippocampus[J].Nature,2004,429(6993):717-723.
[63]Nelson SB,Valakh V.Excitatory/inhibitory balance and circuit homeostasis in autism spectrum disorders[J].Neuron,2015,87(4):684-698.
[64]Dehghani N,Peyrache A,Telenczuk B,Le Van Quyen M,Halgren E,Cash SS,et al.Dynamic balance of excitation and inhibition in human and monkey neocortex[J].Sci Rep,2016,6:23176.
[65 ]Hu H,Gan J,Jonas P.Interneurons.Fast-spiking,parvalbumin+GABAergic interneurons:from cellular design to microcircuit function[J].Science,2014,345(6196):1255263.
[66 ]Adesnik H,Bruns W,Taniguchi H,Huang ZJ,Scanziani M.A neural circuit for spatial summation in visual cortex[J].Nature,2012,490(7419):226-231.
[67]Xue M,Atallah BV,Scanziani M.Equalizing excitation-inhibition ratios across visual cortical neurons[J].Nature,2014,511(7511):596-600.
[68 ]Kapfer C,Glickfeld LL,Atallah BV,Scanziani M.Supralinear increase of recurrent inhibition during sparse activity in the somatosensory cortex[J].Nat Neurosci,2007,10(6):743-753.
[69 ]Fino E,Yuste R.Dense inhibitory connectivity in neocortex[J].Neuron,2011,69(6):1188-1203.
[70 ]Rubin DB, Van Hooser SD, Miller KD.The stabilized supralinear network:a unifying circuit motif underlying multi-input integration in sensory cortex[J].Neuron,2015,85(2):402-417.
[71 ]Litwin-Kumar A,Rosenbaum R,Doiron B.Inhibitory stabilization and visual coding in cortical circuits with multiple interneuron subtypes[J].J Neurophysiol,2016,115(3):1399-1409.
[72 ]Adesnik H.Synaptic mechanisms of feature coding in the visual cortex of awake mice[J].Neuron,2017,95(5):1147-1159.e4.
[73 ]Kato HK,Asinof SK,Isaacson JS.Network-level control of frequency tuning in auditory cortex[J].Neuron,2017,95(2):412-423.e4.
[74 ]Urban-Ciecko J,Barth AL.Somatostatin-expressing neurons in cortical networks[J].Nat Rev Neurosci,2016,17(7):401-409.
[75 ]Neske GT,Connors BW.Distinct roles of SOM and VIP interneurons during cortical up states[J].Front Neural Circuits,2016,10:52.
[76 ]Gentet LJ,Kremer Y,Taniguchi H,Huang ZJ,Staiger JF,Petersen CC.Unique functional properties of somatostatin-expressing GABAergic neurons in mouse barrel cortex[J].Nat Neurosci,2012,15(4):607-612.
[77 ]Royer S,Zemelman BV,Losonczy A,Kim J,Chance F,Magee JC,et al.Control of timing,rate and bursts of hippocampal place cells by dendritic and somatic inhibition[J].Nat Neurosci,2012,15(5):769-775.
[78 ]Silberberg G,Grillner S,LeBeau FE,Maex R,Markram H.Synaptic pathways in neural microcircuits[J].Trends Neurosci,2005,28(10):541-551.
[79 ]Shu Y, Hasenstaub A, Badoual M, Bal T,McCormick DA.Barrages of synaptic activity control the gain and sensitivity of cortical neurons[J].J Neurosci,2003,23(32):10388-10401.
[80 ]Haider B,Duque A,Hasenstaub AR,McCormick DA.Neocortical network activity in vivo is generated through a dynamic balance of excitation and inhibition[J].J Neurosci,2006,26(17):4535-4545.
[81 ]Schelter B,Timmer J,Schulze-Bonhage A.Seizure Prediction in Epilepsy:from Basic Mechanisms to Clinical Applications[M].New Jersey:John Wiley&Sons,2008.
[82 ]Klausberger T,Magill PJ,Márton LF,Roberts JD,Cobden PM,Buzsáki G,et al.Brain-state-and cell-type-specific firing of hippocampal interneurons in vivo[J].Nature,2003,421(6925):844-848.
[83 ]Shu Y,Hasenstaub A,McCormick DA.Turning on and off recurrent balanced cortical activity[J].Nature,2003,423(6937):288-293.
[84 ]Hasenstaub A,Shu Y,Haider B,Kraushaar U,Duque A,McCormick DA.Inhibitory postsynaptic potentials carry synchronized frequency information in active cortical networks[J].Neuron,2005,47(3):423-435.
[85 ]Lo¨rincz ML,Gunner D,Bao Y,Connelly WM,Isaac JT,Hughes SW,et al.A distinct class of slow(~0.2-2 Hz)intrinsically bursting layer 5 pyramidal neurons determines UP/DOWN state dynamics in the neocortex[J].J Neurosci,2015,35(14):5442-5458.
[86 ]McCormick DA,Shu Y,Hasenstaub A,Sanchez-Vives M,Badoual M,Bal T.Persistent cortical activity:mechanisms of generation and effects on neuronal excitability[J].Cereb Cortex,2003,13(11):1219-1231.
[87 ]Lerner TN,Ye L,Deisseroth K.Communication in neural circuits:tools,opportunities,and challenges[J].Cell,2016,164(6):1136-1150.

