骨髓基質(zhì)細(xì)胞自體移植兔坐骨神經(jīng)的研究
何驍+鄧?yán)蚶?/p>

[摘要]目的 觀察兔自體骨髓基質(zhì)細(xì)胞作為種子細(xì)胞移植修復(fù)兔坐骨神經(jīng)長(zhǎng)距離缺損的能力及其安全性,探討骨髓基質(zhì)細(xì)胞在坐骨神經(jīng)損傷模型內(nèi)分化為神經(jīng)元樣細(xì)胞的可行性。方法 兔骨髓基質(zhì)細(xì)胞分離培養(yǎng)、誘導(dǎo)、鑒定以及傳代后注入坐骨神經(jīng)損傷的兔模型中,并于細(xì)胞移植后第1、2、4、8及16周分別行透射電鏡及免疫組化等方法觀察。結(jié)果 移植側(cè)與對(duì)照側(cè)神經(jīng)纖維均有不同程度再生,但對(duì)照側(cè)較移植側(cè)神經(jīng)纖維數(shù)量明顯減少(t=175.88,P<0.01)。結(jié)論 BMCSs移植能促進(jìn)兔坐骨神經(jīng)功能障礙的恢復(fù),并與本身相容性良好,為細(xì)胞替代療法提供了樂觀的應(yīng)用前景。
[關(guān)鍵詞]骨髓基質(zhì)細(xì)胞;細(xì)胞培養(yǎng);自體移植;坐骨神經(jīng)
[中圖分類號(hào)] R-332 [文獻(xiàn)標(biāo)識(shí)碼] A [文章編號(hào)] 1674-4721(2017)01(c)-0013-04
[Abstract]Objective To observe the ability and safety of autologous bone marrow stromal cells (BMSCs) as seed cells in repairing long distance defect of sciatic nerve in rabbits,and to explore the feasibility of BMSCs differentiating into neuron-like cells in sciatic nerve injury model.Methods BMSCs were injected into rabbit model of sciatic nerve injury,after isolated,cultured,induced,and identificated.Then electron microscope and immunohistochemisty were performed at the 1st,2nd,4th,8th and 16th weeks after cell transplantation.Results After transplantation,there were different degrees of regenerated nerve fibers between transplanted side and controlled side,but the number of nerve fibers was significantly reduced in control group,compared with the transplantation group (t=175.88,P<0.01).Conclusion BMCSs transplantation has a well compatibility,which can promote the recovery of rabbit sciatic nerve dysfunction and provide an optimistic application prospect for cell replacement therapy.
[Key words]Bone marrow stromal cell;Cell culture;Autotransplantation;Sciatic nerve
長(zhǎng)距離周圍神經(jīng)缺損的傳統(tǒng)治療方法是自體神經(jīng)移植,但此治療方式存在嚴(yán)重缺陷,如為獲取供體而導(dǎo)致的其他功能損害。目前干細(xì)胞的研究已逐漸深入,關(guān)于骨髓基質(zhì)細(xì)胞(bone marrow stormal cells,BMSCs)自體移植修復(fù)長(zhǎng)距離神經(jīng)系統(tǒng)損傷的研究也越來越多,并逐漸成為熱點(diǎn)[1]。作為自身組織,骨髓具有來源豐富、取材容易、高分裂增殖性、多組織分化潛能及不受免疫排斥等優(yōu)點(diǎn),這為細(xì)胞移植療法提供了樂觀的應(yīng)用前景[2]。
本研究旨在識(shí)別、跟蹤移植后BMSCs的存活狀態(tài)及與宿主神經(jīng)組織整合情況,最終為其進(jìn)一步行體內(nèi)自體移植治療的實(shí)驗(yàn)應(yīng)用奠定基礎(chǔ)。
1材料與方法
1.1材料
選取體重為1.5~2.0 kg、約3月齡的新西蘭兔(New Zealand Rabite)10只,均由南華大學(xué)動(dòng)物中心提供。
1.2試劑
白血病抑制因子(leukemia inhibitory factor,LIF)、兔神經(jīng)巢蛋白(nestin)抗體由Santa Cruz公司提供;FITC標(biāo)記山羊抗小鼠IgG、生物素標(biāo)記山羊抗小鼠IgG試劑盒均由Chemicon公司提供;堿性成纖維細(xì)胞生長(zhǎng)因子(basic fibroblast growth factor,b-FGF)由R&D公司提供;PKH67染料試劑盒、3,3-二氨基苯聯(lián)胺試劑盒(3,3-diaminobenzidinetetrahydrochloride,DAB)、細(xì)胞表皮因子(epidermal growth factor,EGF)、淋巴細(xì)胞分離液(percoll)、鼠抗單克隆神經(jīng)元特異性烯醇化酶(NSE)抗體均由Sigma公司提供;神經(jīng)干細(xì)胞培養(yǎng)基來自于南方醫(yī)科大學(xué)實(shí)驗(yàn)室,專利號(hào)為02134314.4。
1.3主要器材
組織剪、彎鉗、有齒鑷、血管鉗、顯微器械1套、縫針、無菌縫線、注射器、無菌操作臺(tái)等。
1.4實(shí)驗(yàn)步驟
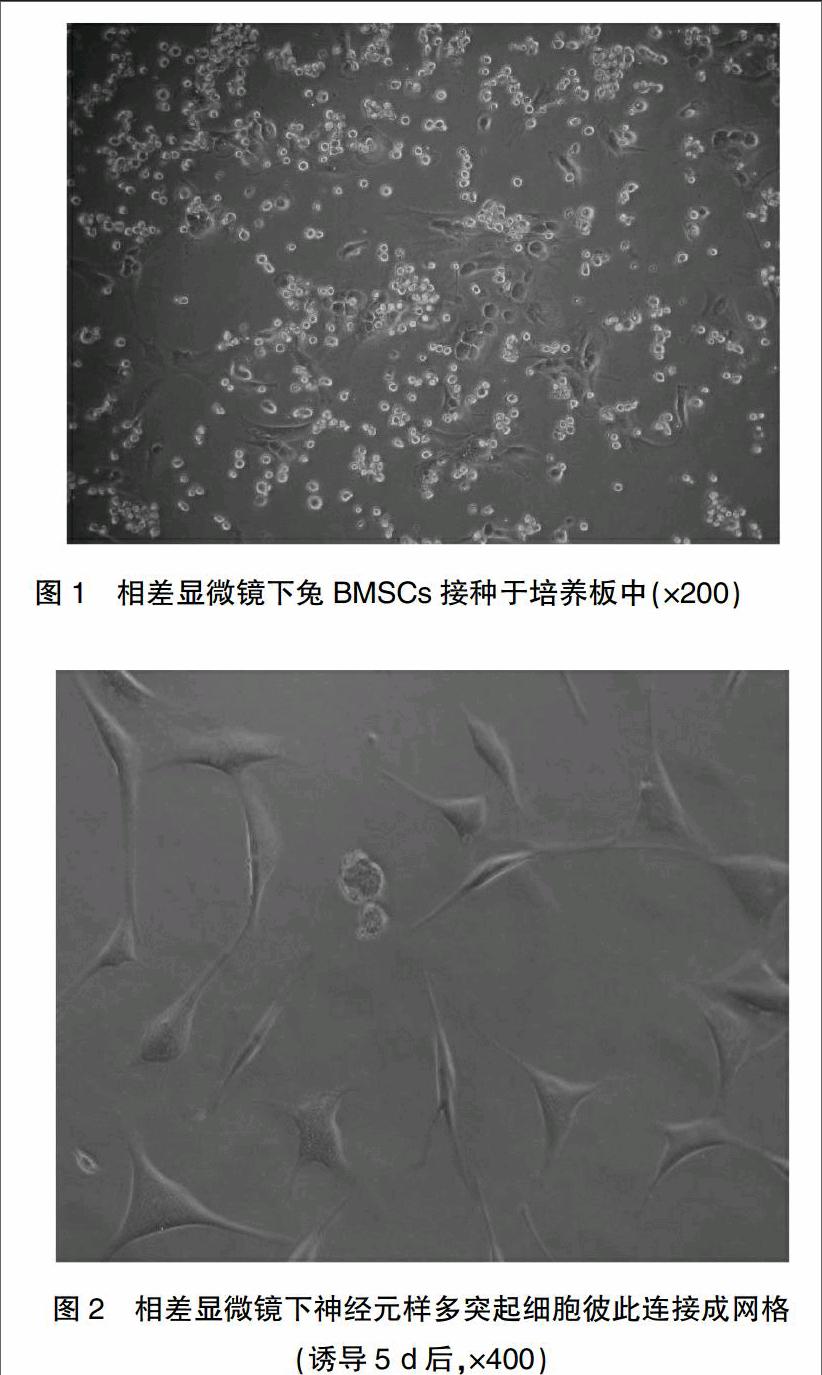
1.4.1骨髓采集、BMSC的分離、擴(kuò)增及體外誘導(dǎo) 于兔耳緣靜脈將10%水合氯醛注入致其麻醉后,在無菌操作臺(tái)上抽取股骨遠(yuǎn)端骨髓約4 ml。所獲取的骨髓用Hank液稀釋,細(xì)胞懸液與淋巴細(xì)胞分離液按1∶2比例混合,2500 r/min梯度離心15 min。將含核細(xì)胞的界面層吸出,加入1~2 ml雙蒸水吹打,加入干細(xì)胞培養(yǎng)基,800 r/min離心約5 min,去除上清后加相同培養(yǎng)基,并加10%胎牛血清接種于培養(yǎng)板和培養(yǎng)瓶中(圖1)。收集第三代細(xì)胞胞懸液加入本實(shí)驗(yàn)室配制的神經(jīng)干細(xì)胞培養(yǎng)液及EGF(10 ng/ml)+LIF(10 ng/ml)+b-FGF(10 ng/ml)+FBS(1%終濃度),接種于24孔培養(yǎng)板和培養(yǎng)瓶中,培養(yǎng)5 d(圖2)。
1.4.2兔坐骨神經(jīng)損傷模型的制作 兔稱重從耳緣靜脈注入10%水合氯醛致麻醉后,于雙側(cè)髖部消毒,置于無菌臺(tái)并鋪手術(shù)單。行髖關(guān)節(jié)后入路,依次切開皮膚、皮下、淺深筋膜,仔細(xì)止血,彎鉗鈍性分離臀大肌,顯露坐骨神經(jīng)分叉處。在分叉上方切開神經(jīng)外膜,切除約8 mm長(zhǎng)神經(jīng)。用微量注射器吸取神經(jīng)干細(xì)胞并注入神經(jīng)缺損區(qū)內(nèi),縫合神經(jīng)外膜及肌膜以加強(qiáng)對(duì)移植干細(xì)胞的包裹力。對(duì)照側(cè)注射DMEM培養(yǎng)液。移植側(cè)及對(duì)照側(cè)隨機(jī)選擇,最后用明膠海綿包裹,在皮膚外標(biāo)記實(shí)驗(yàn)組移植側(cè)。將兔放入清潔籠具,預(yù)防感染,觀察生命體征。
1.4.3免疫組化染色 取細(xì)胞移植手術(shù)成功后1、2、4、8、16周的實(shí)驗(yàn)新西蘭兔各2只,采用1%戊巴比妥鈉以100 mg/kg注射入腹腔后麻醉。消毒后打開胸腔,暴露心臟,導(dǎo)管插入左心室,生理鹽水快速?zèng)_洗,將4%多聚甲醛由插管處(pH7.4)灌注500 ml固定,由原切口切開皮膚皮下并暴露、剝離含移植干細(xì)胞段的坐骨神經(jīng)。
將剝離的兔坐骨神經(jīng)依次移入10%~30%蔗糖(0.1 mol/L PB配制)溶液梯度浸泡,標(biāo)本下沉后進(jìn)行冰凍切片,片厚12 μm,貼于載玻片上。切片先進(jìn)行常規(guī)普魯士藍(lán)染色,從中選擇細(xì)胞形態(tài)較好的切片再進(jìn)行抗S-100免疫組織化學(xué)法染色及DAB-H2O2棕色法染色。
1.4.4透射電鏡樣品制備 將移植端坐骨神經(jīng)切片,片厚50 μm,顯微鏡觀察后選取切片,用1%四氧化鋨固定30 min,50%~95%梯度乙醇脫水,環(huán)氧丙烷置換,包埋及滲透,純包埋劑(Epon 812)浸透過夜,聚合(37℃ 12 h、45℃ 12 h、60℃ 12 h)。對(duì)含移植細(xì)胞的紋狀體區(qū)域在體視顯微鏡下進(jìn)行超薄切片,片厚50 nm左右,由2%醋酸雙氧鈾(10 min)和枸櫞酸鉛(3 min)雙重染色后在電子顯微鏡下觀察,并進(jìn)行拍照記錄。
1.5統(tǒng)計(jì)學(xué)處理
采用SPSS 15.0統(tǒng)計(jì)軟件處理對(duì)照側(cè)、移植側(cè)各組織神經(jīng)纖維數(shù)量(各取6張切片,每張切片選8點(diǎn)統(tǒng)計(jì)纖維條數(shù)),計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差(x±s)表示,統(tǒng)計(jì)方法為配對(duì)t檢驗(yàn),α水平為0.05。
2觀察指標(biāo)及結(jié)果
2.1染色觀察
通過HE染色對(duì)組織進(jìn)行觀察,各只兔移植側(cè)與對(duì)照側(cè)神經(jīng)纖維均有不同程度再生,但對(duì)照側(cè)神經(jīng)纖維稀疏,較移植側(cè)神經(jīng)纖維數(shù)量明顯減少,切片見明顯的神經(jīng)不連續(xù),基質(zhì)黏液變較移植側(cè)改變明顯(圖3)。移植側(cè)神經(jīng)纖維較對(duì)照側(cè)明顯增多,且排列較整齊。術(shù)后4周和8周,移植側(cè)形態(tài)上無顯著差別;移植后16周神經(jīng)纖維有序排列,S-100免疫組化染色可見施萬細(xì)胞核均勻分散在神經(jīng)纖維及神經(jīng)束之間(圖4)。移植治療側(cè)神經(jīng)纖維數(shù)量為2126.63±23.76,高于對(duì)照側(cè)的914.13±19.65,差異有統(tǒng)計(jì)學(xué)意義(t=175.88,P<0.01)。
2.2透射電鏡檢查
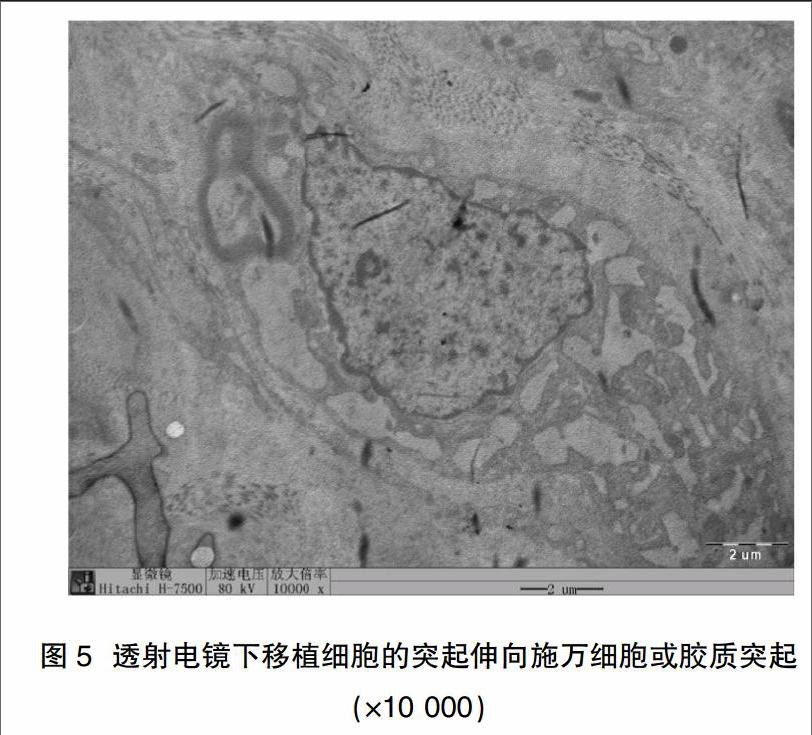
透射電鏡下觀察,移植后8周內(nèi)在宿主坐骨神經(jīng)缺損處神經(jīng)樣細(xì)胞與移植細(xì)胞之間未觀察到有明顯突觸樣結(jié)構(gòu),但移植16周標(biāo)本可見移植細(xì)胞的突起伸向宿主施萬細(xì)胞突起或膠質(zhì)突起,兩者之間可見少量突觸形成(圖5)。
3討論
在臨床治療中,周圍神經(jīng)損傷是一類殘疾率高、治療困難的疾病[3],臨床上再生修復(fù)效果常不理想[4-5],這不僅給社會(huì)帶來沉重的負(fù)擔(dān),同樣給家庭帶來了巨大痛苦。作為一種治療神經(jīng)系統(tǒng)損傷的方法,細(xì)胞移植開辟了一條的新途徑[1,6-7]。2007年1月,Hu等[8]提取恒河猴自體BMSCs移植在尺神經(jīng)缺損處,并與自體神經(jīng)移植進(jìn)行比較,結(jié)果顯示,BMSCs移植與自體神經(jīng)移植術(shù)后神經(jīng)恢復(fù)效果相當(dāng),這為BMSCs用來修復(fù)動(dòng)物周圍神經(jīng)損傷提供了有力的證據(jù)。
BMSCs是成體干細(xì)胞,與其他干細(xì)胞相比有顯著優(yōu)越性[9]。由于BMSCs具有來源廣泛、強(qiáng)大的再生及分化潛能,且移植后體內(nèi)排斥反應(yīng)弱,并可以在誘導(dǎo)及相應(yīng)環(huán)境下分化出神經(jīng)元和神經(jīng)膠質(zhì)細(xì)胞等優(yōu)點(diǎn)[10-13],因此,BMSCs移植治療神經(jīng)損傷一直是人們探索的目標(biāo)。2006年6月,Hou等[14]先在體外將BMSCs誘導(dǎo)分化,然后將分化后的MSC插入導(dǎo)管中來橋接大鼠坐骨神經(jīng)損傷,手術(shù)后3個(gè)月顯示,移植組橋接管內(nèi)MSC在組織學(xué)上具有較完整的再生神經(jīng)結(jié)構(gòu),復(fù)合肌動(dòng)作電位(CMAP)的波幅、再生神經(jīng)組織百分比、有髓神經(jīng)纖維密度、軸突平均直徑、髓鞘厚度等參數(shù)均高于未移植BMSCs的對(duì)照組,并在神經(jīng)移植物遠(yuǎn)端觀察到大量S100和NF陽性的神經(jīng)纖維。2013年9月,Salomone等[15]將誘導(dǎo)、培養(yǎng)的BMSCs移植到面神經(jīng)損傷的大鼠實(shí)驗(yàn)?zāi)P停谟^察12周后進(jìn)行CMAP測(cè)量及組織學(xué)評(píng)價(jià),結(jié)果顯示,移植組再生神經(jīng)的傳導(dǎo)速度有了明顯改善,CMAP波幅有了明顯升高;顯微鏡下觀察發(fā)現(xiàn)大量的再生軸突。經(jīng)過以上實(shí)驗(yàn)研究發(fā)現(xiàn),BMSCs與周圍神經(jīng)有著及密切的關(guān)系[16-18]。
通過本實(shí)驗(yàn)觀察到:①分離的BMSCs在體外培養(yǎng)3~4 d后能夠迅速貼壁生長(zhǎng),貼壁后細(xì)胞形態(tài)為有多個(gè)突觸的梭形或多角形,隨后細(xì)胞開始分裂增殖,表現(xiàn)出克隆生長(zhǎng)的特性。通過傳代培養(yǎng)可去除非黏附細(xì)胞,這些細(xì)胞有可持續(xù)培養(yǎng)增殖的能力,提示BMSCs具有很強(qiáng)的再生能力。②在持續(xù)誘導(dǎo)、培養(yǎng)中發(fā)現(xiàn),分離、誘導(dǎo)的BMSCs可形成細(xì)胞克隆團(tuán),并逐漸出現(xiàn)出芽現(xiàn)象,由此形成細(xì)胞胞突,并彼此發(fā)生聯(lián)系,最終突起伸長(zhǎng)連接成網(wǎng)狀結(jié)構(gòu),呈典型的神經(jīng)細(xì)胞形態(tài)。該結(jié)果提示BMSCs具有分化為組織細(xì)胞的潛能。③2014年,Mohammadi等[19]取大鼠的BMSCs進(jìn)行體外培養(yǎng)、擴(kuò)增并標(biāo)記,移植入坐骨神經(jīng)損傷的大鼠模型中,對(duì)照組移植磷酸緩沖鹽水,手術(shù)后4、8、12周觀察大鼠行為及形態(tài)組織學(xué),結(jié)果顯示,再生纖維的形態(tài)定量分析顯移植側(cè)的纖維數(shù)量和直徑均顯著高于對(duì)照組。本實(shí)驗(yàn)也觀察到自體骨髓源性神經(jīng)干細(xì)胞移植兔坐骨神經(jīng)缺損有利于神經(jīng)纖維的修復(fù),對(duì)照組比自體移植組神經(jīng)纖維生長(zhǎng)有明顯差異,自體移植組明顯優(yōu)于對(duì)照組。
綜上所述,兔骨髓基質(zhì)源神經(jīng)干細(xì)胞移植后,可在自體坐骨神經(jīng)內(nèi)存活、遷移、分化,且無明顯排斥反應(yīng)。
[參考文獻(xiàn)]
[1]Kim HJ,Lee JH,Kim SH,et al.Therapeutic effects of human mesenchymal stem cells on traumatic brain injury in rats:secretion of neurotrophic afators and inhibition of apoptosis[J].J Neurotrauma,2010,27(l):131-138.
[2]石更強(qiáng),胡益.周圍神經(jīng)種子細(xì)胞的研究進(jìn)展[J].生物醫(yī)學(xué)工程學(xué)雜志,2015,32(2):470-474.
[3]Torres RY,Miranda GE.Epidemiology of traumatic peripheral nerve injuries evaluated by electrodiagnostic studies in a tertiary care hospital clinic[J].Bol Asoc Med P R,2015, 107(3):79-84.
[4]姚東東,張潔元,劉彬.周圍神經(jīng)損傷修復(fù)微環(huán)境的研究進(jìn)展[J].中國修復(fù)重建外科雜志,2015,29(9):1167-1170.
[5]H?觟ke A.Mechanisms of disease:what factors limit the success of peripheral nerve regeneration in humans[J].Nat Clin Pract Neurol,2006,2(8):448-454.
[6]Wakao S,Matsuse D,Dezawa M.Mesenchymal stem cells as a source of Schwann cells:their anticipated use in peripheral nerve regeneration[J].Cell Tissues Organs,2014,200(1):31-41.
[7]Mohammadi R,Mahmoodzadeh S.Combination of local transplantation of in vitro bone-marrow stromal cells and pulsed electromagnetic fields accelerate functional recovery of transected sciatic nerve regeneration:a novel approach in transected nerve repair[J].Curr Neurovasc Res,2015,12(3):222-231.
[8]Hu J,Zhu QT,Liu XL,et al.Repair of extended peripheral nerve lesions in rhesus monkeys using acellular allogenic nerve grafts implanted with autologous mesenchymal stem cells[J].Exp Neurol,2007,204(2):658-666.
[9]Gong Y,Wang H,Xia H.Stable transfection into rat bone marrow mesenchymal stem cells by lentivirus-mediated NT-3[J].Mol Med Rep,2015,11(1):367-373.
[10]Freedman MS,Bar-Or A,Atkins HL,et al.The therapeutic potential of mesenchymal stem cell transplantation as a treatment for multiple sclerosis:consensus report of the International MSCT Study Group[J].Mult Scler,2010,16(4):503-510.
[11]方波,馬虹.骨髓基質(zhì)干細(xì)胞移植治療脊髓損傷機(jī)制的研究進(jìn)展[J].中國康復(fù)醫(yī)學(xué)雜志,2011,26(10):985-989.
[12]Chopp M,Li Y.Treatment of neural injury with marrow stromal cells[J].Lancet Neurol,2002,1(2):92-100.
[13]]Totey S,Totey S,Pal R,et al.Adult stem cells:a clinical update[J].Stem Cells,2009,4(2):105-121.
[14]Hou SY,Zhang HY,Quan DP,et al.Tissue-engineered peripheral nerve grafting by diffentiated bone marrow stromal cells[J].Neuroscience,2006,140(1):101-110.
[15]Salomone R,Bento RF,Costa HJ.Bone marrow stem cells in facial nerve regeneration from isolated stumps[J].Muscle Nerve,2013,48(3):423-429.
[16]Schafer KH,Micci MA,Pasricha PJ.Neural stem cell transplantation in the enteric nervous system:roadmaps and roadblocks[J].Neurogastroenterol Motil,2009,21(2):103-112.
[17]Osakada F,Hirami Y,Takahashi M.Stem cell biology and cell transplantation therapy in the retina[J].Biotechnol Genet Eng Rev,2010,26:297-334.
[18]Cunullings BJ,Tamaki SJ.Human neural stern cells differentiate and promote locomotor recover in spinal cord-injured mice[J].Proc Natl Acad Sci U S A,2005,102(39):1406-1407.
[19]Mohammadi R,Vahabzadeh B,Amini K.Sciatic nerve regeneration induced by transplantation of in vitro bone marrow stromal cells into an inside-out artery graft in rat[J].Craniomaxillofac Surg,2014,42(7):1389-1396.
(收稿日期:2016-11-01 本文編輯:祁海文)

