淺談高考電化學解題技巧
廖華強
摘 要:電化學是高考考試的重要內容,本文以2016年全國高考電化學試題為例,從拆、寫、裝、算四個角度分析電化學習題的解題方法,旨在找到操作性較強的解題技巧,進而提高學生靈活應用所學知識解決問題能力。
關鍵詞:高考 電化學 解題技巧
中圖分類號:G633.8 文獻標識碼:C 文章編號:1672-1578(2017)03-0109-02
電化學是化學知識在生活中應用比較廣泛的知識點,一直以來都是高考的重點考察內容。學生若能順利解決電化學題目,有利于增加其對化學知識的興趣,增強其學習化學的自信心。但電化學題目題型多樣,涉及范圍較廣,對化學相關知識要求較高,經常是學生們感覺到比較吃力的一類題型。本文以2016年全國高考電化學試題為例,介紹拆、寫、裝、查四個方面的解題方法,進而提高學生靈活應用所學知識解決問題的能力。
1 拆——辨別裝置類型、標注電極種類、分析帶電粒子移動、反應類型
解好電化學的題目,首先要先會拆,接負載的為原電池,接電源的為電解池;一般情況下較活潑金屬當負極,較不活潑電極為正極等,達到“腦中有圖”。例如,帶電粒子在電化學裝置中的移動如下圖所示: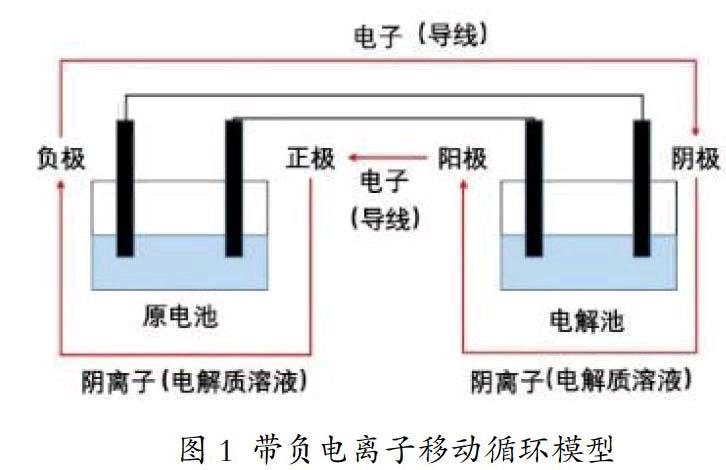
從圖中很容易得出:負極:失去電子,化合價升高,氧化反應;陰極:得到電子,化合價降低,還原反應;陽極:失去電子,化合價升高,氧化反應;正極:得到電子,化合價降低,還原反應。
例1.[2016海南] 某電池以K2FeO4和Zn為電極材料,KOH溶液為電解質溶液。下列說法正確的是( )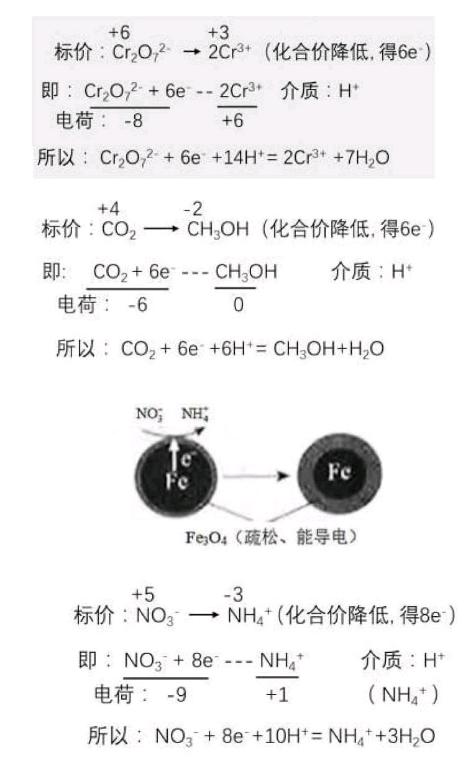
A. Zn為電池的負極
B. 正極反應式為2FeO42-+ 10H++6e-=Fe2O3+5H2O
C. 該電池放電過程中電解質溶液濃度不變
D. 電池工作時向負極遷移
分析:A、D:拆-原電池:活潑金屬Zn-負極,陰離子OH-向負極遷移。
2 寫——寫出電極反應方程式:重點關注電解質環境和電荷守恒
解好電化學的題目,其次要會寫,寫電極反應方程式,常見流程為:化合價的標注→得失電子(注意原子個數)→電荷守恒(用電解質溶液中的離子配)。
例1.[2016江蘇卷](1)鐵炭混合物在水溶液中可形成許多微電池。將含有Cr2O72-的酸性廢水通過鐵炭混合物,在微電池正極上Cr2O72-轉化為Cr3+其電極反應式為____。
分析:
例2.[2016浙江卷] 28.(5)研究證實,CO2也可在酸性水溶液中通過電解生成甲醇,則生成甲醇的反應發生在____極,該電極反應式是_____。
分析:
例3.[2016北京卷](1)Fe還原水體中NO3-的反應原理如右圖所示。①作負極的物質是____。②正極的電極反應式是____。
分析:
3 裝——總反應方程式、電極反應產物判斷、組合裝置等
電化學知識點在考試中又常以總反應的形式出現,要求從整體上把握裝置的電極產物以及原電池充放電過程。解決這類題目時,需要學生認真審題,如交換膜類型,電池充放電過程等。
例1.[2016全國卷2]Mg—AgCl電池是一種以海水為電解質溶液的水激活電池。下列敘述錯誤的是( )
A. 負極反應式為Mg—2e-=Mg2+
B. 正極反應式為Ag++e-=Ag
C. 電池放電時Cl-由正極向負極遷移
D. 負極會發生副反應 Mg+2H2O=Mg(OH)2+H2↑
分析:該電池工作原理應該為2Mg+O2+2H2O=2Mg(OH)2,因此,正極應該是O2+4e-+2H2O=4OH-,Mg為活潑金屬,會與水發生副反應Mg+2H2O=Mg(OH)2+H2↑。
例2.[2016全國卷1]三室式電滲析法處理含Na2SO4廢水的原理如下圖所示,采用惰性電極,ab、cd均為離子交換膜,在直流電場的作用下,兩膜中間的Na+和SO42-可通過離子交換膜,而兩端隔室中離子被阻擋不能進入中間隔室。
下列敘述正確的是( )
A. 通電后中間隔室的SO42-離子向正極遷移,正極區溶液pH增大
B. 該法在處理含Na2SO4廢水時可以得到NaOH和Na2SO4產品
C. 負極反應為2H2O-4e-=O2+4H+,負極區溶液pH降低
D. 當電路中通過1mol電子的電量時,會有0.5mol的O2生成
分析:B.陰極:主要離子為向陰極移動的Na+和電極反應產生的OH-; 陽極:主要離子為向陽極移動的SO42-和電極反應產生的H+ ——反應產物判斷;
例3.[2016全國卷3]鋅——空氣燃料電池可用作電動車動力電源,電池的電解質溶液為KOH溶液,反應為2Zn+O2+4OH–+2H2O = 2Zn(OH)42-。下列說法正確的是( )
A. 充電時,電解質溶液中K+向陽極移動
B. 充電時,電解質溶液中C(OH-)逐漸減小
C. 放電時,負極反應為:Zn+4OH--2e- = Zn(OH)42-
D. 放電時,電路中通過2mol電子,消耗氧氣22.4L(標準狀況)
分析:拆、寫:放電——原電池,Zn:負極Zn+4OH--2e-=
Zn(OH)42-,充電-電解池,K+向陰極移動;
裝:充電方程式與放電剛好相反,所以反應生成OH-,
C(OH-)逐漸增大。
4 算——定量計算電子轉移和反應產物
化學是一門需要計算的學科,計算題在電化學中出現頻率很高,總體上要求學生根據電子轉移的數目來計算反應的產物,需掌握好物質的量的四個基本計算公式。
例1.[2016四川卷]某電動汽車配載一種可充放電的鋰離子電池。放電時電池的總反應為:
Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。下列關于該電池的說法不正確的是( )
A. 放電時,Li+在電解質中由負極向正極遷移
B. 放電時,負極的電極反應式為LixC6-xe-= xLi++C6
C. 充電時,若轉移1mole-,石墨C6電極將增重7xg
D. 充電時,陽極的電極反應式為LiCoO2-xe-=Li1-xCoO2+xLi+
分析:算:石墨C6電極在陰極方程式為:xLi++C6+xe-= LixC6,因此若轉移1mole-,石墨C6電極將增重7g。
總之,電化學題干雖然多樣,若能從拆、寫、裝、算四方面有計劃的訓練,可以較好的提高學生的解題實際操作能力,達到比較好的教學效果。
參考文獻:
[1] 王維臻.電化學認識模型及其在高三原電池復習教學中的應用[J].化學教育,2014.01.
[2] 陳鍵.高中電化學教材編寫順序探析——基于“解題程序”教學順序的視角[J].化學教育,2014.19.

