應用時間分辨法檢測石蠟包埋子宮頸組織p16INK4a蛋白
丁 莉,鄒先進,范婉婷,鄭 杰,陳 瓊
應用時間分辨法檢測石蠟包埋子宮頸組織p16INK4a蛋白
丁 莉1,鄒先進1,范婉婷1,鄭 杰1,陳 瓊2
目的探討時間熒光分辨法(time-resolved fluoroimmunoassay,TRFIA)檢測子宮頸組織中 p16INK4a蛋白的表達。方法選
子宮頸組織;p16INK4a;免疫組織化學;時間熒光分辨法
p16INK4a基因在乳腺癌、胰腺癌、結腸癌和惡性黑色素瘤等許多腫瘤中,易出現缺失、突變或表觀沉默,其表達減少并失去生長抑制作用[1]。在子宮頸癌及癌前病變中,人乳頭狀瘤病毒(human papillomavirus,HPV)持續感染并與宿主細胞整合產生E6/7原癌基因蛋白,打斷 pRb-E2F-p16INK4a負反饋通路,導致 p16INK4a功能失活在細胞中蓄積增多。子宮頸癌及子宮頸鱗狀上皮內病變中 p16INK4a表達均升高,免疫組化 EnVision兩步法檢測子宮頸組織、子宮頸脫落細胞中 p16INK4a蛋白,用于輔助診斷子宮頸腫瘤性病變,得到眾多學者的共識[2-5],p16INK4a是具有發展前景的子宮頸癌標志物。時間熒光分辨法(time-resolved fluoroimmunoassay,TRFIA)檢測蛋白表達線性范圍廣、非特異性信號低,其標志物制備簡便、保存時間長、無放射性污染,被臨床廣泛應用。本實驗建立 TRFIA法檢測子宮頸組織中p16INK4a蛋白表達,并與免疫組化 EnVision兩步法進行相關性分析,為p16INK4a蛋白應用于臨床檢測工作提供依據。
1 材料與方法
1.1 標本選取2013年6月 ~2015年6月荊門市第一人民醫院存檔的子宮頸小活檢標本 126例,患者年齡21~75歲,均已婚且無子宮頸手術史。免疫組化染色切片同時切取子宮頸組織薄片收集于 EP管中用于 TRFIA法檢測。
1.2 儀器與試劑免疫組化p16INK4a抗體購自福州邁新公司,子宮頸石蠟包埋組織蛋白提取試劑盒購自上海生工公司,TRFIA檢測 p16INK4a抗體購自 Abnova公司。半自動 VICTOR 1420多標記檢測儀購自 Perkin Elmer公司。
1.3 免疫組化檢測子宮頸組織中 p16INK4a蛋白所有標本均經 10%中性福爾馬林固定,常規石蠟包埋,切片,HE染色。免疫組化采用 EnVision兩步法,3 mm厚切片,EDTA抗原修復液高壓修復,DAB顯色。
1.4 TRFIA檢測子宮頸組織中 p16INK4a蛋白(1)組織蛋白提取:切取 6片 5μm厚石蠟包埋組織置于1.5 mL EP管中,加入1 mL預處理試劑 A,高速渦懸震蕩30 s后室溫靜置 5 min,并顛倒離心管數次。加入100μL預處理試劑B,渦懸震蕩10 s后離心10 000 r/min×2min,移去上下兩層液體。用500 μL雙蒸水清洗脫蠟的組織 2次,加入 100μL提取試劑,渦懸震蕩數秒,置于金屬浴中 100℃處理20 min,然后調節金屬浴至60℃處理2 h,約20 min震蕩1次。4℃離心12 000 r/min×15 min,取上清至潔凈EP管中置于-20℃備用。(2)包被:以多克隆抗體包被進口雷勃板,室溫慢速震蕩 1 h,4℃靜置20 h后以每孔300μL PBS洗板2次并拍干,每孔加入200μL封閉液(PBS配制2%BSA)于37℃靜置2 h,拍干并密封-20℃保存備用。(3)標記:將單克隆抗體加入超濾管中離心 10 000 r/min×10 min,將濃縮后的抗體加入 200μL標記緩沖液(50 mmol/L Tris-HCl,pH 9.0)中離心10 000 r/min×10 min,棄濾液;重復5~6次。將幾次離心后的超濾管取出棄濾液,把離心管濾膜反轉,4 000 r/min×3 min離心收集濾液。再次將濾膜反轉,加入 100μL標記緩沖液靜置 5 min,將濾膜重新反轉,5 000 r/min×2 min離心收集液體。按摩爾比(5∶1)加入Eu-DTTA充分混勻后于室溫震蕩孵育 16~20 h,過凝膠層析柱純化,對標記樣品進行上樣洗脫。待蛋白檢測儀顯示出現蛋白峰時,開始收集樣品(每管1 mL)。取5μL收集樣品,加至空白孔中,每孔加200 μL增強液,室溫緩慢震蕩5 min,測熒光值,收集信號最高的幾管合并,加終濃度為0.1%去金屬離子的 BSA,小量分裝備用。(4)p16INK4a蛋白檢測:稀釋樣品,用生理鹽水將待測樣品1∶100稀釋,按每孔100μL加入稀釋后的樣品,封板于37℃震蕩孵育1 h,每孔300μL洗板4次并拍干。每孔加入100μL銪標記抗體1∶100(分析緩沖液稀釋)并封固于室溫震蕩孵育2 h。洗板 6次并拍干,加入每孔 200 μL增強液,室溫慢速振搖5 min,檢測熒光值。每個樣本設2個重復孔,應用免疫組化檢測 p16INK4a蛋白強陽性的 HSIL樣本為陽性對照、p16INK4a蛋白陰性的未見上皮內病變細胞及惡性細胞、生理鹽水為陰性對照。
1.5 結果判讀子宮頸組織學活檢結果判讀為未見上皮內病變細胞及惡性細胞、低級別鱗狀上皮內病 變 (low-grade squamous intraepithelial lesion,LSIL)、高級別鱗狀上皮內病變(high-grade squamous intraepithelial lesion,HSIL)和子宮頸鱗狀細胞癌(squamous cell carcinoma,SCC)。
免疫組化檢測子宮頸組織 p16INK4a蛋白:細胞核和(或)細胞質內出現棕黃色顆粒為陽性,陽性強度根據陽性細胞占腫瘤細胞比例及染色深淺判斷。按陽性細胞百分比計分:不著色或陽性細胞數 <5%為0分,5%~25%為1分,26%~50%為2分,>50% 為3分;按染色強度計分:黃色為 1分,棕黃色為 2分,棕褐色為3分。兩項指標相乘:0~1分為陰性(-),2~3分為弱陽性(+),4~6分為中陽性(?),>6分為強陽性(?)。
TRFIA檢測子宮頸組織 p16INK4a蛋白:統計學中,當數據處于正態分布時,個體樣本的測量值與平均值之差落在 3倍標準差之內的可信限為 99%。本實驗選取的所有免疫組化結果陰性未見上皮內病變細胞及惡性細胞病例平均熒光值記為 MOD,標準差記為SD,檢測樣本個體熒光值記為ODi,以ODi<MOD+3SD判讀為陰性(-),ODi≥MOD+3SD判讀為陽性(+)。
1.6 統計學處理采用 SPSS 17.0軟件進行統計學分析,χ2檢驗法進行率的比較,以 P<0.05為差異有顯著性。
2 結果
2.1 病理組織學檢查126例活檢樣本中,未見上皮內病變細胞及惡性細胞標本 20例,LSIL標本 24例,HSIL標本53例,SCC標本29例。
2.2 免疫組化檢測子宮頸活檢組織中 p16INK4a蛋白表達應用免疫組化 EnVision兩步法檢測 p16INK4a蛋白:20例未見上皮內病變細胞及惡性細胞中p16INK4a蛋白呈弱陽性 1例,陰性 19例;24例LSIL 中 p16INK4a蛋白呈陰性5例,弱陽性 11例,中等陽性+強陽性 8例;53例 HSIL中 p16INK4a蛋白呈弱陽性6例、中等陽性及強陽性 47例,未出現陰性病例。29例子宮頸癌中,p16INK4a蛋白陰性 1例,弱陽性 5例,中等陽性+強陽性23例(表1,圖1~4)。
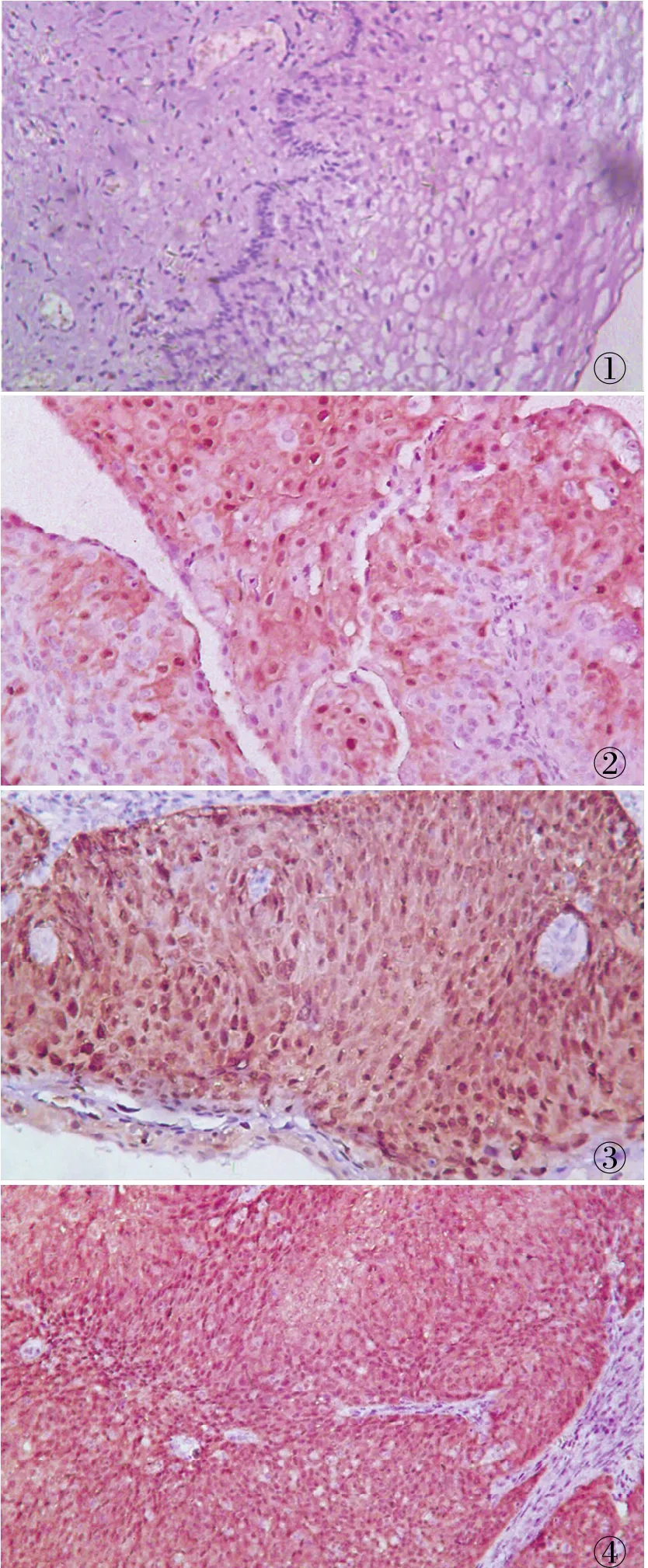
圖 1 在未見上皮內病變細胞及惡性細胞中 p16INK4a蛋白呈陰性,EnVision兩步法 圖 2 在 LSIL中 p16INK4a蛋白呈弱陽性,EnVision兩步法 圖3 在 HSIL中 p16INK4a蛋白呈強陽性,EnVision兩步法 圖 4 在 SCC中 p16INK4a蛋白呈強陽性,EnVision兩步法
2.3 TRFIA檢測子宮頸組織 p16INK4a蛋白表達與免疫組化結果分析20例未見上皮內病變細胞及惡性細胞標本中,TRFIA檢測 p16INK4a蛋白陽性 3例,其中1例為免疫組化陽性。另 2例雖然免疫組化結果判讀為陰性,但活檢組織面積較大,TRFIA檢測 p16INK4a水平在陽性閾值之上。TRFIA檢測LSIL 組 p16INK4a蛋白陽性 17例,HSIL及 SCC組中陽性分別為50、27例。LSIL、HSIL及SCC組中TRFIA檢測p16INK4a蛋白陽性的病例,免疫組化檢測均為陽性。免疫組化結果判讀為陽性而TRFIA檢測陰性的病例,在LSIL、HSIL、SCC組中分別為2、3、1例(表2)。

表 1 免疫組化檢測子宮頸組織 p16INK4a蛋白的表達
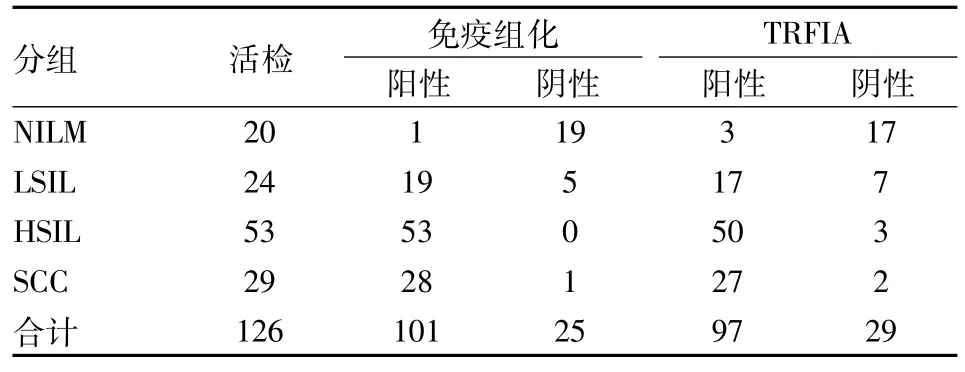
表 2 TRFIA檢測 p16INK4a蛋白表達與免疫組化結果比較
TRFIA檢測 LSIL組織中 p16INK4a蛋白陽性率為70.83%(17/24),檢測HSIL及 SCC兩組的總陽性率為93.90%(77/82),差異有顯著性(χ2=9.842,P =0.002)。TRFIA檢查子宮頸組織 p16INK4a蛋白在未見上皮內病變細胞及惡性細胞組中的陽性率為15.00%(3/20),低于 LSIL(χ2=13.716,P<0.001)、HSIL及SCC組(χ2=59.171,P<0.001)。
3 討論
p16INK4a是子宮頸癌及鱗狀上皮內病變較特異性的分子標志物,在多數子宮頸SCC和癌前病變中呈過表達或高表達,而在正常組織中不表達或低表達[4]。不同形態的子宮頸腺癌,包括子宮頸型、漿液型、子宮 內 膜 樣 型 等,p16INK4a蛋 白 均過表 達[6]。2005~2010年中國7個地區9個醫院的169例根治子宮頸腺癌標本中,免疫組化檢測大部分 p16INK4a過表 達[7]。
p16INK4a蛋白檢測方法有多種,免疫組化法因其檢測結果直觀、無需特殊條件,應用最為廣泛;但該方法程序繁多、耗時較長,大部分基層醫院仍然保持手工操作,因此不適合大規模檢測。熒光原位雜交(fluorescence in situ hybridization,FISH)法用于檢測子宮頸脫落細胞中p16INK4a蛋白,比細胞形態學篩查具有更高的敏感性和相似的特異性[8],但試劑及熒光檢測系統成本高昂,并需要專業培訓的病理學醫師,且與免疫組化染色相比并無明顯的優越性。電壓免疫傳感器法通過抗體吸附蛋白,引起傳感器諧振頻率改變反映 p16INK4a蛋白的數量[9],該方法客觀、快速且技術成本較小,但穩定性和精密度有待提高。枸櫞酸鈉還原法制備13 nm金顆粒,建立基于免標記納米金和抗重組 p16INK4a適配體,可用于快速檢 測 p16INK4a蛋白[10]。
酶聯免疫吸附法(enzyme linked immunosor-bent assay,ELISA)檢測子宮頸脫落細胞 p16INK4a蛋白,具有快速、成本低廉的優點,且量化的數值能夠使檢測更加客觀,減少主觀判讀引起的偏差[11-12]。ELISA是將抗原及抗體的特異性反應與酶對底物的高效催化作用相結合,利用呈色反應進行定量分析,但是酶標志物的穩定性較差,對檢測結果可能產生一定影響。
TRFIA分析法采用具有獨特熒光特性的鑭系元素及其螯合物為示蹤物,是目前最靈敏的微量分析技術。鑭系元素標志物克服了酶穩定性差的缺點,只要反應板的液體不揮發,反應終止后測定值能穩定較長時間。鑭系離子螯合物的熒光衰變時間極長,是傳統熒光的103~106倍,通過時間延遲,待激發光衰減后進行發射熒光檢測。由于標記離子的熒光激發光波長范圍較寬,而發射光譜峰范圍較窄,激發光與發射光之間的波長位移大,可達 290 nm,通過濾光片幾乎可以消除背景熒光的干擾。通過時間延遲和波長分辨,將強特異性熒光和背景熒光分辨開,極大提高該方法的特異性。TRFIA檢測在臨床上廣泛應用于病原微生物血清標志物、腫瘤標志物、激素含量檢測等,并發展為新生兒篩查質控中心推薦的先天性甲狀腺功能減退首選方法[13]。
本實驗檢測 20例子宮頸未見上皮內病變細胞及惡性細胞中p16INK4a蛋白表達,免疫組化染色顯示陰性15例,TRFIA檢測亦陰性;1例鱗狀上皮化生陽性,TRFIA檢測陽性;另外4例雖然免疫組化染色鱗狀上皮部分區域散在細胞著色[14],免疫組化結果判讀時依據陽性細胞比例,未參考病灶大小,因此仍然被判讀為陰性。若取材面積較大時,p16INK4a蛋白總量高于 TRFIA判讀閾值。TRFIA檢測4例子宮頸未見上皮內病變細胞及惡性細胞,結果顯示陰陽性各2例。
LSIL、HSIL及 SCC組中,TRFIA檢測陽性的病例,免疫組化染色也顯示陽性。免疫組化檢測結果僅僅對腫瘤細胞比例進行計算,未考慮病灶大小,因此在部分病例病灶面積較小、染色較弱的情況下,p16INK4a蛋白總水平低于陽性判讀閾值。SCC組中1例經免疫組化及TRFIA檢測均陰性,提示 p16INK4a蛋白可陰性[15]。
免疫組化檢測未見上皮內病變細胞及惡性細胞陽性1例,TRFIA檢測陽性3例;免疫組化檢測LSIL陽性19例,TRFIA檢測陽性17例;免疫組化檢測HSIL陽性53例,TRFIA檢測陽性50例。少數病例因組織中病灶大小、表達 p16INK4a蛋白強度差異等因素影響,絕大部分病例中,TRFIA檢測子宮頸組織p16INK4a蛋白表達與免疫組化保持一致,提示 TRFIA適合于檢測子宮頸組織 p16INK4a蛋白。
TRFIA檢測 p16INK4a在子宮頸組織未見上皮內病變細胞及惡性細胞組的陽性率為 15.00%(3/20),而在 LSIL陽性率為70.83%(17/24),差異有顯著性(χ2=13.716,P<0.001)。TRFIA檢測子宮頸組織 p16INK4a在 HSIL及SCC組的總陽 性率為93.90%(77/82),高于 LSIL組(χ2=9.842,P=0.002)。p16INK4a蛋白表達對于子宮頸病變有預測作用,強陽性患者疾病可能進展,而陰性模式僅出現在自然消退的子宮頸病變組[16]。因此若不加干預治療,TRFIA檢測 p16INK4a蛋白陽性的患者疾病可能進展,而檢測陰性患者可能隨著病灶面積擴大被檢測出來,也可能自行消退。
本實驗采用TRFIA檢測石蠟包埋子宮頸組織p16INK4a蛋白,提取需進行脫蠟等一系列處理,且經10%中性福爾馬林固定、石蠟包埋處理可造成蛋白鉸鏈、抗原位點折疊或斷裂等,降低檢測的敏感性并增加非特異性。子宮頸脫落細胞全蛋白提取則只需收集細胞、裂解并提取上清,即可進行蛋白檢測。如果 TRFIA檢測 p16INK4a蛋白試劑商品化,可大大降低檢測成本,簡化操作過程。該方法具有高靈敏度、高特異性、線性范圍廣、示蹤物穩定、無同位素放射性污染的特點,且對檢測條件要求不高,可滿足基層醫院到三甲醫院臨床不同層次的需求,有利于大規模應用。
[1] Li J,Poi M J,Tsai M D.The regulatory mechanisms of tumor suppressor p16INK4aand their relevance to cancer[J].Biochemistry,2011,50(25):5566-5582.
[2] Shidham V B,Mehrotra R,Varsegi G,et al.P16 immunocytochemistry on cell blocks as an adjunct to cervical cytology:potential reflex testing on specially prepared cell blocks from residual liquid-based cytology specimens[J].Cytojournal,2011,8(1):1.
[3] Schmidt D,Bergeron C,Denton K J,etal.p16/ki-67 dual-stain cytology in the triage of ASCUS and LSIL papanicolaou cytology results from the european equivocalormildly abnormal papanicolaou cytology study[J].Cancer Cyto Pathol,2011,119(3):158-166.
[4] Yu L L,Chen W,Lei X Q,et al.Evaluation of p16/Ki-67 dual staining in detection of cervical precancer and cancers:a multicenter study in China[J].Oncotarget,2016,7(16):21181-21189.
[5] Ekalaksananan T,Pientong C,Kongyingyoes B,et al.Combined P16INK4A and human papillomavirus testing improves the prediction of cervical intraepithelial neoplasia(C1NII-III)in that patients with low grade cytological abnormalities[J].Asian Pac J Cancer Prev,2011,12(7):1777-1783.
[6] 張著學,易 韋,文安智,等.宮頸腺癌中 IMP3和 p16INK4a的表達及意義[J].診斷病理學雜志,2015,22(4):228-232.
[7] 劉 彬,吳澤妮,劉瀟陽,等.人乳頭瘤病毒與子宮頸腺癌病因關系研究[J].中華腫瘤雜志,2016,38(4):277-282.
[8] ZengW J,Li Y,Fei H L,et al.The value of p16INK4aexpression by fluorescence in situ hybridization in triage for high risk HPV positive in cervical cancer screening[J].Gynecol Oncol,2011,120(1):84-88.
[9] Yang L,Huang X,Sun L.A piezoelectric immunosensor for early cervical cancer detection[J].Asian Pac JCancer Prev,2014,15 (21):9375-9378.
[10]徐 雯,薛 婷,余 娟,等.一種基于適配體的快速檢測宮頸癌標志物 p16INK4a的方法[J].華中科技大學學報(醫學版),2015,44(6):667.
[11]Wentzensen N,Hampl M,Herkert M,et al.Identification of high-grade cervical dysplasia by the detection of p16INK4ain cell lysates obtained from cervical samples[J].Cancer,2006,107 (9):2307-2313.
[12]Ding L,Zou X J,Ao JE,et al.ELISA test to detect CDKN2A (p16INK4a)expression in exfoliative cells:a new screening tool for cervical cancer[J].Mol Diagn Ther,2008,12(6):395-400.
[13]Van Vliet G,Deladoey J.Diagnosis,treatment and outcome of congenital hypothyroidism[J].Endocr Dev,2014,26:50-59.
[14]Bibbo M,DeCecco J,Kovatich A J.p16INK4aas an adjunct test in liquid-based cytology[J].Anal Quant Cytol Histol,2003,25 (1):8-11.
[15]Volgareva G,Zavalishina L,Andreeva Y,et al.Protein p16 as a marker of dysplastic and neoplastic alterations in cervical epithelial cells[J].Cancer,2004,4:58.
[16]Hoshikawa S,Sano T,Yoshida T,etal.Immunohistological analysis of HPV L1 capsid protein and p16 protein in low-grade dysplastic lesions of the uterine cervix[J].Pathol Res Pract,2010,206(12):816-820.
Detection p16INK4aprotein in cervical tissuesw ith time-resolved fluoroimmunoassay
DING Li1,ZOU Xian-jin1,FANWan-ting1,ZHENG Jie1,CHEN Qiong2
(1Department of Pathology,the First People’s Hospital of Jingmen,Jingmen 448000,China;2School of Laboratory Medicine and Biotechnology,Southern Medical University,Guangzhou 510515,China)
PurposeTo establish a new method for detecting p16INK4ain cervical tissueswith time-resolved fluoroimmunoassay(TRFIA).M ethods126 cases of paraffin imbedding tissues of cervix were selected for immunohistochemistry(IHC)of EnVision two-step and TRFIA.ResultsThere were 20 cases of no intraepithelial lesion ormalignancy,24 cases of low-grade squamous intraepithelial lesion(LSIL),53 cases of high-grade squamous intraepithelial lesion(HSIL)and 29 cases of squamous cell carcinoma(SCC).In the groups of no intraepithelial lesion or malignancy,LSIL,HSIL and SCC,p16INK4apositive was seen in 1,19,53 and 28,respectively.TRFIA test results displayed p16INK4apositive in 3,17,50 and 27 cases,respectively.Positive of p16 using by TRFIA in no intraepithelial lesion ormalignancy,LSIL,above HSIL was 15.00%,70.83% and 93.90%,respectively(P<0.01).ConclusionTRFIA is suitable for detecting of p16INK4aprotein and demand low detection equipment.p16INK4aexpression detected by TRFIA may helpful for large scale detection in various clinical institution.
cervical tissues;p16INK4a;immunohistochemistry;time-resolved fluoroimmunoassay
R 737.33;R 446
A 文章編號:1001-7399(2017)01-0017-05
10.13315/j.cnki.cjcep.2017.01.005
接受日期:2016-11-16
湖北省自然科學基金(2013CFB478)
1荊門市第一人民醫院病理科 4480002南方醫科大學檢驗與生物技術學院,廣州 510515
丁 莉,女,碩士,副主任醫師。E-mail:dl789521@126. com鄒先進,男,主任醫師,通訊作者。E-mail:xjz6074@sina. com
取子宮頸組織病理學小活檢標本126例,采用免疫組化EnVision兩步法及 TRFIA法檢測石蠟包埋組織中 p16INK4a蛋白。結果126例標本中,未見上皮內病變細胞及惡性細胞 20例、低級別鱗狀上皮內病變(low-grade squamous intraepithelial lesions,LSIL)24例、高級別鱗狀上皮內病變(high-grade squamous intraepithelial lesions,HSIL)53例、子宮頸鱗狀細胞癌(squamous cell carcinoma,SCC)29例。免疫組化檢測未見上皮內病變細胞及惡性細胞組、LSIL組、HSIL組、SCC組中p16INK4a蛋白陽性病例分別為1、19、53、28例,TRFIA檢測 p16INK4a蛋白陽性病例分別為3、17、50、27例。LSIL、HSIL及 SCC組中,TRFIA檢測 p16INK4a蛋白陽性的病例經免疫組化結果均為陽性。TRFIA檢測p16INK4a蛋白在未見上皮內病變細胞及惡性細胞組、LSIL、HSIL及 SCC組的陽性率分別為15.00%、70.83%、93.90%,差異有顯著性(P<0.01)。結論TRFIA適合于檢測 p16INK4a蛋白,且對檢測條件要求低,有利于臨床工作中不同機構大規模檢測。

