甲狀腺癌的腔鏡手術治療及臨床有效性研究
張曉靜 陳延松 王彬彬 陳汝潔
蚌埠醫學院第一附屬醫院腫瘤外科,安徽蚌埠 233004
甲狀腺癌屬于臨床上一類發病率較高的惡性腫瘤,以頸前部較為多見,發病初期該類疾病無明顯的臨床癥狀,且不會對內患者的吞咽、發音[1-2]等情況造成影響,因此,臨床上較易出現漏診、誤診案例[3]。臨床上對該類疾病患者多半采取手術切除治療方案,但是術后疾病容易復發,且手術操作步驟較為繁雜,需選派臨床經驗十分豐富的醫師進行操作,由此容易出現術后并發癥情況[4-5]。近些年來,隨著微創技術的發展進步,許多微創技術逐漸應用于臨床。為此,本次研究將我院2011年3月~2015年3月收治的60例分化型甲狀腺癌患者納入實驗研究,并分別采取甲狀腺手術切除與全腔鏡甲狀腺切除術進行治療,探究兩組的治療效果,詳見下文。
1 資料與方法
1.1 一般資料
選取我院2011年3月~2015年3月收治的TNM分期為Ⅰ期和Ⅱ期的分化型(低危型)甲狀腺癌患者60例納入本次實驗研究,醫護人員對入院患者詳細講解了甲狀腺癌的發病機制、臨床表現、診斷與治療方法、并發癥、注意事項等,提高了患者對自身疾病的認知程度;另外,醫護人員對患者詳細講解了本次實驗的目的、意義、流程等。納入標準:所有患者知情同意納入本次實驗研究;所有患者年齡均≥18周歲,甲狀腺瘤直徑均在2.0cm以下,且包膜部分未遭受到侵犯,頸部未發生粘連的淋巴結直徑在2.0cm以下,術前進行病理診斷后疾病均確診;經過本地醫學倫理委員會的批準同意。
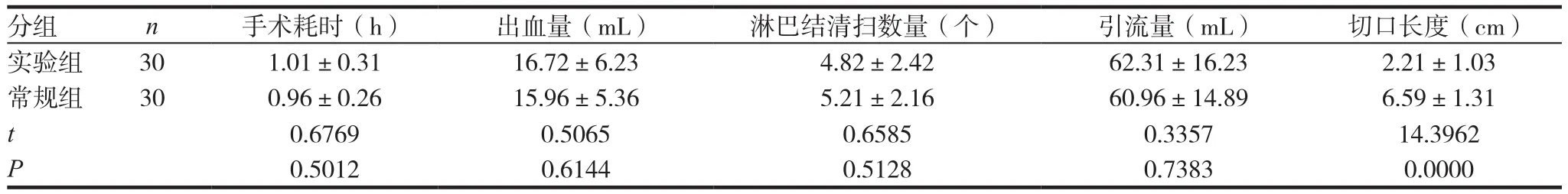
表1 兩組患者手術情況比較(x ± s)
對所有患者給予信封隨機分組,常規組:男18例(60.00%),女12例(40.00%),年齡20~68歲,平均(43.69±3.48)歲;29例乳頭狀癌,1例濾泡狀癌;實驗組:男16例(53.33%),女14例(46.67%),年齡21~69歲,平均(43.78±3.18)歲;28例乳頭狀癌,2例濾泡狀癌。將兩組甲狀腺癌患者的一般資料進行比較,差異無統計學意義(P>0.05),具有可比性。
1.2 方法
常規組:給予常規外科手術進行治療。做好麻醉處理后對患者頸部皮紋部位作一手術切口,切口長度為6~8cm之間,游離患者頸部闊肌深面皮瓣部位,并將頸白線切開,使得患者的甲狀腺組織充分暴露;依次切除患者患側腺葉、對側腺葉與峽部,若為峽部或者多發病變可進行對側近全切除,將喉返神經進行顯露,并對中央區淋巴結進行清掃(清掃位置包括喉返神經旁、氣管旁、氣管食管旁淋巴結等),手術完成后置管引流,并對患者的臨床癥狀與體征進行嚴密的觀察記錄。
實驗組:采取全腔鏡甲狀腺切除術進行治療。給予氣管內插管全身麻醉方案,幫助患者采取仰臥位,給予胸乳入路,注射多卡因腎上腺素生理鹽水于患者胸前壁擬操作區皮下深筋膜部位,作一1cm的手術切口于雙側乳頭連線中點胸骨柄部位,作一0.5cm的小切口于雙側乳暈內上方乳暈邊緣,并給予穿刺棒制造皮下隧道,將1cm Trocar插入中間切口,給予CO2氣體壓力并保持在6~8mm Hg之間,并將觀察鏡置入。將0.5cm Trocar置入雙側乳暈切口部位,將超聲刀置入并將皮下疏松的結締組織進行分離,后將頸白線切開使得患側甲狀腺腺葉充分暴露,頸前帶狀肌無需離斷。將患者甲狀腺真包膜外疏松的組織進行分離,并在腔鏡的直視下對患者甲狀腺血管、甲狀旁腺、喉返神經進行清晰地辨別,用超聲刀切斷甲狀腺狹部、甲狀腺下極血管、上血管、甲狀腺中靜脈等,將腺體組織沿著內側托起,切除部分側腺葉,若為峽部或者多發病變可進行對側近全切除,將喉返神經進行顯露,并對中央區淋巴結進行清掃(清掃位置包括喉返神經旁、氣管旁、氣管食管旁淋巴結等),將切除的標本置入標本袋內,并進行病理檢查,等到創面無出血跡象后將頸白線進行縫合,引流管接負壓。
1.3 評價指標
(1)對比兩組甲狀腺癌患者的手術情況,包括手術耗時、術中出血量、引流量、清掃淋巴數目、手術切口長度等,比較兩組數據差異。(2)比較兩組患者術后并發癥發生率。
1.4 統計學處理
采用統計學軟件SPSS19.0版對數據進行統計分析,術后并發癥發生率用百分比、率表示,采用χ2檢驗,手術情況以(x±s)表示,采用 t檢驗,P < 0.05為差異有統計學意義。
2 結果
2.1 兩組患者手術情況比較
兩組患者在清掃淋巴數量、引流量、術中出血量、手術耗時等方面差異無統計學意義(P>0.05),但實驗組患者的手術切口長度相比常規組明顯較短,差異有統計學意義(P<0.05)。見表1。
2.2 兩組患者術后并發癥情況比較
實驗組與常規組患者術后并發癥發生率分別為13.33%與16.67%,差異無統計學意義(P>0.05)。見表2。
3 討論
對分化型甲狀腺癌患者來說,臨床上主要采取傳統聯合根治手術進行治療,但是該類治療方案后期會在患者頸部遺留瘢痕組織或者傷口,嚴重影響了患者對美觀的要求,影響了患者的日常生活[6-7]。近些年來,隨著微創技術的發展進步,許多微創手術在臨床上廣泛推廣[8]。其中采用腔鏡下給予手術治療獲得了許多醫學工作者的關注。該項操作技術目前已經日趨完善,但是臨床上仍然對該類手術存在不同的意見,分析主要原因為對淋巴進行清掃時具有一定的操作難度且具有一定的缺陷,若在操作過程中對患者術后美觀效果較為重視則可能出現術野暴露難度加大、對癌灶、周圍淋巴結清掃不徹底等情況[9-10];另外,該項操作方案具有有限的操作空間,直接影響了手術中止血操作與手術視野等,所以說,對甲狀腺癌患者來說,給予全腔鏡甲狀腺切除術仍然需要更加深入的臨床研究,最大程度上減少手術缺陷[11-12]。
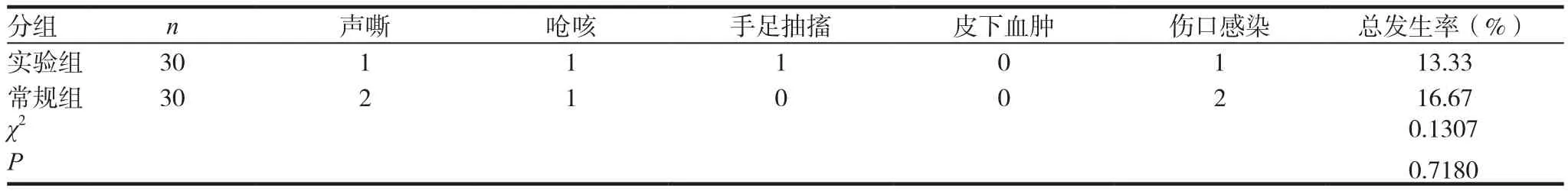
表2 兩組患者術后并發癥情況比較
本次研究對實驗組患者采取全腔鏡甲狀腺切除術進行治療,對常規組患者采取一般外科手術治療,結果顯示,比較兩組患者的清掃淋巴數量、引流量、術中出血量、手術耗時等方面差異無統計學意義(P>0.05),但實驗組患者的手術切口長度僅為(2.21±1.03)cm,明顯短于常規組的(6.59±1.31)cm,比較組間手術切口長度差異有統計學意義(P<0.05)。比較兩組患者手術完成后的并發癥發生率差異無統計學意義(P>0.05)。由此可知,給予全腔鏡甲狀腺切除術治療的臨床意義重大,手術安全可靠。分析其主要原因為實驗組患者行手術治療時給予細線加自動拉鉤將皮瓣進行懸吊,利于手術操作空間的建立,便于腔鏡、超聲刀等器械進入手術視野,后給予超聲刀進行切割處理,使得對患者肌肉組織與神經的損傷較小,手術安全有效[13];相比傳統外科手術,全腔鏡手術操作的切口較為隱蔽,患者容易接受,手術空間建立較簡便,醫師容易掌握[14];另外,手術操作方式較為靈活,一旦出現大出血情況便于及時進行對癥處理[15]。
本次研究可知,實驗組患者手術操作方案的應用效果明顯優于常規組。綜上所述,對甲狀腺癌患者來說,給予全腔鏡甲狀腺切除術的臨床意義顯著,相比開放手術治療方案的應用價值更大,該手術方案具有并發癥少、微創、可保持傷口美觀等優勢,值得實踐推廣。
[1] 張偉,仇明,江道振,等.完全腔鏡與中轉開放甲狀腺癌根治術的比較[J].中國微創外科雜志,2012,12(1):33-35.
[2] 龔茂松,叢偉,郝戰宇,等.腔鏡輔助與傳統手術在甲狀腺癌頸側區淋巴結清掃術中的效果比較[J].山東醫藥,2016,56(13):107-108.
[3] 王波,趙文新,顏守義,等.針式輔助技術在全腔鏡甲狀腺癌手術中的應用研究[J].中華外科雜志,2016,54(1):44-48.
[4] 譚卓,王文棟,賞金標,等.腔鏡甲狀腺癌手術與頸部開放甲狀腺手術的臨床對比研究[J].中華普通外科雜志,2013,28(2):150-151.
[5] 李翔,劉雪宜,史振超,等.完全腔鏡下分化型甲狀腺癌根治術的臨床應用[J].佛山科學技術學院學報(自然科學版),2016,34(2):72-75.
[6] 王存川,陳志強,李進義,等.內鏡治療甲狀腺疾病[J].腹腔鏡外科雜志,2011,16(8):567-571.
[7] 弓健,徐浩,王存川,等.腔鏡分化型甲狀腺癌術后殘留甲狀腺組織的131I治療結果分析[C].中華醫學會第九次全國核醫學學術會議論文集.2011:320.
[8] Chung Yong,Kim Sun,G wang,et al.Determination of essential elements with functions in oriental medicinal prescriptions for thyroid cancer patients using instrumental neutron activation analysis[J].Journal of Radioanalytical and Nuclear Chemistry:An International Journal Dealing with All Aspects and Applications of Nuclear Chemistry,2012,291(2):445-450.
[9] 葉軻,李新營,常實,等.納米炭在腔鏡下甲狀腺癌手術中的臨床應用[J].中國普通外科雜志,2016,25(5):653-658.
[10] 王勇,趙群仔,燕海潮,等.三維腔鏡胸前入路甲狀腺癌手術32例臨床分析[J].中華外科雜志,2015,53(3):176-178.
[11] 傅錦波,羅曄哲,洪曉泉,等.經胸經口聯合入路腔鏡甲狀腺癌切除術26例[J].中華普通外科雜志,2017,32(3):191-193.
[12] 孫小亮,魯瑤,楊猛,等.經胸乳途徑行腔鏡甲狀腺手術的臨床體會[J].腹腔鏡外科雜志,2017,22(6):401-403.
[13] 孫紅蘭.腔鏡甲狀腺癌手術與傳統手術臨床療效的比較[D].北京:首都醫科大學,2012.
[14] 盧玉元,王新.甲狀腺癌在腔鏡與根治術中的臨床效果觀察 [J].醫學理論與實踐,2017,30(8):1166-1168.
[15] Looyenga BD,Furge KA,Dykema KJ.et al.Chromosomal amplification of leucine-rich repeat kinase-2(LRRK2)is required for oncogenic MET signaling in papillary renal and thyroid carcinomas[J].Proceedings of the National Academy of Sciences of the United States of America,2011,108(4):1439-1444.

