巧用實驗計算提高教學效能
■郝蓉燕
巧用實驗計算提高教學效能
■郝蓉燕
教師以實驗探究方式引入對某一問題的解決,再將題型由探究題轉換為抽象的計算題,并逐步改變問題或條件,與其他章節(jié)知識結合,逐步加深難度,能夠讓學生感性地、漸進式地掌握探究的方法以及一系列類似計算題的解法。
實驗計算效能
當前,學生對化學計算題發(fā)怵,首先計算題相對于豐富多彩的化學世界來說顯得單調(diào)枯燥,難以引起學生的興趣;其次一道計算題往往包含題意的正確理解、隱含知識點的正確剖析、化學方程式的正確書寫、數(shù)學計算的能力以及細心等諸多因素,綜合性較強,因此對學生的要求較高。如何讓學生愛做計算題、做好計算題,成了教師需要思考的問題。
我們可以將實驗探究思想滲透到計算題的教學中,從身邊的化學中發(fā)現(xiàn)問題、提出問題,讓學生用探究的方法解決,然后將此實驗探究題涉及的知識點改編為計算題。學生已經(jīng)親手做過實驗,親身體驗過實驗過程,解決計算題時對題意的理解就能非常準確,對列式中可能出現(xiàn)的錯誤也能避免。接著我們通過改變題目中的問題或已知條件的給出方式來逐漸加深題目的難度,引導學生積極思考、比較異同,逐步解決問題。這樣的教學方法使學生能夠從以往的被動接受知識、簡單記憶中走出來,變?yōu)榉e極主動地去尋找相似點、相通點解決問題,解題能力將得到了極大的提高。
一、探究實驗引入
下面以銅鋅合金與酸反應的一類計算題型為例:
【提出問題】
“藥金”又稱“愚人金”,實為銅鋅合金。由于“藥金”外觀與黃金相似,常被不法商販用來冒充黃金牟取暴利。怎樣甄別它?
【學生進行討論并設計鑒別方案】
指導思想:利用“藥金”中的成分銅或者鋅與金的不同點進行區(qū)分。
設計原理:利用銅在空氣中加熱變成黑色的氧化銅,而金加熱不變色加以區(qū)分;或利用鋅能與稀鹽酸(或稀硫酸)反應產(chǎn)生氣體而金不與稀鹽酸(或稀硫酸)反應加以區(qū)分。
【學生進行實驗、觀察現(xiàn)象、得出結論】
通過這樣一個探究過程,學生不僅復習了原有的知識,而且能夠靈活運用知識解決實際問題,還掌握了一整套解決問題的探究手法。
二、巧用計算
這個問題的解決并非到此結束,此時教師可以對問題進行適當改編,引申出下面一條常見的計算題。
例1:某化學興趣小組稱取10g“藥金”(銅鋅合金)于燒杯中,加入100g稀硫酸,充分反應后測得產(chǎn)生的氫氣的質(zhì)量為0.2g,求合金中鋅的質(zhì)量。
[分析]該題條件比較明確,什么樣的物質(zhì)以及對應的量都清楚給出,學生在做完實驗的基礎上能迅速理解。但教師講解時要讓學生明確:第一,銅鋅合金的10g是合金的總質(zhì)量,方程式中的Zn指的是參加反應的鋅的質(zhì)量,銅未參加反應,因此不能將10g代入方程式求解;第二,稀硫酸的100g是溶液的質(zhì)量,既包括溶質(zhì)硫酸的質(zhì)量也包括溶劑水的質(zhì)量,方程式中H2SO4指的是參加反應的溶質(zhì)硫酸的質(zhì)量,因此不能將100g代入方程式求解。兩點綜合起來最終讓學生明確:不能將混合物的質(zhì)量直接代入方程式中求解。
學生明確了注意點并順利解決了例1后,教師可趁熱打鐵,將問題進行延伸,逐層加大難度,如改變?yōu)椋?/p>
(1)求“藥金”中銅的質(zhì)量;(2)求“藥金”中鋅的質(zhì)量分數(shù);(3)求“藥金”中銅的質(zhì)量分數(shù)。
由于例1已知條件的明確給出,問題的改變并沒有加大題目的難度,當學生為問題的解決而逐一沉浸在喜悅中時,教師可以向學生展示例2和例3。
例2:某化學興趣小組稱取10g“藥金”于燒杯中,加入100g稀硫酸充分反應后,稱得總質(zhì)量減少了0.2g,求生成氫氣的體積(標準狀況下氫氣的密度為0.089g/L)。
例3:某化學興趣小組稱取10g“藥金”于燒杯中,加入100g稀硫酸充分反應后,稱得燒杯內(nèi)物質(zhì)總質(zhì)量為109.8g,求合金中銅的質(zhì)量分數(shù)。
[分析]分析此兩例,發(fā)現(xiàn)與例1最大的區(qū)別為:將例1中生成的氫氣的質(zhì)量為0.2g這一明確條件轉變角度,用溶液質(zhì)量的減輕和反應后各物質(zhì)總質(zhì)量的數(shù)值這種隱含的方式給出,由于學生已做過探究活動,可以很快分析出總質(zhì)量之所以會減輕就是由于產(chǎn)生的氫氣從整個體系中逸出,因此例2中減輕的0.2g即為氫氣的質(zhì)量,例3中反應后總質(zhì)量比反應前總質(zhì)量(合金的質(zhì)量10g+硫酸溶液的質(zhì)量100g=110g)減少了0.2g(110g-109.8g=0.2g),這就是氫氣的質(zhì)量。這一點明確以后,問題就迎刃而解了。
三、逐層推進,效能提升
以上例題的完成主要還是局限在金屬材料這一單元,此時可以通過條件與問題的改變,與溶液這一單元聯(lián)系起來,拓展學生的思路,開闊學生的眼界。具體見例4。
例4:某化學興趣小組稱取10g“藥金”于燒杯中,加入100g稀硫酸充分反應后,稱得燒杯內(nèi)物質(zhì)總質(zhì)量為109.8g。求:(1)稀硫酸的溶質(zhì)質(zhì)量分數(shù);(2)反應后溶液中溶質(zhì)質(zhì)量分數(shù);(3)過濾,將濾液恒溫蒸發(fā)掉6.2g水后,析出0.1g晶體(晶體不含結晶水),求所得溶液中溶質(zhì)的質(zhì)量分數(shù)。
[分析]問題(1)較簡單,只要通過方程式求出參加反應的硫酸的質(zhì)量再除以硫酸溶液的質(zhì)量即可。問題(2)中必須向學生講明兩點:第一,反應后溶液中的溶質(zhì)是什么,必須從方程式的右邊即生成物中去找;第二,反應后溶液的質(zhì)量不能直接視為倒入的稀硫酸的質(zhì)量,而是發(fā)生了改變,到底怎樣改變,由于學生已進行探究,可用圖示法形象給出(見圖1)。以質(zhì)量守恒定律為依據(jù),反應后溶液質(zhì)量應等于所有原料質(zhì)量之和(合金質(zhì)量+稀硫酸質(zhì)量),但必須扣除:①不溶于溶液的雜質(zhì)質(zhì)量,即m雜(如燒杯中銅的質(zhì)量);②從體系中逸出的氣體的質(zhì)量,即m氣(如氫氣的質(zhì)量);③以沉淀形式從體系中析出的固體質(zhì)量,即m沉(此題未涉及),最終得到m溶液=(m固+m液)-(m雜+m氣+m沉),當然生成溶液的質(zhì)量也可用溶質(zhì)質(zhì)量加溶劑質(zhì)量來求,但如果反應前后有多種溶液參與,而水又作為反應物或生成物之一,那么計算就會變得很繁瑣,不如此法來得簡單直觀;第(3)問為一個完全的溶液方面的題目,只要將溶質(zhì)減去0.1g晶體的質(zhì)量,溶液減去6.2g水和0.1g晶體質(zhì)量即可。
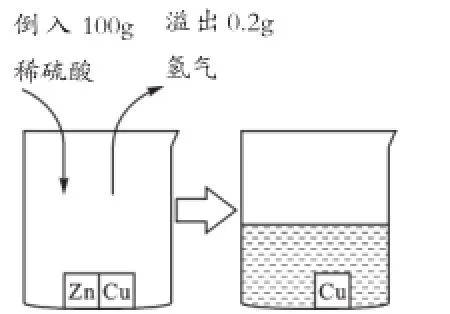
圖1
我們還可以將其改編為實驗處理型的題目。這種題目往往為了解決某一問題,設計一定的實驗方案,給出圖表,考查學生分析處理圖形表格中的數(shù)據(jù)并最終解決問題的能力。對學生的各方面能力要求較高。如例5、例6。
例5:為了測定銅鋅合金(即銅鋅混合物)中鋅的質(zhì)量分數(shù),某同學利用該合金與稀硫酸反應,進行了三次實驗,所得相關的實驗數(shù)據(jù)記錄如下(實驗中的誤差忽略不計):
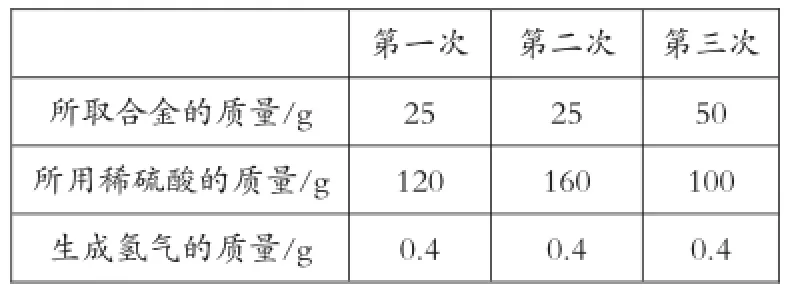
第三次50 100 0.4所取合金的質(zhì)量/g所用稀硫酸的質(zhì)量/g生成氫氣的質(zhì)量/g第一次25 120 0.4第二次25 160 0.4
(1)計算該銅鋅合金中鋅的質(zhì)量分數(shù);
(2)從上表數(shù)據(jù)分析,當所取合金與所用稀硫酸的質(zhì)量比為_____時,表明合金中的鋅與稀硫酸中的硫酸恰好完全反應。
[分析]本題是一道利用所取原料質(zhì)量的改變,比較生成物質(zhì)的質(zhì)量來確定原料最合適的質(zhì)量比的實驗型計算題。關鍵要著眼于化學方程式中參加反應的各物質(zhì)以及生成的各物質(zhì)的質(zhì)量成正比例關系,通過比較各組中數(shù)據(jù)發(fā)現(xiàn):第一次與第二次所取合金質(zhì)量相同,第二次所用稀硫酸的質(zhì)量比第一次多,但生成的氫氣的質(zhì)量卻相等,由此說明第二次所用稀硫酸是過量的,合金是完全反應的,即25g合金完全反應掉會生成0.4g氫氣;第三次所取的合金的質(zhì)量為前兩次的兩倍,但產(chǎn)生的氫氣卻與前兩次一樣多,說明第三次所取合金為過量,而酸是完全反應的,即100g稀硫酸完全反應掉生成0.4g氫氣,因此,生成0.4g氫氣需要25g合金和100g稀硫酸,即25g合金與100g稀硫酸是恰好完全反應的,并且生成0.4g氫氣。
例6:某同學利用日常生活用品制作了一套裝置(見圖2),用該裝置對粗鋅樣品進行實驗。請幫助其完成下列實驗報告。
(一)實驗目的:
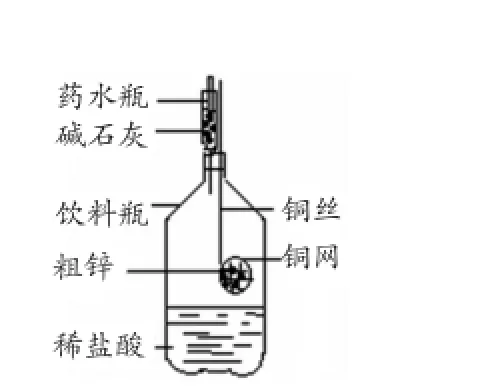
圖2
(二)實驗用品:托盤天平、藥水瓶、銅網(wǎng)、銅絲、飲料瓶、粗鋅、稀鹽酸、堿石灰(CaO和NaOH)
(三)實驗步驟:
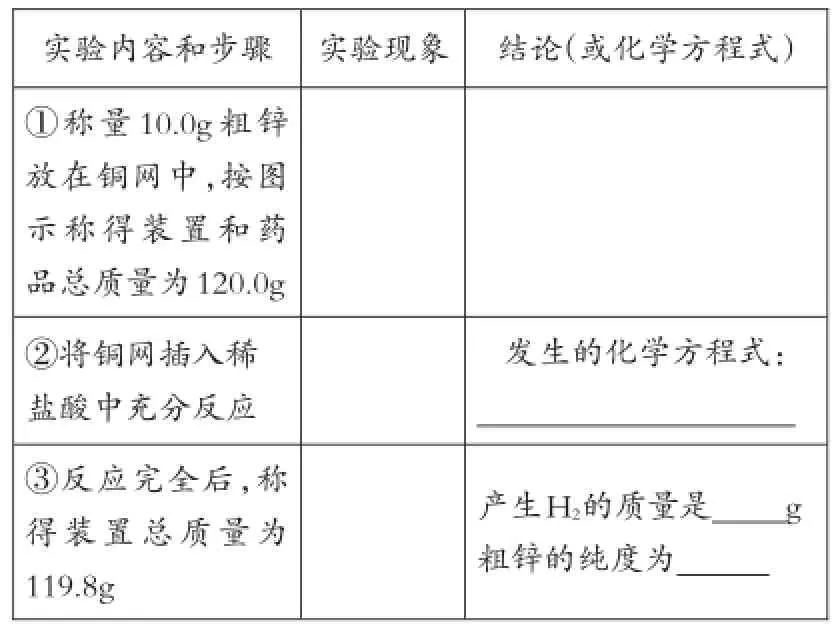
實驗內(nèi)容和步驟①稱量10.0g粗鋅放在銅網(wǎng)中,按圖示稱得裝置和藥品總質(zhì)量為120.0g②將銅網(wǎng)插入稀鹽酸中充分反應③反應完全后,稱得裝置總質(zhì)量為119.8g實驗現(xiàn)象結論(或化學方程式)發(fā)生的化學方程式:產(chǎn)生H2的質(zhì)量是g粗鋅的純度為
[分析]此題實際上是例3的另一種給出形式,將一道簡單的計算題設計成了一道非常新穎的實驗題,關鍵是要從繁雜的文字中找出考查的知識點所在。此題實際上是利用銅網(wǎng)不與酸反應,而鋅與酸反應,將銅網(wǎng)作為實驗儀器將粗鋅包住,伸入酸中,讓鋅與酸反應并產(chǎn)生氫氣。氫氣逸出時須經(jīng)過堿石灰,其目的是將氫氣可能帶出的水蒸氣以及揮發(fā)的氯化氫氣體完全留在體系中,保證減少的是純凈氫氣質(zhì)量,減小誤差。
利用裝置總質(zhì)量在反應前后的差值即氫氣的質(zhì)量(m氫氣=120.0g-119.8g=0.2g)計算鋅的質(zhì)量,進而計算粗鋅的純度。明白了題意,實際就簡化為了例3,解法略。
通過探究式實驗的引入,題型的轉換,難度的加深,學生能夠逐步掌握探究的方法以及一系列計算題的解法。
(作者為江蘇省江陰市暨陽中學教師)

