赤芍對LPS誘導急性肺損傷大鼠的預防作用
韓文杰,王晴,張旗,丁楠,高菁,陳丹陽,李強
(北京中醫藥大學,北京 100102)
赤芍對LPS誘導急性肺損傷大鼠的預防作用
韓文杰,王晴,張旗,丁楠,高菁,陳丹陽,李強*
(北京中醫藥大學,北京 100102)
目的:探討赤芍不同給藥劑量對大鼠脂多糖(Lipopolysaccharide,LPS)誘導的急性肺損傷(acute lung injury,ALI)的預防作用,篩選最佳給藥劑量,為后期藥效物質基礎研究奠定基礎。方法:SD大鼠隨機分為高劑量組、中劑量組、低劑量組、陽性藥(DEX)組、模型組(LPS組)、空白組(NS組),每組10只。采用氣管內滴注內毒素方法[1]建立急性肺損傷模型,造模12h后取肺灌洗液檢測白細胞數目、蛋白濃度,取右肺上葉測濕干比,取右肺下葉觀察肺組織病理形態學變化。結果:地塞米松、赤芍高中劑量給藥組均能顯著減少白細胞數目(P<0.05),降低肺濕干比(W/D)(P<0.05)和蛋白濃度(P<0.05),緩解肺水腫、肺泡結構破壞、炎性細胞浸潤,改善肺內出血情況。結論:赤芍能顯著改善肺部結構受損、肺水腫、中性粒細胞浸潤等病變,尤其以中劑量為佳。
赤芍;急性肺損傷;內毒素
急性肺損傷(ALI)是肺部的嚴重無序狀態,死亡率較高,每年都造成約0.175%的人死亡。ALI的標志包括肺泡-毛細血管屏障的破壞,肺水腫外滲進入血管間隙和肺泡內白細胞浸潤。而當氧合指數惡化到低于200的PaO2/FiO2濃度時將會引發急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)[1]。ARDS的突出的臨床特征描述為嚴重的呼吸困難,呼吸急促,肺順應性下降和彌漫胸部X光浸潤。組織病理學變化包括間質和肺泡出血和水腫,肺泡中出現大量巨噬細胞,但最突出的表現為透明膜的存在[2]。急性肺損傷還是多器官障礙綜合征(multiple organ dysfunction syndrome,MODS)的重要組成部分,致死率極高。急性肺損傷的發病機理十分復雜,目前國內外專家并沒有能力對其完全闡述。目前認為,肺內過度的失控性炎癥反應是導致各種病因ALI的根本原因[3]。
赤芍為清熱涼血的代表藥物,含有多種化學成分,具有清熱涼血、散瘀鎮痛之功效。近年來,有關赤芍的研究不少[4-5],但是對其作用的最佳給藥劑量及藥效物質基礎的研究未見報道。本文從篩選最佳劑量入手,探討不同給藥劑量對ALI的干預作用,以期確定最佳給藥劑量,為后期藥效物質基礎的研究做好鋪墊,并最終開發出治療急性肺損傷的理想藥物,更好地應用于臨床。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物
清潔級SD大鼠,雄性70只,體質量200~220 g,購自北京維通利華實驗動物技術有限公司,動物合格證號:11400700036742。
1.1.2 試劑及主要儀器
赤芍藥材購自河北安國藥材市場(批號20151123),經北京中醫藥大學生鑒定系劉春生教授鑒定為毛茛科植物赤芍的干燥根;大腸桿菌內毒素(L2880,sigma);牛血清白蛋白(A7030,PH -7,sigma);地塞米松注射液(批號1507111);吉姆薩染液(北京博奧拓達科技有限公司);考馬斯亮藍G-250 (北京拜爾迪生物科技有限公司);TXD型離心甩片機(湖南湘儀實驗室儀器開發有限公司);MK3型酶標儀(賽默飛儀器有限公司);Effendorf5810R離心機(德國);血液分析儀、Bx40F4型光學顯微鏡(OLYMPUS,日本);AxioCam ERC5s成像系統(德國蔡司數碼成像系統)。
1.2 實驗方法
1.2.1 赤芍水提物制備
赤芍藥材,10倍量水,回流提取3次,每次1 h,四層紗布過濾,合并濾液,減壓濃縮得到赤芍水提物高中低3種劑量,含生藥量分別為1 ml≈1 g,1 ml≈0.5 g,1 ml≈0.17 g。
1.2.2 內毒素性急性肺損傷(ALI)模型制備
將大鼠隨機分為高劑量組、中劑量組、低劑量組、陽性藥(DEX)組、模型組(LPS組)、空白組(NS組)。動物正常飼養兩天后灌胃,分別灌胃三種赤芍水提物,每日1次,每次9 ml/kg,共計5天。造模前1 h,再灌胃1次,陽性藥組注射地塞米松注射液2 mg/kg。造模前,各組均用水合氯醛(4 mg/kg)麻醉,預防給藥組、陽性藥組、模型組氣管內滴注內毒素(LPS,5 mg/kg),空白組在同樣條件下,氣管內滴注等體積的生理鹽水。造模12 h后各組動物均取材。
1.3 指標檢測
各組動物按照造模時間以腹主動脈取血處死后,剪開頸、胸部皮膚,分離氣管,行氣管插管。右支氣管結扎,用磷酸緩沖液(PBS)6 mL分3次進行左肺灌洗(灌洗時保證每次打入、吸出等體積的液體),收集肺泡灌洗液(BALF)4.5 ml,離心(4℃,1 300 r/min,10 min)。
1.3.1 BALF中蛋白含量測定
取離心后上清液,考馬斯亮藍法測定BALF中蛋白含量。以牛血清白蛋白(BSA)做標準曲線,100 !g/ml考馬斯亮藍G-250染液加入待測稀釋液或蛋白標準液(v∶v=5∶1),渦旋儀振勻后20℃ ~25℃放置15 min,加入96孔板。充分反應后,以考馬斯亮藍G-250染液作為調零孔,于酶標儀595 mn處測吸光度,根據蛋白質標準曲線計算BALF中的蛋白含量。
1.3.2 肺濕干比(W/D)
收集灌洗液后,取右肺上葉,稱量濕重(W),80℃烘干至恒重,稱取干重(D),計算濕干比(W/D)。
1.3.3 BALF中白細胞計數
用500 μl磷酸鹽緩沖液(PBS)重旋沉淀,吹打均勻。取400 μl于血液分析儀中檢測白細胞(WBC)數目。剩余100 μl混合液加入400 μl PBS,混勻。取100 μl于離心甩片機中離心做細胞涂片,吉姆薩(Gemsa)染色15 min,洗片,無水乙醇固定,中性樹膠封片,于顯微鏡下觀察細胞形態。
1.3.4 肺組織病理形態學觀察
取右肺下葉,10%中性福爾馬林固定48 h,流水沖洗12 h,常規石蠟包埋,切片,蘇木精-伊紅(Hematoxylinand Eosin,HE)染色,封片,光鏡下病理觀察。
1.4 統計學處理
采用SAS統計軟件進行統計,計量資料以均數±標準差表示,單因素方差分析檢驗,組間兩兩比較采用LSD方法。
2 實驗結果
2.1 各組白細胞(WBC)統計結果
LPS組BALF中WBC數目明顯高于NS組(P<0.05),顯示造模成功;與模型組相比,DEX組、高劑量組、中劑量組 WBC數目較 LPS組明顯降低(P<0.05),低劑量組WBC與LPS組比較并無明顯差異。結果說明LPS誘導炎性細胞的聚集活化,低劑量給藥組并不能顯著降低炎性細胞數量,高劑量組及中劑量組均能減少炎性細胞數量,但兩者預防作用并無顯著差異,中劑量組相比高劑量組療效作用稍明顯。各組白細胞數目見表1。
表1 各組白細胞(WBC)數目(±s,n=6)
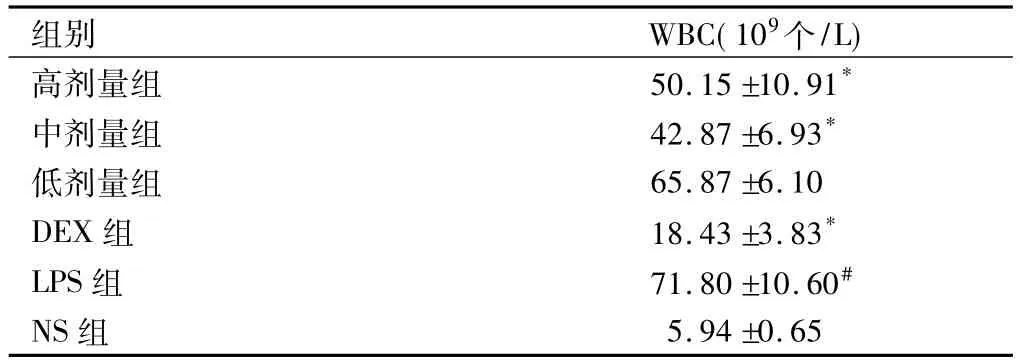
表1 各組白細胞(WBC)數目(±s,n=6)
注:與空白組比較,#P<0.05;與模型組比較,*P<0.05。
組別 WBC(109個/L)高劑量組 50.15"10.91*中劑量組 42.87"6.93*低劑量組 65.87"6.10 DEX組 18.43"3.83*LPS組 71.80"10.60#NS組 5.94"0.65
2.2 各組Gimsa染色細胞形態及數目觀察
空白組中細胞結構完整,未見多形核白細胞及巨噬細胞浸潤現象,視野范圍內可見細胞數目較少。模型組與空白組相比,細胞數目大量增多,多形核白細胞及巨噬細胞大量浸潤,出現炎癥的明顯跡象,說明模型成功。三個給藥組與LPS組比較均能減少炎性細胞的數目,說明赤芍對于LPS誘導的炎癥反應有一定預防作用,而且中劑量組預防作用強于其他兩劑量組。結果見圖1(×100)及圖2(×400)所示。
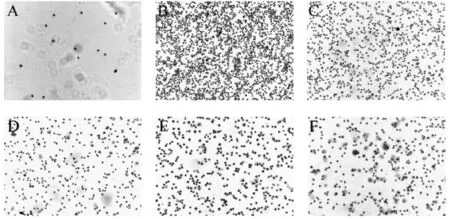
圖1 各組PMN圖涂片顯微鏡觀察(Gemsa染色,×100)
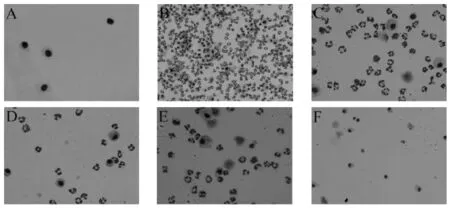
圖2 各組PMN圖涂片顯微鏡觀察(Gemsa染色,×400)
2.3 各組肺W/D ratio變化
肺W/D ratio用來評價肺水腫的嚴重程度。與正常組相比,模型組W/D ratio顯著升高(P<0.05),陽性藥組可顯著降低W/D ratio(P<0.05)。三個給藥組W/D ratio均與模型組有顯著差異,中劑量組降低作用最明顯。結果說明LPS能引起肺泡通透性增加,造成肺損傷,而高、中、低三組預防給藥組均能減低肺水腫嚴重程度。結果見表2所示。
表2 不同給藥劑量各組W/D ratio(±s,n=6)
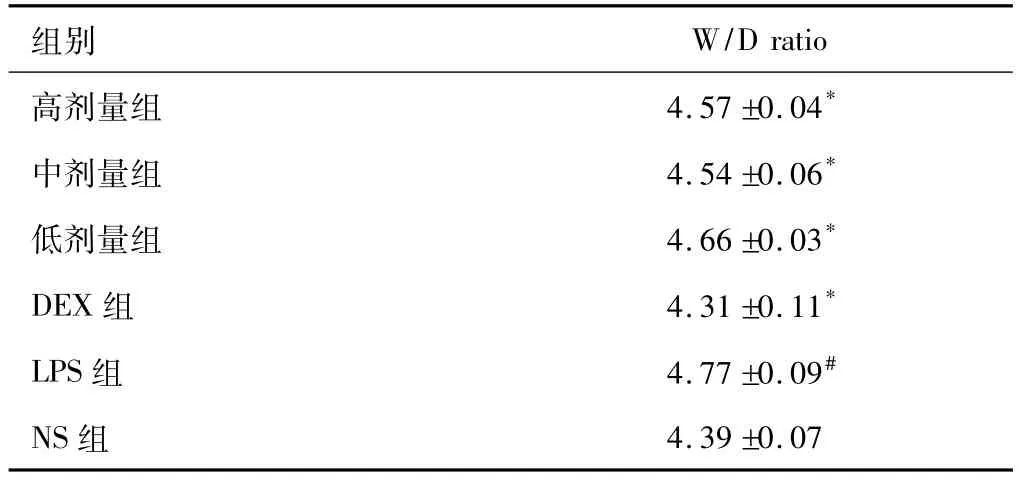
表2 不同給藥劑量各組W/D ratio(±s,n=6)
注:與空白組比較,#P<0.05;與模型組比較,*P<0.05。
組別W/D ratio高劑量組 4.57"0.04*中劑量組 4.54"0.06*低劑量組 4.66"0.03*DEX組 4.31"0.11*LPS組 4.77"0.09#NS組 4.39"0.07
2.4 各組蛋白濃度變化
LPS組蛋白濃度相比空白組明顯升高(P<0.05),高劑量組、中劑量組蛋白濃度均比模型組顯著降低(P<0.05),且兩組作用并無顯著性差異。低劑量組蛋白濃度與模型組無明顯差異。模型組大鼠BALF中蛋白含量急劇增多,說明LPS刺激后大鼠肺泡通透性增加,炎性反應加重,肺損傷較嚴重。而高、中預防給藥組均可以預防肺水腫,低劑量組對于LPS引起的炎性反應無顯著改善作用。結果如表3顯示。
表3 不同給藥劑量各組蛋白濃度(±s,n=6)
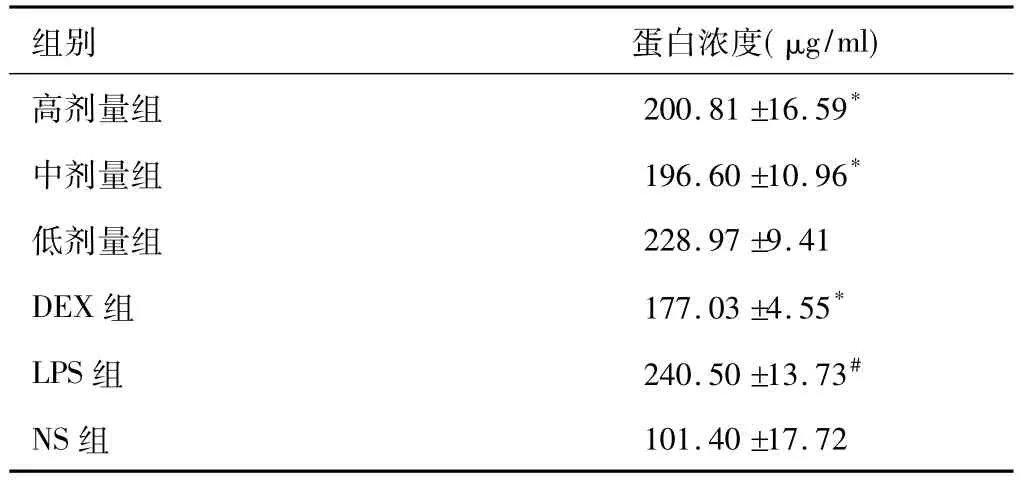
表3 不同給藥劑量各組蛋白濃度(±s,n=6)
注:與空白組比較,#P<0.05;與模型組比較,*P<0.05。
組別 蛋白濃度(μg/ml)高劑量組 200.81"16.59*中劑量組 196.60"10.96*低劑量組 228.97"9.41 DEX組 177.03"4.55*LPS組 240.50"13.73#NS組 101.40"17.72
2.5 肺組織病理形態學考察
NS組中肺泡結構完整,大小均勻,肺泡腔清晰、壁薄。大鼠肺組織中LPS組表現特征性病理改變的跡象,包括間質性水腫,肺充血,肺泡壁和滲透增厚,炎性細胞浸潤,肺泡塌陷和纖維化。LPS誘導的病理變化被高、中劑量組顯著減弱,低劑量組與模型組并無顯著差異。結果見圖3。
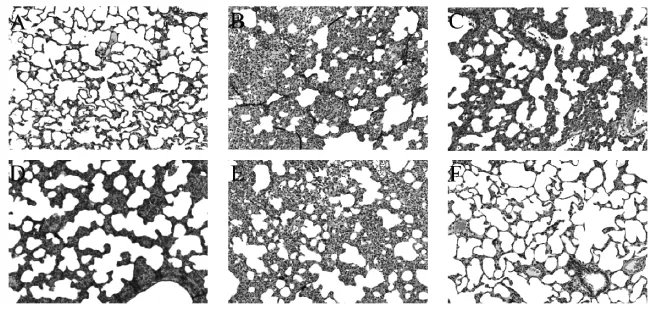
圖3 各組肺組織病理形態學觀察(HE染色,×100)
3 討論
目前多數學者認為,參與炎癥反應的細胞主要有多形核白細胞、巨噬細胞、血管內皮細胞、肺泡上皮細胞等。活化的多形核白細胞會引發呼吸大爆發并釋放大量炎性介質及細胞因子,損傷肺泡上皮細胞和肺毛細血管內皮細胞,導致肺水腫和肺換氣功能障礙。大量炎癥介質及炎癥細胞構成炎癥反應和免疫調節的“細胞網絡”和“細胞因子網絡”,并通過NF-κB、p38絲裂霉素原活化蛋白激酶等信號通路調控機體炎癥反應[6-8]。
根據ALI所引起的臨床表現,一般認為多屬中醫的“暴喘”“結胸”“喘脫”等病證范圍[9],葉天士《溫熱論》中提出衛氣營血辨證,《溫病條辨·上·十一》:“太陰溫病,血從上溢者,犀角地黃湯……”提出血從上溢,肺之化源速竭的溫病第一死癥,在病因病機和臨床表現上均符合現代醫學 ARDS的臨床特征[10]。SARS、流感等重大疫情,也屬中醫溫病學范疇。赤芍出現在很多經方里,如《清瘟敗毒飲》《犀角地黃湯》等,專于涼血解毒化瘀。陳暢等[11]研究發現,赤芍能抑制LPS誘導的中性粒細胞和巨噬細胞在肺內的聚集,減少肺血管內皮的傷害,抑制肺組織iNOS異常高表達,減少NO的生成和釋放,進而減輕肺組織脂質過氧化損傷。
以上結果顯示,赤芍高、中預防給藥組均能明顯減少白細胞數目、肺濕干比、蛋白濃度及降低肺組織病理程度,說明赤芍可以預防由LPS引起的中性粒細胞、巨噬細胞等的炎性細胞浸潤、減輕肺水腫、減少肺血管內皮細胞的損害,低劑量組不能顯著減輕以上癥狀。綜合以上指標,中劑量為最佳給藥劑量,對預防急性肺損傷作用明顯。為進一步研究赤芍作用于大鼠急性肺損傷的藥效物質及作用機制奠定堅實的基礎,具有一定的參考價值。
[1]Mutz C,V Mirakaj,Vagts DA,et al.The neuronal guidance protein netrin-1 reduces alveolar inflammation in aporcine model of acute lung injury[J].Critical care,2010,14(5):189.
[2]Costa EL,Amato MB.The new definition for acute lung injury and acute respiratory distress syndrome:is there room for improvement?[J].Current Opinion in Critical Care,2013,19(1):16-23.
[3]洪輝華,蔡宛如.急性肺損傷的發病機制及中醫藥治療的實驗研究進展[J].浙江中醫藥大學學報,2007,31(1):33-135.
[4]李穎.不同劑量赤芍對馬錢子增效減毒作用影響的實驗研究[J].中醫藥學報,2015,43(6):39-41.
[5]吳修紅,楊東霞,楊波,等.大孔樹脂純化赤芍中芍藥苷的工藝研究[J].中醫藥學報,2012,40(1):74-75.
[6]劉家昌,孫燕妮,彭屹峰,等.益氣補腎活血方對佐劑關節炎大鼠JNK和P38MAPK的影響[J].中醫藥信息,2016,33(5):39-42.
[7]馬李杰,李王平,金發光.急性肺損傷/急性呼吸窘迫綜合征發病機制的研究進展[J].中華肺部疾病雜志,2013,6(1):65-68.
[8]宋芊,相田園,許建梅,等.冬連膠囊對STZ誘導糖尿病腎病大鼠P38mapk、CREB1及TGFβ1蛋白表達的影響[J].中醫藥信息,2016,33(1):1-5.
[9]耿耘,魏星.急性呼吸窘迫綜合征的中醫發病機理探討[J].江西中醫藥,2002,33(5):11-12.
[10]汪東穎,楊愛東,郭永潔,等.急性肺損傷的中醫證治探討及思考[J].遼寧中醫雜志,2008,35(7):1010-1012.
[11]陳暢,夏中元,孟慶濤.赤芍對大鼠內毒素性急性肺損傷保護作用機制的研究[J].中國急救醫學,2005,25(1):41-43.
Preventive Effect of Radix Paeoniae Rubra on Lipopolysaccharide-induced Acute Lung Injury in Rats
HAN Wen-jie,WANG Qing,ZHANG Qi,DING Nan,CAO Jing,CHEN Dan-yang,LI Qiang*
(Beijing University of Chinese Medicine,Beijing 100102,China)
Objective:To probe the preventive effect of different doses of Paeoniae Rubra Radix on lipopolysaccharide-induced acute lung injury in rats,filtering the optimal dose and speculating the possible mechanism.Methods:SD rats were divided into a high dose group,a middle dose group,a low dose group,a positive drug group(DEX group),a model group(LPS group)and a control group(NS group),with 10 rats in each group.The model group was established by intratracheal administration of lipopolysaccharide.12 h later detect the number of white blood cells,protein concentration from the lung lavage fluid and measure wet weight and dry weight of upper lobe of the right lung and observe pathological changes of lower lobe of the right lung.Results:Dexamethasone,the high dose group and the middle dose group could significantly reduce the number of white blood cells(P<0.05),reduce lung wet to dry ratio(W/D)(P<0.05)and protein concentration (P<0.05),relieve pulmonary edema,alveolar structural damage and inflammatory cell infiltration and reduce pulmonary hemorrhage.Conclusion:Radix paeoniae rubra can relieve the acute lung injury induced by lipopolysaccharide and the middle dose is the optimal.
Radix paeoniae rubra;Acute lung injury;Lipopolysaccharide
R285.5
A
1002-2406(2017)02-0014-04
韓文杰(1993-),女,北京中醫藥大學2014級中藥學專業科碩研究生。
李強*(1972-),男,研究員,碩士研究生導師,主要研究方向:中藥藥效物質基礎及功效成分組研究。
2016-06-21
修回日期:2016-07-01

