黃曲霉毒素G1與人血清白蛋白的結(jié)合機(jī)理及分子對接
鐘 紅,王佳曼,馬 良,江 濤
(西南大學(xué)食品科學(xué)學(xué)院,重慶 400715)
黃曲霉毒素G1與人血清白蛋白的結(jié)合機(jī)理及分子對接
鐘 紅,王佳曼,馬 良*,江 濤
(西南大學(xué)食品科學(xué)學(xué)院,重慶 400715)
在模擬人體血液pH 7.4的條件下,用分子對接及其熒光光譜、3D熒光、圓二色譜等方法研究黃曲霉毒素G1(aflatoxin G1,AFG1) 與人血清白蛋白(human serum albumin,HSA)的相互作用。結(jié)果發(fā)現(xiàn),根據(jù)雙對數(shù)方程得出AFG1與HSA結(jié)合反應(yīng)猝滅機(jī)制為靜態(tài)猝滅,4 個溫度條件下結(jié)合常數(shù)數(shù)量級均為104,結(jié)合位點(diǎn)數(shù)近似為1。通過分子對接和熱力學(xué)參數(shù)計算,AFG1結(jié)合在HSA的ⅠB疏水腔中,二者結(jié)合力主要為疏水作用和氫鍵。通過研究體內(nèi)金屬離子對AFG1-HSA反應(yīng)的影響,F(xiàn)e3+、Mg2+能增大AFG1對HSA的親和力,而Zn2+、Cu2+、Mn2+離子則能大大降低AFG1與HSA的親和力。基于F?rster’s能量轉(zhuǎn)移,二者反應(yīng)距離為3.26 nm。3D熒光結(jié)果顯示,二者的結(jié)合反應(yīng)使HSA生色團(tuán)氨基酸殘基疏水性增加,二級結(jié)構(gòu)發(fā)生改變;圓二色譜結(jié)果表明,加入AFG1使得HSA的α-螺旋含量增加。
黃曲霉毒素G1;人血清白蛋白;光譜;分子對接;結(jié)合反應(yīng)
鐘紅, 王佳曼, 馬良, 等. 黃曲霉毒素G1與人血清白蛋白的結(jié)合機(jī)理及分子對接[J]. 食品科學(xué), 2017, 38(5): 86-91.
DOI:10.7506/spkx1002-6630-201705014. http://www.spkx.net.cn
ZHONG Hong, WANG Jiaman, MA Liang, et al. Binding mechanism and molecular docking between aflatoxin G1and human serum albumin[J]. Food Science, 2017, 38(5): 86-91. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201705014. http://www.spkx.net.cn
黃曲霉毒素G1(aflatoxin G1,AFG1)是由黃曲霉(Aspergilus f l avus)和寄生曲霉(Aspergilus parasiticus)產(chǎn)生的主要次級代謝產(chǎn)物之一,主要污染花生、大豆等大宗糧油作物[1-4]。糧油產(chǎn)品產(chǎn)生的黃曲霉毒素中AFG1毒性僅次于AFB1[5]。有研究表明,它比AFB1具有更強(qiáng)的誘發(fā)腎臟瘤的潛力,且與肺癌的發(fā)生有一定的關(guān)聯(lián)[6-8]。目前黃曲霉毒素經(jīng)肝臟代謝引起癌癥的機(jī)理已有很多研究,而在與血清蛋白結(jié)合轉(zhuǎn)運(yùn)到肝臟的毒代動力學(xué)鮮少研究[9-11]。
人血清白蛋白(human serum albumin,HSA)主要由肝臟產(chǎn)生,它是重要的轉(zhuǎn)運(yùn)蛋白,能很好地結(jié)合很多外源性和內(nèi)源性物質(zhì),并通過對有毒代謝產(chǎn)物的螯合,對機(jī)體產(chǎn)生一定的保護(hù)作用,同時也會加強(qiáng)該物質(zhì)的慢性毒作用[12]。黃曲霉毒素經(jīng)食物進(jìn)入消化道,50%被排除體外,50%被吸收進(jìn)入血液和淋巴循環(huán),通過與血清白蛋白形成AFs-HSA復(fù)合物轉(zhuǎn)運(yùn)到人體肝臟,并長期蓄積,通過肝臟代謝活化成強(qiáng)致癌物[13]。
黃曲霉毒素與HSA的反應(yīng)在其毒代動力學(xué)中起著重要的作用。因此研究AFG1與HSA的相互作用對于更深入地了解AFG1的毒理學(xué)機(jī)制和發(fā)展?jié)撛谟行Ы舛緞┖皖A(yù)防措施起著重要作用。本實驗采用計算模擬和實驗分析相結(jié)合的方法研究AFG1與HSA的結(jié)合模式特性,二者相互佐證、相互補(bǔ)充,為AFG1與HSA反應(yīng)的毒動力學(xué)提供多角度的分析。
1 材料與方法
1.1 材料與試劑
AFG1標(biāo)準(zhǔn)儲備液(固體粉末標(biāo)品用甲醇配制成濃度為4.0×10-3mol/L)、HSA(分子質(zhì)量66 000 u,溶于Tris-HCl緩沖液中配制濃度為1.0×10-3mol/L)、Tris美國Sigma-Aldric公司;濃鹽酸、甲醇、氯化鈉、氯化鈣、氯化鎂、氯化鐵、氯化鋅、氯化銅、氯化錳 成都市科龍化工試劑廠。
金屬離子儲存液由Tris-HCl緩沖液配制,pH 7.40、0.05 mol/L Tris-HCl緩沖液含0.10 mol/L NaCl。
1.2 儀器與設(shè)備
PHS-25酸度計 杭州雷磁分析儀器廠;UV-2450紫外分光光度計 日本Shimadzu公司;F-4500熒光分光光度計 日本Hitachi公司;MOS-450圓二色譜儀 法國Bio-Logic公司;超純水系統(tǒng) 美國Milli-Pore公司。
1.3 方法
1.3.1 內(nèi)濾光的效應(yīng)的校正
由于AFG1在HSA的激發(fā)波長280 nm處有較強(qiáng)吸收,隨著AFG1濃度增加,其猝滅行為中存在內(nèi)濾光效應(yīng),需要進(jìn)行相應(yīng)的校正。校正方法如下:在1 cm比色皿中加入2.0 mL緩沖液,用微量進(jìn)樣器每次加入一定體積濃度為4.0×10-3mol/L的AFG1溶液,使AFG1濃度分別2.0×10-6、4.0×10-6、6.0×10-6、8.0×10-6、10.0×10-6、12.0×10-6、14.0×10-6、16.0×10-6、 18.0×10-6、20.0×10-6mol/L,混勻后,掃描紫外波段為190~400 nm。結(jié)果中所用的熒光數(shù)據(jù)均為校正后的值。按公式(1)對實驗中獲得的熒光值進(jìn)行校正[14]:

式中:Fcor為校正后的熒光值;Fobs為校正前的熒光值;Aex為HSA激發(fā)波長下相應(yīng)濃度的AFG1吸收度;Aem為發(fā)射波長下相應(yīng)濃度的AFG1吸收度。
1.3.2 不同溫度熒光猝滅和3D熒光的測定
1 cm石英比色皿中加入1.0 mL 2.0×10-6mol/L的HSA溶液,用微量進(jìn)樣器每次加入一定量濃度為4.0×10-3mol/L的A F G1溶液,使A F G1濃度分別2.0×1 0-6、4.0×10-6、6.0×10-6、8.0×10-6、10.0×10-6、12.0×10-6、14.0×10-6、16.0×10-6、18.0×10-6、20.0×10-6mol/L,混勻后,在不同的溫度條件(298、303、308、313 K)條件下,固定激發(fā)波長λex=280 nm,狹縫寬度為5 nm,發(fā)射波長在220~500 nm范圍內(nèi)分別掃描HSA的熒光光譜及HSA與AFG1作用后的熒光光譜。
將激發(fā)波長掃描范圍設(shè)置為200~450 nm,發(fā)射波長設(shè)置為220~600 nm,激發(fā)波長每遞增5 nm掃描一次譜圖,用F-4500熒光分光光度計測定,可分別得到HSA及HSA與AFG1作用后的三維熒光光譜。
1.3.3 圓二色譜測定
配制1.0×10-6mol/L的HSA和HSA-AFG1復(fù)合物混合液(HSA濃度為1.0×10-6mol/L;AFG1濃度為1.0×10-5mol/L),單位掃描間隔設(shè)置為1 nm,單位掃描時間為2 s,掃描波段為190~250 nm。
1.3.4 AFG1與HSA的分子對接
先以Chemdraw畫出AFG1配體的結(jié)構(gòu)簡圖,(HSA結(jié)構(gòu)從Protein Data Bank(PDB)數(shù)據(jù)庫獲取,利用Autodockb 4.0進(jìn)行分子對接,設(shè)置遺傳算法計算次數(shù)(number of GA runs)設(shè)置為10,種群數(shù)(population size)設(shè)置為150,最大迭代次數(shù)(maximum number of evals)設(shè)置為25 000 000,其他參數(shù)采用默認(rèn)值。其次是搜索方法采用拉馬克遺傳算法,最后保存對接參數(shù)為dpf文。最后進(jìn)行分子對接,輸出dlg文件。
1.3.5 金屬離子對AFG1與HSA結(jié)合的影響
在1 cm比色皿中加入1.0 mL濃度為2.0×10-6mol/L的HSA溶液,用微量進(jìn)樣器加入配制好的金屬離子儲存液1 μL,混勻后掃描熒光光譜,再用進(jìn)樣器每次加入一定量的AFG1標(biāo)液,使AFG1濃度分別為2.0×10-6、4.0×10-6、6.0×10-6、8.0×10-6、10.0×10-6、12.0×10-6、1 4.0×1 0-6、1 6.0×1 0-6、1 8.0×1 0-6、20.0×10-6mol/L,混勻后,在25 ℃條件下,固定激發(fā)波長λex=280 nm,狹縫寬度為5 nm,發(fā)射波長在220~500 nm范圍內(nèi)掃描熒光光譜。
2 結(jié)果與分析
2.1 AFG1與HSA的結(jié)合常數(shù)、結(jié)合位點(diǎn)數(shù)研究
AFG1與HSA結(jié)合時,HSA熒光強(qiáng)度和AFG1濃度與結(jié)合常數(shù)和結(jié)合位點(diǎn)數(shù)的關(guān)系滿足方程式[15]:

式中:F0和F分別為加入毒素前后的HSA熒光強(qiáng)度;Q0和P0分別為AFG1和HSA的濃度/(mol/L);K和n分別為結(jié)合常數(shù)和結(jié)合位點(diǎn)數(shù)。利用公式,通過(lg(F0-F)/F)對lg{[Q0]-(F0-F)/F0×[P0]}進(jìn)行線性擬合得到直線的斜率和截距,計算得到AFG1與HSA在不同溫度條件下的n和K,線性擬合效果如圖1所示:
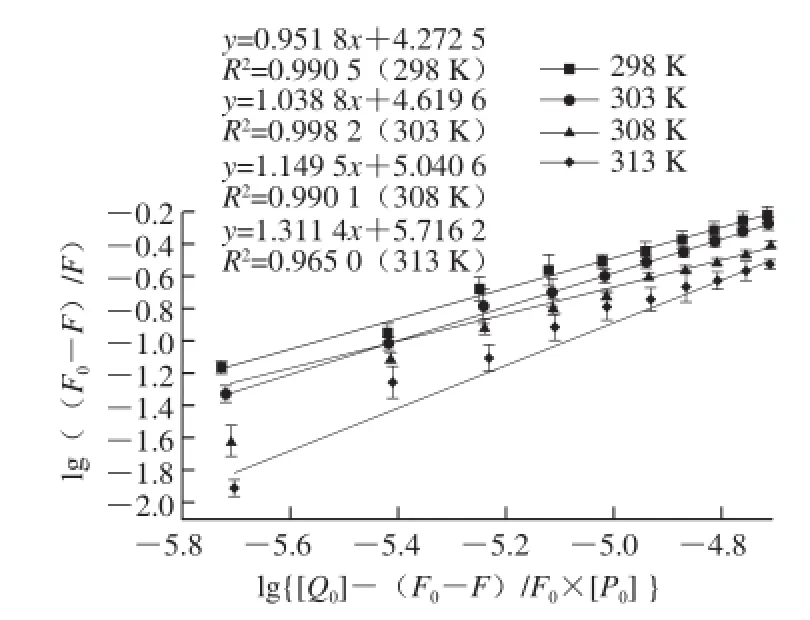
圖 1 不同溫度條件下的AFG1-HSA的雙對數(shù)曲線Fig. 1 Double logarithmic curves of AFG1-HSA binding at different temperatures
通過線性擬合,AFG1-HSA在4 個溫度條件下得到的結(jié)合位點(diǎn)數(shù)n值分別為0.951 8、1.038 8、1.149 5、1.311 4,都約為1,表明一分子的HSA與一分子AFG1結(jié)合,且結(jié)合過程中只有一個結(jié)合位點(diǎn)。通過計算,4 個溫度條件下的結(jié)合常數(shù)K值分別為3.08×104、2.80×104、2.43×104、2.28×104L/mol,K值隨著溫度的升高而變小,說明反應(yīng)過程中形成了不穩(wěn)定的復(fù)合物,溫度升高,復(fù)合物發(fā)生分解,進(jìn)一步說明猝滅機(jī)制是靜態(tài)猝滅[16]。此外,AFG1-HSA在4 個溫度條件下K值的數(shù)量級都為104,同時溫度對結(jié)合常數(shù)的影響不大,說明AFG1與HSA存在較強(qiáng)的親和力[17]。毒素分子與HSA的高親和力結(jié)合,不僅會延長毒素在血液中的半衰期,更有利于毒素對器官的定位和形成高劑量的毒素。
2.2 分子對接分析AFG1和HSA結(jié)合特性
為了研究AFG1與HSA的結(jié)合位點(diǎn)、鍵合機(jī)理和相互作用力,利用Autodock程序進(jìn)行分子對接研究。HSA由3 個相似的結(jié)構(gòu)域(Ⅰ~Ⅲ)組成:域Ⅰ(1~195)、域Ⅱ(196~383)、域Ⅲ(384~585),每個結(jié)構(gòu)域可以分為A、B兩個亞結(jié)構(gòu)域(subdomain),每個亞結(jié)構(gòu)域又分為3 個螺旋(X、Y、Z),以槽口相對的方式形成圓筒狀結(jié)構(gòu),幾乎所有的疏水性氨基酸都包埋在圓筒腔內(nèi)部,構(gòu)成疏水性腔[18-19],如圖2所示。

圖 2 HSA的X-射線晶體結(jié)構(gòu)Fig. 2 X-Ray crystallographic structure of HSA
通過Autodock程序進(jìn)行HSA與AFG1的分子對接模擬計算,二者在298 K時的Gibbs自由能(Δ G)為-30.646 kJ/mol,最佳對接構(gòu)象(結(jié)合位點(diǎn)為HSA的ⅠB疏水腔)見圖3。在ⅠB疏水腔中有兩個結(jié)合位點(diǎn):一個位點(diǎn)為L1鏈、α-螺旋h7和h8之間,為遠(yuǎn)端位點(diǎn);另一個位點(diǎn)在L1和α-螺旋h9之間,為近端位點(diǎn)[19]。

圖 3 AFG1與HSA的最佳分子對接圖Fig. 3 Best molecular modeling for the interaction between AFG1and HSA
圖3顯示,AFG1整個分子嵌在ⅠB疏水腔的近端結(jié)合位點(diǎn),說明二者主要的作用力為疏水作用。另外還能觀察到AFG1的外環(huán)酯鍵的羰基氧與精氨酸(Arg-114)形成了兩個氫鍵,鍵長為2.2 ?和3.0 ?,同時內(nèi)環(huán)酯鍵羰基氧與組氨酸(His-146)、橋連五環(huán)醚基氧與酪氨酸(Tyr-138)各形成了一個氫鍵作用,鍵長分別為2.4 ?和2.0 ?,進(jìn)一步穩(wěn)定了AFG1-HSA復(fù)合物且增加了AFG1在HSA疏水腔中的疏水性。此外,AFG1雙呋喃環(huán)上的雙鍵能與附近的氨基酸His-146、Phe-149、Phe-157發(fā)生π-π*共軛作用,與呋喃環(huán)上沒有雙鍵的AFG1相比,AFG1-HSA復(fù)合物結(jié)構(gòu)更為穩(wěn)定,在血液中存在的半衰期時間更長,對人體來說,潛在毒性更大。
此外,有研究表明ⅠB結(jié)構(gòu)域是復(fù)雜的雜環(huán)分子的主要結(jié)合位點(diǎn)[20]。而通過X-晶體衍射研究,含有雜環(huán)結(jié)構(gòu)的植物抗癌藥物喜樹堿也結(jié)合在HSA的該疏水腔內(nèi)[20]。在黃曲霉毒素引起的肝癌治療中,在手術(shù)前后,用喜樹堿藥物治療可以增加手術(shù)的成活率,這或許不僅跟喜樹堿本身的抗癌性有關(guān),還與其能從血清蛋白中置換出黃曲霉毒素,減小黃曲霉毒素與血清蛋白的親和力,從而增加黃曲霉毒素自由濃度,加強(qiáng)其代謝有關(guān)。有赭曲霉毒素A(ochratoxin A,OTA)動物實驗表明,將OTA從血清蛋白中置換出來可以加快消除OTA在靶器官中的積累[21]。因此研究能降低黃曲霉毒素與HSA親和力的物質(zhì),能發(fā)展?jié)撛诘狞S曲霉毒素中毒預(yù)防措施。
2.3 金屬離子對AFG1與HSA結(jié)合反應(yīng)的影響
在小分子與血清白蛋白相互結(jié)合并被轉(zhuǎn)運(yùn)的過程中,外源或內(nèi)源金屬離子可能會對AFG1-HSA的相互作用過程產(chǎn)生影響。本實驗考察了人體內(nèi)常見的6 種金屬離子對AFG1與HSA親和力的影響,結(jié)果見圖4。

圖 4 金屬離子對AFG1-HSA結(jié)合常數(shù)的影響Fig. 4 Effect of metal ions on the binding constant of AFG1to HSA
由圖4可看出,加入Ca2+對AFG1-HSA的相互作用沒有影響,結(jié)合常數(shù)幾乎不變,而Fe3+、Mg2+的參與卻增大了AFG1對HSA的親和力,表明這兩種金屬離子參與降低了AFG1的游離濃度,有助于AFG1分子持久緩釋的發(fā)揮毒性,增加了個體攝入黃曲霉毒素后患癌癥的風(fēng)險。Zn2+、Cu2+、Mn2+的參與則能大大降低AFG1與HSA的親和力,具有一定的潛在預(yù)防AFG1對人體持久危害的作用,且Zn2+的效果最好。
2.4 熱力學(xué)參數(shù)和結(jié)合力的確定
一般情況下,蛋白質(zhì)與配體形成超分子復(fù)合物主要通過疏水作用、靜電作用、范德華力及氫鍵等來實現(xiàn)[22]。ΔH(焓變)、ΔS(熵變)、ΔG(自由能變化)可通過Van’t Hoff方程進(jìn)行計算,再根據(jù)熱力學(xué)參數(shù)判斷AFG1與HSA主要作用力類型。

表 1 不同溫度條件下的AFG1-HSA熱力學(xué)參數(shù)Table 1 Thermodynamic parameters of AFG1-HSA system at different temperatures
由表1可知,AFG1與HSA反應(yīng)的ΔG<0,說明AFG1與HSA反應(yīng)過程為自發(fā)過程。Ross等[23]通過大量實驗結(jié)果,得出了通過熱力學(xué)參數(shù)確定蛋白與配體作用力類型的判斷依據(jù)。結(jié)果顯示在4 個溫度條件下ΔH<0,說明反應(yīng)是放熱反應(yīng)。ΔS>0,說明AFG1與HSA之間存在疏水作用力。由于HSA的復(fù)雜結(jié)構(gòu),在實際與配體的反應(yīng)中,往往同時存在幾種相互作用力[24],而ΔH<0,說明反應(yīng)中還存在一定的氫鍵作用。通過ΔH和ΔS推斷出,AFG1與HSA結(jié)合作用力主要是疏水作用力和氫鍵,且ΔG值、相互作用力類型與分子對接結(jié)果一致。在研究AFG1的降毒過程中,增加AFG1的親水基團(tuán),降低其進(jìn)入HSA疏水腔的概率,可以降低AFG1與HSA的親和力,從而達(dá)到降低AFG1對人體毒性作用的效果。
2.5 AFG1與HSA結(jié)合距離的研究
能量轉(zhuǎn)移現(xiàn)象是內(nèi)源性熒光發(fā)色基團(tuán)發(fā)生猝滅,本質(zhì)上是存在一個分子發(fā)射光譜(供體)與另一個分子吸收光譜(受體)重疊,而此時分子之間在偶極-偶極共振耦合作用下使得能量發(fā)生轉(zhuǎn)移。根據(jù)F?rster’s非輻射能量轉(zhuǎn)移,供體和受體之間的距離r與轉(zhuǎn)移效率E、臨界距離R0的關(guān)系式如下[25]:
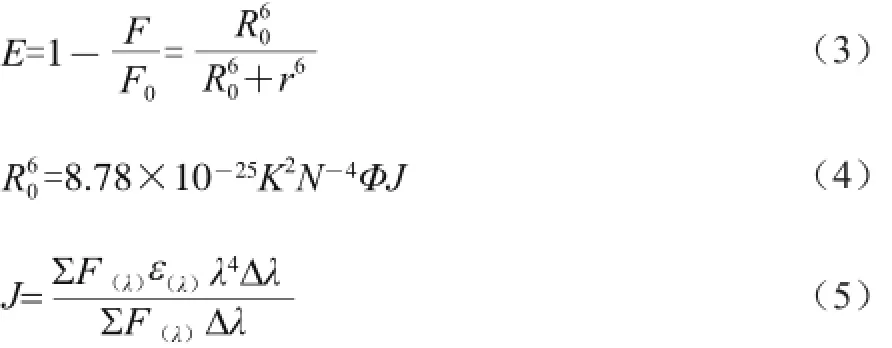
式中:F0和F分別是加入供體前后的HSA熒光值;K2為偶極空間取向因子;N是介質(zhì)折射指數(shù);J為毒素的吸收光譜與蛋白質(zhì)的熒光發(fā)射光譜之間的重疊積分;F(λ)是供體在波長λ時的熒光強(qiáng)度;ε(λ)是毒素在波長λ處的摩爾吸光系數(shù)。毒素的紫外光譜與HSA的熒光重疊圖譜見圖5。在該實驗條件下,有報道K2=2/3、N=1.336和Φ=0.118[26]。

圖 5 熒光發(fā)射光譜與AFG1紫外吸收光譜重疊圖Fig. 5 Overlap between fl uorescence emission spectra and absorption spectra of HSA
根據(jù)上述公式計算得出,在AFG1-HSA體系中:J= 1.16×10-14(cm3·L)/mol,E=0.17,R0=2.51 nm,r=3.26 nm。數(shù)據(jù)結(jié)果表明AFG1與HSA反應(yīng)的結(jié)合距離r小于7 nm,且同時符合了0.5 R0<r<2.0 R0,說明AFG1與HSA在結(jié)合過程中發(fā)生了非輻射能量轉(zhuǎn)移,導(dǎo)致HSA熒光猝滅,而R0<r,說明非輻射能量轉(zhuǎn)移引起的熒光猝滅幾率較小,靜態(tài)猝滅占主要地位。
2.6 AFG1與HSA的3D熒光掃描

圖 6 HSA與AFG1-HSA的3D熒光譜圖和相對應(yīng)的等高圖Fig. 6 Three-dimensional fl uorescence spectra and contour diagrams of HSA and AFG1-HSA
三維熒光光譜體現(xiàn)的是熒光強(qiáng)度隨激發(fā)和發(fā)射波長同時變化的信息,引起譜圖特征以及豐富的信息含量,為小分子與生物相互作用機(jī)理的研究提供了有力手段[27]。HSA及HSA與AFG1相互作用后的三維熒光及其等高圖見圖6。
HSA在激發(fā)波長為230 nm(峰1)和280 nm(峰2),發(fā)射波長為340 nm處分別有一個最大吸收峰。峰1主要顯示色氨酸和酪氨酸殘基的光譜特性;峰2主要顯示多肽鏈主鏈結(jié)構(gòu)的熒光特征,是由于多肽骨架結(jié)構(gòu)具有C=O發(fā)生n–π*躍遷引起的,該峰的熒光強(qiáng)度與蛋白質(zhì)的二級結(jié)構(gòu)密切相關(guān)[28]。從圖6中的3D熒光的高度及其等高圖的疏密程度可以看出,加入AFG1后,HSA的峰1和峰2的熒光強(qiáng)度都呈現(xiàn)明顯下降,說明AFG1的加入使得HSA二級結(jié)構(gòu)發(fā)生一定的變化。HSA的峰1位置為280 nm/340 nm(λex/λem),峰2位置為235 nm/340 nm;加入AFG1后峰1位置為280 nm/335 nm,峰2位置為235 nm/335 nm,兩個峰的stoke位移都發(fā)生了約5 nm藍(lán)移,說明AFG1與HSA的結(jié)合引起了HSA中部分肽鍵及其發(fā)色熒光基團(tuán)微環(huán)境的疏水性增加,使整個大分子更趨向于折疊狀態(tài)。
2.6 AFG1與HSA反應(yīng)的圓二色譜分析
不同二級結(jié)構(gòu)的蛋白質(zhì)或多肽所產(chǎn)生的CD譜帶的位置、吸收的強(qiáng)弱都不相同。因此CD譜帶的π–π*躍遷)和222 nm(肽鍵的n–π*躍遷)處出現(xiàn)負(fù)的吸收峰,α-螺旋結(jié)構(gòu)的含量可用公式(6)、(7)求得[29]:

式中:θobs為208 nm波長處的橢圓度/mdeg;MRE為平均殘基的橢圓度/mdeg;Cp為HSA的濃度/(mol/L);n為氨基酸殘基數(shù)目(HSA中氨基酸殘基數(shù)目為585);l為樣品池的光徑(0.1 cm)。實驗中測定得到了cHSA∶cAFG1=1∶10時體系的CD光譜,結(jié)果見圖7。

圖 7 AFG1與HSA的圓二色譜圖Fig. 7 CD Spectra of AFG1and HSA
由圖7發(fā)現(xiàn),在AFG1存在的條件下,HSA的208 nm和222 nm處的α-螺旋特征峰顯著地體現(xiàn)出來。通過計算,單獨(dú)HSA的α-螺旋含量為49.27%,加入10 μmol/LAFG1后,HSA的α-螺旋含量增加到60.60%。α-螺旋結(jié)構(gòu)主要是由多肽鏈上羰基(—CO)和氨基(NH—)之間的氫鍵穩(wěn)定[30]。結(jié)果說明AFG1與HSA的結(jié)合誘導(dǎo)了HSA多肽鏈的重排,引起原有的氫鍵網(wǎng)絡(luò)的結(jié)構(gòu)改變,使得卷曲結(jié)構(gòu)增加,肽鏈的二級結(jié)構(gòu)發(fā)生了較大變化。推斷是AFG1與HSA相互作用,使得蛋白質(zhì)分子的疏水性增強(qiáng),導(dǎo)致HSA的肽鏈結(jié)構(gòu)收縮,使得α-螺旋含量增加。說明血清蛋白在運(yùn)輸AFG1的過程中,不僅改變了氨基酸所處的微環(huán)境,還使得HSA二級結(jié)構(gòu)發(fā)生較大變化,該過程對HSA有一定的毒害作用。
3 結(jié) 論
通過研究AFG1與HSA相互作用,可獲取AFG1在體內(nèi)被運(yùn)轉(zhuǎn)、分配和代謝過程的重要信息。本實驗主要運(yùn)用分子對接及其各種光譜方法,獲得AFG1-HSA體系的作用信息。研究發(fā)現(xiàn)AFG1能對HSA產(chǎn)生很強(qiáng)的猝滅效果,且猝滅機(jī)制為生成復(fù)合物的靜態(tài)猝滅,二者結(jié)合常數(shù)數(shù)量級為104,親和力較強(qiáng),且結(jié)合位點(diǎn)數(shù)約為1。人體內(nèi)必需的金屬離子能夠增大或降低AFG1對HSA的親和力,影響AFG1對人體的毒性行為。通過計算,二者反應(yīng)距離為
3.26 nm,存在非輻射能量轉(zhuǎn)移。AFG1與HSA的最佳結(jié)合位點(diǎn)是HSA的ⅠB疏水腔中,主要結(jié)合力是疏水作用和氫鍵,且二者反應(yīng)引起了HSA生色團(tuán)氨基酸殘基微環(huán)境疏水性增加和二級結(jié)構(gòu)α-螺旋含量增加。該研究對于深入分析小分子毒素在人體內(nèi)的中毒機(jī)理及其暴露的風(fēng)險評估提供了重要信息,且為發(fā)展?jié)撛诘闹卸绢A(yù)防措施提供基礎(chǔ)理論研究。
[1] CORRIER D E. Mycotoxicosis: mechanisms of immunosuppression[J]. Veterinary Immunology and Immunopathology, 1991, 30(1): 73-87. DOI:10.1016/0165-2427(91)90010-A.
[2] RICHARD J L. Some major mycotoxins and their mycotoxicoses: an overview[J]. International Journal of Food Microbiology, 2007, 119(1): 3-10. DOI:10.1016/j.ijfoodmicro.2007.07.019.
[3] RICHARD E, HEUTTE N, SAGE L, et al. Toxigenic fungi and mycotoxins in mature corn silage[J]. Food and Chemical Toxicology, 2007, 45(12): 2420-2425. DOI:10.1016/j.fct.2007.06.018.
[4] SCHENZEL J, FORRER H R, VOGELGSANG S, et al. Mycotoxins in the environment: I. production and emission from an agricultural test field[J]. Environmental Science & Technology, 2012, 46(24): 13067-13075. DOI:10.1021/es301557m.
[5] GROOPMAN J D, WOGAN G N. Chemical Carcinogenesis[M]. New York: Humana Press, 2011: 113-133. DOI:10.1007/978-1-61737-995-6_6.
[6] 馬良, 張敏, 張宇昊, 等. 黃曲霉毒素G1與β-環(huán)糊精及其衍生物超分子體系的熒光光譜研究[J]. 食品科學(xué), 2012, 33(12): 143-148.
[7] WOGAN G N, EDWARDS G S, NEWBERNE P M. Structureactivity?relationships?in?toxicity?and?carcinogenicity?of?af l atoxins?and?analogs[J]. Cancer Research, 1971, 31(12): 1936-1942.
[8]?ROGERS?A?E.?Variable?effects?of?a?lipotrope-def i cient,?high-fat?diet?on chemical carcinogenesis in rats[J]. Cancer Research, 1975, 35(9): 2469-2474.
[9]?ANSARI?F,?KHODAIYAN?F,?REZAEI?K,?et?al.?Modelling?of?af l atoxin?G1reduction by kefir grain using response surface methodology[J]. Journal of Environmental Health Science and Engineering, 2015, 13(1): 1. DOI:10.1186/s40201-015-0190-2.
[10] EPSTEIN S M, BARTUS B, FARBER E. Renal epithelial neoplasms induced in male Wistar rats by oral af l atoxin B1[J]. Cancer Research, 1969, 29(5): 1045-1050.
[11] AYRES J L, LEE D J, WALES J H, et al. Aflatoxin structure and hepatocarcinogenicity in rainbow trout (Salmo gairdneri)[J]. Journal of the National Cancer Institute, 1971, 46(3): 561-564. DOI:10.1093/jnci/46.3.561.
[12] CUI Fengling, WANG Junli, CUI Yanrui, et al. Fluorescent investigation of the interactions between N-(p-chlorophenyl)-N’-(1-naphthyl) thiourea and serum albumin: synchronous fluorescence determination of serum albumin[J]. Analytica Chimica Acta, 2006, 571(2): 175-183. DOI:10.1016/j.aca.2006.05.002.
[13] 王清蘭, 陶艷艷, 劉成海. 黃曲霉毒素體內(nèi)吸收與代謝的干預(yù)措施研究進(jìn)展[J]. 腫瘤, 2007, 27(5): 415-418. DOI:10.3781/ j.issn.1000-7431.2007.05.021.
[14] MENDON?A A, ROCHA A C, DUARTE A C, et al. The inner fi lter effects and their correction in fl uorescence spectra of salt marsh humic matter[J]. Analytica Chimica Acta, 2013, 788: 99-107. DOI:10.1016/ j.aca.2013.05.051.
[15] CAO Shina, LIU Baosheng, LI Zhiyun, et al. A fluorescence spectroscopic study of the interaction between glipizide and bovine serum albumin and its analytical application[J]. Journal of Luminescence, 2014, 145: 94-99. DOI:10.1016/j.jlumin.2013.07.026.
[16] GE F, JIANG L, LIU D, et al. Interaction between alizarin and human serum albumin by fl uorescence spectroscopy[J]. Analytical Sciences, 2011, 27(1): 79-84. DOI:10.2116/analsci.27.79.
[17] 王俊杰. 有機(jī)農(nóng)藥分子與牛血清白蛋白相互作用研究[D]. 南昌: 南昌大學(xué), 2008: 30-31.
[18] HE X M, CARTER D C. Atomic structure and chemistry of human serum albumin[J]. Nature, 1992, 358: 209-215. DOI:10.1038/358209a0.
[19] CARTER D C, HO J X. Structure of serum albumin[J]. Advances in Protein Chemistry, 1994, 45: 153-203. DOI:10.1016/S0065-3233(08)60640-3.
[20] WANG Z M, HO J X, RUBLE J R, et al. Structural studies of several clinically important oncology drugs in complex with human serum albumin[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2013, 1830(12): 5356-5374. DOI:10.1016/j.bbagen.2013.06.032.
[21] POóR M, KUNSáGI-MáTé S, CZIBULYA Z, et al. Fluorescence spectroscopic investigation of competitive interactions between ochratoxin A and 13 drug molecules for binding to human serum albumin[J]. Luminescence, 2013, 28(5): 726-733. DOI:10.1002/bio.2423.
[22] N?RBY J G, OTTOLENGHI P, JENSEN J. Scatchard plot: common misinterpretation of binding experiments[J]. Analytical Biochemistry, 1980, 102(2): 318-320. DOI:10.1016/0003-2697(80)90160-8.
[23] ROSS P D, SUBRAMANIAN S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3102. DOI:10.1021/bi00514a017.
[24] LAKOWICZ J R. Principles of fluorescence spectroscopy[M]. New York: Springer US, 1999: 25-61. DOI:10.1007/978-1-4757-3061-6_2.
[25] SHAHABADI N, HADIDI S. Molecular modeling and spectroscopic studies on the interaction of the chiral drug venlafaxine hydrochloride with bovine serum albumin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 122: 100-106. DOI:10.1016/ j.saa.2013.11.016.
[26] BERTUCCI C, DOMENICI E. Reversible and covalent binding of drugs to human serum albumin: methodological approaches and physiological relevance[J]. Current Medicinal Chemistry, 2002, 9(15): 1463-1481. DOI:10.2174/0929867023369673.
[27] 劉志宏, 蔡汝秀. 三維熒光光譜技術(shù)分析應(yīng)用進(jìn)展[J]. 分析科學(xué)學(xué)報, 2000, 16(6): 516-523. DOI:10.3969/j.issn.1006-6144.2000.06.017.
[28] ROY A S, PANDEY N K, DASGUPTA S. Preferential binding of fisetin to the native state of bovine serum albumin: spectroscopic and docking studies[J]. Molecular Biology Reports, 2013, 40(4): 3239-3253. DOI:10.1007/s11033-012-2399-9.
[29] SHAHABADI N, FILI S M. Molecular modeling and multispectroscopic studies of the interaction of mesalamine with bovine serum albumin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 118: 422-429. DOI:10.1016/j.saa.2013.08.110.
[30] SANO T, OHNO T, OTSUKA-FUCHINO H, et al. Carp natural actomyosin: thermal denaturation mechanism[J]. Journal of Food Science, 1994, 59(5): 1002-1008. DOI:10.1111/j.1365-2621.1994.tb08177.x.
Binding Mechanism and Molecular Docking between Af l atoxin G1and Human Serum Albumin
ZHONG Hong, WANG Jiaman, MA Liang*, JIANG Tao
(College of Food Science, Southwest University, Chongqing 400715, China)
The?interaction?between?the?mycotoxin?af l atoxin?G1(AFG1) and human serum albumin (HSA) was investigated by?molecular?docking,?f l uorescence?spectroscopy,?3D?f l uorescence?spectrum,?and?circular?dichroism?(CD)?under?simulated?physiological conditions (pH 7.4). According to the double logarithmic equation, the major binding mechanism between AFG1and HSA was a static quenching process. At four different temperatures, the magnitude of binding constants was 104and the number of binding sites was approximate to 1. Through the molecular docking and the calculation of thermodynamic parameters, the binding site of AFG1was in the ⅠB hydrophobic cavity, and hydrophobic interaction and hydrogen bonding were the major forces in the binding process. By studying the effect of metal ions on AFG1-HSA?reaction,?the?aff i nity?of?AFG1to HSA could be increased by Mg2+and Fe3+but greatly reduced by Zn2+, Mn2+and Cu2+. The binding distance between AFG1and?HSA?was?calculated?to?be?3.26?nm?based?on?F?rster’s?non-radiation?energy?transfer?theory.?The?3D?f l orescence?spectra revealed that the microenvironment of amino acid residues became more hydrophobic after the binding reaction. CD spectra revealed that the conformation of HSA was changed during the binding reaction as shown by an increase in α-helix. Key words: af l atoxin?G1(AFG1); human serum albumin (HSA); spectrum; molecular docking; binding interaction
10.7506/spkx1002-6630-201705014
R994.4
A
2016-09-10
國家重點(diǎn)基礎(chǔ)研究發(fā)展計劃(973計劃)項目(2013CB127803);國家自然科學(xué)基金青年科學(xué)基金項目(31301476)
鐘紅(1991—),女,碩士研究生,研究方向為食品安全與質(zhì)量控制。E-mail:625444055@qq.com
*通信作者:馬良(1979—),女,副教授,博士,研究方向為食品安全與食品檢測技術(shù)。E-mail:zhyhml@163.com

