新生兒期母子隔離與撫觸刺激對成年后大鼠社會交往行為的影響
安勇博 梁文英 李軼雯 劉璐 王冬青 戴笑顏 馬馳 錢驛 馬瑞 丁瞳 張嶸
童年期遭遇負面生活經歷會增加日后患精神疾病(如抑郁癥、焦慮癥)的可能[12]。孤獨癥譜系綜合征是一類永久性精神發育障礙,癥狀體現在不同程度的交流困難及重復刻板行為。2009年統計美國的孤獨癥譜系綜合征患病率為1/110[3],而2015年已增至1/45[4]。ASD的病因及發病機制仍在探索中。目前認為,該疾病是由于一系列遺傳因素加環境危險因素導致。關于社會環境因素,兒童成長過程中的家庭因素是極其重要的。孤兒較正常兒童明顯更容易有認知功能障礙以及心理發育缺陷[5]。家庭因素的負面影響對中國農村地區的兒童也尤為明顯。中國經濟等方面的高速發展吸引了許多外地農村人口大量涌入大城市,鑒于這類人群無條件令自己的孩子在大城市和自己生活,他們只能將孩子留在家鄉讓其他親戚撫養。這些兒童被稱為留守兒童。2000—2013年,中國留守兒童的數量從2千萬增至6千萬以上[6]。而與雙親隔離使得留守兒童成為精神發育障礙相關疾病的易患人群[7],因此,社會環境因素對社會行為以及精神健康的影響受到越來越多的關注[6]。
為了探究不同家庭生活背景對孤獨癥發病的影響,本研究以大鼠新生兒期隔離(neonatal isolation,NI)作為動物模型來模擬兒童早期被忽視的逆境,以新生兒撫觸刺激(neonatal tactile stimulation,NTS)來模擬兒童早期溫和的社會環境,之后對大鼠成年后的社會行為進行觀察,以揭示早期處理的影響。常用的NI模型是每日母鼠與子鼠隔離3 h,先前研究結果表明,此操作會增加大鼠幼年時期焦慮水平[89],損害認知功能[10],以及增加大鼠幼年期、成年期的侵略性。異常行為改變常常伴隨神經內分泌系統的異常,比如下丘腦垂體腎上腺軸(HPA軸)調節功能異常。然而,母子隔離對子鼠的長期影響因子鼠性別及隔離處理細節的不同呈現不一樣的結果[11]。NTS是另一種對大鼠的新生兒期社會環境模擬處理,這類處理將幫助子鼠更加適應壓力環境,并能降低子鼠成年后HPA軸的興奮水平[12]。Todeschin等[13]研究顯示,NTS降低雄性子鼠成年后的社交能力。本實驗室調查研究發現,孤獨癥兒童比正常兒童幼年遭遇與父母的隔離的比率更高(181%和65%),且孤獨癥兒童與父母的親密親子互動顯著低于正常兒童(218%和478%),提示親密的親子關系也許具有潛在的預防與治療效果,其背后蘊藏的機理仍不明確(待發表)。
催產素(oxytocin,OXT)和精氨酸后葉加壓素(arginine vasopressin,AVP)是下丘腦室旁核(paraventricular nucleus,PVN)與視上核(supraoptic nucleus,SON)產生的2種神經肽。2種肽類物質對調節哺乳動物社交行為有重要作用。PVN與SON中的大細胞神經元的軸突會延續至垂體后葉,在那里將OXT與AVP釋放入外周血液循環。PVN中的小細胞性神經元則會將兩種神經肽釋放至杏仁核、海馬、伏隔核等腦區。對動物而言,這兩種神經肽對于社會識別、記憶、配對有重要作用。對人類而言,2種神經肽對調控焦慮、信任、社會識別具有重要作用[14]。研究還發現,童年期有被忽視經歷的兒童較正常家庭撫養的兒童AVP水平低,正常家庭撫養的兒童在與母親親密接觸后OXT水平會增高[15]。NI與NTS會影響子鼠成年后的焦慮水平,但是對于子鼠成年后社交能力的影響暫不明確。OXT與AVP是調節社會行為、社會識別的重要因子,且會被社會環境所影響[1316]。本研究分析子鼠早期接受NI與NTS對其成年后(90天)社會交往與焦慮水平的影響,并初步探索其機制。
對象與方法
一、對象
6只SD孕鼠均來自北京大學醫學部實驗動物部。初始重量220~250 g。6只孕鼠各自分籠喂養,食水充足,晝夜12 h循環(早7點至晚7點日光燈照明),室內溫度(24±1)℃,濕度50%。孕鼠均自然生產,共產78只子鼠,以出生日記作出生后第0天(postnatal day 0,PND0)。78只子鼠被隨機分配入3組。NI組28只,雄性13只,雌性15只;NI+NTS組27只,雄性13只,雌性14只;正常對照(standard facility rearing,SFR)組23只,雄性8只,雌性15只。并將子鼠連續編號(178),號碼標記在大鼠的身體及尾巴上。斷奶(PND 28)后,子鼠按性別每4只/籠喂養。該研究方案經大學研究倫理委員會(LA 201380)批準,并符合實驗動物研究NIH指南要求。
二、方法
1新生兒期隔離(NI)與新生兒期撫觸刺激(NTS):NI組子鼠在PND 1—PND 28每日與母鼠隔離3 h(17:30—20:30)。隔離的流程如下,將母鼠從籠中移出,隨即將子鼠從籠中移出并分別單獨置入另準備的小紙杯中(紙杯充滿墊料),環境溫度維持在36℃。3 h隔離結束后,所有子鼠移回籠中,最后將母鼠也移回籠中。NTS組子鼠除經歷與NI組相同的隔離處理之外,每日在3 h隔離期間有15 min的撫觸刺激。撫觸刺激具體措施如下,實驗者戴上毛絨手套溫柔觸摸子鼠。為了持續撫觸刺激對子鼠的影響,將每日撫觸15 min的這項處理一直延續至子鼠成年(PND 90),而非停止在斷奶后(PND 28)。
SFR組母鼠與子鼠在PND 1—PND 28一直生活在一起。實驗設計見圖1。
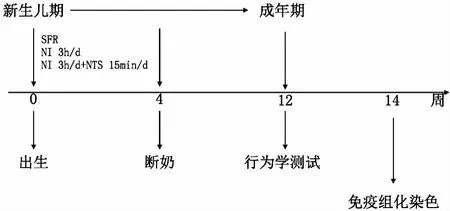
圖1 實驗設計圖 SFR:正常對照;NI:新生兒期隔離;NTS:新生兒期撫觸刺激
2社會交往測試(三室實驗):大鼠成年后(PND 90)進行社會交往行為測試。社會交往測試方法參考先前研究[10]。測試裝置由3個有機玻璃小室(40 cm×34 cm×24 cm)串聯構成。兩邊的小室通過中間走廊(10 cm×10 cm×15 cm)與中間的小室相通。子鼠在正式測試前一天放入裝置15 min熟悉環境。交往對象鼠被放入3個小室中邊側1個小室的小籠中,另一邊側小室放入一個同樣大小的空的小籠。接受測試鼠可以自由在三室裝置中活動15 min,每個過道設有紅外線探測儀可探測到過往物體,以此可測定計算出實驗鼠在每個小室中度過的時間。測試鼠在有社交對象鼠的邊側小室中度過的時間被定義為社交時間。實驗選取的交往對象鼠與所有測試鼠同齡且實驗前保持互相陌生。所有行為學測試時間為夜間(19:30熄燈后)。每次測試后實驗鼠都放回籠中,并將裝置徹底清潔除味。
3環境所導致焦慮水平測試(黑白箱探索實驗):實驗裝置由三室實驗裝置改裝而成。將三室中的一個邊側小室與另兩小室隔擋,將余下的兩個小室其中一個裝上黑色不透光的天花板,作黑箱;另一個小室裝上透明天花板作白箱。實驗開始時將實驗鼠放入黑箱,實驗鼠可以自由穿梭于黑白箱中,記錄其在每個箱中的時間。焦慮水平測試中,子鼠在黑箱中度過的時間反映其環境導致的焦慮水平。在黑箱中所處時間越長表示測試鼠的焦慮水平越高。每次測試后實驗鼠都放回籠中,并將裝置徹底清潔除味。
4對PVN和SON中OXT和AVP免疫組化染色:在行為學實驗后,用10%水合氯醛(300 mg/kg體重)腹腔注射,對大鼠進行麻醉。先后使用生理鹽水和4%多聚甲醛(pH 74)經心臟對大鼠灌注固定,取腦,在相同固定液中4℃固定24 h。之后以30μm為厚度連續切片,-20℃保存在具有防凍功能的固定液中。
采用抗生物素生物素過氧化酶法(avidin biotin peroxidase complex,ABC)對 OXT和 AVP陽性細胞進行免疫組化染色。具體方法如下,室溫下將冰凍切片用001 M PBS于搖床上洗3遍,置于甲醛固定10 min。再用001 M PBS洗3遍后,03%過氧化氫溶液室溫孵育腦片30 min以清除內源過氧化酶活性。001 M PBS洗3遍后,用10%山羊血清和003%Triton X100(001M PBS)在37℃溫箱中封閉30 min。之后加入兔源抗大鼠OXT或AVP單克隆抗體(Abcam,USA,1∶2 000稀釋于含1%山羊血清和03%TritonX100的001 M PBS溶液)于37℃溫箱震蕩孵育2 h,之后置于4℃冰箱繼續孵育48 h。用001 M PBS洗3遍,每次15 min后加入二抗(用生物素標記的山羊源抗兔 IgG,Vectastain,USA,1∶200稀釋),37℃震蕩孵育30 min。PBS洗3遍后,用加鏈酶親和素生物素過氧化物酶復合物(Vectastain,USA,1∶200稀釋)于37℃孵育 45 min。PBS洗 3遍后用含 005 M Tris HCl(pH 76)的 05 mg/ml二氨基聯苯胺和 003%過氧化氫溶液顯色10 min。可見神經元細胞內出現棕色反應產物。對腦片進行貼片、烤干,之后用酒精梯度脫水,二甲苯透明,樹脂封片。
因NI和NTS干預后雌鼠表現出顯著行為學改變,故以下實驗聚焦于雌鼠。每組挑選有明顯行為改變的5只雌鼠,通過測量PVN和SON免疫組化陽性的大細胞和小細胞神經元數量,研究雌鼠OXT和AVP表達水平的改變。
5細胞計數和數據分析:本研究使用Olympus顯微鏡和Canon相機對免疫組化陽性細胞觀察、照相和計數。在顯微鏡下,PVN和SON區域的神經元細胞核呈棕色染色即為OXT或AVP免疫組化陽性細胞。本研究所涉及的所有大腦核團命名和定位均依據1997年Paxinos和Watson的文章。在計數方面,本研究在距大鼠前囟(bregma)-092~-140 mm的范圍每隔三張腦片對雙側免疫組化染色陽性神經元進行計數,取數量最多的平面進行統計。對于大、小細胞區域的界定依據1982年Swanson等[17],本研究所取平面也與該文章類似(圖 2)。

圖2 計數平面
以上2個示意圖顯示了本研究所選計數平面中OXT(A)和AVP(B)染色陽性細胞在PVN的分布情況。pm posterior magnocellular后部大細胞區域;dp dorsal parvocellular背側小細胞區域;mp medial parvocellular內側小細胞區域
6統計學處理:采用Prism 50統計軟件。計量資料以(均數±標準差)表示,三組比較采用單因素方差分析(one way ANOVA),兩兩比較采用非配對t檢驗。p<005為差異有統計學意義。
結 果
一、社會交往測試
1同性交往(測試鼠與社交對象鼠為同一性別):NI組的子鼠社交時間百分比為(6298±299)%,少于 SFR組(7301±197)%及 NTS組(7259±276)%差異均有統計學意義,見圖3A。
2異性交往(測試鼠與社交對象鼠為不同性別):NI、NTS、SFR組子鼠社交時間百分比分別為(6867±307)%、(6893±284)%、(7271±193)%,三組比較差異無統計學意義,見圖3B。
3雄性子鼠交往時間(測試鼠為雄鼠,社交對象鼠為雄鼠或雌鼠):NI、NTS、SFR組雄鼠子鼠社交時間百分比分別為(6826±372)%、(7157±314)%、(7421±258)%,三組比較差異均無統計學意義,見圖3C。
4雌性子鼠交往時間(測試鼠為雌鼠,社交對象鼠為雄鼠或雌鼠):NI組的雌性子鼠社交時間百分比為(6372±241)%,少于 SFR組(7214±160)%及 NTS組(7000±251)%,差異均有統計學意義,見圖3D。
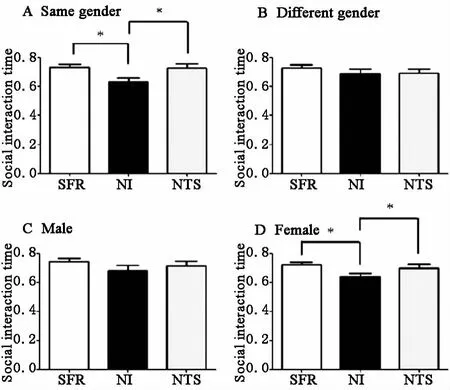
圖3 NI與NTS對子鼠成年后社會交往的影響(三室實驗) A同性交往;B異性交往;C雄鼠;D雌鼠。 p<005。SFR:正常對照;NI:新生兒期隔離;NTS:新生兒期撫觸刺激
二、焦慮水平測試(黑白箱測試)
NI、NTS、SFR組雌鼠在黑箱中度過的時間百分比分別為(6290±284)%、(5514±250)%、(6256±264)%,雄鼠在黑箱中度過的時間百分比分別為(7035±540)%、(6993±588)%、(6635±907)%,全部子鼠在黑箱中度過的時間百 分 比 分 別 為 (6636±297)%、(6226±338)%、(6388±349)%。三組不同性別子鼠焦慮水平無差異,見圖4,說明NI或NTS對環境所導致的焦慮水平無影響。
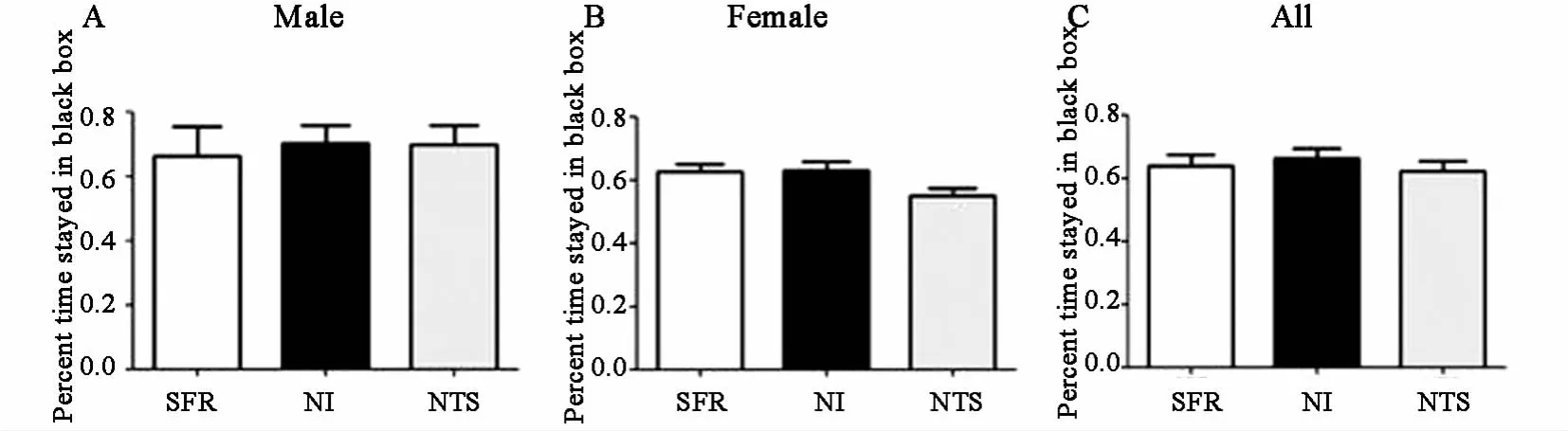
圖4 NI與NTS對子鼠成年后環境所導致焦慮水平的影響(黑白箱實驗) A雄鼠;B雌鼠;C雌雄鼠合計。SFR:正常對照;NI:新生兒期隔離;NTS:新生兒期撫觸刺激
三、OXT在PVN和SON的表達
在PVN中(圖5A、C),NI組 OXT陽性的大細胞神經元數目為(366±531),較 SFR組(662±749)和 NTS組(714±986)減少,差異均有統計學意義;NI、NTS、SFR組OXT陽性的小細胞神經元數目分別(220±689)、(302±531)、(296±605),三組比較差異無統計學意義,見圖5E、F。在PVN中,NI、NTS、SFR組OXT陽性的細胞神經元數目分別為(882±140)、(668±149)、(1010±158);在 SON中(圖 5B、D),NI、NTS、SFR組 OXT陽性的細胞神經元數目分別為(914±774)、(898±589)、(890±373),三組比較差異均無統計學意義,見圖5G、H。
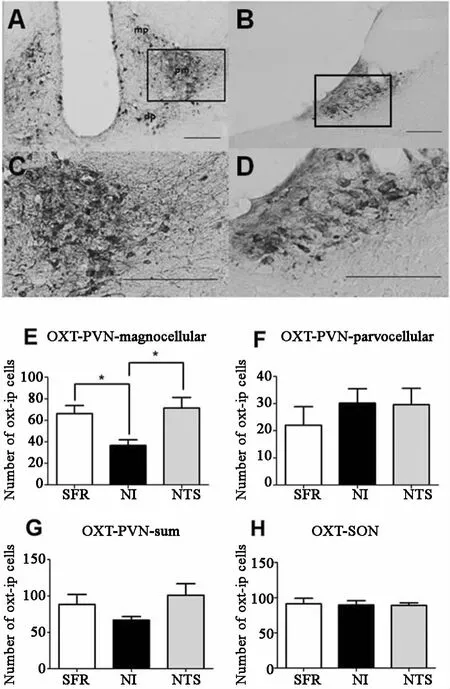
圖5 雌性成年大鼠OXT陽性細胞圖和在各組中的表達 APVN(免疫組化,×20);BSON(免疫組化,×20);CPVN(免疫組化,×50);DSON(免疫組化,×50)。pm posterior magnocellular后部大細胞區域;dp dorsal parvocellular背 側 小 細 胞 區 域;mp medial parvocellular內側小細胞區域,比例尺=200μm。成年雌性大鼠PVN(E,F,G)和SON(H)中OXT陽性細胞數目。 p<005
四、AVP在PVN和SON中的表達
在PVN中(圖6A、C),AVP陽性的大細胞神經元的變化與 OXT表達類似,NI組(3343±320)較SFR組(672±1454)和 NTS組(642±696)減少,差異均有統計學意義;NI組AVP陽性的小神經元(88±196)也較 SFP組(344±1061)減少,差異有統計學意義,見圖6E、F。在PVN中,NI組陽性神經元(416±382)較 SFP組(1016±2457)減少,差異有統計學意義,見圖6G;在SON中(圖6B、D),NI、NTS、SFR組 AVP陽性神經元數量分別為(8640±1901)、(9400±2183)、(11600±2607),三組比較差異無統計學意義,見圖6H。
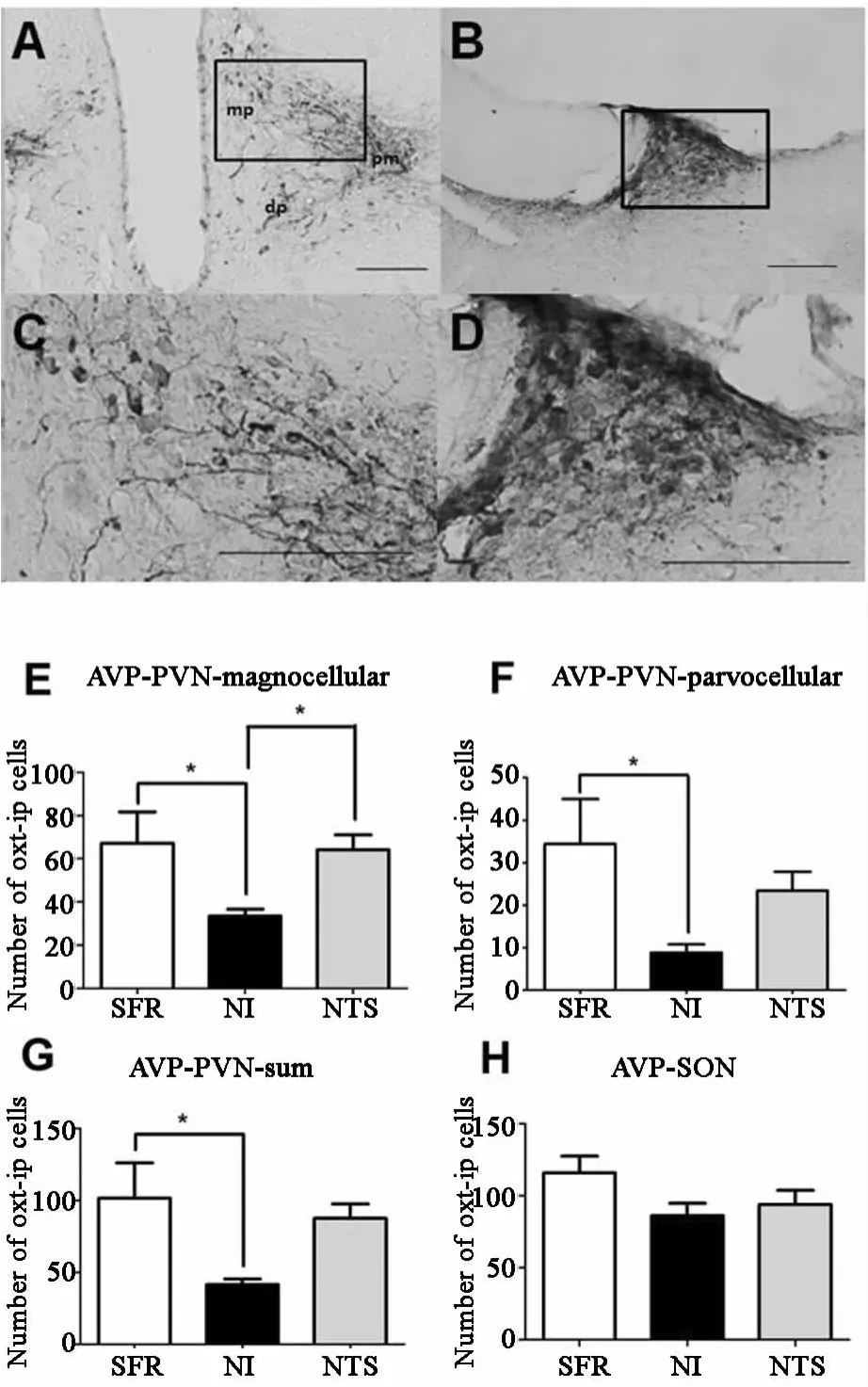
圖6 雌性成年大鼠AVP陽性細胞圖和在各組中的表達 APVN(免疫組化,×20);BSON(免疫組化,×20);CPVN(免疫組化,×50);DSON(免疫組化,×50)。pm posterior magnocellular后部大細胞區域;dp dorsal parvocellular背 側 小 細 胞 區 域;mp medial parvocellular內側小細胞區域,比例尺=200μm。成年雌性大鼠PVN(E,F,G)和SON(H)中OXT陽性細胞數目。 p<005
五、行為學測試結果與OXT、AVP水平相關性分析
雌性子鼠社交測試結果與其腦內PVN中OXT、AVP免疫組化陽性細胞水平的相關性見圖7。雌鼠PVN中OXT、AVP免疫組化陽性的總細胞數目(大小細胞總合)與其同性交往時間呈正相關(r2=0277,P=0044;r2=0325,P=0017)。雌鼠 PVN中AVP免疫組化陽性的大細胞數目與同性交往時間呈正相關(r=0372,P=0009),而雌鼠 PVN中OXT免疫組化陽性的大細胞數目與同性交往時間無相關性(r=0191,P=0103)。
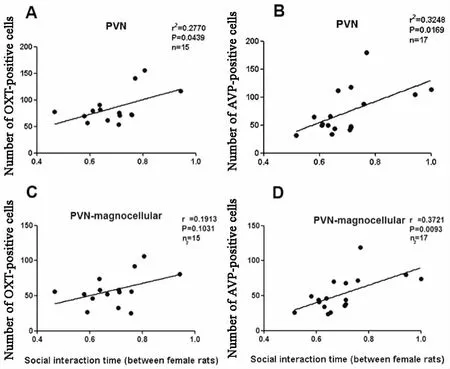
圖7 雌性子鼠社交測試與其腦內PVN中OXT、AVP免疫組化陽性細胞水平的相關性 雌鼠PVN中OXT(A)、AVP(B)陽性的總細胞數目,AVP(D)陽性的大細胞數目與其同性交往時間正相關;雌鼠PVN中OXT(C)陽性的大細胞數目與其同性交往時間無關
討 論
本研究利用新生兒期間母子隔離(NI)和撫觸刺激(NTS)的大鼠模型研究早期社會環境對成年后社交行為的影響。三室實驗的結果顯示,NI組與社交對象鼠相處時間較對照組少,說明NI對大鼠的社交發展有不良影響。而在NI后進行了NTS的大鼠成年后社交行為與同一母鼠撫養的對照組無差異,說明撫觸刺激部分逆轉了母子隔離的不良作用。本研究結果與之前嬰兒期短期撫觸刺激對成年社交行為有不良影響的報道不符[13],可能與撫觸刺激方式不同有關,后者為短期干預。來自異種生物的短期撫觸可能對動物是一種應激刺激,導致對社交行為發展產生不良影響。在本實驗條件下,反復進行的人為撫觸刺激,導致動物已經適應,且皮膚刺激對于OXT、AVP的產生有刺激作用,最終逆轉了母子隔離所致的不良社交影響。因此,本研究結果提示,嬰兒期長期撫觸刺激可能對成年期的社交行為有積極作用,即撫觸刺激在我們實驗中可能模仿了母子接觸,從而產生治療作用。
社交減少可能源于焦慮水平增加。在黑白箱實驗中,三組無差異說明親子隔離對大鼠成年后的焦慮水平無影響。因此,本研究認為,NI和NTS僅特異性地影響社交行為,而對焦慮水平無影響。
PVN合成的OXT與社交行為和雌雄配對有關,且有報道顯示PVN小細胞神經元的OXT陽性細胞減少與親近社交行為減少有關[13],也曾有報道稱NI可導致 PVN小細胞神經元 OXT表達下降[18]。本研究中,NI組PVN處的大細胞神經元OXT表達下降且NTS可使OXT恢復,而小細胞神經元無明顯改變。這些不同的結果可能由于PVN的大、小細胞神元均合成OXT。德國科學家指出,OXT和AVP由兩類神經元合成,一類是PVN和SON的大細胞神經元,另一類是PVN的小細胞神經元;大細胞神經元的下游也有2條通路,一個是通過軸突投射到垂體后葉,另一個是通過樹突釋放到細胞外區域;而后者不僅影響局部OXT含量,還可以擴散到大腦的遠隔區域;小細胞神經元的下游通路為通過軸突投射到其他大腦區域,如杏仁核、海馬等[19]。因此,大、小細胞神經元均可以合成OXT并對特定的大腦區域發揮作用。據此推測,早期的社會環境可能對PVN中這兩類神經元OXT的表達均有影響。本研究也顯示,PVN處總OXT陽性神經元的數目與雌性大鼠同性社會交往有關,說明OXT可能是介導NI或NTS影響社交行為的途徑之一。
很多綜述總結了OXT在社交行為上的作用[2021]。OXT可增加理解他人情緒的能力,并可使個體更愿意接受有風險的合作或信任行為,從而提高社交行為[19]。近期的功能磁共振(functional magnetic resonance imaging,fMRI)研究繪制了可能介導OXT影響社交行為的相關腦區。大部分已發表的文章顯示,經鼻OXT吸入可影響杏仁核和其下游腦區,如腦干[22]。但是,具體的分子機制仍不清楚。
本實驗也發現,NI可導致雌鼠PVN的AVP陽性神經元減少,這與既往研究[16]類似。本研究中NTS對PVN的AVP陽性神經元的影響,與之前研究所報道的因NI而降低的AVP陽性神經元數目可通過NTS升高一致[23]。本實驗還分析了雌鼠AVP陽性神經元數目和社交能力的相關性,發現PVN的AVP陽性神經元數目與同性交往水平正相關。該結果支持AVP可促進社交能力且受NI或NTS影響的假設。
AVP的功能可能來源于其在“社交行為神經網絡”中的作用。此概念由Newman在1999年提出,強調該網絡中的各個成分彼此相互影響,共同調控很多社交行為[24]。AVP和AVP受體(V1a受體等)也在整個網絡中廣泛存在[25]。現有研究指出,AVP可調節對感覺信息的接收,影響社交決策并促進社交行為相關運動神經元的輸出[25]。但是,其具體分子機制仍不明確。
另外,NI和NTS對大鼠社交行為的影響有性別特異性。本研究中,NI對社交的負面影響在雌鼠中更加明顯,這與之前的報道一致[26]。由于雌激素可影響雌鼠情緒和焦慮水平,且具有濃度依賴性,為了消除波動的雌激素水平對社交行為的影響,Tsuda等[9]進一步探究了NI對切除卵巢雌鼠的作用,仍發現類似的結果,即NI可降低雌鼠社交行為。
近期由Dumais和Veenema總結的OXT和AVP系統的性別差異提出新的觀點[27]。越來越多的結果證明,這兩個系統在合成、受體分布及行為功能上存在性別差異[27]。典型的性別特異性是指在一種性別中的影響大于另一種性別,即不同性別對OXT和AVP這兩個系統的敏感性存在差異[28]。且這種性別差異還可能表現為,這兩個系統在不同性別之間存在相反的作用[29]或僅在一種性別起作用[30],還可能不存在性別差異[31]。
OXT系統在大鼠社交行為的影響。一方面,Lukas等[32]研究顯示,經腦脊液注射OXT可緩解成年雄鼠因社交缺陷導致的社交回避,而對雌鼠無影響[33]。而另一方面,經腦脊液注射OXT受體拮抗劑可損傷雄鼠[34]和雌鼠的社會認知能力[35]。可能OXT系統在兩種性別的社會認知能力中有類似的作用,但雄性對OXT更加敏感,而雌性已達到天花板效應[27]。Rilling等[36]通過研究人經鼻吸入 OXT后社會認知能力的改變發現,OXT可增加男性殼核和尾狀核的反應,卻降低女性該區域的反應。因此,本研究所觀察到的性別特異性可能源于兩性別的不同敏感性或OXT下游靶點。
對AVP在人類社交行為中作用的研究,大多以男性為研究對象,導致難以進行性別差異的分析。少數幾個包括女性的研究均顯示不同性別存在行為差異。在面對不熟悉的同性面孔時,男性經鼻吸入AVP可刺激爭勝性面部運動模式,而在女性則可刺激親近性面部運動模式[37]。該正常人群中的研究結果與本研究結果類似。此外,經鼻吸入AVP可增加男性紋狀體、前腦基底層、腦島、杏仁核和海馬的活性,而在女性中則降低或不起作用[36]。該結果提示AVP作用的性別差異很可能與AVP激活不同腦區有關。
本研究發現另一個性別相關的結果是,NI對于同性大鼠間的交往影響更大。類似的結果之前亦有報道[9],但具體機制仍不清楚。
本研究存在以下幾點不足。(1)PVN中OXT和AVP陽性神經元數目的改變并不完全等同于分子功能的改變。因此,通過功能磁共振對OXT和AVP功能從受體水平進行分析,可更加準確測定OXT和AVP功能上的改變。(2)其他母親來源的因素亦可影響本實驗結果。環境因素如NI和NTS亦可通過改變母親養育行為而導致子鼠出現分子和行為水平的改變。(3)未來的研究對象應包括兩種性別,并需要考慮雌鼠所處的月經周期,這樣才能更加準確地反映性別差異。
總之,經歷NI的幼鼠成年后社交能力下降,且在雌鼠及同性交往中更加顯著。NTS可部分逆轉NI對社交行為的不良影響。因此,NTS可能對社交能力有積極作用。NI降低PVN中OXT和AVP陽性神經元的數量,且這種改變與社交行為正相關。提示幼鼠早期經歷的不良社會環境如NI可能通過誘導與哺乳動物社會聯系有關區域的形態學改變,從而引起長期的行為改變,且NTS可有效逆轉這種不良反應。因此,建立一個良好的親子關系對于預防兒童行為障礙性疾病(如孤獨癥)有重要作用。
致謝:感謝創新人才培養計劃基金(J1030831/J0108)對北京大學基礎醫學院的支持,以及 the Research Special Fund for Public Welfare Industry of Health of China(20130200211)對張嶸教授與韓濟生院士的支持。特別感謝韓松平教授對本研究的指導與建議。
1 Agid O,Shapira B,Zislin J,et al.Environment and vulnerability to major psychiatric illness:a case control study of early parental loss in major depression, bipolar disorder and schizophrenia. Mol Psychiatry,1999,4:163172.
2 Heim C,Nemeroff CB.The role of childhood trauma in the neurobiology of mood and anxiety disorders:preclinical and clinical studies.Biol Psychiatry,2001,49:10231039.
3 Kogan MD,Blumberg SJ,Schieve LA,et al.Prevalence of parent reported diagnosis of autism spectrum disorder among children in the US,2007.Pediatrics,2009,124:13951403.
4 Zablotsky B,Black LI,Maenner MJ,et al.Estimated Prevalence of Autism and Other Developmental Disabilities Following Questionnaire Changes in the 2014 National Health Interview Survey.National Health Statistics Reports,2015,87:121.
5 Rutter M,Andersen Wood L,Beckett C,et al.Quasi autistic patterns following severe early global privation.English and Romanian Adoptees(ERA)Study Team.JChild Psychol Psychiatry,1999,40:537549.
6 Zhao X,Chen J,Chen MC,et al.Left behind children in rural China experience higher levels of anxiety and poorer living conditions.Acta Paediatr,2014,103:665670.
7 Ge Y,Se J,Zhang J.Research on relationship among internet addiction,personality traits and mental health of urban left behind children.Glob JHealth Sci,2015,7:41315.
8 Daniels WM,Pietersen CY,Carstens ME,et al.Maternal separation in rats leads to anxiety like behavior and a blunted ACTH response and altered neurotransmitter levels in response to a subsequent stressor.Metab Brain Dis,2004,19:314.
9 Tsuda MC,Ogawa S.Long lasting consequences of neonatal maternal separation on social behaviors in ovariectomized female mice.PLoS One,2012,7:e33028.
10 Hulshof HJ,Novati A,Sgoifo A,et al.Maternal separation decreases adult hippocampal cell proliferation and impairs cognitive performance but has little effect on stress sensitivity and anxiety in adult Wistar rats.Behav Brain Res,2011,216:552560.
11 Vetulani J.Early maternal separation:a rodent model of depression and a prevailing human condition.Pharmacol Rep,2013,65:14511461.
12 Imanaka A,Morinobu S,Toki S,et al.Neonatal tactile stimulation reverses the effect of neonatal isolation on open field and anxiety like behavior,and pain sensitivity in male and female adult Sprague Dawley rats.Behav Brain Res,2008,186:9197.
13 Todeschin AS,Winkelmann Duarte EC,Jacob MH,et al.Effects of neonatal handling on social memory,social interaction,and number of oxytocin and vasopressin neurons in rats.Horm Behav,2009,56:93100.
14 Harony H,Wagner S.The contribution of oxytocin and vasopressin to mammalian social behavior:potential role in autism spectrum disorder.Neurosignals,2010,18:8297.
15 Wismer Fries AB,Ziegler TE,Kurian JR,et al.Early experience in humans is associated with changes in neuropeptides critical for regulating social behavior.Proc Natl Acad Sci USA,2005,102:1723717240.
16 Lukas M,Bredewold R,Landgraf R,et al.Early life stress impairs social recognition due to a blunted response of vasopressin release within the septum of adult male rats.Psychoneuroendocrinology,2011,36:843853.
17 Sawchenko PE,Swanson LW.Immunohistochemical identification of neurons in the paraventricular nucleus of the hypothalamus that project to the medulla or to the spinal cord in the rat.J Comp Neurol,1982,205:260272.
18 Veenema AH,Bredewold R,Neumann ID.Opposite effects of maternal separation on intermale and maternal aggression in C57BL/6 mice:link to hypothalamic vasopressin and oxytocin immunoreactivity.Psychoneuroendocrinology,2007,32:437450.
19 Meyer Lindenberg A,Domes G,Kirsch P,et al.Oxytocin and vasopressin in the human brain:social neuropeptides for translational medicine.Nat Rev Neurosci,2011,12:524538.
20 Heinrichs M,Von Dawans B,Domes G.Oxytocin,vasopressin,and human social behavior.Front Neuroendocrinol,2009,30:548557.
21 Shahrestani S,Kemp AH,Guastella AJ.The impact of a single administration of intranasal oxytocin on the recognition of basic emotions in humans:a meta analysis.Neuropsychopharmacology,2013,38:19291936.
22 Kanat M,Heinrichs M,Domes G.Oxytocin and the social brain:neural mechanisms and perspectives in human research.Brain Res,2014,1580:160171.
23 Wei B,Tai F,Xiao L,et al.Neonatal tactile stimulation alleviates the negative effects of neonatal isolation on novel object recognition,sociability and neuroendocrine levels in male adult mandarin voles(Microtus mandarinus).Physiology&Behavior,2013,112:1422.
24 Newman SW.The medial extended amygdala in male reproductive behavior.A node in the mammalian social behavior network.Ann N Y Acad Sci,1999,877:242257.
25 Albers HE.The regulation of social recognition,social communication and aggression:vasopressin in the social behavior neural network.Horm Behav,2012,61:283292.
26 Spivey JM,Padilla E,Shumake JD,et al.Effects of maternal separation,early handling,and gonadal sex on regional metabolic capacity of the preweanling rat brain.Brain Res,2011,1367:198206.
27 Dumais KM,Veenema AH.Vasopressin and oxytocin receptor systems in the brain:Sex differences and sex specific regulation of social behavior.Front Neuroendocrinol,2015.
28 Liu Y,Curtis JT,Wang Z.Vasopressin in the lateral septum regulates pair bond formation in male prairie voles(Microtus ochrogaster).Behav Neurosci,2001,115:910919.
29 Miller M,Bales KL,Taylor SL,Yoon J,Hostetler CM,Carter CS,Solomon M.Oxytocin and vasopressin in children and adolescents with autism spectrum disorders:sex differences and associations with symptoms.Autism Res,2013,6:91102.
30 Bredewold R,Smith CJ,Dumais KM,et al.Sex specific modulation of juvenile social play behavior by vasopressin and oxytocin depends on social context.Front Behav Neurosci,2014,8:216.
31 Tabak BA,Meyer ML,Castle E,et al.Vasopressin,but not oxytocin,increases empathic concern among individuals who received higher levels of paternal warmth: A randomized controlled trial.Psychoneuroendocrinology,2015,51:253261.
32 Lukas M,Toth I,Reber SO,et al.The neuropeptide oxytocin facilitates pro social behavior and prevents social avoidance in rats and mice.Neuropsychopharmacology,2011,36:21592168.
33 Lukas M,Neumann ID.Social preference and maternal defeat induced social avoidance in virgin female rats:sex differences in involvement of brain oxytocin and vasopressin.J Neurosci Methods,2014,234:101107.
34 Lukas M,Toth I,Veenema AH,et al.Oxytocin mediates rodent social memory within the lateral septum and the medial amygdala depending on the relevance of the social stimulus:male juvenile versus female adult conspecifics.Psychoneuroendocrinology,2013,38:916926.
35 Engelmann M,Ebner K,Wotjak CT,et al.Endogenous oxytocin is involved in short term olfactory memory in female rats.Behav Brain Res,1998,90:8994.
36 Rilling JK,Demarco AC,Hackett PD,et al.Sex differences in the neural and behavioral response to intranasal oxytocin and vasopressin during human social interaction.Psychoneuroendocrinology,2014,39:237248.
37 Thompson RR,George K,Walton JC,et al.Sex specific influences of vasopressin on human social communication.Proc Natl Acad Sci USA,2006,103:78897894.

