姜黃素對宮頸癌干細胞增殖、聚集及化療敏感性的影響
張燕華,高艷娥,臧睿,楊紅梅
(1西安630醫院,西安710000;2西安交通大學第二附屬醫院)
姜黃素對宮頸癌干細胞增殖、聚集及化療敏感性的影響
張燕華1,高艷娥2,臧睿1,楊紅梅1
(1西安630醫院,西安710000;2西安交通大學第二附屬醫院)
目的探討姜黃素對宮頸癌干細胞增殖、聚集及化療敏感性的影響。方法用流式細胞術從人宮頸癌細胞株CASKI中分選CD133+的宮頸癌干細胞。將宮頸癌干細胞隨機分為七組,CC10組、CC20組、CC40組、CC60組、CC80組及CC100組分別給予終濃度為10、20、40、60、80、100 mg/mL姜黃素進行培養,對照組給予等量溶劑與培養基培養。用MTT法檢測各組細胞增殖抑制率。取對照組、CC60組細胞用無血清培養基培養1周,光鏡下計數聚集的直徑大于100 μm的干細胞球個數,流式細胞術檢測宮頸癌干細胞比例。取宮頸癌干細胞隨機分為BV組、CC組、BV+CC組、對照組四組,分別加入10 mg/mL貝伐單抗、60 mg/mL姜黃素、10 mg/mL BV+60 mg/mL姜黃素、等量溶劑與培養基,培養48 h后采用流式細胞術測算細胞凋亡率。結果CC10組、CC20組、CC40組、CC60組、CC80組、CC100組細胞增殖抑制率均高于對照組(P均<0.05);且隨著姜黃素濃度的增加,宮頸癌干細胞增殖抑制率逐漸升高(P均<0.05)。CC60組直徑大于100 μm的干細胞球個數少于對照組(P<0.05),干細胞比例低于對照組(P<0.05)。BV+CC組細胞凋亡率高于對照組、BV組、CC組(P均<0.05),CC組高于對照組、BV組(P均<0.05),BV組高于對照組(P均<0.05)。結論姜黃素可抑制宮頸癌干細胞增殖,降低其聚集能力,增加其對貝伐單抗的治療敏感性。
宮頸癌;宮頸癌干細胞;姜黃素;細胞增殖;細胞聚集;貝伐單抗;治療敏感性
宮頸癌是發病率僅次于乳腺癌的女性惡性腫瘤,其發病率逐年升高,且發病年齡呈現年輕化趨勢[1]。目前宮頸癌新藥的研發多側重于預防。雖然傳統放化療可部分提高宮頸癌患者的生存率、改善患者預后,但仍無法有效控制宮頸癌的復發、轉移及治療耐藥[2,3]。貝伐單抗為一種人源單克隆抗體,可通過抑制血管內皮生長因子的活性而抑制血管生成。貝伐單抗單用或與其他化療藥物聯用可減少腫瘤血管生成,治療轉移性或復發性宮頸癌療效顯著,但易耐藥[4,5]。腫瘤干細胞是一類富有廣泛增殖和形成腫瘤能力的細胞,是腫瘤發生復發、轉移及治療耐藥的根本原因[6,7]。研究顯示,宮頸癌干細胞具有極強的自我更新、不斷增殖和體內成瘤能力。CD133+是常見的宮頸癌干細胞流式分選的分子標志物[8]。姜黃素是從姜黃根莖提取物中分離得到的一種多酚類化合物,具有顯著的抗腫瘤作用,可抑制轉移性宮頸癌細胞增殖遷移、促進細胞凋亡、降低宮頸癌細胞的體內成瘤能力[9,10]。但關于姜黃素對宮頸癌干細胞的作用鮮有報道。2015年7月~2017年5月,本研究探討姜黃素對宮頸癌干細胞增殖、聚集和化療敏感性的影響,以期為宮頸癌的復發、轉移、治療耐藥提供新思路。
1 材料與方法
1.1 材料來源 人宮頸癌細胞CASKI(用含10%胎牛血清的RPMI-1640培養基培養,置于37 ℃、飽和濕度、含5%CO2的培養箱內孵育,貼壁后用流式細胞儀分選CD133+的宮頸癌干細胞)由中國科學院上海生命科學院生化細胞所提供。姜黃素液(按2 g/mL溶于二甲基亞砜后保存于4 ℃冰箱,使用時用培養基分別稀釋成10、20、40、60、80和100 mg/mL)購于美國Sigma公司。貝伐單抗(按10 mg/mL溶于二甲基亞砜后保存于4 ℃冰箱)購于Roche公司;FITC標記CD133抗人抗體購于美國BD公司;細胞培養所用的試劑均購于美國Gibco公司。Annexin V-FITC/PI雙染凋亡檢測試劑盒購于江蘇凱基生物技術股份有限公司;Multiskan Ascent酶標儀(型號413MBY042078)、奧林巴斯倒置顯微鏡購于日本Olympus公司,BD FACSAriaTM流式細胞分選儀購于美國BD公司。
1.2 宮頸癌干細胞增殖能力檢測 采用MTT法。將宮頸癌干細胞隨機分為七組,CC10組、CC20組、CC40組、CC60組、CC80組及CC100組分別給予終濃度為10、20、40、60、80、100 mg/mL姜黃素,對照組給予培養基,繼續培養48 h。取各組細胞以1×103/孔接種于低吸附的96孔板中,每組設置5個復孔,細胞匯合度接近90%時,每孔加入滅菌MTT液30 μL。37 ℃孵育4 h后每孔中加入DMSO 150 μL,低速振蕩10 min。用酶標儀檢測490 nm波長處各孔的吸光度(A)值。計算細胞增殖抑制率。細胞增殖抑制率=(1-實驗組A值)/對照組A值×100%。實驗重復3次,取平均值。計算姜黃素對宮頸癌干細胞的半數抑制濃度(IC50),IC50=57.23 mg/mL。
1.3 宮頸癌干細胞聚集能力檢測 采用流式細胞術。取對照組、CC60組(因60 mg/mL最接近姜黃素的IC50)細胞用無血清養基懸浮培養1周富集宮頸癌干細胞。無血清培養基由DMEM-F12(1∶1)500 mL、B27(1∶50)10 mL、20 ng/mL表皮生長因子1 mL、20 ng/mL堿性成纖維細胞生長因子500 μL組成。200倍奧林巴斯倒置顯微鏡(OLYMPUS IX71)下觀察細胞聚集成球情況。隨機取3個視野進行拍照,統計直徑大于100 μm的干細胞球個數,取平均值。采用流式細胞術檢測宮頸癌干細胞比例。
1.4 宮頸癌干細胞貝伐單抗敏感性檢測 采用流式細胞術。將宮頸癌干細胞隨機分為BV組、CC組、BV+CC組、對照組,分別加入終濃度10 mg/mL貝伐單抗、60 mg/mL姜黃素、10 mg/mL BV+60 mg/mL姜黃素、培養基。培養48 h后采用流式細胞術測算細胞凋亡率。操作按流式細胞儀說明書進行。以上重復3次,取平均值。
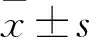
2 結果
2.1 姜黃素對宮頸癌干細胞增殖能力的影響 對照組、CC10組、CC20組、CC40組、CC60組、CC80組、CC100組細胞增殖抑制率分別為27.52%±2.68%、40.18%±1.70%、47.41%±1.68%、55.49%±1.98%、77.02%±3.55%、93.02%±1.40%。CC10組、CC20組、CC40組、CC60組、CC80組、CC100組細胞增殖抑制率均高于對照組(P均<0.05)。且隨著姜黃素濃度的增加,宮頸癌干細胞增殖抑制率逐漸升高(P均<0.05)。
2.2 姜黃素對宮頸癌干細胞聚集的影響 對照組、CC60組直徑大于100 μm的干細胞球個數分別為143、84個/視野。CC60組直徑大于100 μm的干細胞球個數少于對照組(P<0.05);對照組、CC60組宮頸癌干細胞比例分別為3.47%±0.06%、1.23%±0.09%,CC60組宮頸癌干細胞比例低于對照組(P<0.05)。
2.3 姜黃素對宮頸癌干細胞貝伐單抗敏感性的影響 BV組、CC組、BV+CC組、對照組細胞凋亡率分別為4.63%±0.47%、37.70%±1.09%、53.44%±1.98%、0.00 17%±0.00 07%。BV+CC組細胞凋亡率高于對照組、BV組、CC組(P均<0.05),CC組高于對照組、BV組(P均<0.05),BV組高于對照組(P均<0.05)。
3 討論
研究顯示,腫瘤干細胞是維持腫瘤細胞生長的根本原因[6],其具有先天耐藥性,是導致腫瘤復發和轉移的重要原因[7]。因此腫瘤干細胞是腫瘤治療的重要靶標,尋找可直接或間接作用于腫瘤干細胞的藥物是治療腫瘤的有效策略。CD133是宮頸癌、前列腺和黑素瘤等多種腫瘤的腫瘤干細胞標志之一[8]。因此,本研究以CD133為分子標志物分選宮頸癌干細胞,后經無血清懸浮培養法富集宮頸癌干細胞。
藥理學研究顯示,姜黃素具有抗腫瘤和殺滅腫瘤干細胞的作用[11],可增加直腸癌CD133+腫瘤干細胞的放療敏感性[12],姜黃素可抑制肝癌細胞增殖,并可通過調控信號傳導與轉錄激活因子3的磷酸化而干預肝癌干細胞標志物的表達[13]。本研究結果顯示,隨著姜黃素濃度的增加宮頸癌干細胞增殖抑制率逐漸升高,與姜黃素對肺癌干細胞的增殖抑制作用類似,說明姜黃素也可抑制宮頸癌干細胞的增殖。本研究還發現,姜黃素可顯著降低宮頸癌干細胞成球能力,該結果與相關研究[13]類似。表明姜黃素在宮頸癌干性維持中發揮重要作用,可能抑制宮頸癌的復發、轉移。
貝伐單抗是治療復發性宮頸癌的有效藥物,但使用范圍仍有局限性,且已有研究顯示部分患者對貝伐單抗耐藥[4,5]。本研究檢測貝伐單抗單獨使用、姜黃素單獨使用、貝伐單抗聯合姜黃素使用時宮頸癌干細胞的凋亡率,結果經貝伐單抗聯合姜黃素組干預的細胞凋亡率最高,該結果與相關研究[12]具有相似性。說明姜黃素也可增加宮頸癌干細胞對貝伐單抗治療的敏感性,可能具有抑制宮頸癌干細胞耐藥的作用。
綜上所述,姜黃素可顯著抑制宮頸癌干細胞的增殖和成球能力,并可增強宮頸癌干細胞對貝伐單抗的治療敏感性。姜黃素可能在宮頸癌干細胞的干性維持、宮頸癌的復發、轉移和治療耐藥中發揮重要作用,有潛力成為宮頸癌治療的輔助藥物。
[1] Shi JF, Canfell K, Lew JB, et al. The burden of cervical cancer in china synthesis of the evidence[J]. Br J cancer, 2012,130(3):641-652.
[2] Eskander RN, Tewari KS. Chemotherapy in the treatment of metastatic,persistent,and recurrent cervical cancer[J]. Curr Opin Obstet Gynecol, 2014,26(4):314-321.
[3] 劉煥芝.宮頸癌的治療進展[J].中國當代醫藥,2010,17(25):19-20.
[4] Monk BJ, Sill MW, Burger RA, et al. PhseⅡ trial of bevacizumab in the treatment of persistent or recurrent squamous cell carcinoma of the cervix: a gynecologic oncology group study[J]. J Clin Oncol, 2009,27(7):1069-1074.
[5] Panares RL, Garcia AA. Bevacizumab in the management of solidtumors[J]. Expert Rev Anticancer Ther, 2007,7(4):433-445.
[6] Dalerba P, Clarke M. Cancer stem cells and tumor metastasis:first steps into uncharted territory[J]. Cell Stem Cell, 2007,1(3):241-242.
[7] Shimono Y, Zabala M, Cho R, et al. Downregulation of miRNA-200c links breast cancer stem cells with normal stem cells[J]. Cell, 2009,138(3):592-603.
[8] 靳榮,李紅芳.泛素水解酶22siRNA對宮頸癌CD133+宮頸癌干細胞增殖和侵襲的影響[J].中山大學學報,2016,37(1):48-53.
[9] 李牧,王麗,劉海莉,等.姜黃素通過降低一氧化氮合酶水平抑制宮頸癌HeLa細胞的侵襲和轉移[J].南方醫科大學學報,2013,33(12):1752-1756.
[10] 游贛花,羅俊,潘年松,等.姜黃素對宮頸癌荷瘤裸鼠的作用及機制研究[J].華西藥學雜志,2014,29(6):654-656.
[11] Yu X, Zhong J, Yan L, et al. Curcumin exerts antitumor effects in retinoblastoma cells by regulating the JNK and p38 MAPK pathways[J]. Int J Mol Med, 2016,38(3):861-868.
[12] 舒小鐳,何笑冬,李倩,等.姜黃素對直腸癌CD133+腫瘤干細胞樣細胞群放療敏感性的影響[J].中國老年學雜志,2014,35(4):1013-1015.
[13] 王斌,潘戰宇,閆祝辰,等.姜黃素對人肝癌細胞SMCC-7721增殖及干細胞標志物表達的影響及機制[J].河北中醫,2016,38(12):1778-1783.
Effectsofcurcuminoncellproliferation,aggregation,andchemosensitivityofcervicalcancerstemcells
ZHANGYanhua1,GAOYan'e,ZANGRui,YANGHongmei
(1Xi'an630Hospital,Xi'an710000,China)
ObjectiveTo explore the effects of curcumin on the cell proliferation, aggregation, and the sensitivity to bevacizumab of cervical cancer stem cells.MethodsThe CD133+cervical cancer stem cells (CCSCs) were isolated from CASKI cells by flow cytometry. The CCSCs were divided into seven groups: CC10 group, CC20 group, CC40 group, CC60 group, CC80 group, and CC100 group which were given a final concentration of 10, 20, 40, 60, 80 and 100 mg/mL curcumin, while cells in the control group were given the same amount of solvent and culture medium. The inhibition rate of cell proliferation in each group was detected by MTT. The cells in the control group and CC60 group were cultured in serum-free medium for 1 week. The number of stem cell spheres with diameter greater than 100 μm was counted by light microscope, and the proportion of CD133+cells was detected by flow cytometry. The cervical cancer stem cells were divided into four groups, BV group (added with bevacizumab 10 mg/mL), CC group (added with 60 mg/mL curcumin), BV+CC group (added with 10 mg/mL bevacizumab and 60 mg/mL curcumin), and the control group (treated with the same amount of solvent and medium). After 48-hour culture, the apoptosis rate was determined by flow cytometry.ResultsThe rates of cell proliferation inhibition in the CC10 group, CC20 group, CC40 group, CC60 group, CC80 group, and CC100 group were higher than that of the control group (allP<0.05), and with the increase of curcumin concentration, the proliferation inhibition rate of cervical cancer stem cells gradually increased (allP<0.05). The number of stem cell spheres with diameter greater than 100 μm of the CC60 group was less than that of the control group (P<0.05). The proportion of cervical cancer stem cell in the CC60 group was lower than that in the control group (P<0.05). The apoptosis rate in the BV+CC group was higher than that in the control group, BV group, and CC group (P<0.05), the apoptosis rate in the CC group was higher than that in the control group and BV group (P<0.05), and the apoptosis rate in the BV group was higher than that in the control group (P<0.05).ConclusionCurcumin can inhibit the proliferation and decrease the stem cell aggregation of CCSCs and increase the sensitivity of CCSCs to bevacizumab.
cervical carcinoma; cervical cancer stem cells; curcumin; cell proliferation; cell aggregation; bevacizumab; treatment sensitivity
10.3969/j.issn.1002-266X.2017.37.005
R737.33
A
1002-266X(2017)37-0015-03
陜西省自然科學基金資助項目(2016JM8067)。
張燕華(1969-),女,副主任醫師,主要研究方向為婦科腫瘤及婦科內分泌。E-mail:xi_an630@qq.com
2017-07-08)

