骨髓間充質干細胞聯合外源性Shh蛋白對骨髓造血干細胞增殖的影響
朱小鳳,黃純蘭,李曉明
(西南醫科大學附屬醫院,四川瀘州646000)
骨髓間充質干細胞聯合外源性Shh蛋白對骨髓造血干細胞增殖的影響
朱小鳳,黃純蘭,李曉明
(西南醫科大學附屬醫院,四川瀘州646000)
目的探討骨髓間充質干細胞(BMMSC)聯合外源性Shh蛋白干預對骨髓造血干細胞(HSC)增殖的影響。方法分別采用全骨髓培養法、磁珠分選法(MASC)從正常志愿者骨髓中分離BMMSC、HSC,并用流式細胞術進行鑒定。將分選好的HSC隨機分為三組,MSC+HSC+Shh組Transwell培養板上室接種用IMDM培養基+500 ng/mL的Shh蛋白重懸的HSC,下室接種BMMSC;BMMSC+HSC組上室接種用IMDM培養基重懸后的HSC,下室接種BMMSC;HSC+Shh組上室接種用IMDM培養基+500 ng/mL的Shh蛋白重懸的HSC,下室加入培養基;對照組上室接種用IMDM培養基重懸的HSC,下室加入培養基。各組均培養72 h,用計數板計數HSC活細胞數。結果培養72 h,HSC+BMMSC+Shh組HSC細胞計數較其他各組高(P均<0.05),HSC+MSC組、HSC+Shh組較HSC組高(P均<0.05),HSC+BMMSC組、HSC+Shh組比較差異無統計學意義(P>0.05)。結論BMMSC與外源性Shh蛋白可協同作用共同促進HSC增殖。
骨髓造血干細胞;骨髓間充質干細胞;Shh蛋白;細胞增殖
骨髓造血干細胞(HSC)是一種多能干細胞,是一群最原始的并具有多向分化潛能的造血細胞,具有高度的自我復制潛能。HSC移植可重建受者造血和免疫功能,是治療各種良惡性血液病的有效手段。如何簡便、快速分離及擴增高純度的HSC是當前研究的熱點。骨髓間充質干細胞(BMMSC)可分泌多種細胞趨化因子、細胞因子及細胞外基質,調節HSC的歸巢和增殖,具有支持造血和免疫調節功能。Shh信號通路是在動物胚胎發育過程中起重要作用的信號通路之一[1]。Shh在很多組織中調控細胞增殖和分化[2~4],外源性的Shh蛋白可以促進造血干細胞的增殖[5]。2014年8月~2015年3月,本研究觀察BMMSC聯合外源性的Shh蛋白對HSC的調控作用,為HSC的體外擴增提供基礎。
1 材料與方法
1.1 材料來源 FBS購自Hyclone公司,低糖DMEM購自Invitrogen公司,胰蛋白酶購自Sigma公司,人抗鼠CD34-ECD、CD105-FITC、重組人干細胞因子(SCF)購自美國Peprotech公司,CD45-PCy7購自美國BD公司。IL-3購自美國Peprotech公司,Shh蛋白購自R&D system公司,Transwell培養板購自Corning公司,流式細胞儀購自Beckman公司,微型磁珠分選儀(mini MACS)購自Miltenyibiotec公司。
1.2 BMMSC分離、培養及鑒定 在無菌條件下抽取正常志愿者(22例,均為本院體檢健康者,男15例、女7例,年齡20~45歲)骨髓約6 mL,用全骨髓培養法,加入含10% FBS的低糖DMEM培養液,置于37 ℃、5% CO2飽和濕度的培養箱中培養。培養至第8天,當細胞融合度達70%~80%時,加入0.25%胰蛋白酶消化傳代。傳至第3代,將細胞用PBS洗2遍后,用0.25%胰蛋白酶消化第3代細胞,PBS沖洗后,分別用人抗鼠CD34-ECD、CD105-FITC、CD45-PCy7標記。采用流式細胞術進行細胞學鑒定。
1.3 HSC分選及鑒定 無菌條件下抽取志愿者骨髓約12 mL。用淋巴細胞分離液分離單個核細胞(MNCs),采用磁珠分選法,按照mini MACS說明書進行CD34+細胞分選,將分選的細胞用CD34+細胞試劑盒進行表面抗原抗體標記,采用流式細胞術進行細胞學鑒定。
1.4 HSC增殖能力檢測 將分選成功的HSC隨機分為三組。BMMSC+HSC+Shh組:收集HSC用含10%胎牛血清、100 U/mL青霉素及0.1 mg/mL鏈霉素的IMDM培養基+500 ng/mL的Shh蛋白重懸制成細胞懸液,按照每孔100 μL的細胞懸液接種于Transwell培養板上室內,HSC為1×105/孔;將含BMMSC培養液600 μL接種于Transwell培養板下室,BMMSC為1×106/孔。BMMSC+HSC組:收集HSC用含10%胎牛血清、100 U/mL青霉素及0.1 mg/mL鏈霉素的IMDM培養基重懸制成細胞懸液,按照每孔100 μL的細胞懸液接種于Transwell培養板上室內,HSC為1×105/孔;將含BMMSC培養液600 μL接種于Transwell培養板下室,BMMSC為1×106/孔。HSC+Shh組:將HSC接種于Transwell培養板上室,接種方法同BMMSC+HSC+Shh組,下室加入相應的培養基。對照組:上室僅添加IMDM培養基重懸的HSC,下室加入相應的培養基。培養72 h,將Transwell上室加入IMDM培養基500 μL,用吸管反復輕輕吹打,將細胞移入試管,室溫下,離心(1 000 r/min)5 min,棄上清液。加入培養基500 μL重懸細胞,用計數板計數HSC活細胞數。
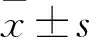
2 結果
2.1 細胞鑒定結果 CD105+而CD34-、CD45-的細胞即為BMMSC,培養4 d,光鏡下可見少數梭形貼壁細胞,呈單個或成簇存在;培養7 d,細胞呈融合狀態;細胞比例為52.4%。CD34+細胞即為HSC,鏡下可見呈圓形,比例為81.9%。臺盼蘭拒染試驗檢測細胞活率均大于95%。
2.2 各組HSC增殖能力比較 共培養72 h,HSC+MSC+Shh組、HSC+MSC組、HSC+Shh組、HSC組HSC細胞計數分別為(25.200±6.138)、(7.825±0.624)、(6.900±2.049)、(1.500±1.291)×105個。HSC細胞計數比較,HSC+MSC+Shh組較其他各組高(P均<0.05),HSC+MSC組、HSC+Shh組較HSC組高(P均<0.05),HSC+MSC組、HSC+Shh組比較差異無統計學意義(P>0.05)。
3 討論
BMMSC作為骨髓基質細胞的一種,是造血微環境中的重要組成部分。BMMSC不但對造血干細胞的生長起支持作用,而且還分泌多種細胞因子,進而調節造血干細胞的增殖與分化[6~8]。BMMSC可支持HSC的生長[9,10],促進HSC的快速增殖,維持HSC池的擴增和自我更新,保持HSC的多向分化潛能。BMMSC的這些作用可能與其分泌的細胞因子、表面的黏附分子受體和細胞外基質有關[11]。分泌的黏附分子受體和細胞外基質分子能夠為HSC的增殖提供基礎。并且BMMSC分泌的細胞因子參與調控HSC增殖、分化、凋亡、生長抑制、趨化和隨意運動等。同時BMMSC可以分泌多種促進HSC增殖又抑制其分化的細胞因子。BMMSC能夠分泌血管再生各種所需的細胞因子,如血管內皮細胞生長因子(VEGF)、血管生成素等。目前認為,VEGF、血管生成素1(Ang-1)及Ang-2在毛細血管形成過程中發揮重要作用[12]。BMMSC促進HSC增殖可能還與其分泌的促血管生長因子相關,促進血管形成,為HSC的生長提供營養物質,更有利于促進其增殖。研究證實,不同的細胞作為滋養層模擬體內造血微環境對促進HSC增殖和修復的重要性[13]。基于BMMSC分泌的細胞因子可以促進HSC的增殖[14]。本研究將HSC與BMMSC加入Transwell培養板中進行共培養,72 h后HSC出現了增殖現象。其原因可能為在共培養過程中,下室的BMMSC分泌的多種細胞因子穿過Transwell培養板的微網進入上室,從而促進HSC增殖。但具體BMMSC分泌的哪些細胞因子促進了HSC增殖,在后期研究中將對其進行檢測。本文對研究骨髓造血微環境,特別對BMMSC促進HSC體外擴增的機制有了進一步的闡釋,為研究HSC體外長期擴增以及培養提供基礎。
Hedgehog基因作為一種分節性極性基因,在哺乳動物中有3個同源基因,包括編碼Shh蛋白的SHH基因、編碼Ihh蛋白的IHH基因和編碼Dhh蛋白的DHH基因[15]。用可溶性的Shh處理過的人HSC在小鼠體內可生產大量的人造血細胞。表明,HSC對Hh信號起了應答反應,并進行了自我更新。在穩態下,激活Hh信號通路可以促進原始血細胞的擴增[16]。研究證明Hh信號可以抑制細胞因子誘導的人HSC增殖,而加入可溶性的Shh蛋白可誘導HSC的增殖和擴展[17]。加入外源性Shh蛋白內可觸發成血-血管干細胞的增殖[18]。另有研究發現,在體外加入外源性Shh蛋白可以促進HSC/祖細胞(HSC/HPC)的增殖,其促HSC/HPC增殖的作用是通過BMP-4實現的[19]。本研究亦證實,外源性Shh蛋白可促進HSC增殖。
Shh可以促進BMMSC增殖分化,并可促進HSC的增殖,BMMSC也可以促進HSC增殖,但兩者在促進HSC增殖方面是否存在協同作用是本研究的目的。外源性的Shh蛋白可促進HSC增殖,而將外源性的Shh蛋白加入BMMSC與HSC共培養的Transwell中,之前很少有相關研究。本研究將外源性的Shh蛋白與BMMSC聯合,模擬造血微環境,觀察其對HSC的調控作用。研究證實,Shh聯合BMMSC促進了HSC的增殖。說明Shh蛋白與BMMSC之間存在相互協同作用,共同促進HSC的增殖。猜測Shh蛋白在促進HSC增殖的同時,也可能作用于BMMSC,促進其某些促造血成分的分泌,導致相關信號通路分子的表達上調。外源性的Shh蛋白與BMMSC聯合共同促進HSC增殖的機制將是繼續研究的方向。
[1] Cohen MM Jr. The hedgehog signaling network[J]. Am J Med Genet A, 2003,123A(1):5-28.
[2] Zhao Y, Tong C, Jiang J. Transducing the Hedgehog signal across the plasma membrane[J]. Fly(Austin), 2007,1(6):333-336.
[3] Bhardwaj G, Murdoch B, Wu D, et al. Sonic hedgehog induces the proliferation of primitive human hematopoietic cells via BMP regulation [J]. Nat Immunol, 2001,2(2):172-180.
[4] Baron M. Induction of embryonic hematopoietic and endothelial stem/progenitor cells by hedgehog-mediated signals[J]. Differentiation, 2001,68(4-5):175-185.
[5] Trowbridge JJ, Scott MP, Bhatia M. Hedgehog modulates cell cycle regulators in stem cells to control hematopoietic regeneration[J]. Proc Natl Acad Sci U S A, 2006,103(38):14134-14139.
[6] Yao CL, Chu IM, Hsieh TB, et al. A systematic strategy to optimize ex vivo expansion medium for human hematopoietic stem cells derived from umbilical cord blood mononuclear cells[J]. Exp Hematol, 2004,32(8):720-727.
[7] Rossmanith T, Schrder B, Bug G, et al. Interleukin 3 improves the ex vivo expansion of primitive human cord blood progenitor cells and maintains the engraftment potential of scid repopulating cells[J]. Stem Cells, 2001,19(4):313-320.
[8] Ueda T, Tsuji K, Yoshino H, et al. Expansion of human NOD/SCID-repopulating cells by stem cell factor, Flk2/Flt3 ligand,thrombopoietin,IL-6 and soluble IL-6 receptor[J]. J Clin Invest, 2000,105(7):1013-1021.
[9] Ludwig A, Saffrich R, Eckstein V, et al. Functional potentials of human hematopoietic progenitor cells are maintained by mesenchymal stromal cells and not impaired by plerixafor[J]. Cytotherapy, 2014,16(1):111-121.
[10] Oodi A, Noruzinia M, Habibi Roudkenar M, et al. Expression of P16 cell cycle inhibitor in human cord blood CD34+expanded cells following co-culture with bone marrow-derived mesenchymal stem cells[J]. Hematology, 2012,17(6):334-340.
[11] Colter DC, Class R, DiGirolamo CM. Rapid expansion of recycling stem cells in cultures of plastic-adherent cells from human bone marrow[J]. Proc Natl Acad Sci U S A, 2000,97(7):3213-3218.
[12] Carmeliet P. Angiogenesis in health and disease[J]. Nat Med, 2003,9(6):653-660.
[13] Jing D, Fonseca AV, Alakel N, et al. Hematopoietic stem cells in co-culture with mesenchymal stromal cells modeling the niche compartments in vitro[J]. Haematologica, 2010,95(4):542-550.
[14] Chang DT, Lopez A, von Kessler DP, et al. Products, genetic linkage and limb patterning activity of a murine Hedgehog gene[J]. Development, 1994,120(11):3339-3353.
[15] Wagner W, Roderburg C, Wein F, et al. Molecular and secretory profiles of human mesenchymal stromal cells and their abilities to maintain primitive hematopoietic progenitors[J]. Stem Cells, 2007,25(10):2638-2647.
[16] Wicking C, Smyth I, Bale A. The hedgehog signaling pathway in tumorigenesis and development[J]. Oncogene, 1999,18(55):7844-7851.
[17] Zhou K, Hu C, Zhou Z, et al. Fetal liver stromal cells promote hematopoietic cell expansion[J]. Biochem Biophys Res Commun, 2009,387(3):596-601.
[18] 付勁蓉,劉文勵,周劍鋒,等.Sonic hedgehog信號通路對AGM區來源的成血-血管細胞增殖、遷移和分化作用[J].中華血液學雜志,2007,28(11):757-761.
[19] Bhardwaj G, Murdoch B, Wu D, et al. Sonic hedgehog induces the proliferation of primitive human hematopoietic cells via BMP regulation[J]. Nat Immunol, 2001,2(2):172-180.
10.3969/j.issn.1002-266X.2017.37.010
R329.2
A
1002-266X(2017)37-0031-03
2017-07-03)

