苦參黃酮抑制血管新生活性成分的虛擬篩選
陳錫欣+劉怡+黃榮+趙林林+陳磊+王淑美

[摘要]血管新生是一個動態(tài)的、多步驟的過程,現(xiàn)在已知大約70種疾病與血管新生紊亂相關(guān)。作者前期研究及文獻報道均表明苦參黃酮類成分有明顯抑制血管新生的作用,但其藥效物質(zhì)基礎(chǔ)和作用機制尚未明確。該研究應(yīng)用分子對接技術(shù)虛擬篩選苦參黃酮抑制血管新生的藥效物質(zhì),搜集現(xiàn)已分離鑒定的126個苦參黃酮類化合物組成配體數(shù)據(jù)庫,選擇VEGFa,TEK,KDR等6個與血管新生密切相關(guān)的靶點組成受體數(shù)據(jù)庫,以DrugBank中對各靶點有抑制作用并已上市的小分子藥物為參照,設(shè)定各靶點對應(yīng)的已上市小分子藥物最低打分為閾值,應(yīng)用Discovery Studio 25(DS25) 軟件的LibDock模塊進行分子對接, 虛擬篩選出打分高于閾值且排名前10%的化合物共37個。對比分析了原配體、已上市藥物和苦參黃酮作用于各靶點的主要活性位點,初步揭示了苦參黃酮抑制血管新生的作用機制,為研發(fā)血管新生抑制劑類藥物提供了一定的參考。
[關(guān)鍵詞]苦參黃酮; 抗血管新生; 分子對接; 虛擬篩選
[Abstract]Angiogenesis is a dynamic, multistep process It is known that about 70 diseases are related to angiogenesis Both the experimental and the literature reports showed that Sophora flavescens inhibit angiogenesis significantly, but the material basis and the mechanism of action have not been clear In this study, molecular docking was used for screening of antiangiogenesis flavonoids from the roots of S flavescens One handred and twentysix flavonoids selected from S flavescens were screened in the docking ligand database with six targets(VEGFa,TEK,KDR,F(xiàn)lt1,F(xiàn)GFR1 and FGFR2) as the receptors In addition, the smallmolecule approved drugs of targets from DrugBank database were set as a reference with minimum score of each target′s approved drugs as threshold The LibDock module in Discovery Studio 25 (DS25) software was applied to screen the compounds As a result, 37 compounds were screened out that their scores were higher than the minimum score of approved drugs as well as being in the top of 10% At last the mechanism of flavonoids antiangiogenesis was preliminarily revealed, which provided a new method for the development of angiogenesis inhibitor drugs
[Key words]flavonoids from Sophora flavescens; antiangiogenesis; molecular docking; virtual screening
血管新生是一個動態(tài)的、多步驟的過程,現(xiàn)在已知大約 70 種疾病與血管新生紊亂相關(guān)[1],腫瘤、糖尿病、動脈粥樣硬化等重大疾病的病理環(huán)節(jié)都與血管新生有關(guān)[24],故研究血管新生抑制劑具有重要意義。血管新生主要過程包括血管基底膜降解,血管內(nèi)皮細(xì)胞的激活、增殖、遷移,以芽生方式在原有血管基礎(chǔ)上重構(gòu)新的血管和血管網(wǎng),這一過程主要由可溶性血管生成刺激因子誘導(dǎo)[510],如VEGF,KDR,VEGF可增加血管通透性,其受體KDR是抗VEGF受體療法的一種主要靶點,為早期成血管細(xì)胞發(fā)育所必需;FLT1,使成血管細(xì)胞形成血管;FGF,可促進血管細(xì)胞增殖、遷移;TEK,是促血管生成素(Ang)受體,具促進血管芽生式新生作用。上述因子及受體已成為研究抑制血管新生的重要靶點[711]。
苦參為豆科槐屬植物苦參Sophora flavescens Ait的干燥根,現(xiàn)代藥理研究表明其黃酮類成分具有抗腫瘤[1215]、抗糖尿病血管并發(fā)癥(糖尿病腎病、糖尿病視網(wǎng)膜病)的作用[1620]。張秀莉[21]在對苦參中黃酮化合物(2S)8異戊烯基7,2′,4′三羥基5甲氧基二氫黃酮的研究中發(fā)現(xiàn),該化合物質(zhì)量濃度達到40 mg·L-1時能明顯抑制ECV304細(xì)胞的增殖、遷移、黏附和管樣結(jié)構(gòu)形成,并能明顯抑制細(xì)胞內(nèi)ROS生成和血管內(nèi)皮生長因子(VEGF)的表達,流式細(xì)胞術(shù)分析表明該化合物可阻滯ECV304細(xì)胞周期在G1期;同時,檢索發(fā)現(xiàn)在2011年有關(guān)于苦參酮(kurarinone)抗血管新生的專利授權(quán)[22];本研究在前期實驗中發(fā)現(xiàn)苦參黃酮部位可以明顯抑制斑馬魚胚胎血管新生的發(fā)生,值得進一步明確其具體藥效物質(zhì)基礎(chǔ)、挖掘活性更好的黃酮小分子,并闡明其藥理作用機制。分子對接是將配體小分子放到受體活性位點處,通過變化配體小分子構(gòu)象,按照幾何、能量及化學(xué)環(huán)境互補的原則來評價配體小分子與受體互相作用的強弱,尋找配體小分子與受體作用的最佳構(gòu)象,并預(yù)測其結(jié)合模式、親和力的方法[23]。本研究應(yīng)用分子對接技術(shù),以DrugBank中對各靶點確證有抑制作用并已上市的小分子藥物為參照,設(shè)定各靶點對應(yīng)的已上市小分子藥物最低打分為閾值,對已報道的苦參黃酮化合物進行研究,優(yōu)選出對血管新生有抑制作用的化合物,并初步闡釋其作用機制,為研發(fā)血管新生抑制劑類藥物提供一定的參考。
1材料與方法
11程序系統(tǒng)本研究所有工作均在Microsoft Windows XP Professional 操作系統(tǒng)中完成,采用ChemBioOffice2004程序(美國劍橋公司)中的ChemBioDraw模塊、Accelrys公司的Discovery Studio 25。參數(shù)設(shè)置除非特殊指明,均為默認(rèn)值。
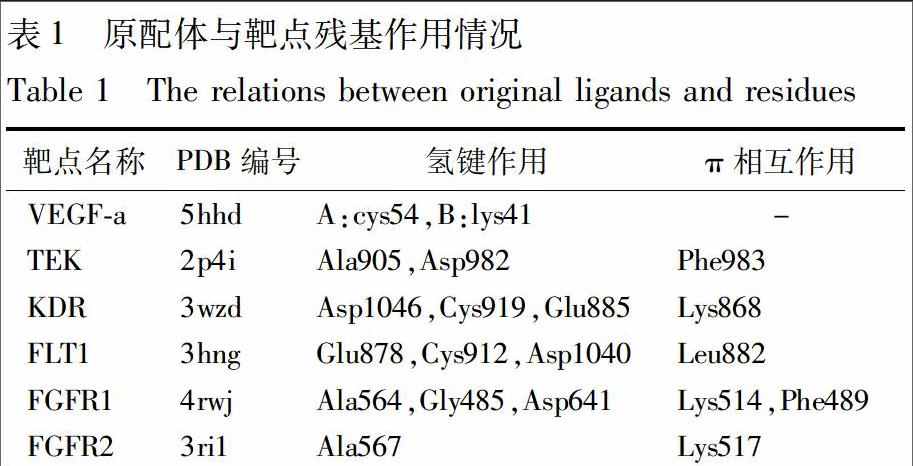
12受體數(shù)據(jù)庫的組建選取6個與血管新生相關(guān)的靶點,分別為內(nèi)皮血管生長因子a(VEGFa)、血管生長素受體(TEK)、內(nèi)皮生長因子受體2(KDR)、內(nèi)皮生長因子受體1(FLT1)、成纖維細(xì)胞生長因子受體1(FGFR1)和成纖維細(xì)胞生長因子受體2(FGFR2),從RCSB PDB數(shù)據(jù)庫(http://wwwrcsborg/pdb/home/homedo)搜索并下載對應(yīng)的蛋白晶體結(jié)構(gòu),PDB 編號及原配體與靶點殘基作用情況,見表1。蛋白晶體前處理及結(jié)合口袋的定義:刪除水分子、原配體分子及其非相關(guān)的蛋白質(zhì)構(gòu)象,經(jīng)Clean Protein工具處理,再加CHARMm力場進行能量優(yōu)化,定義蛋白為受體,以它的原配體位置為中心,選擇半徑5 范圍的殘基為活性殘基,將其定義sphere球,修改sphere球半徑為15 ,此范圍內(nèi)的空腔為結(jié)合口袋,最后保存?zhèn)溆谩?/p>
13配體數(shù)據(jù)庫的組建通過檢索文獻收集[2425]和從TCMSP數(shù)據(jù)庫[26] (http://lspnwsuafeducn/tcmspphp)中搜集得到苦參黃酮類化合物126個,將其二維結(jié)構(gòu)通過ChemDraw轉(zhuǎn)為三維結(jié)構(gòu)。將三維的化合物結(jié)構(gòu)導(dǎo)入對接軟件DS25中,加CHARMm力場進行能量優(yōu)化,保存作為分子對接的配體分子集。
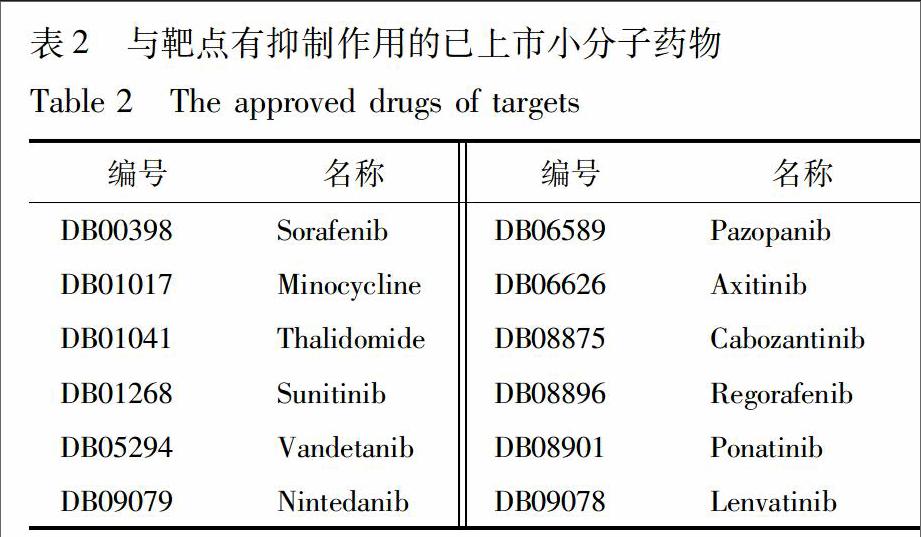
作參照的小分子藥物的準(zhǔn)備:DrugBank是整合了藥物的分子結(jié)構(gòu)、作用靶點等信息的數(shù)據(jù)庫[27]。從DrugBank搜索對上述6個靶點有抑制作用并已批準(zhǔn)上市(狀態(tài)為approved)的小分子藥物,見表2,下載其化合物結(jié)構(gòu),同苦參黃酮化合物前處理后,保存作為參照分子集。
14苦參黃酮類成分與關(guān)鍵靶點對接將上述組建的配體和受體導(dǎo)入DS25,調(diào)用LibDock對接模塊,設(shè)定對接的受體、配體及活性坐標(biāo)位置后,修改對接參數(shù)Conformation Method:BEST,Docking Preferences:High Quality,其余均為默認(rèn)值;同樣的參數(shù)條件,將已上市小分子藥物與受體進行對接。對接完成后,將結(jié)果按LibDock Score打分由大到小排序,以靶點對應(yīng)已上市小分子藥物最低的對接打分為閾值,打分高于閾值的予以保留,作為每個靶點的候選化合物。
15對接結(jié)果分析分析原配體、已上市藥物和苦參黃酮候選化合物作用于各靶點的作用模式,得到與各靶殘基作用的情況,如產(chǎn)生的氫鍵作用,對比原配體、已上市藥物和苦參黃酮候選化合物三者主要作用殘基的相似性,推測擬篩的化合物是否具有與已上市藥物相似的活性作用。
16對接方法可行性驗證含有原配體的蛋白晶體復(fù)合結(jié)構(gòu),若將原配體抽離,然后按設(shè)定的參數(shù)對接回其結(jié)合口袋,計算對接后構(gòu)象與原配體結(jié)構(gòu)的均方根偏差值(RMSD),一般認(rèn)為RMSD≤2 時[28],說明該套參數(shù)能較好地重現(xiàn)此配體與受體的結(jié)合模式,認(rèn)為該對接方法可行。
2結(jié)果與分析
21對接結(jié)果從上述得到的候選化合物中篩選出打分高于閾值且各靶點對接打分最高的10%(前13名)作為最具潛力的候選化合物,刪除重復(fù)項后共37個,具體結(jié)果見表3。
22結(jié)果分析分析以上37個候選化合物與各靶點相互作用模式,統(tǒng)計得出化合物與靶點相互作用的殘基見表4,殘基右上標(biāo)為該殘基與化合物產(chǎn)生氫鍵或π相互作用的個數(shù),數(shù)字越大,說明與該殘基相互作用的化合物就越多。
分析已上市小分子藥物對接后與各靶點的相互作用模式,得出已上市小分子藥物與靶點相互作用
的殘基見表5。
23可行性驗證結(jié)果作者選取的6個靶點均為含有原配體的復(fù)合結(jié)構(gòu)晶體,將原配體抽離,再對接回其結(jié)合口袋,計算對接后構(gòu)象與原配體結(jié)構(gòu)的RMSD,都小于 2 ,比較對接構(gòu)象和原配體位置,發(fā)現(xiàn)兩者幾乎重疊,見表6,說明該對接方法、所選用的晶體結(jié)構(gòu)及參數(shù)的設(shè)定可行。
3討論
DS25中活性位點的定義有3種途徑:一是DS25中自動搜索活性位點的算法,計算機搜索出幾種或十幾種Binding Site供參考,通常把第一個也是最大的一個選作為對接位點;二是根據(jù)文獻報道的活性殘基為中心定義活性位點;三是含原配體的復(fù)合質(zhì)晶體結(jié)構(gòu),以原配體位置為中心,指定半徑范圍內(nèi)的殘基為活性位點。本研究采用第3種方法以原配體位置為中心確定受體蛋白的活性位點。
該研究采用DS25中的LibDock對接模塊為高通量的分子庫篩選方法,其根據(jù)蛋白受體網(wǎng)格點的功能來定義作用熱區(qū)(hotspots),然后將配體分子構(gòu)象對接到熱區(qū)所在的活性口袋中[2931]。這為大數(shù)據(jù)分子虛擬篩選提供了方便快捷的手段。
分析原始配體、已上市小分子藥物和候選化合物與受體的相互作用模式,見表1,4,5。觀察表中數(shù)據(jù),發(fā)現(xiàn)原配體、已上市小分子藥物和候選化合物的重要作用殘基具有很大程度的相似性。
VEGFa(5hhd):原配體與其氫鍵作用的殘基為A:cys54和 B:lys41,而A:cys54恰恰也是已上市小分子藥物和候選化合物與VEGFa作用最多的殘基,并且候選化合物與已上市小分子藥物作用模式相似,在A:cys54,B:ser43,B:phe40,A:cys61產(chǎn)生氫鍵作用,在B:phe29,A:glu57形成π相互作用。TEK(2p4i):原配體為TEK的抑制劑[32],其關(guān)鍵活性殘基為Ala905,Glu982,Phe983,已上市小分子藥物與TEK對接結(jié)果顯示Ala905,Lys855,Arg987為重要活性殘基,候選化合物作用最多的殘基為Lys855,Asp982,Ala905,Arg987。
KDR(3wzd):原配體與Asp1046,Cys919,Glu885殘基形成氫鍵,與Lys868構(gòu)成π相互作用,已上市小分子藥物主要在Asp1046上形成氫鍵,候選化合物則主要與Cys919,Gly846,Asp1046形成氫鍵以及與Phe918,Lys868構(gòu)成π相互作用。查閱文獻發(fā)現(xiàn)Oguro Y等[33]對imidazo[1,2b]pyridazine及其衍生物的抗血管新生作用及其機制的研究印證了對殘基Cys919的模擬,其采用共晶結(jié)構(gòu)分析方法,發(fā)現(xiàn)imidazo[1,2b]pyridazine母核上N1氮原子與KDR殘基Cys919的NH形成氫鍵為兩者的結(jié)合方式,這一結(jié)合模式在對KDR均有強烈抑制活性的多個衍生物上得到了重現(xiàn)。Abreu R M等[34]的研究則表明,選擇Lys868,Glu885,Cys919和Asp1046等4個KDR的殘基可有效地設(shè)計關(guān)于KDR靶點的藥物。綜上可見候選化合物作用模式與原配體、已上市小分子藥物和文獻報道的作用模式均有相似之處。
FLT1(3hng): Mathi P等[35]實驗證明白皮杉醇具有抑制血管新生的活性,并預(yù)測其機制為與靶點FLT1的Cys912和Glu878殘基形成直接的氫鍵作用[32]。已上市小分子藥物作用的主要殘基為Cys912和Glu878。原配體氫鍵作用的殘基為Cys912,Glu878,Asp1040。可見與殘基Cys912和Glu878形成氫鍵作用是FLT1抑制劑作用的共通模式。而候選化合物與FLT1作用模式主要為:與Lys861形成π相互作用、與Cys912,Asp1040,Ile1019形成氫鍵作用,作用模式相似于文獻報道的、原配體的及已上市小分子藥物的;值得一提的是,苦參酮的對接結(jié)果顯示,其與FLT1的對接打分相對較高,作用殘基為Asp1040和Arg1021。
FGFR1(4rwj):已上市小分子藥物顯示的重要殘基與原配體的相似,在Ala564和Gly485上形成氫鍵,候選化合物亦表現(xiàn)與Ala564和Gly485的氫鍵作用。
FGFR2(3ri1):候選化合物與原配體及已上市小分子藥物都表現(xiàn)了與殘基Lys517的π相互作用,可見Lys517為FGFR2的重要殘基,且候選化合物在Ala567上形成氫鍵與原配體作用模式一致。
綜上可見苦參黃酮候選化合物具有與原配體及已上市小分子藥物相似的作用模式,且與文獻報道的部分靶點相關(guān)活性殘基相似,因此推測其會表現(xiàn)為相似的活性作用,其藥理藥效作用有待進一步驗證。
4結(jié)論
本研究首次將分子對接應(yīng)用到苦參黃酮類化合物的藥效物質(zhì)篩選中,從現(xiàn)有的126個苦參黃酮類化合物中虛擬篩選出37個潛在活性的化合物,完成了對抑制血管新生的化合物初篩,相對于傳統(tǒng)篩選,節(jié)約了大量時間、精力和物力。并初步探討了苦參黃酮抑制血管新生的作用機制,為其藥效學(xué)研究和血管新生抑制劑類藥物的研發(fā)提供參考。
[致謝] 該論文得到中山大學(xué)羅海彬教授的幫助。
[參考文獻]
[1]Carmeliet P, Jain R K.Angiogenesis in cancer and other diseases [J].Nature, 2000, 407: 249
[2]Michael P, Holger G, Peter C.Basic and therapeutic aspects of angiogenesis [J].Cell, 2011, 146:873
[3]Ichinose K, Maeshima Y, Yamamoto Y, et al.Antiangiogenic endostatin peptide ameliorates renal alterations in the early stage of a type 1 diabetic nephropathy model [J].Diabetes, 2005, 10:2891
[4]劉美之 動脈粥樣硬化早期管壁微血管新生的相關(guān)機制及通絡(luò)干預(yù)研究[D]石家莊:河北醫(yī)科大學(xué), 2015
[5]向本旭, 劉婷婷, 孫芳玲,等 VEGF 相關(guān)信號通路在血管新生中的研究進展[J] 中國比較醫(yī)學(xué)雜志, 2015(12):81
[6]張璐, 付毅, 孔煒 血管新生抑制因子研究進展[J] 轉(zhuǎn)化醫(yī)學(xué)研究:電子版,2013(3):12
[7]Folkman J Tumor angiogenesis: therapeutic implications[J] New Engl J Med, 1971, 285(21): 1182
[8]Zhang S, Liu JJ, Li H,et al Antiangiogenesis therapy for lung cancer: the shore and the other shore[J] Oncol Trans Med,2015(1):15
[9]Manoj Kumar Gupta Mechanism and its regulation of tumorinduced angiogenesis[J] World J Gastroenterol, 2003(6):1144
[10]張夢澤, 李國珅, 趙欣童,等 血管新生的分子機制與相關(guān)疾病[J] 中國病理生理雜志, 2016, 32(9):1718
[11]程磊, 鄧玉華 具有抗腫瘤血管生成作用的三大類中藥研究現(xiàn)狀和思考[J] 中國當(dāng)代醫(yī)藥,2014(19):187
[12]溫靜, 黃亞婷, 潘婷,等 苦參黃酮類化學(xué)成分和藥理作用研究進展[C] 廈門:中華中醫(yī)藥學(xué)會中藥化學(xué)分會學(xué)術(shù)年會, 2014
[13]孫明瑜, 左劍, 段繼峰,等 苦參總黃酮體內(nèi)外抗腫瘤作用實驗研究[J] J Integr Med, 2008, 6(1):51
[14]夏艷陽, 李艷 中藥苦參抗腫瘤作用研究進展[J] 中醫(yī)藥臨床雜志,2014(1):91
[15]Ding PL, Chen DF, Kenneth F B, et al.Cytotoxic isoprenylated flavonoids from the roots of Sophora flavescens [J].Helv Chim Acta, 2004, 87:2574
[16]黃秋云, 施海潮 中藥苦骨的抗糖尿病活性研究[J] 海峽藥學(xué), 1998(1):9
[17]施海潮, 黃秋云 中藥苦骨抗糖尿病并發(fā)癥白內(nèi)障作用的實驗研究[J] 海峽藥學(xué), 1999(1):15
[18]Kim J H, Ryu Y B, Kang N S, et al Glycosidase inhibitory flavonoids from Sophora flavescens [J] Biol Pharm Bull, 2006,29: 302
[19]Sato S, Takeo J, Aoyama C, et al Na+Glucose cotransporter (SGLT) inhibitory flavonoids from the roots of Sophora flavescens[J] Bioorg Med Chem, 2007, 15: 3445
[20]Yang X, Yang J, Xu C, et al Antidiabetic effects of flavonoids from Sophora flavescens EtOAc extract in type 2 diabetic KKay mice [J] J Ethnopharmacol, 2015,171:161
[21]張秀莉 一種新黃酮類化合物((2S)8異戊烯基7,2′,4′三羥基5甲氧基二氫黃酮)的抗血管生成作用及其機制研究[D] 蘭州: 蘭州大學(xué), 2010
[22]李梢 苦參酮作為具有抗血管新生作用的藥物有效成分: 中國,102018697 A [P] 20110420
[23]段愛霞, 陳晶, 劉宏德,等 分子對接方法的應(yīng)用與發(fā)展[J]. 分析科學(xué)學(xué)報, 2009, 25(4):473
[24]張翅, 馬悅, 高慧敏,等 苦參化學(xué)成分研究進展[J] 中國實驗方劑學(xué)雜志,2014(4):205
[25]曹美愛 苦參化學(xué)成分及生物活性研究[D] 蘭州:蘭州大學(xué), 2007
[26]Ru J, Li P, Wang J, et al TCMSP: a database of systems pharmacology for drug discovery from herbal medicines [J] J Cheminform, 2014, 6(1):1
[27]傅征然, 王曉玲 以DrugBank數(shù)據(jù)庫為中心分析藥物信息[J] 藥物生物技術(shù),2011(1):70
[28]Gohlke H, Hendlich M, Klebe G Knowledgebased scoring function to predict proteinligand interactions[J] J Mol Biol, 2000, 295(2):337
[29]Diller D J, Merz K M High throughput docking for library design and library prioritization[J] Proteins, 2001, 43(2):113
[30]Rao S N, Head M S, Kulkarni A, et al Validation studies of the sitedirected docking program LibDock[J] J Chem Inf Mod, 2007, 47(6):2159
[31]Diller D J, Li R Kinases, homology models, and high throughput docking[J] J Med Chem, 2003, 46(22):4638
[32]Brian L H, Stephanie D G, Paul E H, et al Evolution of a highly selective and potent 2(pyridin2yl)1,3,5triazine tie2 kinase inhibitor[J] J Med Chem, 2007, 50(4):611
[33]Oguro Y, Cary D R, Miyamoto N, et al Design, synthesis, and evaluation of novel VEGFR2 kinase inhibitors: discovery of [1,2,4]triazolo[1,5a]pyridine derivatives with slow dissociation kinetics[J] Bioorg Med Chem, 2013, 21(15):4714
[34]Abreu R M, Froufe H J, Queiroz M J, et al Selective flexibility of sidechain residues improves VEGFR2 docking score using AutoDock Vina[J] Chem Biol Drug Design, 2012, 79(4):530
[35]Mathi P, Das S, Nikhil K, et al Isolation and characterization of the anticancer compound piceatannol from Sophora interrupta Bedd[J] Int J Prev Med, 2015, doi: 104103/20087802167181[責(zé)任編輯丁廣治]

