離體培養(yǎng)條件下GA對煙草胚柄PCD的誘導研究
羅岸 陳克強
(1. 長江大學生命科學學院,荊州 434023;2. 武漢大學生命科學學院,武漢 430072)
離體培養(yǎng)條件下GA對煙草胚柄PCD的誘導研究
羅岸1陳克強2
(1. 長江大學生命科學學院,荊州 434023;2. 武漢大學生命科學學院,武漢 430072)
細胞程序性死亡(PCD)對于植物的正常生長至關重要,涉及整個生命周期中的諸多發(fā)育事件,其中植物激素是植物細胞PCD的一種重要調控因子。本研究建立了有效的煙草胚珠和胚胎離體培養(yǎng)體系。通過設置不同的赤霉素(GA)濃度梯度和不同的培養(yǎng)天數進行比較,認為100 μmol/L的GA濃度和不超過3 d的培養(yǎng)時間對于研究比較合適。胚胎離體培養(yǎng)表明外源GA能夠有效誘導煙草胚柄細胞PCD的發(fā)生;且隨著GA濃度的增加,胚柄細胞PCD的比例會逐步上升。但過高的GA濃度和過長的培養(yǎng)時間也會導致胚體細胞出現異常的PCD現象。
胚柄細胞;PCD;赤霉素;離體培養(yǎng)
所謂細胞程序性死亡(Programmed cell death,PCD)是指細胞在內在或者外在因素的誘導下,通過一系列復雜的調控網絡產生特定的死亡信號來控制細胞走向主動死亡的現象。在植物的整個生命周期中包含了營養(yǎng)生長和生殖生長兩個連續(xù)的過程,在這兩個過程中植物細胞PCD都參與其中,例如,導管分子的形成、根冠細胞的更替、葉片的脫落、花器官的發(fā)育、糊粉層的降解和胚胎的發(fā)生等,此外PCD還涉及到植物抗逆的超敏反應[1]。
眾所周知,植物激素在細胞分裂分化,器官形態(tài)建成和種子脫水成熟等許多方面扮演著重要的角色。它們是在內部或外部環(huán)境的刺激下,通過自身的生理代謝而產生的一類小分子化合物,廣泛參與調控植物生長發(fā)育的各個方面。目前的研究表明在植物細胞PCD中同樣也不乏植物激素的參與。例如,赤霉素(GA)和脫落酸(ABA)作為兩種重要的植物激素,對大麥糊粉層細胞的PCD能夠產生誘導與抑制作用[2]。經GA處理的糊粉層原生質體能夠產生一系列PCD事件,如質膜完整性的喪失,細胞高度液泡化,DNA降解等,而GA信號通路的抑制劑LY83583及ABA則能夠抑制PCD的發(fā)生[2]。同樣在小麥的糊粉層細胞中,GA能夠誘導Ca2+/Mg2+依賴的的核酶的表達,而后者可能直接參與了PCD相關的DNA片段化[3]。此外GA對水稻和擬南芥花粉絨氈層PCD的啟動也很重要[4]。除了GA,乙烯也是誘導植物細胞PCD的重要激素。在玉米胚乳的發(fā)育中,乙烯和ABA的平衡被認為是胚乳細胞PCD正常啟動與進行的關鍵[5]。而在配子成功融合的擬南芥中未接受花粉管的助細胞會在乙烯的調控下執(zhí)行PCD[6]。同時,乙烯還被發(fā)現參與番茄葉片和花的離區(qū)細胞的PCD過程,這些組織中與PCD相關的水解酶的表達是由乙烯誘導產生,且可被乙烯的抑制物下調[7]。即使是在導管分子的形成中,除了已知的生長素和細胞分裂素調控途徑,油菜素內酯和乙烯也已被證明與導管分子的特化和PCD密切相關[8]。此外,在水稻不定根的發(fā)生中,乙烯和GA可參與啟動表皮細胞的PCD,ABA則起到拮抗作用[9]。
植物激素對于植物細胞PCD的發(fā)生相當重要。盡管有關植物激素參與植物細胞PCD的報道已有不少,但是目前關于植物激素對胚柄細胞PCD的調控作用仍未可知。胚柄細胞的發(fā)育與退化是一次非常有意思的PCD事件。精、卵細胞受精后形成合子,合子隨后不等分裂產生發(fā)育命運完全不同的頂細胞和基細胞。基細胞經過一系列橫向分裂產生一縱列細胞,這一縱列細胞就被稱為胚柄。雖然胚柄作為一個短命的結構對于胚胎晚期發(fā)育毫無作用,但是在胚胎發(fā)育早期,它不僅幫助胚胎保持極性,還為胚體提供營養(yǎng)[10,11]和激素[12-15]。這些營養(yǎng)和激素通過細胞間的物質交換由胚柄進入胚體,從而促進胚體的生長發(fā)育[16,17]。在此之后胚柄細胞借助PCD逐步消亡,以幫助胚胎順利的形成成熟結構。因此胚柄細胞PCD的有序進行是植物正常發(fā)育中不可或缺的一環(huán)。
本研究試圖通過建立煙草胚珠和胚胎的離體培養(yǎng)體系,以研究外源GA對胚柄細胞PCD 的影響。研究中同時使用了兩種PCD檢測方法:一種是TUNEL檢測(terminal deoxynudeotidyl transferases mediated dUTP nick end labeling,TUNEL),也叫作末端脫氧核苷酸轉移酶介導的dUTP(脫氧尿苷三磷酸)原位切口末端標記。由于細胞執(zhí)行PCD 的過程中其核基因組DNA會首先發(fā)生斷裂,因此會產生諸多暴露的3'OH。這些3'OH 可以在末端脫氧核苷酸轉移酶的催化下加上帶有熒光素標記的dUTP,從而可以通過熒光顯微鏡對細胞是否發(fā)生PCD 進行檢測;另一種對細胞中半胱氨酸蛋白酶(caspase)家族蛋白進行檢測。該家族是一類以半胱氨酸作為催化基團,能對底物的天冬氨酸位點進行特異切割的蛋白酶。在細胞PCD的調控途徑中,該家族蛋白酶一般處于下游,可影響凋亡小體的形成。通過對上述技術方法的綜合應用,本研究可望為全面認識植物細胞PCD的分子機制奠定基礎。
1 材料與方法
1.1 材料
1.1.1 植物材料 實驗所用材料為野生型煙草(Nicotiana tabacum var. SR1),種植于武漢大學溫室,光照時間16 h/d,溫度25±1℃。
1.1.2 主要試劑 常規(guī)藥品(國藥集團化學試劑有限公司),纖維素酶R-10、離析酶 R-10(YaKult公司),礦物油、MES、Triton X-100(BIOSHARP公司),微室MILICELL(Millipore公司),DeadEndTMFluorometric TUNEL System試劑盒(Promega公司)
1.1.3 培養(yǎng)基與酶解液 胚珠離體培養(yǎng)基:MS,6%蔗糖,pH 5.8,過濾滅菌。胚胎離體培養(yǎng)基:(1)微室內培養(yǎng)基:MS大量 + Km8P-Vitamin + Km8P-微量 + Km8P-有機 + Km8P-鐵鹽 + 3 mmol/L MES + 0.5 mg/L NAA + 0.25 mg/L 6-BA,0.5 mol/L蔗糖,pH5.8,過濾滅菌;(2)微室外培養(yǎng)基:MS大量 + Km8PVitamin + Km8P-微量 + Km8P-有機 + Km8P-鐵鹽 + 3 mmol/L MES,0.5 mol/L蔗糖,pH5.8,過濾滅菌。酶解液:1%纖維素酶,0.8%離析酶,11%甘露醇,pH5.8,過濾滅菌。
1.2 方法
1.2.1 煙草胚珠離體培養(yǎng) 取人工授粉96 h的煙草子房(合子時期),75%酒精消毒10 min,無菌水清洗3次,每次5 min。使用無菌牙簽剝開子房表皮,將胚珠挑至預先放置有胚珠培養(yǎng)基和GA的培養(yǎng)皿中,25℃暗培養(yǎng)后進行觀察。
1.2.2 煙草胚胎離體培養(yǎng) 取人工授粉132 h的煙草子房(8胞胚時期)用于分離胚胎,75%酒精消毒10 min,無菌水清洗3次,每次5 min。使用無菌牙簽剝開子房表皮,將胚珠從子房挑至無菌酶解液中,28℃酶解30 min。利用酶解時間在Φ3.5 cm的培養(yǎng)皿中加入室外培養(yǎng)基,再將微室MILICELL置于培養(yǎng)皿中央,在微室MILICELL中加入室內培養(yǎng)基。待酶解完成后,分離煙草胚胎轉入微室MILICELL中。再取人工授粉144 h的煙草子房(16胞胚時期)用于分離胚珠做飼養(yǎng)物,75%酒精消毒10 min,無菌水清洗3次,每次5 min。使用無菌牙簽剝開子房表皮,將胚珠從子房挑至加有GA的室外培養(yǎng)基中(約150個胚珠/皿),25℃暗培養(yǎng)后進行觀察。煙草胚胎的分離按照文獻[18-20]方法進行。
1.2.3 TUNEL反應 使用4%多聚甲醛固定胚胎,按照DeadEndTMFluorometric TUNEL System試劑盒的要求進行操作。之后將10 mg/mL 4’,6-diamidino-2-phenylindole(DAPI)加入 11%甘露醇中用以對胚胎的細胞核進行染色。染色15-20 min后,再用11%甘露醇清洗兩次即可進行熒光觀察。
1.2.4 酶活檢測 用自制的微吸針將培養(yǎng)1 d的胚胎轉移到準備好的1 μL保存液中(15 mmol/L磷酸鈉加上0.1% Brij-35)。底物VEID-AMC的酶活檢測反應體系如下:樣品2 μL,10 mmol/L EDTA 1 μL,400 μmol/L底物2 μL,50 mmol/L半胱氨酸(CYS)2 μL,15 mmol/L PBS(PH5.0)3 μL,總體積10 μL,30℃反應16 h。其中EDTA、底物和半胱氨酸用15 mmol/L PBS(pH5.0)配制使用。反應后使用毛細管電泳對熒光基團AMC的熒光值進行檢測。
1.2.5 圖像觀察與處理 胚胎分離在普通倒置顯微鏡下(Olympus IMT-2)下進行,胚珠在體視顯微鏡(Olympus)下觀察并采集圖像,TUNEL反應的檢測在激光共聚焦掃描顯微鏡(Olympus FluoView FV1000)下觀察并采集圖像,Photoshop 和Core l DRAW用于圖像處理。
2 結果
2.1 煙草胚珠和胚胎離體培養(yǎng)體系的建立
本研究建立了兩種培養(yǎng)體系:胚珠離體培養(yǎng)利用普通MS培養(yǎng)基在培養(yǎng)皿中暗培養(yǎng);胚胎離體培養(yǎng)通過微室飼養(yǎng)培養(yǎng)(圖1)。
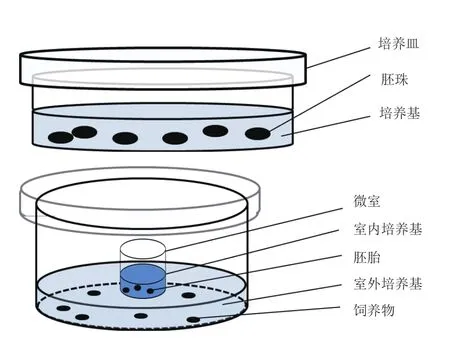
圖1 煙草胚珠和胚胎離體培養(yǎng)示意圖
2.2 GA濃度對煙草胚珠離體發(fā)育的影響
利用建立的煙草胚珠體外培養(yǎng)體系進行實驗。選擇人工授粉96 h的胚珠(合子時期)分別用于不同GA濃度的離體培養(yǎng),濃度梯度為50、100、200、400和500 μmol/L。1周后對不同GA濃度培養(yǎng)的胚珠進行觀察發(fā)現未受GA處理的胚珠絕大多數能夠發(fā)育膨大,與自然條件下相同發(fā)育時間的胚珠一樣呈現為白色,只有少數胚珠褐化并且敗育(圖2)。而在GA處理組中,大部分胚珠雖然褐化,但仍能發(fā)育膨大,不過敗育胚珠的數量有所增加。統(tǒng)計結果表明,在GA濃度超過50 μmol/L的情況下,隨著GA濃度的增加,胚珠的敗育比例逐步提高(圖3)。由于400 μmol/L和500 μmol/L的GA處理組中的胚珠敗育比例高達50%以上,因此該濃度的GA可能對胚珠的正常生長有較大影響,后續(xù)實驗不再將其列入考察范圍。
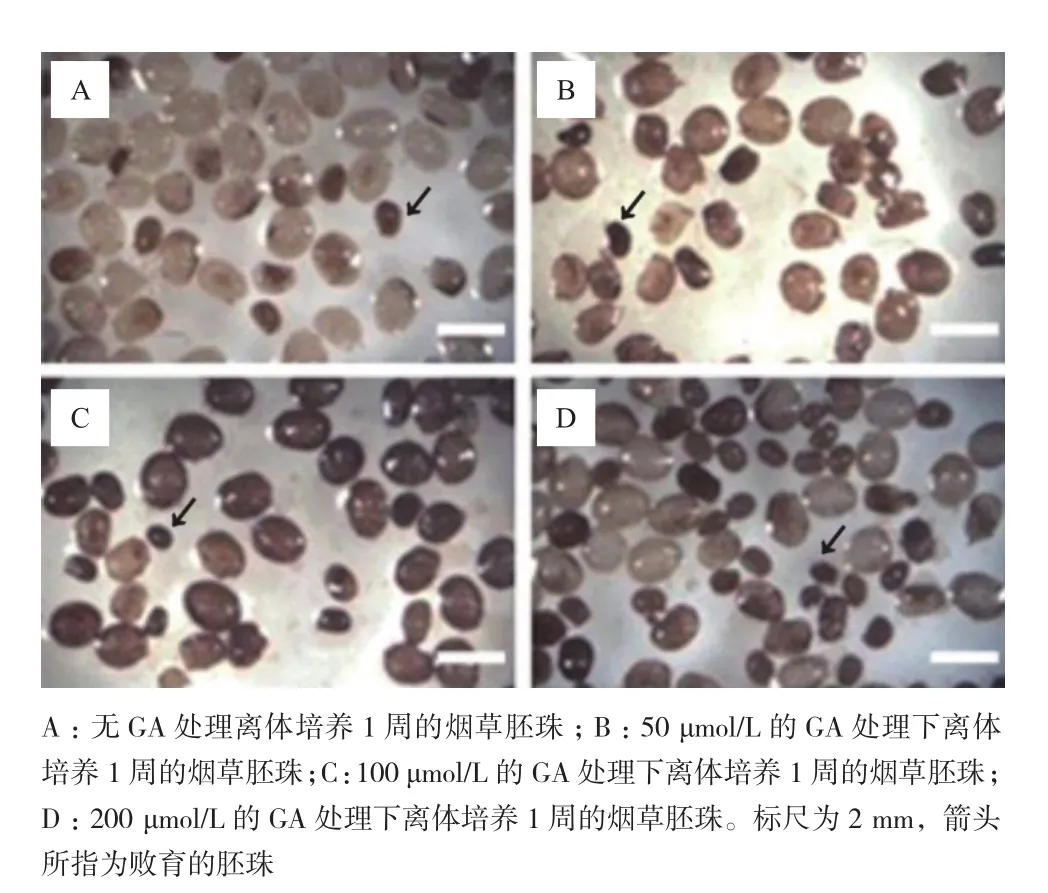
圖2 煙草胚珠離體培養(yǎng)1周后的表現
對培養(yǎng)2周后的胚珠的發(fā)育情況繼續(xù)進行觀察發(fā)現,未經GA處理以及經過GA處理的胚珠此時絕大多數都已經褐化。統(tǒng)計結果表明此時的敗育胚珠的比例雖然也有所上升,但與一周前相比未表現出明顯增量(圖3)。因此實驗結果說明100 μmol/L的GA即可影響離體培養(yǎng)的煙草胚珠的正常發(fā)育。在離體培養(yǎng)的第一周GA對胚珠發(fā)育的影響更加明顯,隨著時間的增加,影響逐步降低。這為后續(xù)實驗選擇合適的GA濃度和處理時間提供了依據。

圖3 煙草胚珠離體培養(yǎng)1周和2周后的敗育比例
2.3 離體培養(yǎng)條件下GA對胚柄細胞PCD的誘導
為分析外源GA對胚柄細胞PCD的誘導作用,擬通過整體透明法和酶解分離法對離體培養(yǎng)中的胚珠的胚胎進行研究。但這兩種方法的觀察結果都不理想,故直接采用胚胎離體培養(yǎng)的方式進行研究。
前期研究已證實煙草SR1的胚胎在8胞時期即擁有胚柄細胞,隨后胚柄細胞會在32胞時期開始執(zhí)行PCD[21],因此本研究選擇煙草8胞時期的胚胎(此時胚柄還未出現PCD)進行離體培養(yǎng)。由于2.2的結果表明GA在早期培養(yǎng)時對胚胎發(fā)育的影響較大,以及考慮到離體培養(yǎng)對胚胎發(fā)育的影響,實驗選擇對離體培養(yǎng)3 d后的胚胎進行TUNEL反應檢測。 實驗結果表明經GA處理的胚胎的胚柄細胞中出現了明顯的TUNEL信號(圖4,表1);而在未經GA處理的胚胎的胚柄細胞中只出現了極少量的TUNEL信號(表1),這可能是離體培養(yǎng)環(huán)境造成的異常。
此外觀察亦發(fā)現有少量胚胎的胚體細胞中也出現了TUNEL信號(圖5),而自然狀態(tài)下胚體細胞不會出現PCD現象[21],這可能是由于異常的外界環(huán)境導致的胚胎發(fā)育障礙。表1結果也表明100 μmol/L 和200 μmol/L的GA的處理組中,胚柄細胞出現TUNEL信號的比例沒有明顯區(qū)別,但是200 μmol/L的GA的處理組中胚體細胞出現TUNEL信號的比例高出約一倍。這說明離體培養(yǎng)條件下200 μmol/L的GA對煙草胚胎的正常發(fā)育影響較大,因此選擇100 μmol/L的GA進行胚胎離體培養(yǎng)更合適。
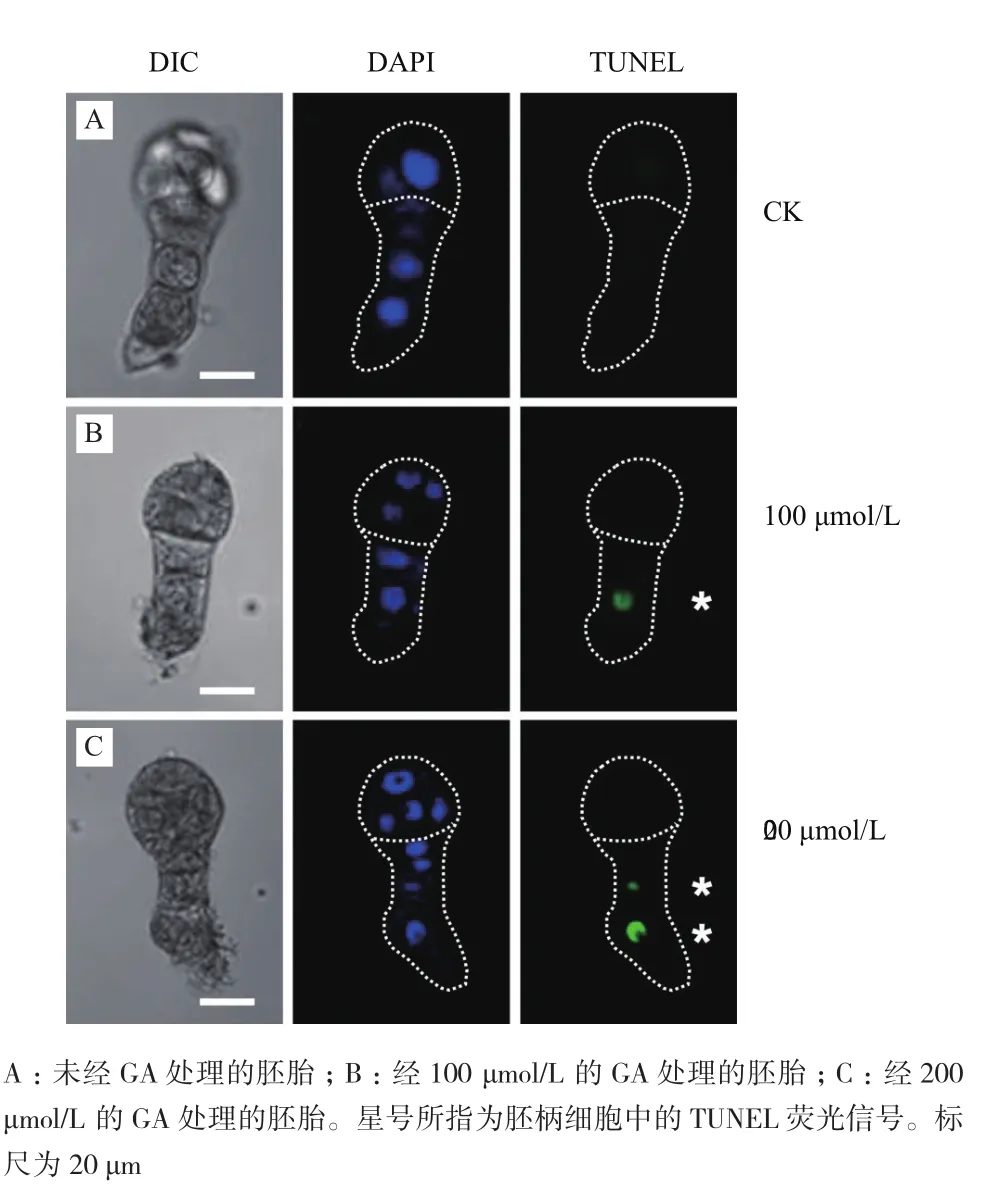
圖4 GA處理下離體培養(yǎng)3 d的煙草胚胎TUNEL檢測
2.4 培養(yǎng)時間對GA誘導的胚柄細胞PCD的影響
為了解培養(yǎng)時間對胚柄細胞PCD的影響,使用100 μmol/L的GA對8胞時期的胚胎進行不同天數的離體培養(yǎng)。結果表明胚胎離體培養(yǎng)過程中,胚柄細胞出現TUNEL信號的比例會隨著培養(yǎng)時間的增加而增加。表2結果顯示培養(yǎng)3 d的胚胎的胚柄細胞出現TUNEL信號的比例為67.6%,超過培養(yǎng)1 d的胚胎的胚柄細胞出現TUNEL信號的比例25%大約1.5倍。然而對比培養(yǎng)3 d和培養(yǎng)5 d的胚胎的胚柄細胞出現TUNEL信號的比例發(fā)現,TUNEL信號的比例僅由67.6%提高到75%,增量相對較低。而隨著培養(yǎng)時間的增加,胚體細胞出現異常TUNEL信號的比例逐漸提高。因此實驗結果表明,外源GA對胚柄細胞的影響主要體現在離體培養(yǎng)的前3 d,過長的培養(yǎng)時間會逐漸干擾胚體的正常發(fā)育。

表1 GA處理下離體培養(yǎng)3 d的煙草胚胎細胞TUNEL信號統(tǒng)計
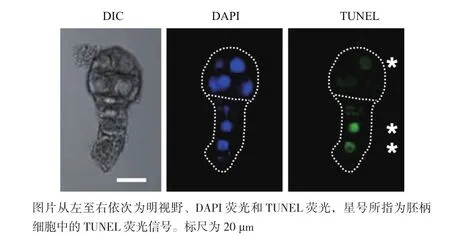
圖5 GA處理下離體培養(yǎng)3 d后的胚體細胞中出現TUNEL信號
2.5 離體培養(yǎng)條件下對胚胎細胞的caspase 6-like酶活的檢測
依照以往實驗結果,caspase家族蛋白caspase 6-like可能參與了胚柄細胞PCD[21],故使用caspase 6-like的特異底物VEID-AMC以檢測經外源GA誘導的胚柄細胞中caspase 6-like的酶活是否升高。由于胚體和胚柄不易分離,酶活檢測使用的是整個胚胎。根據2.4中的結果,經100 μmol/L的外源GA離體培養(yǎng)一天的胚胎較適于檢測,因為此時胚體細胞幾乎不受影響,且胚柄細胞已被誘導產生PCD(表2)。
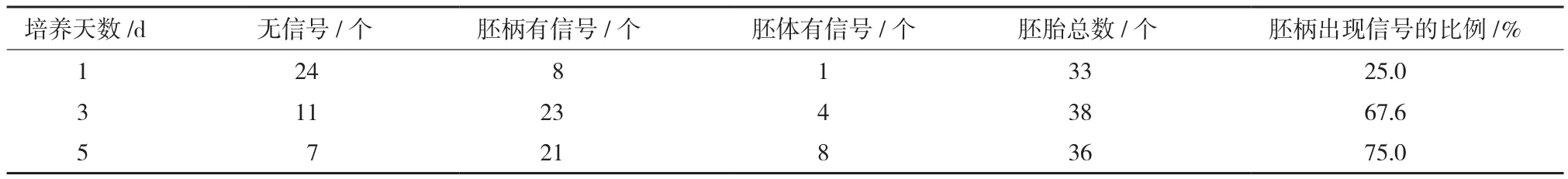
表2 100 μmol/L的GA處理下離體培養(yǎng)不同天數的煙草胚胎細胞TUNEL信號統(tǒng)計
檢測的結果(圖6)表明在GA處理組中底物經caspase 6-like切割而釋放的AMC基團的熒光值要比對照組的熒光值高出約1倍,這說明在100 μmol/L GA處理下,細胞中caspase 6-like的酶活有了明顯的提高,這從另一方面暗示GA誘導了胚柄細胞PCD的發(fā)生。
3 討論
目前在動物[22-25]和微生物[26,27]中,對PCD相關的調控、介導和效應因子的研究已頗為深入,但對植物中相似過程的了解遠遠不夠,盡管PCD對于植物的營養(yǎng)和生殖生長也不可或缺[28]。與動物不同的是,植物有兩種產生能量的細胞器,線粒體和葉綠體,這可能更增加了了解植物PCD機制的難度[29]。
本研究利用離體培養(yǎng)技術對外源GA在植物胚柄PCD中發(fā)揮的作用進行了初步探索。實驗中運用了兩種離體培養(yǎng)技術:胚珠離體培養(yǎng)和胚胎離體培養(yǎng)。前者操作相對簡單,可培養(yǎng)大量胚珠進行實驗條件的摸索,但由于珠被組織的干擾,難以對胚胎進行直接觀察和檢測。反而是后者雖然操作過程較為復雜,培養(yǎng)的胚胎數量較少,但是胚胎清晰可見,可方便的對其進行細胞學和分子生物學檢測。
胚珠離體培養(yǎng)表明外源的GA可影響煙草胚珠的正常發(fā)育,濃度越高影響越大。而胚胎離體培養(yǎng)更證實外源GA能夠誘導胚柄細胞TUNEL反應的發(fā)生以及提高細胞中caspase 6-like的酶活。這些都清楚的暗示外源GA也處在胚柄PCD的調控途徑中,并作為上游調控因子啟動其發(fā)生。當然目前對GA參與植物細胞PCD的分子調控機制仍然所知有限,比如GA調控絨氈層的PCD主要是通過水稻的GA-regulated myeloblastosis(GAMYB)轉錄因子和擬南芥中的同源基因MYB33和MYB65來進行[4];另外谷物糊粉層細胞的PCD也受到GA的誘導[2],雖然還不知道這些糊粉層細胞的PCD是如何啟動,但信號通路中的一些二級信使包括Ca2+、NO和ROS都已被確認[30];其他實驗還表明大麥和獨行草的胚乳發(fā)育中GA處理可誘導一些天門冬氨酸和半胱氨酸蛋白酶的上調[30,31]。因此本研究對培養(yǎng)方式、培養(yǎng)材料、培養(yǎng)時間和培養(yǎng)物濃度的選擇為今后深入探索煙草胚柄細胞PCD中GA相關的分子調控網絡奠定了基礎。

圖6 100 μmol/L GA和非GA處理下離體培養(yǎng)1 d的胚胎細胞中caspase 6-like的酶活
4 結論
本研究建立了一套可靠的煙草胚胎和胚珠體外培養(yǎng)體系。證實體外培養(yǎng)條件下,外源GA能夠誘導植物胚柄PCD的發(fā)生,且發(fā)生頻率與濃度之間呈現正相關。100 μmol/L的GA濃度和3 d以內的培養(yǎng)時間對于煙草胚柄PCD的誘導較為合適。
[1]Blanvillain R, Young B, Cai YM, et al. The Arabidopsis peptide kiss of death is an inducer of programmed cell death[J]. EMBO J, 2011, 30:1173-1183.
[2]Behke PC. Hormonally regulated programmed cell death in barley aleurone cells[J]. The Plant Cell, 1999, 11:1033-1045.
[3]Van Hautegem T, Waters AJ, Goodrich J, et al. Only in dying, life:programmed cell death during plant development[J]. Trends Plant Sci, 2015, 20(2):102-113.
[4]Plackett AR, Ferguson AC, Powers SJ, et al. DELLA activity is required for successful pollen development in the Columbia ecotype of Arabidopsis[J]. New Phytol, 2014, 201:825-836.
[5]Young TE, Gallie DR. Regulation of programmed cell death in maize endosperm by abscisic acid[J]. Plant Mol Bio, 2000, 42:397-414.
[6]V?lz R, Heydlauff J, Ripper D, et al. Ethylene signaling is required for synergid degeneration and the establishment of a pollen tube block[J]. Dev Cell, 2013, 25:310-316.
[7]Bar-Dror T, Dermastia M, Kladnik A, et al. Programmed cell death occurs asymmetrically during abscission in tomato[J]. Plant Cell, 2011, 23:4146-4163.
[8]Milhinhos A, Miguel CM. Hormone interactions in xylem development:a matter of signals[J]. Plant Cell Rep, 2013, 32:867-883.
[9]Steffens B, Wang J, Sauter M. Interactions between ethylene, gibberellin and abscisic acid regulate emergence and growth rate of adventitious roots in deepwater rice[J]. Planta, 2006, 223:604-612.
[10]Yeung EC. Embryogeny of phaseolus:the role of the suspensor[J]. Z Pflanzenphysiol, 1980, 96:17-28.
[11]Nagl W. Translocation of putrescine in the ovule, suspensor and embryo of Phaseolus coccineus[J]. Plant Physiol, 1990, 136:587-591.
[12]Picciarelli P, Ceccarelli N, Paolicchi F, et al. Endogenous auxins and embryogenesis in Phaseolus coccineus[J]. Aust J Plant Physiol, 2001, 28:73-78.
[13]Lorenzi R, Bennici A, Cionini PG, et al. Embryo-suspensor relations in Phaseolus coccineus:cytokinins during seed development[J]. Planta, 1978, 143:59-62.
[14]Perata P, Picciarelli P, Alpi A. Pattern of variations in abscisic acid content in suspensors, embryos, and integuments of developing Phaseolus coccineus seeds[J]. Plant Physiol, 1990, 94:1776-1780.
[15]Alpi A, Tognoni F, D’Amato F. Growth regulator levels in embryo and suspensor of Phaseolus coccineus at two stages of development[J]. Planta, 1975, 127:153-162.
[16]M?ller B, Weijers D. Auxin control of embryo patterning[J]. Cold Spring Harb Perspect Biol, 2009, 100:15-45.
[17]Kawashima T, Goldberg RB. The suspensor:not just suspending the embryo[J]. Trend Plant Sci, 2009, 15:23-30.
[18]Zhang JE, Luo A, Xin HP, et al. Genes of both parental origins are differentially involved in early embryogenesis of a tobacco interspecies hybrid[J]. PLoS One, 2011, 6:e23153.
[19]He YC, Chen JY, Guo JZ, et al. A high-frequency in vivo-in vitro experimental system for embryogenesis study[J]. Journal of Wuhan Botanical Research, 2006, 24(1):6-11.
[20]He YC, He YQ, Qu LH, et al. Tobacco zygotic embryogenesis in vitro:the original cell wall of the zygote is essential for maintenance of cell polarity, the apical-basal axis and typical suspensor formation[J]. Plant J, 2007, 49:515-527.
[21]Zhao P, Zhou XM, Zhang LY, et al. A bipartite molecular module controls cell death activation in the Basal cell lineage of plant embryos[J]. PLoS Biol, 2013, 11:e1001655.
[22]Vecino E, Acera A. Development and programed cell death in the mammalian eye[J]. Int J Dev Biol, 2015, 59(1-3):63-71.
[23]Yamaguchi Y, Miura M. Programmed cell death and caspase functions during neural development[J]. Curr Top Dev Biol, 2015, 114:159-184.
[24]De Felici M, Klinger FG. Programmed cell death in mouse primordial germ cells[J]. Int J Dev Biol, 2015, 59(1-3):41-49.
[25]Klinger FG, Rossi V, De Felici M. Multifaceted programmed cell death in the mammalian fetal ovary[J]. Int J Dev Biol, 2015, 59(1-3):51-54.
[26] Bidle KD. Programmed cell death in unicellular phytoplankton[J]. Curr Biol, 2016, 26(13):R594-607.
[27]Durand PM, Sym S, Michod RE. Programmed cell death and complexity in microbial systems[J]. Curr Biol, 2016, 26(13):R587-593.
[28]Van Hautegem T, Waters AJ, Goodrich J, et al. Only in dying, life:programmed cell death during plant development[J]. Trends Plant Sci, 2015, 20(2):102-113.
[29]Ambastha V, Tripathy BC, Tiwari BS. Programmed cell death in plants:A chloroplastic connection[J]. Plant Signal Behav, 2015, 10(2):e989752.
[30]Fath A, Bethke P, Lonsdale J, et al. Programmed cell death in cereal aleurone[J]. Plant Mol Biol, 2000, 44:255-266.
[31]Morris K, Linkies A, Müller K, et al. Regulation of seed germination in the close Arabidopsis relative Lepidium sativum:a global tissuespecific transcript analysis[J]. Plant Physiol, 2011, 155:1851-1870.
(責任編輯 馬鑫)
Suspensor PCD Induced by GA in Nicotiana tabacum Under In Vitro Culture
LUO An1CHEN Ke-qiang2
(1. College of Life Science,Yangtze University,Jingzhou 434023;2. College of Life Science,Wuhan University,Wuhan 430072)
Programmed cell death(PCD)is ubiquitous in the entire developmental process of plant,and hormones are a key regulating factor to PCD in plant. To investigate the role of GA in the suspensor PCD,systems of in vitro culture of the ovule and embryo were well established. By setting different concentrations of GA and culture time,100 μmol/L GA was appropriate and embryos may not be cultured for more than 3 days. The suspensor PCD was efficiently induced by exogenous GA during in vitro culture of embryo. As the concentration of GA increased,the proportion of PCD in suspensor cells gradually raised. Howerver,excessively high concentration of GA and long culture time would also induce abnormal PCD in porper cells.
suspensor;PCD;GA;in vitro culture
10.13560/j.cnki.biotech.bull.1985.2017.03.011
2016-07-28
長江大學自然科學基金項目(2014NSFY023)
羅岸,男,博士,講師,研究方向:植物生殖發(fā)育;E-mail:Anluo@whu.edu.cn

