尿微量白蛋白熒光免疫層析定量檢測試劑的研制及性能評價(jià)
張賽 洪裕好 李凱 何小維 李文美,
(1. 廣州萬孚生物技術(shù)股份有限公司 自檢型快速診斷國家地方聯(lián)合工程實(shí)驗(yàn)室,廣州 510663;2. 華南理工大學(xué)食品科學(xué)與工程學(xué)院,廣州 510640)
尿微量白蛋白熒光免疫層析定量檢測試劑的研制及性能評價(jià)
張賽1洪裕好1李凱1何小維2李文美1,2
(1. 廣州萬孚生物技術(shù)股份有限公司 自檢型快速診斷國家地方聯(lián)合工程實(shí)驗(yàn)室,廣州 510663;2. 華南理工大學(xué)食品科學(xué)與工程學(xué)院,廣州 510640)
旨在建立一種快速定量檢測人尿液中微量白蛋白的熒光免疫層析方法。以羧基熒光微球標(biāo)記的抗人白蛋白單克隆抗體及羊抗兔IgG為標(biāo)記抗體,人白蛋白和兔IgG分別作為檢測線和質(zhì)控線制備熒光免疫層析試紙條。結(jié)果顯示,所制備檢測試劑的線性范圍為5-300 mg/L,檢測限為2.3 mg/L,批內(nèi)和批間變異系數(shù)(CV)分別為6.4%-9.3%和6.5%-12.3%,平均回收率為102.3%。試劑與尿液中20種干擾物質(zhì)無交叉反應(yīng),實(shí)時(shí)穩(wěn)定性試驗(yàn)表明試劑盒有效期>12月。臨床樣本測試,與Orion QuikRead U-ALB試劑相關(guān)性較好(r=0.993,P<0.01),Bland-Altman分析表明兩種方法的診斷結(jié)果具有較好的一致性。所制備的熒光免疫層析檢測試劑提供了一種簡單、快速、準(zhǔn)確的定量檢測尿液中微量白蛋白的方法。
尿微量白蛋白;熒光免疫層析;快速檢測
尿微量白蛋白(Microalbuminuria,MAU)是指在尿中出現(xiàn)微量白蛋白,其分泌率在30-300 mg/24 h的范圍內(nèi)。正常情況下人血白蛋白很難通過腎小球基底膜,只有極少量的白蛋白可以通過尿液排出體外,當(dāng)腎小球基底膜病變,蛋白濾過量超過腎小管重吸收,則導(dǎo)致尿白蛋白增高[1]。尿微量白蛋白是診斷糖尿病腎病早期腎損傷的可靠生化指標(biāo)[2-4]。此外,研究表明MAU也是高血壓、孕婦子癇前期及心血管疾病并發(fā)癥獨(dú)立的危險(xiǎn)因素[5-7]。
目前臨床上常用的檢測MAU的方法有放射免疫法[8]、酶聯(lián)免疫吸附法[9]、化學(xué)發(fā)光法[10]、免疫比濁法[11]和免疫層析法[12]等。放射免疫法利用放射性同位素作為示蹤劑,有放射性污染且儀器較貴;酶聯(lián)免疫吸附法需要多次洗滌和孵育,操作繁瑣;化學(xué)發(fā)光法成本較貴,試劑及儀器皆依賴于進(jìn)口;免疫比濁法靈敏度高、特異性好,但需要高質(zhì)量的特種蛋白分析儀;免疫層析法克服以上幾種方法的缺點(diǎn),具有快速、靈敏、特異性強(qiáng)、操作簡便、成本較低等優(yōu)點(diǎn),是近年免疫檢測中最有發(fā)展前途的方法[13]
本研究為克服膠體金免疫層析靈敏度相對偏低,且只能用于定性或半定量檢測的缺點(diǎn),擬采用免疫標(biāo)記技術(shù)和免疫層析方法,以熒光納米微球作為示蹤物,制備免疫層析試紙條,以期獲得一種操作簡單快速、靈敏度高、特異性強(qiáng)、定量準(zhǔn)確的檢測尿微量白蛋白的新的檢測模式。
1 材料與方法
1.1 材料
人血白蛋白,西班牙Instituto Grifols公司;鼠抗人白蛋白單克隆抗體,芬蘭Medix Biochemica公司;兔IgG 及羊抗兔IgG 均為本實(shí)驗(yàn)室制備[14];熒光微球,美國Bangs lab公司;硝酸纖維素膜,德國Sartorius公司;碳二亞胺(EDC)、N-羥基硫代琥珀酰亞胺(Sulfo NHS),美國Thermo Scientific 公司;牛血清白蛋白(BSA)、吐溫-20、聚乙二醇-4000、一水嗎啉乙磺酸(MES),美國Sigma 公司;硼砂、硼酸、氯化鈉、磷酸二氫鈉、磷酸氫二鈉,廣州化學(xué)試劑廠。其余試劑均為國產(chǎn)分析純。
ND2000 型超微量分光光度計(jì)、Legen RT+臺式高速冷凍離心機(jī),美國Thermo Scientific公司;Iso Flow型噴膜機(jī),美國Imagene Technplogy公司;HGS201切條機(jī),杭州峰航科技有限公司;超聲波細(xì)胞粉碎機(jī),寧波新芝生物科技股份有限公司;Milli-Q 超純水機(jī),美國Millipore公司;LEO1530VP場發(fā)射掃描電子顯微鏡,德國Zeiss公司;飛測II熒光定量檢測儀,廣州萬孚生物技術(shù)股份有限公司。
1.2 方法
1.2.1 MAU熒光免疫層析試紙條的制備及優(yōu)化
1.2.1.1 熒光免疫層析試紙條的制備 采用競爭法反應(yīng)模式,以羧基熒光微球標(biāo)記的抗人白蛋白單克隆抗體及羊抗兔IgG為標(biāo)記抗體,用噴膜機(jī)噴一定濃度的標(biāo)記抗體、人血白蛋白和兔IgG于硝酸纖維素(NC)膜上分別作為標(biāo)記線、檢測線(T線)和質(zhì)控線(C線)。試紙條的組裝是在聚氯乙烯(PVC)板上順次相互搭接樣品墊、NC膜和吸水紙,然后用切條機(jī)切割成4 mm寬的試紙條,試紙條組成如圖1所示。測試時(shí)將75 μL待測尿液樣本直接加入加樣孔中,反應(yīng)3 min后用熒光定量檢測儀檢測。

圖1 試紙條組成
1.2.1.2 熒光微球標(biāo)記抗體濃度的確定 熒光微球的標(biāo)記過程參照本實(shí)驗(yàn)室已建立的方法[14]。研究每毫升1% 熒光微球中加入0.2、0.4、0.6、0.8、1.0和1.2 mg的抗體對檢測線熒光信號T值的影響,以確定最佳抗體標(biāo)記濃度。以標(biāo)記線熒光微球使用濃度30%+3%,T、C線蛋白濃度2.0 mg/mL噴膜,制備試紙條。取濃度為20 mg/L的參考品75 μL進(jìn)行加樣,反應(yīng)時(shí)間3 min,每個(gè)濃度重復(fù)測試5次。
1.2.2 MAU熒光免疫層析檢測試劑的性能評價(jià)
1.2.2.1 檢測限 以零濃度參考品作為標(biāo)本重復(fù)測定20次,計(jì)算其熒光信號均值(x-)及標(biāo)準(zhǔn)差(SD),將+2SD所得的熒光值代入標(biāo)準(zhǔn)曲線方程計(jì)算得出其檢測限。
1.2.2.2 精密度 抽取兩個(gè)批次的MAU檢測試劑,分別對MAU濃度20、45、105 mg/L的參考品進(jìn)行檢測,每個(gè)濃度重復(fù)測定20次,計(jì)算批內(nèi)和批間各濃度變異系數(shù)(Coefficient of variation,CV)。
1.2.2.3 回收率 在已知6個(gè)不同濃度的MAU尿液中加入不同濃度的MAU純抗原,使得尿液中MAU的期望濃度為20 mg/L和100 mg/L,每個(gè)濃度重復(fù)測試5次,計(jì)算回收率,即實(shí)測值與理論值的比值。
1.2.2.4 特異性 以含MAU的尿液樣本(35 mg/L)為對照,向其中分別添加干擾物質(zhì)丙酮、肌酐、膽紅素、抗壞血酸、葡萄糖、對乙酰氨基酚、檸檬酸、尿素、氨芐西林、咖啡因、四環(huán)素、膽固醇、血紅蛋白(1 mg/mL),人IgA、人IgG、人IgM(50 mg/L),β2-微球蛋白(5 mg/L),促甲狀腺激素(TSH,100 mIU/L)、促卵泡激素(FSH,100 mIU/mL)、人絨毛膜促性腺激素(HCG,100 IU/mL),每個(gè)濃度重復(fù)測試5次,比較不同干擾物質(zhì)的測試值,以評價(jià)試劑的特異性。
1.2.2.5 穩(wěn)定性 將成品試劑盒置于干燥房保存,14個(gè)月內(nèi)每個(gè)月分別測試濃度為20、45、105 mg/L的MAU參考品,每個(gè)濃度重復(fù)測試5次,檢測結(jié)果相對偏差在±20%以內(nèi)認(rèn)為試劑穩(wěn)定性良好。
1.2.2.6 臨床驗(yàn)證 用本試劑盒(萬孚-MAU)檢測244例臨床尿液樣本,以O(shè)rion QuikRead U-ALB試劑檢測結(jié)果為對照,每個(gè)臨床樣本測試2次取平均值,比較其檢測結(jié)果的相關(guān)性和一致性。
1.2.3 統(tǒng)計(jì)學(xué)分析 采用Origin8.0軟件擬合標(biāo)準(zhǔn)曲線方程,R2≥0.998,P<0.05表明線性良好。各組數(shù)據(jù)用x-±s表示。兩種方法臨床定量檢測結(jié)果的相關(guān)性采用SPSS18.0進(jìn)行線性回歸分析,相關(guān)系數(shù)r≥0.95表明相關(guān)性良好。采用Bland-Altman圖進(jìn)行臨床測試結(jié)果的一致性分析,統(tǒng)計(jì)95%一致性界限外的百分比。
2 結(jié)果
2.1 熒光微球掃描電鏡圖譜
從原熒光微球掃描電鏡圖(圖2-A)中可以看出,實(shí)驗(yàn)所用熒光微球呈均一分散的球形,粒徑為500 nm 左右。從與抗體蛋白共價(jià)偶聯(lián)后的免疫熒光微球掃描電鏡圖(圖2-B)圖中可以看出,微球-抗體復(fù)合物仍粒度均一,沒有出現(xiàn)團(tuán)聚現(xiàn)象。與抗體蛋白共價(jià)偶聯(lián)后在微球的表層可以觀察到一層“暈”,這層“暈”即為蛋白質(zhì)分子層。
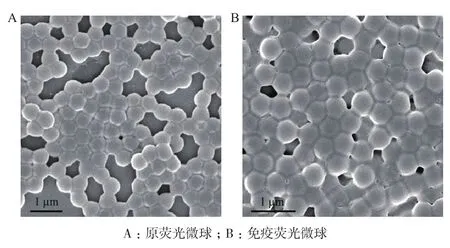
圖2 熒光微球掃描電鏡圖譜
2.2 標(biāo)記抗體蛋白濃度的確定
不同標(biāo)記抗體蛋白濃度下免疫層析熒光信號如圖3所示,在0.2-1.2 mg/mL的范圍內(nèi),隨著蛋白濃度的增加,熒光信號值逐漸增加,高于1.0 mg/mL時(shí),熒光信號值變化平穩(wěn),說明抗體標(biāo)記濃度為1.0 mg/mL時(shí),熒光微球共價(jià)偶聯(lián)蛋白量已達(dá)到飽和,因此最佳抗體標(biāo)記濃度為1.0 mg/mL。

圖3 熒光信號隨標(biāo)記抗體蛋白濃度的變化
2.3 MAU熒光免疫層析定量檢測試劑的標(biāo)準(zhǔn)曲線
MAU熒光免疫層析定量檢測試劑的標(biāo)準(zhǔn)曲線如圖4所示,回歸方程y=0.00902x+0.27324(決定系數(shù)R2=0.99974、P<0.01),熒光信號C/T值與MAU參考品濃度在5-300 mg/L范圍內(nèi)具有良好的線性關(guān)系。將x-±SD所得的熒光值代入標(biāo)準(zhǔn)曲線方程計(jì)算得出其檢測限為2.3 mg/L,試劑分析靈敏度較高。

圖4 MAU熒光免疫層析檢測試劑標(biāo)準(zhǔn)曲線
2.4 精密度
抽取兩個(gè)批次的MAU檢測試劑,分別對MAU濃度20、45、105 mg/L的參考品進(jìn)行檢測,結(jié)果如表1所示,批內(nèi)和批間變異系數(shù)分別為6.4%-9.3%和6.5%-12.3%,批內(nèi)與批間各檢測濃度CV<15%,試劑精密度較高。
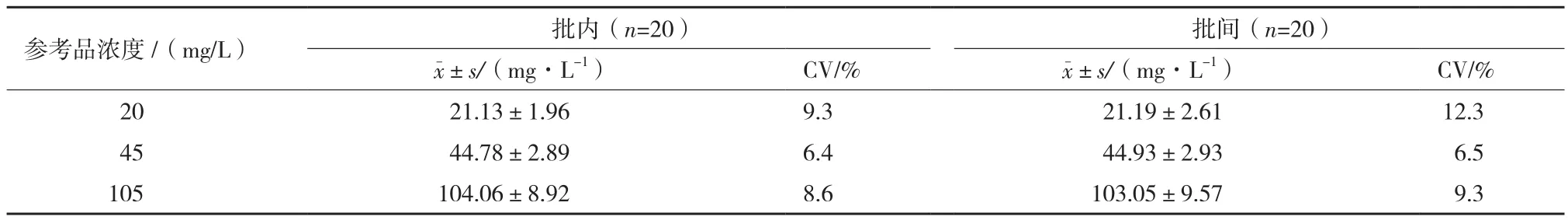
表1 MAU熒光免疫層析檢測試劑精密度
2.5 回收率
如表2所示,MAU熒光免疫層析檢測試劑在回收率在93.6%-108.3%之間,平均回收率為102.3%,表明添加物與尿液被測物一致,基本沒有尿液基質(zhì)物的干擾。

表2 MAU熒光免疫層析檢測試劑回收率
2.6 特異性分析
MAU熒光免疫層析檢測試劑特異性分析結(jié)果如圖5所示,20種干擾物質(zhì)的測試值與對照品的相對偏差均<15%,故這20種干擾物在尿液中對MAU檢測無影響,試劑抗干擾能力較強(qiáng)。
2.7 穩(wěn)定性試驗(yàn)
穩(wěn)定性試驗(yàn)結(jié)果如表3所示,14個(gè)月內(nèi)檢測濃度為20.0、45.0、105.0 mg/L的MAU參考品,各濃度相對偏差均<20%,表明MAU試劑盒較穩(wěn)定,有效期>12月。
2.8 臨床試驗(yàn)
244例臨床尿樣同時(shí)用自制試劑盒與Orion QuikRead U-ALB試劑盒測定的數(shù)值進(jìn)行相關(guān)性分析,結(jié)果兩種方法所測試值有顯著相關(guān)性(圖6),線性回歸方程y=0.9813x+1.9232,Pearson相關(guān)性系數(shù)r=0.993,P<0.01。采用Bland-Altman圖進(jìn)行臨床測試結(jié)果的一致性分析,結(jié)果如圖7所示。244例配對數(shù)據(jù)差值的均數(shù)為-1.0 mg/L,95%一致性界限為-15.1-13.1 mg/L,5.32%(13/244)的點(diǎn)在95%一致性界限以外,在一致性界限范圍內(nèi),Orion試劑與萬孚MAU試劑相比,差值的絕對值最大為13.7 mg/L,該樣本測試均值為216.9 mg/L,這種相差的幅度在臨床上可以接受,因此可以認(rèn)為兩種方法測量的結(jié)果具有較好的一致性。
3 討論
白蛋白的分子量為6.9 kD,帶負(fù)電荷,是腎小球?yàn)V過膜所能通過的最小蛋白質(zhì)分子之一,經(jīng)腎小球?yàn)V過的蛋白質(zhì)基本全部被近曲小管主動(dòng)回吸收,因此尿中只有微量白蛋白。當(dāng)腎小球基底膜病變,蛋白濾過量超過腎小管重吸收,則導(dǎo)致尿白蛋白增高,尿微量白蛋白是指尿中白蛋白含量為30-300 mg/24 h,或隨機(jī)尿樣本中白蛋白濃度為20-200 mg/L。尿微量白蛋白不僅是評估高血壓病和糖尿病腎功能損傷的早期敏感指標(biāo),而且已被證實(shí)是心血管疾病獨(dú)立的危險(xiǎn)因素[15,16],也是內(nèi)皮細(xì)胞功能受損的標(biāo)志,能夠預(yù)報(bào)大血管病變[17]。

圖5 MAU熒光免疫層析檢測試劑特異性

表3 MAU熒光免疫層析檢測試劑穩(wěn)定性

圖6 萬孚-MAU與Orion試劑相關(guān)性
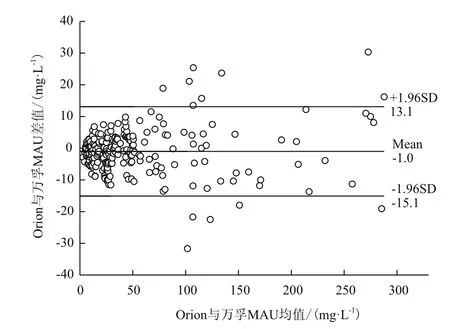
圖7 萬孚-MAU與Orion試劑相關(guān)性Bland-Altman一致性分析
Omidfar等[18]研制了一種膠體金免疫層析試紙條檢測尿液中微量白蛋白,試紙條靈敏度為20 mg/L,測試時(shí)間10 min。劉芳等[19]建立一種快速檢測尿中微量白蛋白的高效液相色譜法,單個(gè)標(biāo)本檢測速度約為6 min,該法在5-2 000 mg/L范圍內(nèi)線性較好,檢測限2 mg/L。Qin等[20]采用時(shí)間分辨熒光共振能量轉(zhuǎn)移分析法快速、定量檢測尿液中微量白蛋白,檢測時(shí)間12 min,檢測范圍10-320 mg/L,檢測限5.5 mg/L。Choi等[21]建立一種現(xiàn)場即時(shí)檢驗(yàn)?zāi)蛭⒘堪椎鞍椎臒晒饷庖叻治龇ǎ繖z測限4.65 mg/L,測試時(shí)間10 min。本研究所研制的尿微量白蛋白熒光免疫層析試劑檢測范圍為5-300 mg/L,檢測限2.3 mg/L,檢測時(shí)間3 min,相比其他方法檢測靈敏度高、測試時(shí)間短。
即時(shí)檢驗(yàn)(Point of care testing,POCT)是體外診斷行業(yè)的子行業(yè),是近幾年體外診斷行業(yè)重要的發(fā)展方向和增長最快的領(lǐng)域。本研究所建立的MAU熒光免疫層析定量檢測方法無需配備大型儀器設(shè)備,采用一步法加樣,操作簡單,靈敏度高,重復(fù)性、準(zhǔn)確度高,特異性及穩(wěn)定性較好。不足之處是由于尿液樣本個(gè)體差異大、分析結(jié)果易受化學(xué)成分的干擾,這可能造成個(gè)別樣本測試結(jié)果與臨床狀態(tài)不符,后期仍需增大臨床樣本測試數(shù)量,并針對特殊樣本進(jìn)行改進(jìn),以增強(qiáng)試劑的抗干擾能力。
4 結(jié)論
本研究所制備MAU熒光免疫層析檢測試劑的線性范圍為5-300 mg/L,檢測限為2.3 mg/L,線性范圍廣,分析靈敏度高;批內(nèi)和批間變異系數(shù)(CV)分別為6.4%-9.3%和6.5%-12.3%,平均回收率為102.3%,試劑重復(fù)性及準(zhǔn)確度高。試劑與尿液中20種干擾物質(zhì)無交叉反應(yīng),特異性較好;實(shí)時(shí)穩(wěn)定性試驗(yàn)表明試劑盒有效期>12月。臨床樣本測試,與Orion QuikRead U-ALB試劑相關(guān)性較好(r=0.993,P<0.01),Bland-Altman分析表明兩種方法的診斷結(jié)果具有較好的一致性。
[1]Quinlan GJ, Martin GS, Evans TW. Albumin:biochemical properties and therapeutic potential[J]. Hepatology, 2005, 41(6):1211-1219.
[2]Doumas BT, Peters T. Serum and urine albumin:a progress report on their measurement and clinical significance[J]. Clinica Chimica Acta, 1997, 258(1):3-20.
[3]陳燕, 趙敏. 尿微量白蛋白的檢測對糖尿病早期腎損害診斷中的臨床價(jià)值[J]. 中華醫(yī)學(xué)雜志, 2003, 26(6):562-564.
[4]Comper WD, Osicka TM. Detection of urinary albumin[J]. Advance in Chronic Kidney Disease, 2005, 12(2):170-176.
[5]Waugh J, Kilby M, Lambert P, et al. Validation of the DCA 2000 microalbumin:creatinine ratio urinanalyzer for its use in pregnancy and preeclampsia[J]. Hypertensi Pregnancy, 2003, 1:77-92.
[6]José SL, Daniel SH, Alejandro DLS, et al. Relationship between urinary albumin excretion and blood pressure in the community pharmacy:the Palmera study[J]. American Journal of Hypertension, 2013, 26(8):3-4.
[7]Mongensen CE, Hansen KW, Osterby R, et al. Blood pressure elevation versus abnormal albuminuria in the genesis and prediction of renal disease in diabetes[J]. Diabetes Care, 1992, 15(9):1192-1204.
[8]Jury DR, Speed JF, Dunn PJ. Urinary albumin radioinununoassay using a solid phase seeond antibody[J]. Clinica Chimica Acta, 1985, 148(1):63-67.
[9]鮑利民, 齊若梅, 高欣, 等. ELISA法檢測尿微量白蛋白的臨床應(yīng)用與評價(jià)[J]. 中國衛(wèi)生檢驗(yàn)雜志, 2006, 2:227-228.
[10]Zhao LX, Lin JM, Li ZJ. Comparison and development of two different solid phase chemiluminescence ELISA for the determination of albumin in urine[J]. Analytica Chimica Acta, 2005, 541(1-2):197-205.
[11]Marre M, C1audel JP, Ciret P, et al. Laser immunonephelometry for routine quantification of urinary albumin exeretion[J]. Clinical Chemistry, 1987, 33(2):209-213.
[12]盧仁泉, 宗英, 鄭佐婭. 尿微量白蛋白半定量金免疫層析試條的研制和臨床評價(jià)[J]. 檢驗(yàn)醫(yī)學(xué), 2007, 22(l):54-57.
[13]Ngom B, Guo Y, Wang X, et al. Development and application of lateral flow test strip technology for detection of infectious agents and chemical contaminants:a review[J]. Analytical and Bioanalytical Chemistry, 2010, 397(3):1113-1135.
[14]張賽. 熒光免疫層析法結(jié)合免疫磁珠分離技術(shù)在單增李斯特菌檢測中的應(yīng)用[D]. 廣州:華南理工大學(xué), 2014.
[15]Verdecchia P, Reboldi GP. Hypertension and microalbuminuria:the new detrimental duo[J]. Blood Press, 2004, 4:198-211.
[16]Wang TJ, Evans JC, Meigs JB, et al. Low-Grade albuminuria and the risks of hypertension and blood pressure progression[J]. Circulation, 2005, 111(11):1370-1376.
[17]Gschwend S, Pinto-Sietsma SJ, Buikema H, et al. Impaired coronary endothelial function in a rat model of spontaneous albuminuria[J]. Kidney International, 2002, 62(1):181-191.
[18]Omidfar K, Kia S, Larijani B. Development of a colloidal goldbased immunochromatographic test strip for screening of microalbuminuria[J]. Hybridoma, 2011, 30(2):117-124.
[19]劉芳, 向躍蕓, 徐克前. 一種快速檢測尿中微量白蛋白的高效液相色譜法[J]. 中南大學(xué)學(xué)報(bào), 2012, 37(10):1066-1070.
[20]Qin QP, Peltola O, Pettersson K. Time-Resolved fluorescence resonance energy transfer assay for point-of-care testing of urinary albumin[J]. Clinical Chemistry, 2003, 49(7):1105-1113.
[21]Choi S, Choi EY, Kim HS, et al. On-Site quantification of human urinary albumin by a fluorescence immunoassay[J]. Clinical Chemistry, 2004, 50(6):1052-1055.
(責(zé)任編輯 李楠)
Establishment and Performance Evaluation of a Quantitative Detection Method for Microalbuminuria Based on Fluorescence Immunochromatography
ZHANG Sai1HONG Yu-hao1LI Kai1HE Xiao-wei2LI Wen-mei1,2
(1. National & Local United Engineering Lab of Rapid Diagnostic Test,Wondfo Biotech Co.,Ltd.,Guangzhou 510663;2. College of Food Science and Engineering,South China University of Technology,Guangzhou 510640)
This work aims to develop a rapid quantitative detecting method of fluorescence immunochromatographic assay(FICA)for human urinary microalbuminuria(MAU). The fluorescence immunochromatographic strips were successfully prepared with anti-human albumin monoclonal antibody and goat anti-rabbit IgG marked by carboxyl fluorescent microspheres as the detection antibody,human albumin as the test line,and the rabbit IgG as the control line. As the results showed,the linear range of prepared kit(i.e.,fluorescence immunochromatographic strips)was in 5 mg/L-300 mg/L with a detection limit of 2.3 mg/L. The intra- and inter-assay coefficient of variation was 6.4%-9.3% and 6.5%-12.3%,respectively. The average recovery percent was 102.3%. The kit showed solid specificity as there was no cross-reactivity with 20 kinds of interfering substances. The shelf time of the kit by real-time stability test was > 12 months. Test with clinical urinary samples by the kit showed high correlation(r = 0.993,P < 0.01)with the control Orion QuikRead U-ALB kit,and Bland-Altman analysis showed that the diagnostic results of the two methods presented promising consistency. In conclusions,the prepared fluorescence immunochromatographic kit provides a simple,rapid and accurate quantitative detection method for microalbuminuria.
microalbuminuria;fluorescence immunochromatography;rapid detection
10.13560/j.cnki.biotech.bull.1985.2017.03.029
2016-09-09
國家科技支撐計(jì)劃資助項(xiàng)目(2012BAI19B05),廣州市科技計(jì)劃資助項(xiàng)目(201503020003)
張賽,男,碩士研究生,研究方向:免疫檢測技術(shù);E-mail:zhangsai0623@126.com
李凱,男,研究方向:免疫檢測技術(shù);E-mail:kaili@wondfo.com.cn

