miR-124靶向TNF-α促進豬皮下脂肪細胞分化
李虹儀 李家標 鄭藝林 吉盧琳 張茂 鄭恩琴
(1. 龍巖學院生命科學學院 動物營養科研創新團隊,龍巖 364012;2. 華南農業大學 廣東省農業動物基因組學與分子育種重點實驗室,廣州 510642)
miR-124靶向TNF-α促進豬皮下脂肪細胞分化
李虹儀1李家標1鄭藝林1吉盧琳1張茂1鄭恩琴2
(1. 龍巖學院生命科學學院 動物營養科研創新團隊,龍巖 364012;2. 華南農業大學 廣東省農業動物基因組學與分子育種重點實驗室,廣州 510642)
前期研究中采用雙螢光素酶報告基因驗證了miR-124與脂解因子豬TNF-α之間的靶關系,以此為基礎研究miR-124是否影響豬皮下脂肪細胞的分化。采用miR-124 模擬物mimics和抑制物inhibitor 分別轉染豬脂肪前體細胞并誘導其分化成成熟脂肪細胞,檢測細胞的聚脂情況,甘油及甘油三酯的含量變化,熒光定量檢測脂肪細胞關鍵轉錄因子PPARγ,脂肪合成和分解的主要酶FASN和HSL基因的表達變化。結果顯示,過表達miR-124 能抑制TNF-α蛋白的表達,脂肪細胞脂滴多于對照組,甘油三酯(TG)含量顯著增加(P<0.01),甘油含量亦顯著增加(P<0.05),PPARγ、FASNT和HSL的表達顯著上調(P<0.01);抑制細胞miR-124的表達脂滴則較少,TG含量顯著減少(P<0.05),PPARγ和FASN的表達均顯著下調(P<0.05)。miR-124可能通過抑制TNF-α調節豬脂肪細胞的分化,為后續研究miR-124調節脂肪代謝的相關機制奠定基礎。
miR-124;豬;脂肪分化;TNF-α
腫瘤壞死因子(Tumor necrosis factor-α,TNF-α)是一個多功能因子,由脂肪細胞產生并分泌,從多方面影響脂肪細胞的功能。TNF-α在脂肪組織中與多個基因相互聯系,起著抑制脂肪生成[1]、促進脂肪細胞脂解[2]等作用。miRNA(microRNA)是近年來逐漸被關注的調控分子,能通過靶mRNA的編碼區或3'非翻譯區互補結合實施轉錄后調控。研究表明miRNA調控哺乳動物至少60%的基因[3],參與了幾乎所有細胞的活動。越來越多的研究結果顯示,miRNA對脂肪細胞的分化增殖及脂肪的沉積起至關重要的作用。如miR-130和miR-27家族均通過減少靶基因PPARγ的生物合成抑制人脂肪細胞的分化[4,5];而miR-148則是通過靶向CREB基因非翻譯區,抑制其表達從而促進人脂肪細胞的分化[6]。
miR-124目前的研究大都與腫瘤相關,研究顯示miR-124可抑制髓母細胞瘤細胞[7]、胃癌細胞[8]、乳腺癌細胞[9]、前列腺癌細胞[10]等癌癥相關細胞的增殖。miR-124調控脂肪相關功能的研究較為少見,而豬作為沉積脂肪能力最強的動物之一,其與人類在生理生化方面有很多相似性,且存在著天然的脂肪型和瘦肉型品種,因此被認為是研究人類肥胖、糖尿病等脂肪代謝相關疾病最佳的模式動物。
在前期的研究中我們用雙螢光素酶系統檢測出miR-124與豬TNF-α有直接的靶關系,能顯著抑制豬TNF-α的表達[11]。因此,本實驗以豬皮下脂肪前體細胞為模型,研究miR-124對豬脂肪細胞分化的影響以及是否通過TNF-α起調節作用。
1 材料與方法
1.1 材料
細胞培養板培養瓶購自Corning公司;DMEM/F12培養基、胎牛血清、胰蛋白酶、I 型膠原酶、雙抗(青、鏈霉素)購自GIBCO公司;地塞米松(Dexmethasone)、重組牛胰島素(Insulin)、油酸(Oleic acid)和辛酸(Octanoic acid)購自SIGMA公司;油紅O(Oil Red O)、PMSF購自Amresco公司;轉染試劑Lipofectamine 2000、Trizol一步法總RNA提取試劑購自Invitrogen公司;96孔定量PCR板和定量PCR膜購自Axygen;miRNA mimics、inhibitor以及陰性對照(NC)由上海吉瑪公司合成;甘油三酯檢測試劑盒購自北京普利萊基因技術有限公司;RIPA細胞裂解液和BCA法總蛋白測定試劑盒購自北京百泰克生物技術有限公司。
1.2 方法
1.2.1 豬皮下脂肪前體細胞的分離培養 采用Zhou等[12]建立的分離培養方法,選取7日齡的長白仔豬,放血處死后用75%(V/V)酒精消毒,在無菌條件下分離背部皮下脂肪,眼科剪將脂肪組織剪碎后用0.1%的I型膠原酶于37℃水浴搖床消化1-2 h。消化液過篩后于800×g離心5 min,在沉淀細胞中加入10 mL紅細胞裂解液,室溫孵育10 min過篩,再用DMEM/F12洗滌細胞,800×g離心10 min后用含10%新生牛血清、100 000 U/L青霉素,100 mg/L的鏈霉素的DMEM/F12培養液重懸細胞,接種于75 cm2細胞培養瓶中,置于37℃、飽和濕度、5%CO2培養箱中培養。
1.2.2 細胞的轉染及誘導 生長良好的脂肪前體細胞消化后以1.5×105cells/cm2接種到6孔板中,細胞24 h內匯合90%時,將70 ng miR-124 mimics或inhibitor與LipofectamineTM2000進行孵育,按照說明書操作方法轉染細胞,并以NC作為陰性對照,每個處理設6個重復。轉染24 h后用含胰島素、地塞米松、油酸和辛酸(各50 nmol/L)的分化培養基進行對細胞誘導,連續誘導8 d。
1.2.3 油紅O染色 將誘導8 d的脂肪細胞用DMEM/F12洗兩次,加入200-250 μL 4%多聚甲醛固定液固定后加入油紅O工作液染色30 min;染完用清水沖洗去掉殘留的油紅O,滴加適量甘油封孔,置于倒置顯微鏡下觀察拍照。
1.2.4 甘油及甘油三酯檢測 細胞誘導過程中收集細胞培養基進行甘油檢測;誘導8 d后脂肪細胞用DMEM/F12洗兩次,加入100 μL細胞裂解液(含1 mmol/L PMSF的RIPA細胞裂解液),輕輕搖動培養板充分裂解細胞,將細胞裂解液轉移到500 μL離心管中,BCA(bicinchoninic acid)法測定每孔細胞總蛋白含量;甘油和甘油三酯測定分別根據試劑盒說明書進行檢測,檢測結果根據標準曲線計算待測樣品中甘油和甘油三酯的濃度,所得數據均用總蛋白數據進行校正。
1.2.5 Western blot 檢測 提取分化成熟脂肪細胞的總蛋白,用5%PAGE濃縮膠和10%SDS-聚丙烯酰胺凝膠分離膠對總蛋白進行電泳分離,分離完全后將膠上TNF-α蛋白和β-actin分別轉到PVDF膜上,1×TBS洗滌膜10 min后用5% 脫脂奶粉室溫封閉1 h。封閉后的PVDF膜加入2 mL適度稀釋的蛋白一抗,4℃冰箱旋轉孵育過夜。次日移出剩余的一抗,加入2 mL 1∶5 000稀釋的紅外二抗孵育1 h,蛋白顯像用Odyssey紅外成像儀(LI COR)掃描。
1.2.6 定量檢測 Trizol一步法抽取誘導后皮下脂肪細胞總RNA,OligodT18反轉錄成cDNA,并以此為模板進行各相關基因的熒光定量PCR檢測,所用引物如下:
PPARγ:S-CATTCGCATCTTTCAGGG,ATGGACGCCATACTTTAGGA;
FASN:S-ACCGAGTGGCTGGGTATT,A-CAAGAAGAGGTTGTTGTGGG;
HSL:S-GCCCGAGACGAGATTAG,ATGAAGGGATTCTTGACG。
檢測結果以β-actin作為內參照,根據以下公式計算出目的基因相對于內參基因的比值來反應各基因mRNA表達豐度:2-ΔCt=2-(Ct目的基因-Ct內參基因)。
1.2.7 數據統計 組間差異采用t檢驗進行分析,以P<0.05作為差異顯著性檢驗標準。所有數據分析均由SPSS19.0統計軟件完成。
2 結果
2.1 豬皮下脂肪前體細胞的誘導分化
豬皮下脂肪前體細胞鋪滿培養板底90%時將培養基更換為含有含胰島素、地塞米松、油酸和辛酸(各50 nmol/L)的分化培養基,隔天換液,連續誘導8 d。從顯微鏡下可以觀察到(圖1),誘導2 d后細胞開始出現黃色小脂滴,此后隨著誘導天數的增加,脂滴的數量逐漸增多,體積逐漸增大。第8天時可以清楚地觀察到細胞的形態以及脂滴在細胞中的分布,前期出現的脂滴在此時已變得飽滿明亮,周圍擠滿了后期分化的脂滴。

圖1 豬脂肪細胞分化模型
2.2 miR-124對豬脂肪細胞TNF-α表達的影響
前期研究工作中得出miR-124能通過種子序列抑制TNF-α的表達,為了進一步研究miR-124是否作用于豬脂肪細胞中TNF-α的表達,利用前體細胞的分化模型,以1.5×105cells/cm2的密度將前體細胞接種于6孔板中,待細胞鋪滿90%時,分別轉染miR-124 mimics以及陰性對照NC,轉染24 h后將培養基更換為分化培養基進行分化誘導,連續誘導8 d后收集細胞蛋白,Western blot 檢測結果(圖2)顯示,過表達miR-124會抑制豬脂肪細胞中TNF-α的表達。
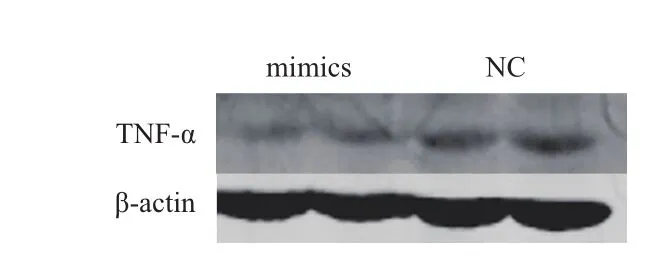
圖2 miR-124抑制TNF-α蛋白表達
2.3 miR-124對豬皮下脂肪前體細胞分化的影響
為了研究miR-124對豬皮下脂肪前體細胞的調節作用,待細胞鋪滿90%時,分別轉染miR-124 mimics、miR-124 inhibitors和NC,轉染24 h后進行分化誘導,連續誘導8 d,收集細胞檢測各處理細胞的總蛋白量及TG含量。校正結果(圖3-A)顯示,轉染miR-124 mimics的細胞TG含量比對照組顯著增加(P<0.01),轉染miR-124 inhibitor 的細胞對照組TG含量比對照組顯著降低(P<0.01)。油紅O對脂肪細胞染色結果與TG檢測結果一致。從圖3-B和3-C可以看出,過表達miR-124時細胞脂滴增多,抑制則呈現相反的結果。同時,又對細胞的甘油含量進行了檢測(圖3-C),發現表過達miR-124的細胞甘油含量也顯著增加(P<0.05)。
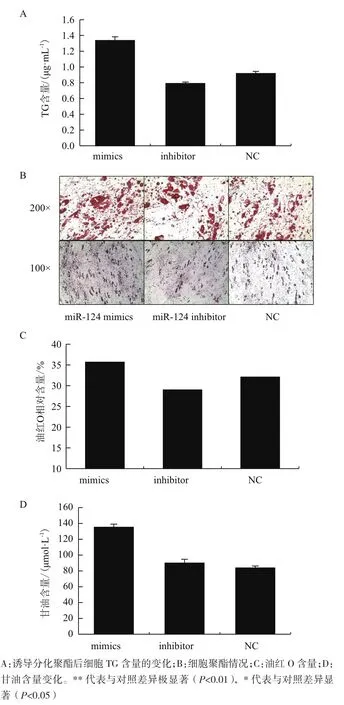
圖3 miR-124調控脂肪細胞的聚酯分化
2.4 miR-124對脂肪前體基因表達的調節
為了驗證miR-124是否通過TNF-α影響脂肪細胞的分化,收集誘導8 d的脂肪細胞進行RNA抽取并反轉錄為cDNA,熒光定量檢測與TNF-α相互調節且對脂肪細胞分化起重要作用的轉錄因子和酶的表達,結果(圖4)顯示,轉染miR-124 mimics的細胞PPARγ、FASN和HSL的表達均顯著上調(P<0.01),而抑制miR-124表達的細胞PPARγ和FASN的表達顯著下調(P<0.05),而HSL則同樣顯著下調(P<0.05)。
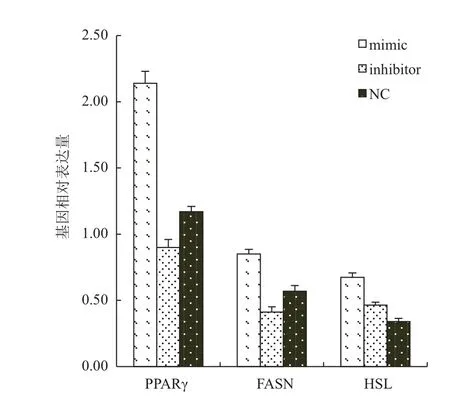
圖4 miR-124調控脂肪細胞代謝相關基因的表達
3 討論
本研究以豬皮下脂肪前體細胞為模型進行誘導分化,分化過程中可見細胞內的脂滴隨著分化天數的增加不斷變多、變大,且能被油紅O所染色,說明豬皮下脂肪細胞培養成功,保證后續實驗的開展。在前期實驗中發現miR-124能抑制豬TNF-α的表達,而TNF-α在脂肪細胞中能夠通過NIK-TAK1/TAB1軸激活NFκB對PPARγ進行抑制[13],從而起到一定的脂解作用。本研究中細胞過表達miR-124后表現為TNF-α蛋白含量減少,脂滴增多,甘油三酯含量顯著增加,可能為細胞分化過程中miR-124通過抑制TNF-α的表達減緩對PPARγ的抑制,使細胞表現為促進脂肪合成。定量檢測中顯示PPARγ和FASN的表達顯著上升,其中PPARγ是脂肪前體細胞分化中后期兩個最重要的轉錄調控因子之一,而FASN在脂肪酸合成中起著至關重要的作用,影響著動物脂肪的沉積。定量的結果正好印證了上述推測觀點。
過多的的脂肪將通過脂肪動員,在HSL的刺激下分解成甘油和游離的脂肪酸,但是,細胞上清甘油的含量和細胞HSL的表達并不如預測中般下降,而是上升。有研究也顯示,TNF-α能夠抑制HSL mRNA表達[14],因此,本研究中過表達miR-124提高HSL基因表達可能是通過抑制TNF-α的表達來完成的,且對應地表現為細胞甘油含量顯著增加。豬脂肪細胞的合成與分解途徑是相互協調的[15],因此推測實驗中過表達miR-124使脂肪細胞合成代謝加快,TG含量顯著增加,但細胞為了維持代謝平衡,提高內部分解代謝酶的表達,一定程度上促進了脂肪的分解,因此甘油含量比對照組高。即過表達miR-124同時促進了脂肪的合成代謝與分解代謝,合成代謝速度比分解代謝快使細胞表現為脂滴增多。
另外,實驗還研究了抑制miR-124的表達細胞TNF-α蛋白水平和脂滴的變化,TG和甘油含量變化以及相關基因的表達變化,結果顯示,細胞的聚酯情況,TG含量,PPARγ和FASN的表達均表現為與miR-124 mimics相反的作用,但TNF-α的蛋白水平及甘油含量均沒顯著變化,而HSL表達雖然不及mimics般顯著但同樣表現為上升,這可能為多個小RNA同時作用于相同靶基因,抑制之后其他小RNA會有一定的補償效應。
4 結論
miR-124能通過調節TNF-α的表達調控脂肪細胞的分化,過表達miR-124將促進細胞的聚酯,提高TG的含量,提高相關基因的表達,而抑制miR-124的表達則結果相反。
[1]MacDougald OA, Mandrup S. Adipogenesis:forces that tip the scales[J]. Trends Endocrinol Metab, 2002, 13(1):5-11.
[2]Langin D, Arner P. Importance of TNFalpha and neutral lipases in human adipose tissue lipolysis[J]. Trends Endocrinol Metab, 2006, 17(8):314-320.
[3]Friedman RC, Farh KK, Burge CB, et al. Most mammalian mRNAs are conserved targets of microRNAs[J]. Genome Res, 2009, 19(1):92-105.
[4]Lee EK, Lee MJ, Abdelmohsen K, et al. MiR-130 suppresses adipogenesis by inhibiting peroxisome proliferator-activated receptor gamma expression[J]. Mol Cell Biol, 2010, 31(4):626-638.
[5] Karbiener M, Fischer C, Nowitsch S, et al. MicroRNA miR-27b impairs human adipocyte differentiation and targets PPARgamma[J]. Biochem Biophys Res Commun, 2009, 390(2):247-251.
[6] Shi C, Zhang M, Tong M, et al. MiR-148a is associated with obesity and modulates adipocyte differentiation of mesenchymal stem cells through Wnt signaling[J]. Sci Rep, 2015, 5:9930.
[7]Silber J, Hashizume R, Felix T, et al. Expression of miR-124 inhibits growth of medulloblastoma cells[J]. Neuro Oncol, 2013, 15(1):83-90.
[8]Xie L, Zhang Z, Tan Z, He R, et al. MicroRNA-124 inhibits proliferation and induces apoptosis by directly repressing EZH2 in gastric cancer[J]. Mol Cell Biochem, 2014, 392(1-2):153-159.
[9]Li W, Zang W, Liu P, Wang Y, et al. MicroRNA-124 inhibits cellular proliferation and invasion by targeting Ets-1 in breast cancer[J]. Tumour Biol, 2014, 35(11):10897-10904.
[10] Shi XB, Xue L, Ma AH, et al. Tumor suppressive miR-124 targets androgen receptor and inhibits proliferation of prostate cancer cells[J]. Oncogene, 2013, 32(35):4130-4138.
[11]. 李虹儀, 習欠云, 張永亮. 調節豬TNF-α表達的miRNAs鑒定[J]. 中國生物工程雜志, 2014, 34(10):35-40.
[12]Zhou GX, Wang SB, Wang ZG, et al. Global comparison of gene expression profiles between intramuscular and subcutaneous adipocytes of neonatal landrace pig using microarray[J]. Meat Science, 86(2010):440-450.
[13]Kralisch S, Klein J, Lossner U, et al. Isoproterenol, TNFalpha, and insulin downregulate adipose triglyceride lipase in 3T3-L1 adipocytes[J]. Mol Cell Endocrinol, 2005, 240(1-2):43-49.
[14]Cawthorn W, Sethi J. TNF-α and adipocyte biology[J]. Febs Letters, 2008, 582(1):117-131.
[15]Gardan D, Gondret F, Louveau I. Lipid metabolism and secretory function of porcine intramuscular adipocytes compared with subcutaneous and perirenal adipocytes[J]. Am J Physiol Endocrinol Metab, 2006, 291(2):E372-380.
(責任編輯 李楠)
miR-124 Regulates Porcine Adipocyte Differentiation Trough Targeting TNF-α
LI Hong-yi1LI Jia-biao1ZHENG Yi-lin1JI Lu-lin1ZHANG Mao1ZHENG En-qin2
(1.Animal Nutrition Scientific Research Innovation Team,College of Life Science,Longyan University,Longyan 364012;2.Guangdong Provincial Key Lab of Agro-animal Genomics and Molecular Breeding, South China Agricultural University, Guangzhou 510642)
In the previous research,porcine TNF-α was found to be the target of miR-124 by dual luciferase assay. Here we verify whether miR-124 has the effect on the differentiation of porcine adipocyte. Porcine pre-adipocyte was transfected with miR-124 mimics or inhibitor to over-express or to repress miR-124,and then induced into mature adipocytes. The accumulation of lipid droplets was observed using Oil Red O staining and the amount of glycerol and triglycerides(TG)were detected by TG assay and glycerol assay. The expressions of PPARγ(proliferator-activated receptor-γ),FASN(fatty acid synthase),and HSL(hormone-sensitive lipase)were detected by real time fluorescence quantitative PCR. The result showed that overexpression of miR-124 repressed the expression of TNF-α protein,therefore,lipid droplets were more than that in the control,TG increased significantly(P < 0.01),also the same for glycerol(P < 0.05),and the expressions of PPARγ,FASNT,and HSL significantly up-regulated(P < 0.01). Repressing miR-124 resulted in the reduction of lipid droplets and the significant decrease of TG,and the expressions of PPARγ and FASNT significantly down-regulated(P < 0.05). In conclusion,miR-124 might regulate the differentiation of porcine adipocyte by suppressing TNF-α,laying a foundation for future studies on the mechanism of miR-124 regulating lipid metabolism.
miR-124;porcine;adipocyte differentiation;TNF-α
10.13560/j.cnki.biotech.bull.1985.2017.03.025
2016-08-02
福建省大學生創新創業訓練計劃項目(201511312055),福建省自然科學基金項目(2014J05043),龍巖學院博士啟動基金項目(LB2013012)
李虹儀,女,講師,研究方向:動物營養生理與生物化學;E-mail:politician_137@163.com
張茂,男,講師,研究方向:動物遺傳;E-mail:zm18email@163.com

