絨氈層發育和激素對擬南芥育性的影響
張艷++何勇++李建雄++田志宏
摘 要:自然界中植物雄性不育是普遍存在的現象,擬南芥植株中雄性不育更是尤為常見。花藥作為雄蕊的重要組成部分,其發育對植物的育性至關重要,絨氈層發育的異常會影響到花粉發育,而植物激素合成異常也會降低其育性。除此之外,環境因素對植物的生育力也有一定的影響。
關鍵詞:雄性不育;花粉發育;絨氈層;植物激素
中圖分類號 Q943.2 文獻標識碼 A 文章編號 1007-7731(2017)06-0034-05
Effects of Tapetal Development and Hormones on Fertility of Arabidopsis thaliana
Zhang Yan1,2 et al.
(1College of Life Science,Yangtze University,Jingzhou 434025,China;2 South China Botanical Garden,Chinese Academy of Sciences,Guangzhou 510650,China)
Abstract:Plant male sterility is a common phenomenon in nature,male sterility is especially common in Arabidopsis thaliana plants.As an important constituent part of stamen,anther plays an important role in the development of plant,abnormal development of tapetum will affect pollen development,phytohormones synthesis abnormalities will also reduce fertility.In addition,the environmental factors on plant fertility also have a certain impact.
Key words:Male sterility;Pollen development;Tapetum;Phytohormones
開花植物的雄性生殖過程發生在雄蕊中,雄蕊由2個形態不同的部分組成——花藥和花絲。花絲是一種維管組織的管道,它具有支持功能,將雄蕊錨定在花上,并作為輸導水和營養物質的管道。相比之下,花藥負責產生和釋放花粉粒,使得授粉和受精過程在花中得以發生,花藥可能產生具有生殖能力和沒有生殖能力的花粉[1]。雄性不育現象是指產生的花粉不具有正常的生活力,雄蕊的畸形,缺失,小孢子異常,花藥不能正常開裂,不形成花粉或是花粉沒有生活力等都會出現不育現象。從花藥原基分化到形成成熟的花粉粒,花藥絨氈層發育,花粉母細胞減數分裂等都是形成可育花粉的關鍵[2]。影響植物花藥發育的因素有很多,例如,茉莉酸甲酯(MeJA)能誘導水稻穎花開放[3]。玉米mscal突變體孢原細胞沒有分裂成初生造孢細胞和初生周緣細胞,出現雄性不育[4]。MAC1(MAIZE MULTIPLE ARCHESPORIAL CELLS 1)基因在花藥發育的早期能夠調控細胞分化,該基因突變會產生過多的孢原細胞,使得花藥發育出現異常現象[5]。擬南芥ems1227突變體營養生長正常,但是生殖生長發育則出現異常,大多數的花藥中沒有花粉,只有極少數的花藥中有少量的正常花粉[6]。花藥能夠正常發育是雄蕊正常授粉的關鍵因素,因而研究花藥正常發育過程和調控該過程的信號傳導途徑,對提高植物的育性有重大作用。
1 擬南芥的花藥發育過程
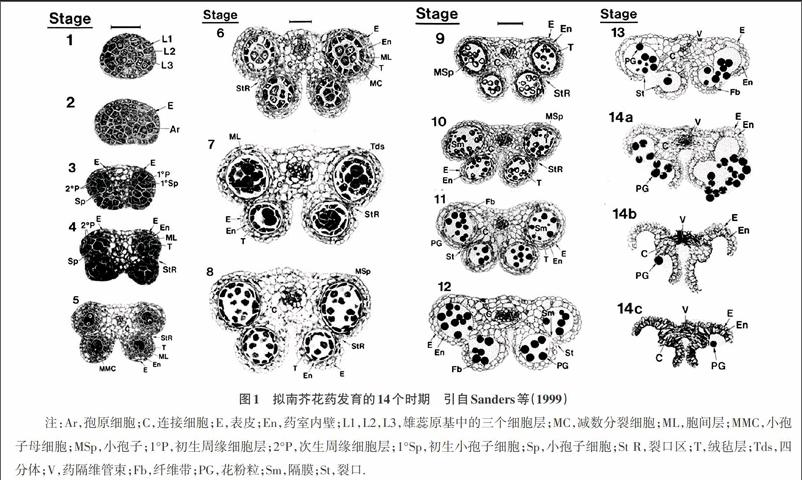
目前已經有很多關于花藥和花粉發育過程的研究[7-11]。通過制作野生型擬南芥花藥切片來詳述發生在細胞水平的從雄蕊原基發生到花藥開裂和衰老的變化過程。Sanders等(1999)將擬南芥花藥發育分為14個時期[12](圖1)。第1期到第8期代表了花藥發育的第一階段,而第9期到第14期則代表了花藥發育的第二階段。在第1期到第4期,發育中的花藥原基發生細胞分裂以建立具有成熟花藥特征的雙側結構小室、花藥壁、連接細胞和維管組織。4個角隔花藥原基內的孢原細胞平周分裂形成不同的初級壁細胞和造孢細胞,最終會分化成內壁細胞、中間層、絨氈層和小孢子母細胞。在第5期到第7期,小孢子母細胞經過減數分裂形成四分體單倍體小孢子。在第8期小孢子被從四分體中釋放并在第9期到第12期分化成三細胞花粉粒。與花粉發育相協調的是花藥的增大、幾個細胞層的退化和花藥開裂時花粉粒釋放前花藥細胞特化的可視變化。包括內層細胞膨大,藥室內壁增厚和連接層細胞中纖維帶沉積,絨氈層和中間層消失。最后,在第11期到第12期隔膜退化形成2藥室,緊接著的13期,裂口區細胞破裂,花藥衰老花粉從小室中被釋放出來脫落到植物的柱頭上。除了要產生具有生活力的花粉外,花藥也必須在適當的時間開裂以在雌性器官雌蕊接受花粉時釋放出成熟花粉粒,并且花絲必須達到適合的高度以將釋放的花粉粒傳送到雌蕊柱頭上。
圖1 擬南芥花藥發育的14個時期 引自Sanders等(1999)
注:Ar,孢原細胞;C,連接細胞;E,表皮;En,藥室內壁;L1,L2,L3,雄蕊原基中的三個細胞層;MC,減數分裂細胞;ML,胞間層;MMC,小孢子母細胞;MSp,小孢子;1°P,初生周緣細胞層;2°P,次生周緣細胞層;1°Sp,初生小孢子細胞;Sp,小孢子細胞;St R,裂口區;T,絨氈層;Tds,四分體;V,藥隔維管束;Fb,纖維帶;PG,花粉粒;Sm,隔膜;St,裂口.
總的來說,花藥發育一般可分為2個階段,在階段1期間,花藥形態形成,細胞和組織分化發生,小孢子母細胞進行減數分裂。在階段1結束時,花藥包含大部分其特化的細胞和組織,四分體小孢子存在于花粉囊中。在階段2期間,花粉粒分化,花藥增大,并且在花中由花絲向上推動延伸,組織退化、花藥開裂和花粉粒釋放。然而,調控花藥細胞分化,建立花藥組織模式和導致花藥從組織特異性(階段1)轉換到細胞退化和花藥開裂(階段2)的細胞學過程目前還不清楚[13]。
2 絨氈層發育對花藥的影響
絨氈層(tapetum)在種子植物中存在于幼花藥的內側,為富于原生質的組織,在減數分裂后退化、解體。形成絨氈層的絨氈細胞(tapetum cell)來源于側壁細胞,在其內側有孢原細胞群,當減數分裂開始時絨氈細胞也開始分裂,所以很容易被誤認為與孢原細胞相同。雖然絨氈細胞的分裂是有絲分裂,但也有很多異常分裂。在花粉囊中絨氈層是直接與花粉母細胞相鄰的一層細胞,主要為花粉發育提供營養,也分泌形成花粉壁所需的物質及各種酶[14-16]。在小孢子母細胞開始減數分裂后,絨氈層細胞就開始進行有絲分裂,形成雙核或多核極性分泌細胞[17]。小孢子母細胞減數分裂完成后包裹四分體的胼胝質層被絨氈層合成分泌的胼胝質酶復合體降解,釋放出小孢子[18-19]。然而,胼胝質層能使花藥中的四分體與孢子體細胞層分隔開,也使得四分體之間分開,避免細胞間因為接觸而融合在一起,防止小孢子發育提前[20-21]。
在目前已報道的研究中,很多的擬南芥突變體植株出現結實異常的情況。擬南芥甘油-3-磷酸乙酰轉移酶6(GPAT6)基因敲除突變體的育性相較于野生型有嚴重下降,同時突變體的花藥絨氈層內的內質網含量有明顯地減少并且絨氈層的發育異常。絨氈層的異常也進一步造成了花藥衰亡和花粉壁發育的缺陷。除此之外,GPAT6也同樣影響花粉內物質的積累并可能影響到花粉的萌發以及花粉管的伸長[22]。ems1227突變體植株的絨氈層細胞出現肥大且空泡化,絨氈層平周分裂出現2層細胞,降解延遲的異常現象,而且絨氈層和中間層不分離。胼胝質層不能正常降解,小孢子不能從四分體中正常釋放出來[6]。
MYB家族是一種參與基因轉錄水平調控的重要轉錄因子,在許多植物生長發育、逆境反應、信號轉導、抗病性等一系列基因表達中起到重要的調控作用。在myb33和myb65雙突變體花藥中,絨氈層在花粉母細胞階段過度增大,導致在減數分裂前花粉發育敗育,而且單個基因的突變體并不表現出表型,表明MYB33和MYB65具有功能冗余,相比較于野生型,myb33和myb65雙突變體的雄蕊通常比較短,未能完全延伸到雌蕊柱頭,除此之外,myb33和myb65雙突變體的花藥比野生型的更小,不能產生花粉,表明這種突變體是雄性不育的。myb33和myb65雙突變體和野生型之間的正反交證明myb33和myb65雙突變體植株的雌蕊部分是完全可育的,這進一步確認了myb33和myb65雙突變體的雄性不育表型,myb33和myb65雙突變體中花粉發育減數分裂前異常是因絨氈層過度增長所造成的[23]。AtMYB103突變后會使得絨氈層過早的解體和小孢子畸形、退化等異常現象,從而導致雄性不育[24-25]。TDF1(TAPETAL DEVELOPMENT AND FUNCTION 1)編碼的R2R3 MYB轉錄因子參與絨氈層細胞和花粉母細胞中的轉錄調控。在tdf1突變體中,由于絨氈層發育畸形,胼胝質未降解釋放小孢子,引起雄配子敗育[26]。該基因還與其上游的AtMYB103、MYC型轉錄因子AMS[27]、下游的DYT1協同參與調控絨氈層的發育。絨氈層是介導配子體和孢子體之間一種很重要的組織。
UDT1(UNDEVELOPED TAPETUM 1)突變體的絨氈層細胞在減數分裂時期高度液泡化,花粉母細胞不分裂成小孢子造成雄性不育[28]。TDR1(TAPETUM DEGENERATION RETARDATION 1)與絨氈層的降解有關,該基因發生突變會造成絨氈層和中間層解體延遲,出現小孢子敗育,引起雄性不育[29]。
bHLH(堿性/螺旋-環-螺旋)轉錄因子家族在生物體內起著重要的調控作用,調控植物各個組織的生長發育過程。bHLH142參與調控花藥絨氈層程序性細胞死亡,其突變體出現絨氈層解體延遲現象,花粉母細胞不進行減數分裂,表現出完全的雄性不育[30]。EXS編碼一種富含亮氨酸重復序列的受體激酶,參與調控花藥原基L2層細胞平周分裂的數量和位置,并在花序分生組織,花序頂端,花藥和發育中的種子里表達[31]。在花藥中,增加的L2層細胞形成孢原細胞并分裂形成更多的孢子細胞。Exs(extra sporogenous cell)雄性不育突變體孢原細胞產生異常的造孢細胞,次生周緣細胞受到造孢細胞團和藥室內壁的擠壓或是解體無法形成絨氈層細胞,使得其形成缺少絨氈層和胞間層的性母細胞。
胞外多肽激素基因CHAL/CLL1/CLL2對擬南芥雄蕊發育有著非常重要的作用[32]。chal/cll1/cll2三突變體有明顯的植株育性異常的表型,表現出雄蕊異常表型:相較于野生型,其花絲短小,花藥絨氈層發育出現異常和部分花粉出現敗育,而且花粉的萌發率也顯著降低。CHAL和CLL2在花發育的整個過程中(包括花藥發育和花絲伸長)都發揮作用;而CLL1可能只在花早期發育中發揮作用。這3個基因CHAL/CLL1/CLL2在花藥絨氈層和花粉母細胞中特異表達。chal/cll1/cll2植株第5期花藥出現絨氈層細胞數目多,排列松散,形狀不規則,局部形成2層,而且這種異常一直到絨氈層降解完全。野生型花藥發育的第12期時絨氈層細胞已全部完全降解了,而同一時期的chal/cll1/cll2卻存在完整的絨氈層。這些都說明CHAL/CLL1/CLL2不僅在調控絨氈層數目及排列規則上有重要功能,而且在絨氈層的降解過程中也發揮作用。除此之外,CHAL/CLL1/CLL2在花粉萌發過程中也發揮重要功能,且功能冗余。在花藥發育過程中,花藥不同細胞層之間的信號交流和相互協調對于花藥結構的正確形成和功能至關重要。而細胞-細胞間的信號交流需要借助胞外多肽和受體激酶所介導的信號傳導途徑。CHAL/CLL1/CLL2可能在雄蕊發育的過程中作為配基-受體復合物來發揮重要功能的。Hord等(2008)報道了ER/ERL1/ERL2基因在花藥發育過程中,通過影響花藥藥室的數目和組成藥室的五層細胞的發育來影響植株的育性[33],ER/ERL1/ERL2在正常的花藥形成和花藥細胞分裂和分化中發揮重要作用。
3 植物激素對育性的影響
植物激素普遍存在于植物組織中,參與調控植物生長發育。例如,生長素可以促進植物維管束發育,花藥中IAA含量不足會引起花藥代謝和小孢子生長發育異常,導致花粉敗育,表現出雄性不育表型[34]。水稻[35]、小麥[36]的可育系花藥中IAA的含量遠高于不育系。赤霉素合成途徑中的關鍵酶內根貝殼杉烯合成酶A發生基因突變后,赤霉素不能正常合成,也會表現出雄性不育[37]。在小麥花粉敗育的轉折時期,不育系花藥中的赤霉素含量降低與后面出現的花粉敗育有關[36]。在玉米雄性不育系小孢子敗育前花藥組織乙烯釋放量顯著高于可育系的,而施加乙烯生物合成抑制劑對T型雄性不育系育性恢復幾乎無效應,但可以使部分小孢子繼續發育1~3個階段。S型雄性不育系可以產生少量可育花粉,說明施加乙烯生物合成抑制劑可以抑制不育系花藥組織過量合成乙烯,使不育性發生逆轉[38]。
由13-LOX途徑產生的茉莉酸類物質和脂肪酸衍生物質參與調控生育和花發育過程。在擬南芥中,與野生型相比較,LOX3和LOX4缺乏導致發育功能障礙,lox3和lox4雙突變體比野生型植株更高,而且會生長出更多的花序芽和花。進一步的分析顯示,在lox3和lox4雙突變體中花序發育停滯的發生與異常的心皮化的花產生有關,與野生型的花相比較,lox3和lox4雙突變體的花出現花絲變短,柱頭乳頭狀突起更長,花藥不開裂等異常現象。而施加外源的茉莉酸(JA)可以恢復突變體的育性,因此,在lox3和lox4雙突變體花中JA的合成受阻,導致了其雄性不育[39]。茉莉酸合成異常或是茉莉酸信號轉導途徑發生異常的擬南芥都會出現雄性不育現象。myb26突變體也表現出花藥不開裂導致其雄性不育,然而施加外源的茉莉酸或是茉莉酸類物質并不能恢復其育性,說明myb26突變體不育的原因并不是由于茉莉酸合成途徑受阻[40]。aos突變體由于花藥和花粉發育受阻表現出嚴重的雄性不育現象,而施加外源的茉莉酸甲酯能夠完全恢復雄性不育表型,表明AOS基因對茉莉酸酯的生物合成是關鍵的[41]。
茉莉酸已經被證實可以誘導與防御相關的基因,這些基因有可能在花粉發育或雄性育性的其它方面發揮作用,如茉莉酸被發現可以調節由另一種植物信號分子水楊酸誘導的程序性細胞死亡[42],茉莉酸促進由伏馬菌毒素B1(mycotoxin fumonisin B1)誘導的細胞死亡[43]。因為花藥開裂需要在2個花藥組織,隔膜和裂口處的程序性細胞死亡[23,44],茉莉酸可能還調節花藥中的程序性細胞死亡。Sanders等觀察到在dde1突變體中隔膜和裂口處細胞正常分化,程序性細胞死亡過程看起來也似乎正常,但是卻延遲了。當花已經開始衰老而且雌蕊的柱頭對花粉粒不具親和力的時候花藥才開裂。所以,除了需要正常發育的花粉外,花絲伸長到適合的位置花藥開裂將花粉釋放到有親和力的雌蕊柱頭對植物的育性也至關重要[45]。opr3突變體植株就表現出花藥開裂延遲現象,然而在開裂的花藥內檢測不到OPR3基因的表達[9],這表明在花藥開裂前茉莉酸已經發揮作用,所以茉莉酸對花藥中的細胞死亡不是必需的,但似乎可以調節細胞死亡的時間[44],而表達OPR3基因可以恢復opr3突變體的育性。
4 環境因素對育性的影響
事實上雙突變體可以零星地結實,而且其結實的程度有很大的變化范圍,這一事實表明環境因素也可能影響植物的生育能力。光照強度,光照時間和溫度都可以影響植物的生育力[28]。番茄sl2溫度敏感型的雄性不育突變體在低溫下雄蕊和花粉能正常發育,而高溫下sl2雄蕊中的IAA和ABA含量遠高于正常植株水平,高溫會完全抑制小孢子的發生[46-47]。光敏核不育水稻農墾58S在適宜溫度下長日照不育、短日照誘導可育[48]。myb33和myb65雙突變體及myb26突變體植株的不育現象,在更強的光照或是更低的溫度條件下其育性會有所恢復[23,40]。這表明除了遺傳的原因,環境因素(光照強度、溫度等)對擬南芥的育性也有很大的影響。
5 結語
在擬南芥中已經鑒定出很多與花藥發育相關的基因,它們對花藥的形成和花粉育性具有重要的作用。有些功能互為冗余的基因,其單個基因發生突變可能對植株的生育力并沒有太大影響,但它們的雙突變一般都會影響到其它基因的表達,最終影響到花藥的發育和花粉育性。而激素也對植物的生長發育有調控作用,影響植物的育性,除了要在分子水平深入研究影響育性相關的基因及其調控機理,也要給植株提供適宜的生長環境,合適的光照、溫度更利于植物傳種和提高產量。
參考文獻
[1]Zhao D Z,Ma H.Male fertility:A case of enzyme identity[J].Current Biology,2000,10:904-907.
[2]劉偉華,邱博,羅紅兵.花藥絨氈層發育和花粉母細胞減數分裂相關基因研究進展[J].作物研究,2015,29(3):311-317.
[3]曾曉春,周燮.茉莉酸甲酯(MeJA)誘導水稻穎花開放[J].植物學報,1999, 41(5):560-562.
[4]Chaubal R,Anderson J R,Trimnell M R,et al.The transformation of anthers in the msca1 mutant of maize[J].Planta,2003,216:778-788.
[5]Wang C R,Nan G L,Kelliher T,et al.Maize multiple archesporial cells 1 (macl),an ortholog of rice TDL1A,modulates cell proliferation and identity in early anther development[J].Development,2012,139:2594-2603.
[6] 成志鵬.擬南芥心皮發育基因MS1522的功能分析及雄性不育突變體ems1227的基因定位[D].上海:上海師范大學,2012.
[7]McConn M,Browse J.The critical requirement for linolenic acid is pollen development,not photosynthesis,in an Arabidopsis mutant[J].The Plant Cell,1996,8:403-416.
[8]Ishiguro S,Kawai-Oda A,Ueda J,et al.The defective in anther dehiscence1 gene encodes a novel phospholipase A1 catalyzing the initial step of jasmonic acid bio- synthesis,which synchronizes pollen maturation,anther dehiscence,and flower opening in Arabidopsis[J].The Plant Cell,2001,13:2191-2209.
[9]Stintzi A,Browse J.The Arabidopsis male-sterile mutant,opr3,lacks the 12- oxophytodienoic acid reductase required for jasmonate synthesis[J].Proc.Natl.Acad.Sci.USA,2000,97(19):10625-10630.
[10]Yang M,Hu Y,Lodhi M,et al.The Arabidopsis SKP1-LIKE1 gene is essential for male meiosis and may control homologue separation[J].Proc.Natl.Acad.Sci.USA,1999,96:11416-11421.
[11]Schiefthaler U,Balasubramanian S,Sieber P,et al.Molecular analysis of NOZZLE,a gene involved in pattern formation and early sporogenesis during sex organ development in Arabidopsis thaliana[J].Proc.Natl.Acad.Sci.USA,1999,96:11664-11669.
[12]Sanders P M,Bui A Q,Weterings K,et al.Anther developmental defects in Arabidopsis thaliana male-sterile mutants[J].Sexual Plant Reproduction,1999,11:297-322.
[13]Goldberg R B,Beals T P,Sanders P M.Anther development:Basic principles and practical applications[J].The Plant Cell,1993,5:1217-1229.
[14]Pacini E,Franchi G G,Hesse M.The tapetum:Its form,function and possible phylogeny in embryophyta[J].Plant Systematics and Evolution,1985,149:155-185.
[15]Hsieh K,Huang A H C.Tapetosomes in Brassica tapetum accumulate endoplasmic reticulum-derived flavonoids and alkanes for delivery to the pollen surface[J].The Plant Cell,2007,19:582-596.
[16]Mascarenhas J P.Molecular mechanisms of pollen tube growth and differen-tiation[J].The Plant Cell,1993,5:1303-1314.
[17]Bedinger P.The remarkable biology of pollen[J].The Plant Cell,1992,4:879-887.
[18]Stieglitz H.Role of β-1,3-glucanase in postmeiotic microspore release[J].Deve- lopmental Biology,1977,57(1):87-97.
[19]Piffanelli P,Ross J H E,Murphy D J.Biogenesis and function of the lipidic structures of pollen grains[J].Sexual Plant Reproduction,1998,11:65-80.
[20]Waterkeyn L,Bienfait A.On a possible function of the callosic special wall in Ipomoea purpuea (L) roth[J].Grana,1970,10:13-20.
[21] Harrison J H,Machenzie A.Autoradiography of soluble (2-14C) thymidine deriveatives during meiosis and microsporogenesis in Lilium anthers[J].Journal of Cell Science,1967,2:387-400.
[22]Li X C,Zhu J,Yang J,et al.Glycerol-3-phosphate acyltransferase 6 (GPAT6) is important for tapetum development in Arabidopsis and plays multiple roles in plant fertility[J].Molecular Plant,2012,5(1):131-142.
[23]Millar A A,Gubler F.The Arabidopsis GAMYB-like genes,MYB33 and MYB65,are microRNA-regulated genes that redundantly facilitate anther develop- pment[J].The Plant Cell,2005,17:705-721.
[24]Zhang Z B,Zhu J,Gao J F,et al.Transcription factor AtMYB103 is required for anther development by regulating tapetum development,callose dissolution and exine formation in Arabidopsis[J].The Plant Journal,2007,52:528-538.
[25]Higginson T,Li S F,Parish R W.AtMYB103 regulates tapetum and trichome development in Arabidopsis thaliana[J].The Plant Journal,2003,35:177-192.
[26]Zhu J,Chen H,Li H,et al.Defective in tapetal development and function 1 is essential for anther development and tapetal function for microspore maturation in Arabidopsis[J].The Plant Journal,2008,55:266-277.
[27]Sorensen A M,Kr?ber S,Unte U S,et al.The Arabidopsis ABORTED MICROSPORES (AMS) gene encodes a MYC class transcription factor[J].The Plant Journal,2003,33:413-423.
[28]Jung K H,Han M J,Lee Y S,et al.Rice undeveloped tapetum1 is a major regulator of early tapetum development[J].The Plant Cell,2005,17:2705-2722.
[29] Li N,Zhang D S,Liu H S,et al.The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development[J].The Plant Cell,2006,18:2999-3014.
[30] Ko S S,Li M J,Sun B K M,et al.The bHLH142 transcription factor coordinates with TDR1 to modulate the expression of EAT1 and regulate pollen development in rice[J].The Plant Cell,2014,26:2486-2504.
[31]Canales C,Bhatt A M,Scott R,et al.EXS,a putative LRR receptor kinase,regulates male germline cell number and tapetal identity and peomotes seed development in Arabidopsis[J].Current Biology,2002,12:1718-1727.
[32]何卓娜,王雙雙,馬紅,等.胞外多肽激素基因CHAL/CLL1/CLL2在擬南芥雄蕊發育過程中發揮重要作用[J].植物生理學報,2016,52(2):167-176.
[33]Hord C L H,Sun Y J,Pillitteri L J,et al.Regulation of Arabidopsis early anther development by the mitogen- activated protein kinases,MPK3 and MPK6,and the ERECTA and related receptor- like kinases[J].Molecular Plant,2008,1(4):645-658.
[34]黃厚哲,樓仕林,王侯聰,等.植物生長素虧缺與雄性不育的發生[J].廈門大學學報自然科學版,1984,23(1):82-97.
[35]黃少白,周燮.水稻細胞質雄性不育與內源GA1+4和IAA的關系[J].華北農學報,1994,9(3):16-20.
[36]李英賢,張愛民,黃鐵城.小麥細胞質雄性不育與花藥組織內源激素的關系[J].農業生物技術學報,1996,4(4):307-313.
[37]Sun T P,Kaimaya Y.The Arabidopsis GA1 locus encodes the cyclase ent-kaurene synthetase A of gibberellin biosynthesis[J].The Plant Cell,1994,6:1509-1518.
[38]夏濤,劉紀麟.玉米細胞質雄性不育性與乙烯的關系[J].華北農學報,1996,11(3):68-72.
[39]Caldelari D,Wang G,Farmer E E,et al.Arabidopsis lox3 lox4 double mutants are male sterile and defective in global proliferative arrest[J].Plant Molecular Biology,2011,75:25-33.
[40]Steiner-Lange S,Unte U S,Eckstein L,et al.Disruption of Arabidopsis thaliana MYB26 results in male sterility due to non-dehiscent anthers[J].The Plant Journal,2003,34:519-528.
[41]Park J H,Halitschke R,Kim H B,et al.A knock-out mutation in allene oxide synthase results in male sterility and defective wound signal transduction in Arabidopsis due to a block in jasmonic acid biosynthesis[J].The Plant Journal,2002,31(1):1-12.
[42]Rao M V,Lee H,Creelman R A,et al.Jasmonic acid signaling modulates ozone-induced hypersensitive cell death[J].The Plant Cell,2000,12:1633-1646.
[43]Asai T,Stone J M,Heard J E,et al.Fumonisin B1-induced cell death in Arabidopsis protoplasts requires jasmonate-,ethylene-,and salicylate-dependent signaling pathways[J].The Plant Cell,2000,12:1823-1835.
[44]Sanders P M,Lee P Y,Biesgen C,et al.The Arabidopsis DELAYED DEHISCENC1 gene encodes an enzyme in the jasmonic acid synthesis pathway[J].The Plant Cell,2000,12:1041-1061.
[45]甘立軍,夏凱,周燮.茉莉酸對擬南芥花粉育性的調控[J].植物生理學通訊,2004,40(3):269-274.
[46]Singh S,Sawhney V K,Pearce D W.Temperature effects on endogenous indole-3-acetic acid levels in leaves and stamens of the normal and male sterile ‘stamenless-2 mutant of tomato (Lycopersicon esculentum mill.)[J].Plant,Cell & Environment,1992,15:373-377.
[47]Singh S,Sawhney V K.Abscisic acid in male sterile tomato mutant and its regultion by low temperature[J].Journal of Experimental Botany,1998,49(19):199-203.
[48]趙玉錦,童哲,陳華君,等.內源植物激素與光敏核不育水稻農墾58S育性的關系[J].植物學報,1996,38(12):936-941.
(責編:張長青)

