脊髓損傷大鼠遠端神經元及骨骼肌變化的實驗研究
李毓新
脊髓損傷大鼠遠端神經元及骨骼肌變化的實驗研究
李毓新
目的 探討脊髓損傷大鼠遠端神經元及骨骼肌變化情況,以期為臨床上治療提供有效依據。方法 選取30只大鼠為研究對象,每組10只,分別為對照組、 手術組和脊髓損傷組。對照組為正常大鼠,手術組行椎板切除術,脊髓損傷組行胸10完全脊髓損傷。在制成模型后1周、2周、4周、12周、24周觀察大鼠坐骨神經-運動終板-內側腓腸肌形態變化情況。結果 脊髓損傷電鏡下坐骨神經術后12周有髓神經纖維髓鞘崩解,崩解髓鞘板層清晰,術后24周有髓神經纖維髓鞘已模糊、碎裂髓鞘增多,薄髓和無髓神經纖維12周后增多;腓腸肌光鏡下術后12周局部肌細胞邊界清楚,多數模糊,肌細胞核相對聚集,結締組織增生明顯;術后24周肌細胞融合,細胞核密集,融合細胞間見有空隙,結締組織增生明顯;電鏡下運動終板術后12周突觸皺褶和突觸前后膜不可辨,突觸結構紊亂,肌纖維明暗帶清晰,z線不連續,高倍鏡下突觸皺褶未見,突觸前后膜不可辨,可見類圓形突觸小泡和細小顆粒,肌板結構清晰。結論 大鼠脊髓損傷后在損傷平面以下周圍神經、運動終板、骨骼肌在形態上會發生規律性變化,12周后顯著變化,24周后則毀損性改變。
脊髓損傷;遠端神經元;骨骼肌變化;大鼠
脊髓損傷是臨床上治療較為棘手疾病,治療目的是恢復損傷平面以下運動和排泄功能。但這依賴于脊髓傳導性、腦和周圍神經肌肉保持良好功能,三者只有統一協調才能恢復滿意。若遠端神經或肌肉不可逆損傷則脊髓傳導恢復幾乎不可能。有研究稱,切斷胸12脊髓制造完全性截癱動物模型,在傷后3周、6周切除下肢全部神經干,病理檢查發現神經纖維、髓鞘等無明顯變化[1]。也有研究認為,在大鼠胸10完全脊髓橫斷損傷后,光鏡和電鏡觀察腓總神經形態學變化,發現脊髓損傷后腓總神經髓鞘和軸索會出現明顯退變,且退變隨時間推移而逐漸加重,會出現軸索發芽現象[2]。故大鼠完全橫斷脊髓損傷后會造成損傷平面以下周圍神經發生跨神經元變性。本研究觀察脊髓損傷后損傷平面以下神經、肌肉、運動終板在自然病程中形態學變化,為脊髓損傷臨床診治提供有效時間窗。
1 材料與方法
1.1 一般材料 選取30只大鼠,分為對照組、手術組和脊髓損傷組,每組10只。近交系,均為雄性,體重(200±10)g,由北京試驗動物中心提供。
1.2 動物模型制備 大鼠術前禁食12 h,稱體重后采取10%水合氯醛(3~4)mL/kg腹腔內注射麻醉,俯臥在手術臺上,備皮消毒后以胸10棘突為中心行背側正中切口,長約3 cm,緊貼棘突骨面縱向分離椎旁肌肉和軟組織,顯露出胸9~11椎板和棘突,咬除胸9~11棘突和移除胸10椎板,顯露胸10水平脊髓,并用剪刀迅速橫斷胸10脊髓,在脊髓斷端頭側切除2 mm脊髓組織,移除后在脊髓端置入明膠海綿。逐層縫合,在試驗期間人工排尿2~3次每日,直至恢復正常排尿為止。手術組則僅行棘突和椎板切除,不損傷脊髓。
1.3 取材 以體積分數10%水合氯醛麻醉后從左心室插管后剪開右心耳,灌注生理鹽水沖洗待液體清亮后用40 g/L多聚圈經心臟緩慢灌注,結束后取右側坐骨神經1 cm,腓腸肌肌腹中部神經入肌處取0.8 cm肌肉和小腿內側腓腸肌肌腹1 cm,固定12 h后進行處理,石蠟打包后將內側腓腸肌標本進行連續橫向切片,厚度為10 μm,進行蘇木精-伊紅染色,將坐骨神經和運動終板行半薄切片后在光鏡下進行定位,超薄切片后行電子染色進行透視電鏡觀察。觀察電鏡下坐骨神經和內側腓腸肌運動終板情況,光鏡下觀察內側腓腸肌情況。
2 結 果
2.1 電鏡下脊髓損傷觀察結果 對照組有髓神經纖維、無髓神經纖維一直存在,髓鞘外形正常。手術組有髓神經纖維外形正常。脊髓損傷則出現規律性變化,表現為術后2周有髓神經纖維髓鞘正常,術后4周有髓神經纖維崩解、板層分離,有髓神經纖維和無髓神經纖維。術后12周有髓神經纖維崩解增多、碎裂、崩解髓鞘板層清晰,新生神經纖維髓鞘細壁薄,無髓神經纖維增多,術后12周有髓神經纖維髓鞘崩解,崩解髓鞘板層清晰,術后24周有髓神經纖維髓鞘已模糊、碎裂髓鞘增多,薄髓和無髓神經纖維12周后增多。 詳見圖1。
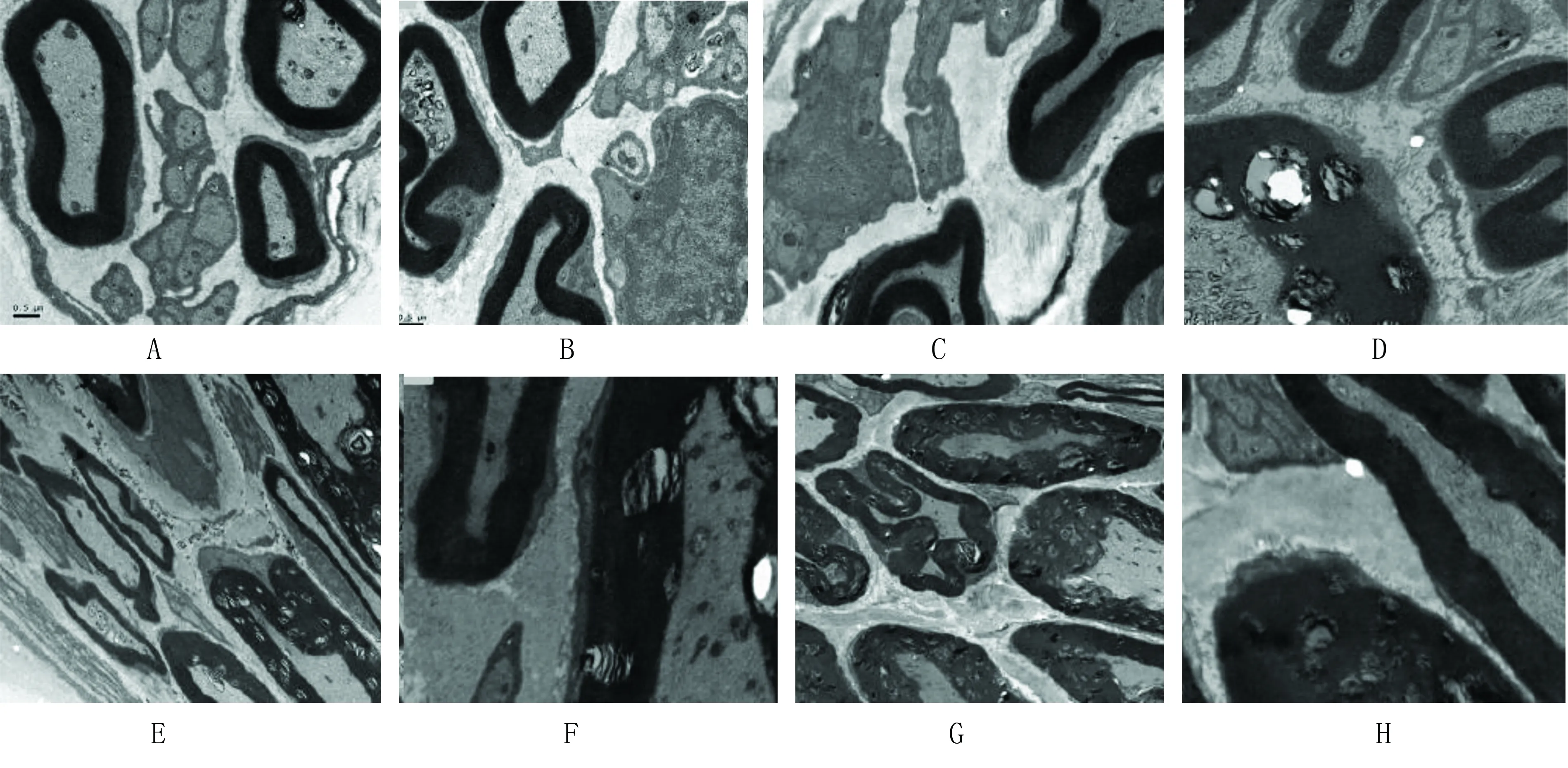
注:A和B為術后2周表現,C和D為脊髓損傷術后4周表現,E和F為脊髓損傷后12周變化;G和H為脊髓損傷24周所見。
圖1 電鏡下脊髓損傷觀察結果
2.2 腓腸肌光鏡下觀察結果 對照組細胞肌束膜和肌內膜邊界清楚,肌細胞核位于肌膜下方。手術組術后2周肌細胞肌束和肌內膜邊界清楚,脊髓損傷術后2周肌細胞結細胞略縮小,術后4周肌細胞截面積縮小,局部肌細胞破壞明顯,術后12周局部肌細胞邊界清楚,多數模糊,肌細胞核相對聚集,結締組織增生明顯;術后24周肌細胞融合,細胞核密集,融合細胞間見有空隙,結締組織增生明顯。詳見圖2。
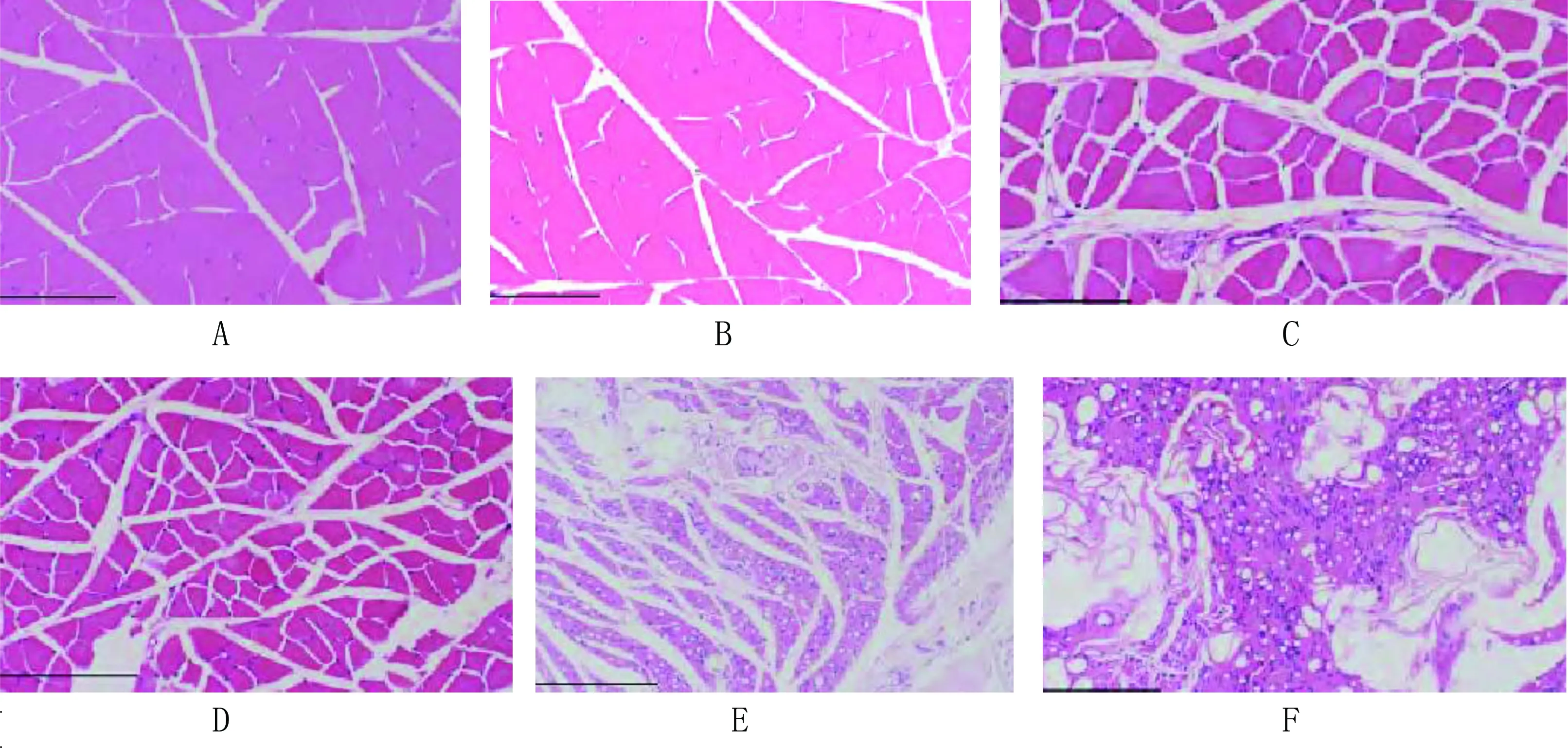
注:A為對照組肌細胞,B為手術組術后2周肌細胞,C,D,E,F為脊髓損傷術后2周、4周、12周、24周肌細胞截面積和組織變化,脊髓損傷術后24周肌細胞融合,細胞核密集,融合細胞間間隙不一,結締組織增生明顯。
圖2 腓腸肌光鏡下觀察結果
2.3 電鏡下運動終板觀察結果 脊髓損傷術后4周突觸皺褶結構清晰,突觸內可見細顆粒狀物質,高倍鏡下觀察可見突觸前后膜清晰,突觸間隙、皺褶清晰,各個結構內見細小顆粒,術后12周突觸皺褶和前后膜清晰,突觸內可見細小顆粒,肌纖維明暗可見,z線不連續。高倍鏡下突觸皺褶清晰,突觸前后膜層次分明,結構內可見細小顆粒,肌板清晰;術后12周突觸皺褶和突觸前后膜不可辨,突觸結構紊亂,肌纖維明暗帶清晰,z線不連續,高倍鏡下突觸皺褶未見,突觸前后膜不可辨,可見類圓形突觸小泡和細小顆粒,肌板結構清晰。詳見圖3。
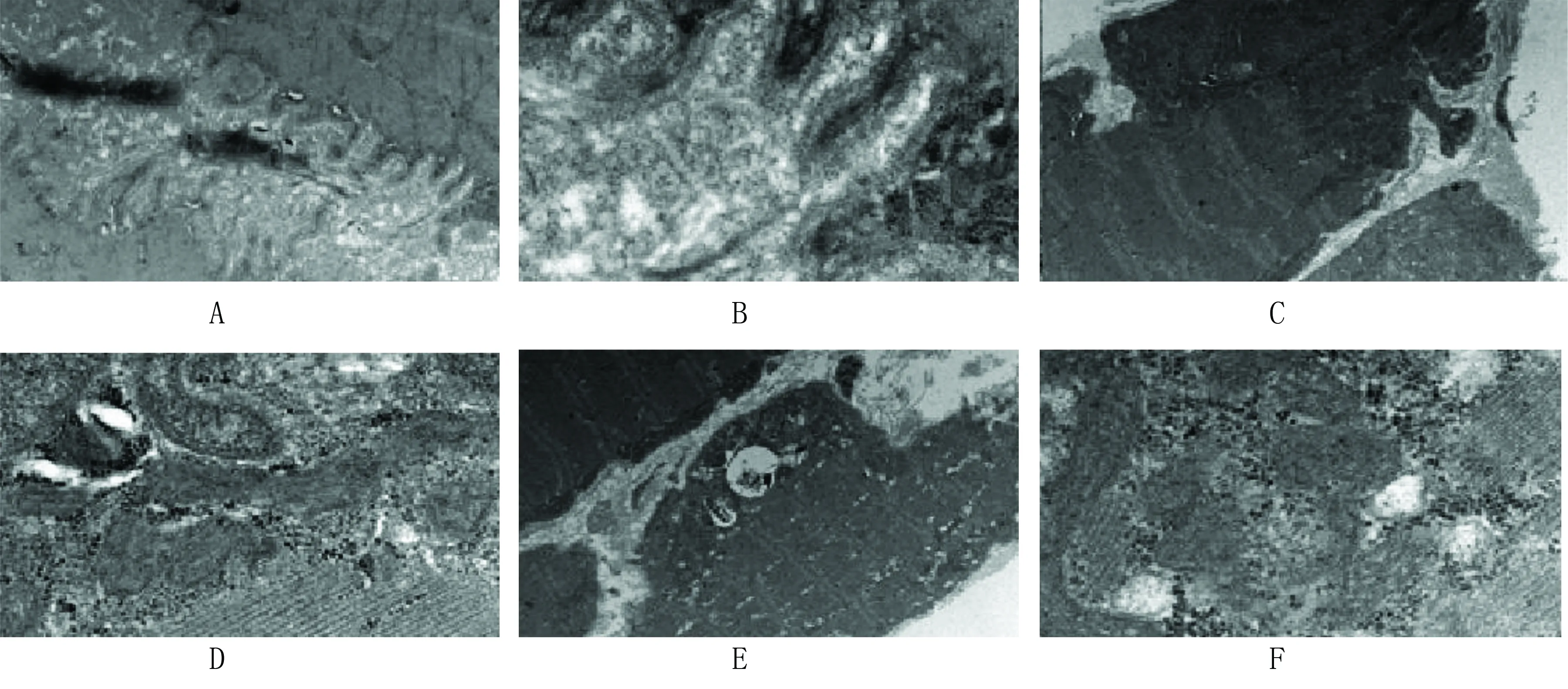
注:A為術后4周橫截面(1萬倍),B為術后4周橫截面(4萬倍),C為術后12周縱切面(4萬倍),D為術后12周縱切面(4萬倍),E為術后12周縱切面(5千倍),F為術后12周縱切面(4萬倍),術后12周突觸皺褶和突觸前后可辨,可見細小顆粒,肌纖維明、暗帶清晰,z線不連續,同時突觸皺褶隱約可見突觸內顆粒,突觸前結構紊亂,肌纖維清晰,z線不連續。
圖3 電鏡下運動終板觀察結果
3 討 論
大鼠脊髓橫斷性損傷4周后坐骨神經出現有髓神經纖維髓鞘退變,且會隨著時間推移而變化,12周后髓鞘出現崩解碎解現象,伴隨有新生薄髓和大量無髓神經纖維,24周后最明顯,髓鞘破裂最明顯,髓鞘結構層模糊不清。這和手術、正常大鼠比較有明顯不同,這可推測出脊髓損傷后遠端神經元發出軸突構成周圍神經發生退變,且會隨著時間進行性加重。結合相關報道[3],是因為存在跨神經元變性。脊髓損傷后發生跨神經元變性時間窗為20周左右。另外,動物模型不同如挫傷模型、壓迫模型、缺血損傷模型、橫斷模型,同一實驗動物不同脊髓損傷模型對損傷結構和運動功能影響不同[4-5]。
在運動終板形態上,脊髓橫斷性損傷4周后內側腓腸肌運動終板結構完整,突觸皺褶清晰,12周退變和完整運動終板均存在,但24周后則無法找到運動終板,這說明完全性脊髓損傷病程中,隨著觀察時間延長,運動終板結構會出現不可逆退變性變化;這和有些報道結果類似[6-7],脊髓橫斷損傷后運動終板著色,數量上和正常無明顯變化,脊髓損傷4周后肌纖維運動終板出現退變,終板染色變淺,軸索終末減少,終板核減少,肌漿淡染,終板邊緣皺縮,中央出現空泡樣淡然區。脊髓損傷8周后運動終板會出現明顯退變,染色區空白。免疫組織化學技術證實橫斷性脊髓損傷大鼠后肢神經肌肉接頭發生解剖學不穩,突觸前后結構減少和軸突終末芽生,神經肌肉突觸出現選擇性分解[8-9]。
在腓腸肌形態變化上,結果顯示,脊髓損傷4周后腓腸肌肌細胞截面積縮小,且截面積和觀察時間呈負相關。12周肌細胞萎縮明顯,大量結締組織增生,24周后肌細胞大片融合,無法確認肌細胞結構,且結締組織增生明顯,而手術組和正常組則無此變化。推測脊髓損傷后肌細胞會發生進行性蛻變,肌細胞截面積縮小,后期表現為一些肌纖維形態結構破壞和結締組織填充[10-11]。這和報道結果類似[12-13],脊髓損傷后大鼠肌纖維數目減少[14],肌纖維萎縮,表現為肌肉截面積縮小,肌肉質量下降,肌間脂肪堆積。 大鼠比目魚肌和內側腓腸肌在脊髓損傷后1周下降22%和27%[15]。脊髓損傷后3周下降15%和18%,脊髓損傷10周和脊髓損傷3周在肌肉濕重量上相近。
大鼠在完全性橫斷性脊髓損傷自然病程中損傷平面以下周圍神經、運動終板和骨骼肌在形態上會發生規律性變化,12周會發生顯著改變,24周后則出現不可逆損傷。
本研究中存在缺陷有,未將神經電生理學相關評價標準納入,這樣就不能從量化程度上反應神經肌肉運動功能變化情況。但大鼠脊髓損傷和人脊髓損傷在運動神經元和骨骼肌上有一定相近性,對治療時間窗有一定的作用。
[1] Liu NK,Xu XM.Neuroprotection and its molecular mechanism following spinal cord injury[J].Neural Regeneration Research,2012,7(26):2051-2062.
[2] Fong AJ,Roy RR,Ichiyama RM,et al.Recovery of control of posture and locomotion after a spinal cord injury:solutions staring us in the face[J].Progress in Brain Research,2009,175:393-418.
[3] Byers JS,Huguenard AL,Kuruppu D,et al.Neuroprotective effects of testosterone on motoneuron and muscle morphology following spinal cord injury[J].The Journal of Comparative Neurology,2012,520(12):2683-2696.
[4] Xu XM,Onifer SM.Transplantation-mediated strategies to promote axonal regeneration following spinal cord injury[J].Respiratory Physiology & Neurobiology,2009,169(2):171-182.
[6] Onifer SM,Zhang O,Whitnel-Smith LK,et al.Horizontal ladder task-specific retraining in adult rats with contusive thoracic spinal cord injury[J].Restorative Neurology and Neuroscience,2011,29(4):275-286.
[7] Amr SM,Gouda A,Koptan WT,et al.Bridging defects in chronic spinal cord injury using peripheral nerve grafts combined with a chitosan-laminin scaffold and enhancing regeneration through them by co-transplantation with bone-marrow-derived mesenchymal stem cells:case series of 14 patients[J].The Journal of Spinal Cord Medicine,2014,37(1):54-71.
[8] Ramer LM,van Stolk AP,Inskip JA,et al.Plasticity of TRPV1-expressing sensory neurons mediating autonomic dysreflexia following spinal cord injury[J].Frontiers in Physiology,2012,3:257.
[9] Boulland JL,Lambert FM,Züchner M,et al.Neonatal mouse spinal cord injury model for assessing post-injury adaptive plasticity and human stem cell integration[J].PLoS ONE,2013,8(8):e71701.
[10] Miranda TA,Vicente JM,Marcon RM,et al.Time-related effects of general functional training in spinal cord-injured rats[J].Clinics,2012,67(7):799-804.
[11] Hillen BK,Yamaguchi GT,Abbas JJ,et al.Joint-specific changes in locomotor complexity in the absence of muscle atrophy following incomplete spinal cord injury[J].Journal of Neuro Engineering and Rehabilitation,2013,10:97.
[12] Pertici V,Amendola J,Laurin J,et al.The use of poly[N-(2-hydroxypropyl)-methacrylamide]hydrogel to repair a T10 spinal cord hemisection in rat:a behavioural,electrophysiological and anatomical examination[J].Asn Neuro,2013,5(2):e00114.
[13] Wang J,Sun J,Tang Y,et al.Basic fibroblast growth factor attenuates the degeneration of injured spinal cord motor endplates[J].Neural Regeneration Research,2013,8(24):2213-2224.
[14] Hall BJ,Lally JE,Vukmanic EV,et al.Spinal cord injuries containing asymmetrical damage in the ventrolateral funiculus is associated with a higher incidence of at level allodynia[J].The Journal of Pain,2010,11(9):864-875.
[15] Ollivier-Lanvin K,Lemay MA,Tessler A,et al.Neuromuscular transmission failure and muscle fatigue in ankle muscles of the adult rat after spinal cord injury[J].Journal of Applied Physiology,2009,107(4):1190-1194.
(本文編輯王雅潔)
西安醫學院第二附屬醫院(西安 710000),E-mail:liyuxinyxtg@163.com
引用信息:李毓新.脊髓損傷大鼠遠端神經元及骨骼肌變化的實驗研究[J].中西醫結合心腦血管病雜志,2017,15(6):686-688.
R285.5
A
10.3969/j.issn.1672-1349.2017.06.013
1672-1349(2017)06-0686-04
2016-08-30)

