侯氏黑散化學(xué)成分對脂多糖誘導(dǎo)BV2細胞活化中炎性反應(yīng)因子分泌平衡的影響
常佳慧 趙 暉 王 蕾 張 弛 陸 躍 張秋霞*
(1.首都醫(yī)科大學(xué)中醫(yī)藥學(xué)院 中醫(yī)絡(luò)病研究北京市重點實驗室, 北京 100069;2.北京中醫(yī)藥大學(xué)期刊中心, 北京 100029)
·基礎(chǔ)研究 ·
侯氏黑散化學(xué)成分對脂多糖誘導(dǎo)BV2細胞活化中炎性反應(yīng)因子分泌平衡的影響
常佳慧1趙 暉1王 蕾1張 弛2陸 躍1張秋霞1*
(1.首都醫(yī)科大學(xué)中醫(yī)藥學(xué)院 中醫(yī)絡(luò)病研究北京市重點實驗室, 北京 100069;2.北京中醫(yī)藥大學(xué)期刊中心, 北京 100029)
目的 探究侯氏黑散方中綠原酸(chlorogenic acid,CGA)、木犀草苷(cynaroside,CYN)、木犀草素(luteolin,LUT)、人參皂苷Rg1(ginsenoside Rg1,GS-Rg1)對脂多糖(lipopolysaccharide,LPS)誘導(dǎo)小膠質(zhì)細胞炎性反應(yīng)因子表達的影響。方法 實驗分對照組、模型組、CGA、CYN、LUT、GS-Rg1處理組。利用LPS誘導(dǎo)BV2細胞過度活化,建立腦缺血后小膠質(zhì)細胞炎性反應(yīng)損傷體外模型;CCK-8法檢測各組細胞活性;Griess法檢測各組細胞上清中一氧化氮(nitric oxide,NO)的量;酶聯(lián)免疫法(enzyme linked immunosorbent assay, ELISA)檢測各組細胞上清中腫瘤壞死因子(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)、白介素-10(interleukin-10,IL-10)、轉(zhuǎn)化生長因子-β1(transforming growth factor-β1,TGF-β1)的量;蛋白印跡法(Western blotting, WB)檢測各組細胞p-p65、p-IκBα蛋白表達。結(jié)果 與模型組相比,不影響細胞生存活性的情況下,CGA、CYN、LUT、GS-Rg1可顯著降低細胞上清中促炎因子NO、TNF-α、IL-6濃度;GS-Rg1可顯著升高抑炎因子IL-10、TGF-β1濃度;CGA、CYN、LUT、GS-Rg1可顯著降低細胞中p-p65、p-IκBα蛋白濃度。結(jié)論 CGA、CYN、LUT、GS-Rg1分別從促炎、抑炎兩方面調(diào)節(jié)腦缺血后炎性反應(yīng)相關(guān)因子分泌的平衡,其機制與核轉(zhuǎn)錄因子-κB(nuclear factor-κB,NF-κB)通路活化有關(guān)。
侯氏黑散;綠原酸;木犀草苷;木犀草素;人參皂苷Rg1;小膠質(zhì)細胞;炎性反應(yīng)因子;NF-κB信號通路
腦缺血是高發(fā)病率、高致殘率及高病死率的常見病,其造成的家庭負擔(dān)、社會危害不容忽視。炎性反應(yīng)作為腦缺血的主要損傷機制之一,可與其他各種機制相互作用,共同造成神經(jīng)損傷。炎性細胞因子是腦缺血損傷發(fā)病機制中的關(guān)鍵介質(zhì),腦缺血后不同作用的炎性反應(yīng)因子可直接或間接參與炎性反應(yīng)細胞的活化和浸潤,并在神經(jīng)元的損傷與修復(fù)過程中起到重要作用[1]。促炎因子可促進炎性反應(yīng)細胞浸潤,導(dǎo)致水腫形成,參與大腦損傷的反應(yīng)過程;抑炎因子可通過抑制缺血期中樞神經(jīng)系統(tǒng)的炎性反應(yīng),減輕腦水腫,減少梗死面積,發(fā)揮神經(jīng)保護作用[2]。已有實驗[3]表明,大腦中動脈栓塞大鼠局灶缺血區(qū)可見反應(yīng)性小膠質(zhì)細胞,缺血再灌注損傷后缺血中心區(qū)內(nèi)充滿小膠質(zhì)細胞,因而進一步探究炎性反應(yīng)因子在腦缺血損傷中的作用,對該病的防治具有重要意義。
侯氏黑散方出自《金匱要略·中風(fēng)歷節(jié)》篇。作為仲景治療卒中第一方,本方在組方用藥上充分體現(xiàn)了風(fēng)藥佐助補虛藥“補不足,損有余”的立法思想。本團隊前期采用高效液相色譜法(high performance liquid chromatography,HPLC)對其化學(xué)成分進行分析[4],通過體內(nèi)實驗已證實侯氏黑散可保護和修復(fù)缺血性腦損傷,促進神經(jīng)再生[5-11]。在此基礎(chǔ)上,本實驗選取侯氏黑散方中風(fēng)藥代表藥物菊花中綠原酸(chlorogenic acid,CGA)、木犀草苷(cynaroside,CYN)、木犀草素(luteolin,LUT)及補虛藥代表藥物人參中人參皂苷Rg1(ginsenoside Rg1,GS-Rg1),通過體外實驗,觀察風(fēng)藥、補虛藥有效成分單體對小膠質(zhì)細胞過度活化后炎性反應(yīng)相關(guān)細胞因子一氧化氮(nitric oxide,NO)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白介素-6(interleukin-6,IL-6)、白介素-10(interleukin-10,IL-10)、轉(zhuǎn)化生長因子-β1(transforming growth factor-β1,TGF-β1)的影響,以及對核轉(zhuǎn)錄因子-κB(nuclear factor-κB,NF-κB)信號通路的激活,探討風(fēng)藥、補虛藥對腦缺血后炎性反應(yīng)的調(diào)節(jié)作用。
1 材料與方法
1.1 材料
1.1.1 細胞
小鼠小膠質(zhì)細胞株BV2,購自中國醫(yī)學(xué)科學(xué)院基礎(chǔ)醫(yī)學(xué)研究所基礎(chǔ)醫(yī)學(xué)細胞中心。
1.1.2 藥品及試劑
脂多糖(美國Sigma公司L880);綠原酸(MUST-16031610),木犀草苷(MUST-16012405),木犀草素(MUST-15021005),人參皂苷Rg1(MUST-15042215),純度均≥98%,購自成都曼斯特公司;DMEM(美國Corning公司11330-032);胎牛血清、青霉素-鏈霉素、胰蛋白酶購自美國Gibco公司;細胞增生-毒性檢測試劑盒(日本Dojindo公司);NO檢測試劑盒(上海碧云天生物有限公司);TNF-α、IL-6、IL-10、TGF-β1ELISA試劑盒購自上海森雄科技實業(yè)有限公司;p-p65、p-IκB(abcam)、β-actin抗體購自北京欣博盛科技有限公司。
1.1.3 主要儀器
超凈生物安全柜(新加坡ESCD公司);二氧化碳培養(yǎng)箱、超低溫冰箱(美國Thermo scientific公司);離心機(德國Eppendorf公司);電泳儀、電轉(zhuǎn)儀(美國Bio-rad公司);微孔板檢測系統(tǒng)(美國Molecular Devices公司)。
1.2 方法
1.2.1 細胞培養(yǎng)
BV2細胞置于含10%(體積分數(shù))滅活胎牛血清的DMEM培養(yǎng)基,在37 ℃,5% (體積分數(shù))CO2+95% (體積分數(shù)) 空氣,飽和濕度條件的CO2培養(yǎng)箱中培養(yǎng),每2 d換液1次。待細胞至80%融合時傳代:棄舊培養(yǎng)基,PBS清洗2次后加入0.25%(質(zhì)量分數(shù))胰蛋白酶適度消化,鏡下見大部分細胞圓縮,間隙增大時,立即加入含血清培養(yǎng)基終止消化,1 000 r/min離心5 min,棄上清,加入新鮮含血清培養(yǎng)基重懸所收集細胞,制成單細胞懸液,適宜密度接種于新培養(yǎng)瓶,取狀態(tài)穩(wěn)定的對數(shù)生長期細胞用于后續(xù)實驗。
1.2.2 LPS誘導(dǎo)BV2活化損傷模型建立及分組處理
取對數(shù)生長期BV2細胞,消化計數(shù),調(diào)整細胞密度,按1.5×105/孔接種于6孔培養(yǎng)板,采用數(shù)字表法隨機分為正常對照組(CON)、炎性反應(yīng)模型組(MOD)、GS-Rg1處理組(GS-Rg1)、LUT處理組(LUT)、CYN處理組(CYN)、CGA處理組(CGA)。各組BV2細胞正常條件培養(yǎng)24 h貼壁后,棄舊液,對照組加無血清新鮮培養(yǎng)基,GS-Rg1處理組、LUT處理組、CYN處理組、CGA處理組分別加入含10 μmol/L GS-Rg1、含30 μmol/L LUT、200 μmol/L CYN、200 μmol/L CGA的無血清培養(yǎng)基,預(yù)處理2 h;棄舊液,對照組加入無血清新鮮培養(yǎng)基,模型組及藥物處理組分別加入含0.1 μg/mL LPS的無血清培養(yǎng)基,正常條件下誘導(dǎo)活化24 h,收集細胞及上清液用于后續(xù)實驗。
1.2.3 細胞活性檢測
細胞以3×104/孔接種于96孔培養(yǎng)板,設(shè)5組分別給予LPS、CGA、CYN、LUT、GS-Rg1處理后,吸棄培養(yǎng)液,加入含10%(體積分數(shù))CCK8的新鮮培養(yǎng)液,100 μL/孔,37 ℃孵育4 h,酶標(biāo)儀測定490 nm處各孔的吸光度(A值),結(jié)果以百分比(%)表示。細胞存活率(%)=實驗組A值/CON組A值×100%。
1.2.4 細胞上清液NO檢測
細胞以1.5×105/孔接種于6孔培養(yǎng)板,給予相應(yīng)處理后收集各組細胞上清液,于96孔板中依次加入50 μL/孔的標(biāo)準(zhǔn)品或待測樣品、Griess試劑Ⅰ和Ⅱ,室溫孵育5 min,酶標(biāo)儀測定540 nm處A值,根據(jù)標(biāo)準(zhǔn)曲線計算NO量,結(jié)果以μmol/L表示。
1.2.5 細胞上清液炎性反應(yīng)因子檢測
細胞以1.5×105/孔接種于6孔培養(yǎng)板,給予相應(yīng)處理后收集各組細胞上清液,ELISA試劑盒于室溫平衡20 min,按照說明書步驟進行操作。酶標(biāo)儀測定450 nm處A值,以A值為縱坐標(biāo),標(biāo)準(zhǔn)品濃度為橫坐標(biāo)擬合標(biāo)準(zhǔn)曲線,根據(jù)標(biāo)準(zhǔn)曲線計算各組炎性反應(yīng)因子相應(yīng)濃度,結(jié)果以pg/mL表示。
1.2.6 細胞p-p65、p-IKBα蛋白檢測
細胞以1.5×105/孔接種于6孔培養(yǎng)板,給予相應(yīng)處理后收集各組細胞,冰上裂解約20 min,4 ℃下12 000g離心15 min,BCA法蛋白定量。各組取等量蛋白樣品進行10%(質(zhì)量分數(shù))SDS-PAGE電泳,采用濕轉(zhuǎn)法50 min將蛋白轉(zhuǎn)移至PVDF膜,5%(質(zhì)量分數(shù))BSA 37 ℃封閉2 h,分別加入p-p65(兔源, 1∶10 000)、p-IκBα(小鼠源,1∶1 000)和β-actin一抗(小鼠源,1∶20 000)4 ℃孵育過夜,TBST洗膜5×5 min后,對應(yīng)加入羊抗兔和羊抗小鼠二抗(IgG/HRP,1∶20 000)37 ℃孵育1 h,TBST洗膜5×5 min,ECL發(fā)光液反應(yīng)后于暗室進行曝光顯影定影處理。采用Image J圖像分析系統(tǒng)測定蛋白質(zhì)條帶灰度值,結(jié)果以目的條帶與內(nèi)參條帶(β-actin)的比值表示。
1.3 統(tǒng)計學(xué)方法
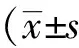
2 結(jié)果
2.1 LPS、CGA、CYN、LUT、GS-Rg1對BV2細胞存活率的影響
與正常組相比,LPS、CGA、CYN、LUT、GS-Rg1處理組BV2細胞活性差異均無統(tǒng)計學(xué)意義(P>0.05),表明不同濃度LPS、CGA、CYN、LUT、GS-Rg1處理24 h均無明顯細胞毒性作用(圖1)。

圖1 LPS、CGA、CYN、LUT、GS-Rg1對BV2細胞存活率的影響
CON: control; LPS:lipopolysaccharide; CGA:chlorogenic acid; CYN:cynaroside; LUT:luteolin; GS-Rg1:ginsenoside Rg1.
2.2 CGA、CYN、LUT、GS-Rg1對LPS損傷BV2細胞NO釋放的影響
與正常組相比,模型組細胞上清液NO量明顯增高;與模型組相比,CGA、CYN、LUT、GS-Rg1處理組可顯著降低細胞上清液NO量,差異有統(tǒng)計學(xué)意義(P<0.001)(圖2)。
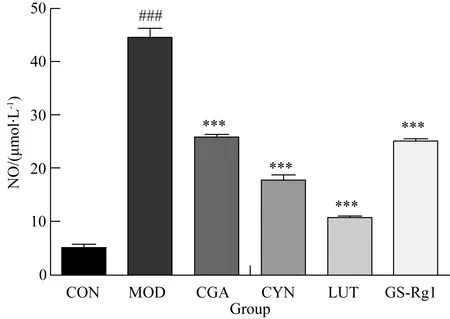
圖2 CGA、CYN、LUT、GS-Rg1對LPS損傷BV2細胞NO釋放的影響
2.3 CGA、CYN、LUT、GS-Rg1對LPS損傷BV2細胞炎性反應(yīng)因子分泌的影響
與正常組相比,模型組細胞上清液TNF-α、IL-6濃度明顯增高;與模型組相比,CGA、CYN、LUT、GS-Rg1處理組可顯著降低細胞上清液TNF-α、IL-6濃度,差異有統(tǒng)計學(xué)意義(P<0.001)(圖3A、B);與正常組相比,模型組細胞上清液IL-10濃度明顯降低;與模型組相比,CGA、LUT、GS-Rg1處理組可顯著升高細胞上清液IL-10濃度,差異有統(tǒng)計學(xué)意義(P<0.001)(圖3C);與正常組相比,模型組細胞上清液TGF-β1濃度明顯增高;與模型組相比,CGA、CYN、LUT處理組可顯著降低細胞上清液TGF-β1濃度,GS-Rg1處理組可顯著升高細胞上清液TGF-β1濃度,差異有統(tǒng)計學(xué)意義(P<0.001)(圖3D)。
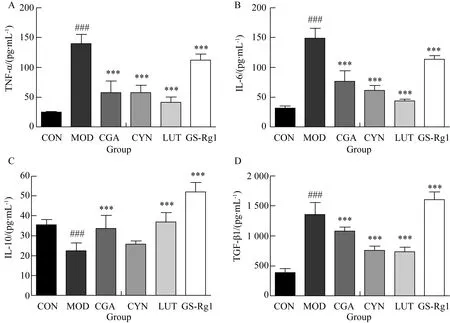
圖3 CGA、CYN、LUT、GS-Rg1對LPS損傷BV2細胞上清液炎性反應(yīng)因子分泌的影響
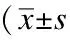
2.4 LUT、GS-Rg1、CYN、CGA對LPS損傷BV2細胞NF-kB通路活化的影響
與正常組相比,模型組細胞p-p65、p-IKBα表達明顯增高;與模型組相比,LUT、GS-Rg1、CYN、CGA處理組可顯著降低細胞p-p65、p-IκBα表達,差異有統(tǒng)計學(xué)意義(P<0.05,P<0.01)(圖4)。
3 討論
本實驗證實了侯氏黑散方中風(fēng)藥、補虛藥化學(xué)成分單體可調(diào)節(jié)腦缺血后炎性反應(yīng),促進腦缺血后神經(jīng)血管單元內(nèi)環(huán)境穩(wěn)態(tài)的恢復(fù)。實驗結(jié)果表明CGA、CYN、LUT和GS-Rg1分別從促炎、抑炎兩方面調(diào)節(jié)小膠質(zhì)細胞NO、TNF-α、IL-6、IL-10、TGF-β1分泌的平衡,其機制與NF-κB通路活化有關(guān)。
小膠質(zhì)細胞是腦實質(zhì)中最主要的免疫細胞。腦缺血后,活化的小膠質(zhì)細胞能顯著上調(diào)許多細胞因子的分泌水平,這些物質(zhì)中某些能吞噬死亡的神經(jīng)元,促進修復(fù),發(fā)揮神經(jīng)保護作用[12],某些可發(fā)揮促炎、細胞毒性等功能,進而導(dǎo)致神經(jīng)元死亡[13]。調(diào)節(jié)小膠質(zhì)細胞活化和炎性反應(yīng),平衡其所釋放神經(jīng)毒性因子跟神經(jīng)保護因子是其功能穩(wěn)定的關(guān)鍵。
NO是神經(jīng)系統(tǒng)中重要的神經(jīng)遞質(zhì),同時又是一種高反應(yīng)性、細胞毒性的自由基,可自由穿透細胞膜,作用于細胞內(nèi)的靶分子發(fā)揮作用。研究[14]表明,腦缺血后24 h內(nèi)NO產(chǎn)生活躍,且主要表現(xiàn)在內(nèi)皮細胞和小膠質(zhì)細胞。過量的NO可介導(dǎo)并放大炎性反應(yīng)級聯(lián)反應(yīng)等,最終導(dǎo)致神經(jīng)元凋亡和壞死,進一步加重腦損傷[15]。已有研究[16-18]表明,木犀草素、綠原酸、人參皂苷Rg1等可有效抑制LPS刺激BV2細胞后NO產(chǎn)生,本實驗同樣證實了綠原酸、木犀草苷、木犀草素、人參皂苷Rg1可顯著減少細胞上清中炎性反應(yīng)介質(zhì)NO的產(chǎn)生。
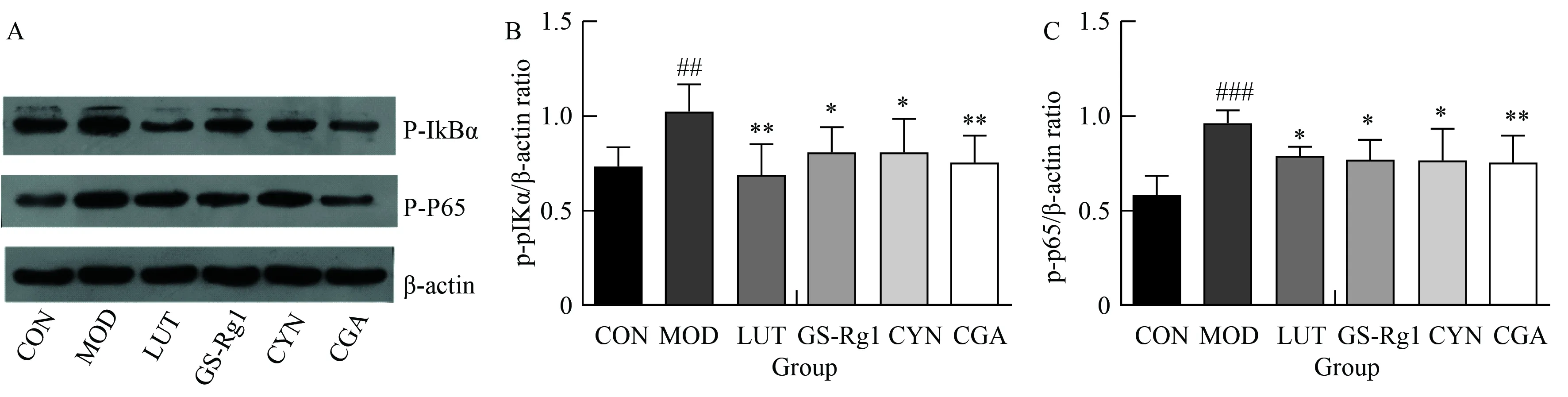
圖4 LUT、GS-Rg1、CYN、CGA對LPS損傷BV2細胞NF-κB通路活化的影響
TNF-α是一種由細胞分泌的前炎性反應(yīng)細胞因子,參與機體的免疫應(yīng)答和炎性反應(yīng),可誘導(dǎo)IL-6、IL-8等因子的mRNA轉(zhuǎn)錄及表達,起協(xié)同致炎作用。可作為缺血性腦卒中的標(biāo)志物,用于腦缺血病人早期診斷[19]。IL-6作為經(jīng)典的炎性反應(yīng)因子,在神經(jīng)組織的生理穩(wěn)態(tài)以及炎性反應(yīng)性疾病的發(fā)病機制中均發(fā)揮重要作用,其病理機制可能與誘導(dǎo)最初的炎性反應(yīng)免疫瀑布發(fā)生及誘導(dǎo)趨化因子的表達有關(guān),可由小膠質(zhì)細胞分泌[20]。已有研究[21]證實,腦梗死急性期IL-6明顯增高,可引起小鼠神經(jīng)元損傷,關(guān)于卒中病人的前瞻性研究[22]也表明IL-6濃度升高與預(yù)后不良關(guān)系密切[23]。前期研究[24]表明,侯氏黑散及其方中風(fēng)藥可減少腦缺血大鼠紋狀體中炎性反應(yīng)因子如IL-2、IL-6、IL-1β、TNF-α的表達,反映風(fēng)藥在炎性反應(yīng)控制方面的優(yōu)勢。本實驗結(jié)果進一步揭示了侯氏黑散中化學(xué)成分綠原酸、木犀草苷、木犀草素、人參皂苷Rg1可顯著減少LPS刺激BV2細胞上清液中促炎因子TNF-α、IL-6濃度,從而減輕腦缺血后炎性反應(yīng)損傷。
IL-10可通過抑制多種促炎細胞因子的產(chǎn)生,阻止炎性反應(yīng)級聯(lián)反應(yīng),在減輕炎性反應(yīng)損害方面發(fā)揮重要作用[25-26]。一項關(guān)于成人小膠質(zhì)細胞的研究[27]表明,其極化時吞噬活性和IL-10表達均高于巨噬細胞,表明小膠質(zhì)細胞在促炎的環(huán)境下也能表現(xiàn)出抗炎作用,對神經(jīng)保護具有重要意義。TGF-β1是一種多功能蛋白質(zhì),通過結(jié)合并激活細胞表面的TGF-β1受體,影響多種細胞的生長、分化、凋亡及免疫調(diào)節(jié)等功能。腦缺血后小膠質(zhì)細胞分泌的TGF-β1可促進增生,調(diào)節(jié)炎性反應(yīng)從而發(fā)揮神經(jīng)保護作用[13,28]。另外,也有研究[29]表明,TGF-β1可抑制谷氨酰胺酶活性,致使谷氨酸鹽堆積,毒性增加,加重缺血性神經(jīng)元的損害。前期實驗[30]表明,侯氏黑散給藥14 d可促進MCAO大鼠大腦皮質(zhì)TGF-β1表達,保護和修復(fù)缺血性腦損傷。本實驗結(jié)果顯示,LPS刺激BV2細胞上清液TGF-β1濃度明顯增高,綠原酸、木犀草苷、木犀草素處理組可顯著降低細胞上清液TGF-β1濃度,人參皂苷Rg1處理組可顯著升高細胞上清液TGF-β1濃度,表明風(fēng)藥、補虛藥中化學(xué)成分對TGF-β1的調(diào)節(jié)各有偏重,其保護與損傷作用或與不同時間節(jié)點有關(guān),具體機制仍需更深入的探究。
為進一步探明侯氏黑散化學(xué)成分抑制LPS刺激BV2細胞炎性反應(yīng)的作用機制,本實驗又進一步研究了炎性反應(yīng)相關(guān)的NF-κB信號通路。NF-κB激活是腦缺血后炎性反應(yīng)發(fā)揮損傷作用的基礎(chǔ)。作為炎性反應(yīng)過程中一個重要的轉(zhuǎn)錄因子,一般狀態(tài)下,NF-κB與其抑制蛋白(IκBs)結(jié)合形成三聚體,以無活性狀態(tài)滯留于細胞質(zhì)內(nèi)[31]。腦缺血后,該通路被激活,與NF-κB結(jié)合的IκB磷酸化、泛素化并被蛋白酶體降解,釋放p50/p65入核,促進多種炎性反應(yīng)介質(zhì)的表達[32]。因而許多抗炎治療手段與抑制NF-κB信號通路有關(guān)。研究[16,33]表明,木犀草素作為一個有效的抗炎藥物及潛在神經(jīng)保護劑,可通過減少iNOS表達抑制LPS刺激BV2細胞后促炎介質(zhì)NO、TNF-α的產(chǎn)生,其抗炎作用機制與抑制LPS誘導(dǎo)的NF-κB轉(zhuǎn)錄活化有關(guān)。本實驗結(jié)果表明,綠原酸、木犀草苷、木犀草素、人參皂苷Rg1可通過降低細胞中p-p65、p-IκBα蛋白水平,抑制NF-κB通路活化從而發(fā)揮保護作用。因此,進一步研究腦缺血后炎性反應(yīng)介質(zhì)的作用機制,通過藥物促進其神經(jīng)元保護作用而拮抗其致炎效應(yīng),對腦缺血的防治具有重要指導(dǎo)意義。另外,對侯氏黑散方中多成分及其相互間的作用仍需進一步探索。
[1] Wang Q, Tang X N, Yenari M A. The inflammatory response in stroke[J]. J Neuroimmunol, 2007, 184(1):53-68.
[2] Michelucci A, Heurtaux T, Grandbarbe L, et al. Characterization of the microglial phenotype under specific pro-inflammatory and anti-inflammatory conditions: Effects of oligomeric and fibrillar amyloid-beta[J]. J Neuroimmunol, 2009, 210(1-2):3-12.
[3] 郭安臣, 趙一龍, 蘇芳, 等. 缺血性卒中體外模型建立[J]. 中國卒中雜志, 2015, 10(4):326-330.
[4] Chang J, Yao X, Zou H, et al. BDNF/PI3K/Akt and Nogo-A/RhoA/ROCK signaling pathways contribute to neurorestorative effect of Houshiheisan against cerebral ischemia injury in rats[J]. J Ethnopharmacol, 2016, 194:1032-1042.
[5] 趙暉, 張秋霞, 穆陽. 侯氏黑散對大鼠局灶性腦缺血再灌注損傷后神經(jīng)生長因子表達的影響[J]. 中國實驗方劑學(xué)雜志, 2006, 12(11):43-46.
[6] 張秋霞, 趙暉. 侯氏黑散對大鼠大腦中動脈閉塞模型缺血腦組織Na+~K+~ATP酶及一氧化氮合酶活性的影響[J]. 中國實驗方劑學(xué)雜志, 2008, 5(7):31-33.
[7] 張秋霞, 趙暉, 王蕾, 等. 經(jīng)方侯氏黑散對腦缺血損傷大鼠神經(jīng)可塑性相關(guān)蛋白的影響[J]. 首都醫(yī)科大學(xué)學(xué)報, 2009, 30(3):341-346.
[8] 張秋霞, 趙暉, 張弛, 等. 風(fēng)藥、補虛藥對腦缺血大鼠Caspase-3和PARP表達的影響[J].北京中醫(yī)藥大學(xué)學(xué)報, 2013, 36(4):246-249.
[9] 王海征, 趙暉, 張弛, 等. 風(fēng)藥、補虛藥對腦缺血大鼠側(cè)腦室GFAP、AQP-4表達的影響[J]. 北京中醫(yī)藥大學(xué)學(xué)報, 2013, 36(10):676-679.
[10]Wang H, Wang L, Zhang N, et al. Houshiheisan compound prescription protects neurovascular units after cerebral ischemia[J]. Neural Regen Res, 2014, 9(7):741-748.
[11]姚曉泉, 趙暉, 王海征, 等. 風(fēng)藥、補虛藥對腦缺血大鼠海馬PI3 K/Akt信號通路的影響[J]. 北京中醫(yī)藥大學(xué)學(xué)報, 2015, 38(10):698-702.
[12]FaustinoJ V, Wang X, Johnson C E, et al. Microglial cells contribute to endogenous brain defenses after acute neonatal focal stroke[J]. J Neurosci, 2011, 31(36):12992-13001.
[13]Hanisch U K, Kettenmann H. Microglia: active sensor and versatile effector cells in the normal and pathologic brain[J]. Nat Neurosci, 2007, 10(11):1387-1394.
[14]Tajes M, Ill-Raga G, Palomer E, et al. Nitro-oxidative stress after neuronal ischemia induces protein nitrotyrosination and cell death[J]. Oxid Med Cell Longev, 2013, 2013(6):997-1008.
[15]Turrin N P, Rivest S. Tumor necrosis factor alpha but not interleukin 1 beta mediates neuroprotection in response to acute nitric oxide excitotoxicity[J]. J Neurosci, 2006, 26(1):143-151.
[16]Zhu L H, Bi W, Qi R B, et al. Luteolin inhibits microglial inflammation and improves neuron survival against inflammation[J]. Int J Neurosci, 2011, 121(6):329-336.
[17]Hwang S J, Kim Y W, Park Y, et al. Anti-inflammatory effects of chlorogenic acid in lipopolysaccharide-stimulated RAW 264.7 cells[J]. Inflamm Res, 2014, 63(1):81-90.
[18]王樂樂. 提取分離的人參皂苷Rg1對脂多糖誘導(dǎo)的小膠質(zhì)細胞的炎癥反應(yīng)的影響[D]. 重慶醫(yī)科大學(xué), 2012.
[19]Jickling G C, Sharp F R. Blood biomarkers of ischemic stroke[J]. Neurotherapeutics, 2011, 8(3):349-360.
[20]Klein M A, M?ller J C, Jones L L, et al. Impaired neuroglial activation in interleukin-6 deficient mice[J]. Glia, 1997, 19(3):227-233.
[21]Basic Kes V, Simundic A M, Nikolac N, et al. Pro-inflammatory and anti-inflammatory cytokines in acute ischemic stroke and their relation to early neurological deficit and stroke outcome[J]. Clin Biochem, 2008, 41(16-17):1330-1334.
[22]Rothaug M, Becker-Pauly C, Rose-John S. The role of interleukin-6 signaling in nervous tissue[J]. Biochim Biophys Acta, 2016, 1863(6 PtA):1218-1227.
[23]姜華. 羥基紅花黃色素A對大鼠腦缺血-再灌注損傷的保護作用及機制[J]. 中藥材, 2013, 36(3):462-464.
[24]Zhang Q, Zhao H, Wang L, et al. Effects of wind-dispelling drugs and deficiency-nourishing drugs of Houshiheisan compound prescription on astrocyte activation and inflammatory factor expression in the corpus striatum of cerebral ischemia rats[J]. Neural Regen Res, 2012, 7(24):1851-1857.
[25]Ouyang W, Rutz S, Crellin N K, et al. Regulation and functions of the IL-10 family of cytokines in inflammation and disease[J]. Annu Rev Immunol, 2011,29:71-109.
[26]He Z, Guo Q, Xiao M, et al. Intrathecal lentivirus-mediated transfer of interleukin-10 attenuates chronic constriction injury-induced neuropathic pain through modulation of spinal high-mobility group box 1 in rats[J]. Pain Physician, 2013, 16(5):E615-E625.
[27]Durafourt B A, Moore C S, Zammit D A, et al. Comparison of polarization properties of human adult microglia and blood-derived macrophages[J]. Glia, 2012, 60(5):717-727.
[28]Pál G, Vincze C, Renner é, et al. Time course, distribution and cell types of induction of transforming growth factor betas following middle cerebral artery occlusion in the rat brain[J]. PLoS One, 2012, 7(10):e46731.
[29]Lester D S, Pine P S, Delnomdedieu M, et al. Virtual neuropathology: three-dimensional visualization of lesions due to toxic insult[J]. Toxicol Pathol, 2000, 28(1):100-104.
[30]張秋霞, 趙暉. 侯氏黑散對MCAO大鼠大腦皮質(zhì)TGF-β1bFGF蛋白表達的影響[J]. 遼寧中醫(yī)雜志, 2007, 34(2):238-240.
[31]Hayden M S, Ghosh S. NF-κB, the first quarter-century: remarkable progress and outstanding questions[J]. Genes & Dev, 2012, 26(3):203-234.
[32]Hanamsagar R, Hanke M L, Kielian T. Toll-like receptor (TLR) and inflammasome actions in the central nervous system[J]. Trends Immunol, 2012, 33(7):333-342.
[33]Zhu L, Bi W, Lu D, et al. Regulation of ubiquitin-specific processing protease 8 suppresses neuroinflammation[J]. Mol Cell Neurosci, 2015,64:74-83.
編輯 陳瑞芳
Effects of chemical components of HSHS on the balance of inflammatory cytokines in LPS-stimulated BV2 cells
Chang Jiahui1, Zhao Hui1, Wang Lei1, Zhang Chi2, Lu Yue1, Zhang Qiuxia1*
(1.CollateralDiseaseResearchUnit,TCMSchool,CapitalMedicalUniversity,Beijing100069,China; 2.JournalCenter,BeijingUniversityofChineseMedicine,Beijing100029,China)
Objective To investigate the influence of chlorogenic acid, cynaroside, luteolin, ginsenoside Rg1 on expression of inflammatory cytokines. Methods The experiment was divided into six groups: control, model, chlorogenic acid, cynaroside, luteolin and ginsenoside Rg1 groups. The mimic ischemia injured microglia model was induced by LPS. The cyto-activity was detected via cell count kit. The NO content was determined by Griess Reagent. Contents of TNF-α、IL-6、IL-10 and TGF-β1were detected by ELISA.The expression levels of p-p65 and p-IκBα were detected by Western blotting. Results Compared with those results of model group, chlorogenic acid, cynaroside, luteolin and ginsenoside Rg1 groups could significantly inhibit the release of NO, and decrease the content of TNF-α and IL-6, ginsenoside Rg1 markedly elevated the TGF-β1level without influencing the cell survival. Chlorogenic acid, cynaroside, luteolin and ginsenoside Rg1 groups could decrease the expression of p-p65, p-IκBα. Conclusion The findings demonstrated that chlorogenic acid, cynaroside, luteolin and ginsenoside Rg1 played regulating roles in balancing ischemia injured microglia homeostasis via promoting anti-inflammatory cytokines as well as inhibiting the inflammatory cytokines. The therapeutic roles in the inflammatory reaction of cerebral ischemia which perhaps worked through the activation of NF-κB signaling pathway.
Houshiheisan; chlorogenic acid; cynaroside; luteolin; ginsenoside Rg1; microglia; inflammatory cytokines; NF-κB signaling pathway
國家自然科學(xué)基金(81373526),北京市自然科學(xué)基金(7102014, 7122018),北京市屬高等學(xué)校高層次人才引進與培養(yǎng)計劃-長城學(xué)者(CIT&TCD20140329)。This study was supported by National Natural Science Foundation of China (81373526), Natural Science Foundation of Beijing (7102014, 7122018), Program for Changcheng Scholars of the Importation and Development of High-Caliber Talents Project of Beijing Municipal Institutions (CIT&TCD20140329).
時間:2017-04-13 20∶01
http://kns.cnki.net/kcms/detail/11.3662.R.20170413.2001.044.html-
10.3969/j.issn.1006-7795.2017.02.013]
R289.5
2016-12-06)
*Corresponding author, E-mail:zqx26@ 163.com

