雙嘧達莫對阿爾茨海默病大鼠學習記憶的改善作用及機制研究
鐘淑娟,鄭思超,李詠梅,黎行山,蘇瑞真,丘秀玉
(廣州醫科大學附屬第五醫院,廣東 廣州 510700)
·實驗研究·
雙嘧達莫對阿爾茨海默病大鼠學習記憶的改善作用及機制研究
鐘淑娟,鄭思超△,李詠梅,黎行山,蘇瑞真,丘秀玉
(廣州醫科大學附屬第五醫院,廣東 廣州 510700)
目的探討雙嘧達莫對阿爾茨海默病(Alzheimer′s disease,AD)的防治作用及其作用機制。方法 海馬注射α-淀粉樣蛋白(Aα25-35)建立大鼠AD模型,選用敞箱試驗、Morris水迷宮試驗和避暗試驗評價雙嘧達莫的抗AD療效;采用酶聯免疫吸附法(ELISA)檢測海馬環磷酸腺苷(cAMP)水平;采用熒光實時定量聚合酶鏈反應(RT-PCR)、免疫印跡法分別檢測大鼠海馬腦源性神經營養因子(Brainderived neurotrophic factor,BDNF)、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白細胞介素1α(interleukin-1α,IL-1α)、白細胞介素6(interleukin-6,IL-6)mRNA表達和磷酸化環磷腺苷效應元件結合蛋白(CREB)、核因子(NF)-αB p65蛋白的表達情況。結果 雙嘧達莫連續給藥對大鼠的水平運動得分和垂直運動得分均無明顯影響,能顯著增加AD大鼠平臺象限的游泳時間和平臺穿越次數,明顯延長AD大鼠進入暗室潛伏期;分子生物學檢測結果顯示,與假手術組比較,Aα25-35注射大鼠海馬cAMP含量、p-CREB蛋白表達、BDNF mRNA表達顯著減少,NF-αB p65蛋白及TNF-α,IL-1α,IL-6的mRNA表達則明顯增加,而雙嘧達莫均能不同程度逆轉Aα25-35引起的變化。結論 雙嘧達莫對AD大鼠的學習記憶有顯著改善作用,其作用機制可能與激活海馬cAMP/CREB/BDNF信號通路和抑制NF-αB介導的炎性反應有關。
雙嘧達莫;阿爾茨海默病;α-淀粉樣蛋白;學習記憶;作用機制
阿爾茨海默病(Alzheimer′s disease,AD)是一種復雜性的神經系統退行性疾病,其臨床表現有進行性的學習記憶力減退、認知障礙、行為異常等[1]。血小板抑制劑雙嘧達莫具有抗凝等多種生理功能,臨床常與低劑量阿司匹林聯用預防腦中風[2]。有研究顯示,雙嘧達莫能改善東莨菪堿造成的斑馬魚學習記憶力障礙[3],提示其在防治AD中可能有積極作用。而關于雙嘧達莫對β-淀粉樣蛋白(Aβ)造成的病理性變化及其在AD中的可能性應用仍需進一步研究。本研究中擬采用Aβ構建大鼠癡呆模型,以觀察雙嘧達莫對AD的干預效果及可能的作用機制,為該藥防治AD提供依據。現報道如下。
1 材料與方法
1.1 動物、試藥與儀器
1.1.1 試驗動物
健康雄性 SD成年大鼠 60只,SPF級,體質量(300±15)g,購自廣東省實驗動物中心,動物合格證號為SCXK(粵)2014-00114。所有大鼠均正常飼養,自由飲水、進食,飼養溫度24~26℃,相對濕度40% ~60%。1.1.2 試藥
雙嘧達莫(dipyridamole,DIP)、鹽酸多奈哌齊(donepezil,Don)、Aβ25-35均購于美國Sigma-Aldrich公司;水合氯醛(天津科密歐化學試劑有限公司);磷酸化環磷腺苷效應元件結合蛋白(CREB)、NF-κB p65兔單抗、二抗羊抗兔均購于Cell Signaling Technology公司;cAMP酶聯免疫吸附法(ELISA)檢測試劑盒(上海生物工程股份有限公司);熒光定量 PCR試劑盒(美國Promega生物技術有限公司);引物由英濰捷基(上海)貿易有限公司合成。
1.1.3 儀器
單臂腦立體定位儀(深圳瑞沃德生命科技有限公司);注射泵(瑞典CMA公司);Morris水迷宮(中國醫學科學院藥物研究所);避暗箱(中國醫學科學院藥物研究所);多功能酶標儀 (瑞士Tecan公司);Bio-Rad免疫印跡系統(美國Bio-Rad公司);Mx3000P型實時定量PCR儀(美國Stratagene公司)
1.2 試驗方法
1.2.1 動物分組、造模與給藥
分組:將60只成年大鼠隨機分為假手術組,模型組,雙嘧達莫低(2.5 mg/kg)、中(5 mg/kg)、高(10 mg/kg)劑量組,以及多奈哌齊片陽性藥(1 mg/kg)組,各10只。
造模:大鼠腹腔注射水合氯醛麻醉后固定于腦立體定位儀上,頭頂部去毛,75%乙醇消毒,切開頭頂部皮層,找到前囪并以其為坐標原點,海馬坐標(AP-3.5 mm,ML±2.0 mm,DV-3.0 mm)注射Aβ25-35或無菌生理鹽水2 μL,注射速率為0.5 μL/min,注射結束后留針5 min使溶液充分彌散和防止退針時溶液反流,各組動物手術后消毒并縫合切口皮膚。
給藥:各組大鼠Aβ25-35注射后24 h給予相應劑量藥物,假手術組和模型組分別給予等體積生理鹽水,每天1次,連續灌胃14 d后開始行為學評價。行為學測試期間,每天給藥30 min后再進行試驗。
1.2.2 敞箱試驗
給藥14 d后進行敞箱試驗,以評價造模及藥物對大鼠自主活動的影響。試驗前,將大鼠移至實驗室適應環境2 h。測試時,將大鼠放入75 cm×75 cm的正方形敞箱中央位置,觀察大鼠在5 min內穿越格子次數和直立次數,分別代表水平運動得分和垂直運動得分。試驗結束后,清理每只大鼠箱底糞便,并用10%乙醇清潔底面,電吹風吹干,避免影響下一只大鼠的試驗。
1.2.3 Morris水迷宮試驗
在直徑為120 cm、深度為50 cm的水池中放置直徑為10 cm的平臺,試驗期間維持水溫為(21±2)℃。人為將水池平均劃分為4個象限,將大鼠從入水點放入水池中,借助水池周圍環境的提示,找到隱藏的平臺,并讓大鼠在平臺上停留20 s。若大鼠在90 s內仍不能找到平臺,實驗者將其引至平臺并停留20 s。每只大鼠每天分別從4個入水點入水,學習如何順利找到隱藏平臺,連續5 d。第6天撤去水迷宮中的平臺,固定1個入水點,影像跟蹤系統記錄大鼠在90 s內在原有平臺象限探索的時間和穿越平臺的次數。
1.2.4 避暗試驗
水迷宮結束后第2天開始避暗試驗。第1天進行適應訓練,試驗裝置不通電,將大鼠放入明箱并背向暗箱,記錄大鼠在5 min內第1次進入暗箱的時間。第2天,試驗裝置通電,將大鼠放在暗箱,背靠洞口,當大鼠被電刺激后3 s,立即取出,訓練結束。第3天進行記憶保留能力檢測,試驗裝置不通電,將大鼠放在明箱,背靠洞口,記錄5 min內大鼠進入暗箱的時間,即為潛伏期。
1.2.5 大鼠海馬中環磷酸腺苷(cAMP)含量檢測
海馬組織按質量體積比1∶5加入RIPA裂解液(含蛋白酶抑制劑)冰上超聲勻漿后,4℃,12 000 r/min離心10 min,收集上清液。根據 ELISA試劑盒步驟測定cAMP的含量。
1.2.6 大鼠海馬相關mRNA和蛋白表達檢測
取海馬組織進行超聲裂解后,收集上清液,分別進行RNA和蛋白的提取。實時定量聚合酶鏈反應(RTPCR)熒光定量檢測腦源性神經營養因子(BDNF)、腫瘤壞死因子-α(TNF-α)、白細胞介素1β(IL-1β)和白細胞介素6(IL-6)mRNA的變化;聚丙烯酰胺凝膠電泳(SDS-PAGE)進行 Western blot試驗,檢測磷酸化CREB和NF-κB p65蛋白水平的變化。
1.3 統計學處理
采用SPSS 13.0統計學軟件進行分析。組間兩兩比較采用 LSD-t分析法。試驗結果以均數±標準差(±s)表示。P<0.05為差異有統計學意義。
2 結果
2.1 對自主活動的影響
敞箱試驗結果見圖1。可見,各組大鼠間的水平運動得分和垂直運動得分比較,差異均無統計學意義(P>0.05),說明手術及各組藥物對大鼠的自主活動均無影響。
圖1 雙嘧達莫對AD大鼠敞箱試驗得分的影響(n=10)
2.2 Morris水迷宮試驗
與假手術組相比,模型組大鼠原有平臺象限游泳時間和穿越平臺次數均顯著減少(P<0.01),提示Aβ25-35注射成功建立AD模型。與模型組相比,給予雙嘧達莫或多奈哌齊均可增加大鼠平臺象限的游泳時間和穿越平臺次數(見圖2)。其中,中、高劑量雙嘧達莫顯著增加AD大鼠在平臺象限的游泳時間(P<0.01),高劑量雙嘧達莫顯著增加AD大鼠穿越平臺的次數(P<0.01)。
2.3 避暗試驗
在適應訓練中,各組大鼠進入暗室潛伏期的差異均無顯著性(P>0.05),表明各組大鼠之間喜暗及鉆洞的習性無顯著性差異。經足底電擊24 h后,與假手術組相比,模型組大鼠進入暗室的潛伏期明顯縮短(P<0.01);給予雙嘧達莫或多奈哌齊均可延長大鼠進入暗室的潛伏期,其中,中、高劑量雙嘧達莫效果顯著。詳見圖3。
2.4 對海馬組織cAMP水平的影響
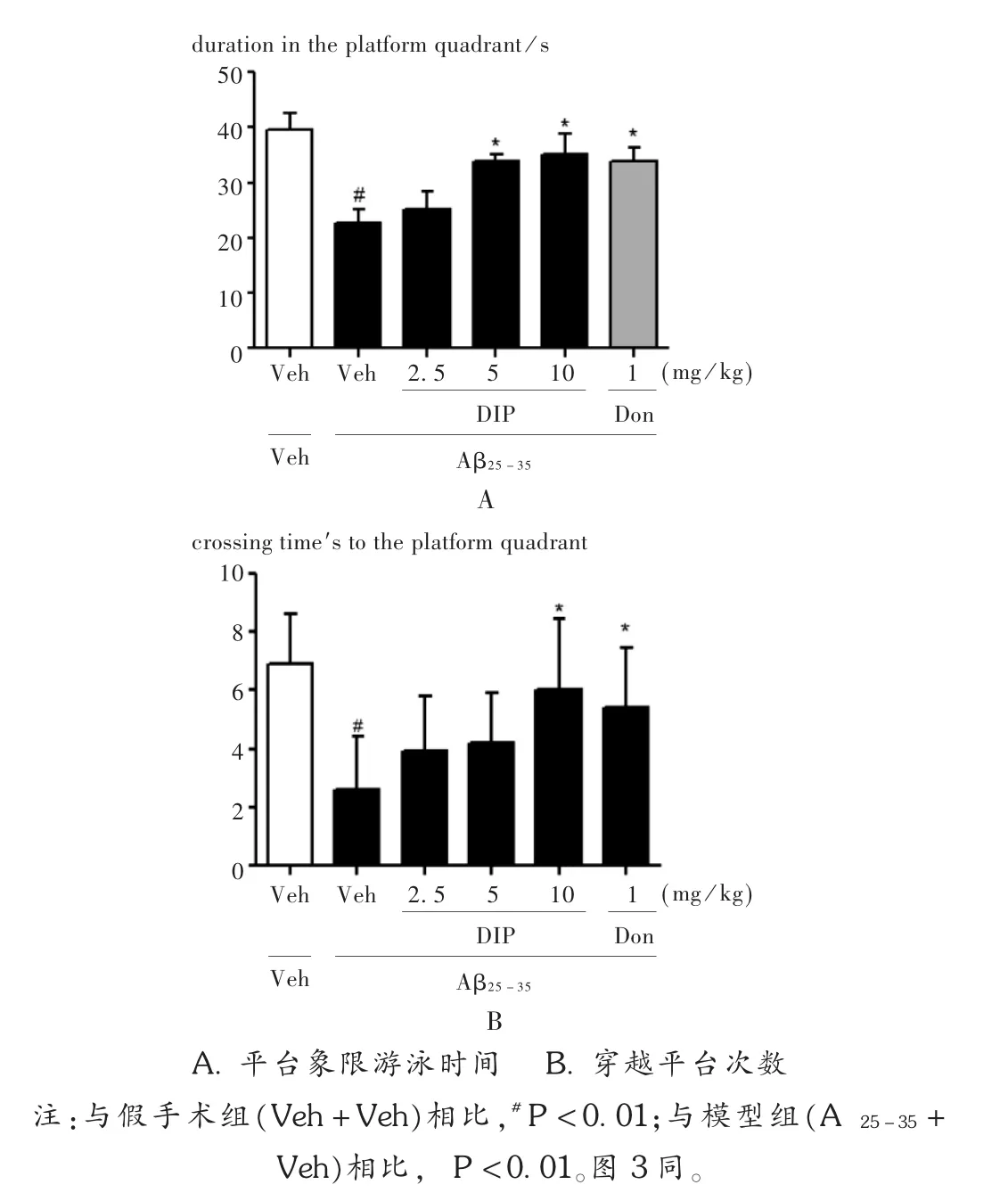
圖2 雙嘧達莫對AD大鼠在Morris水迷宮中平臺象限游泳時間和穿越平臺次數的影響(n=10)
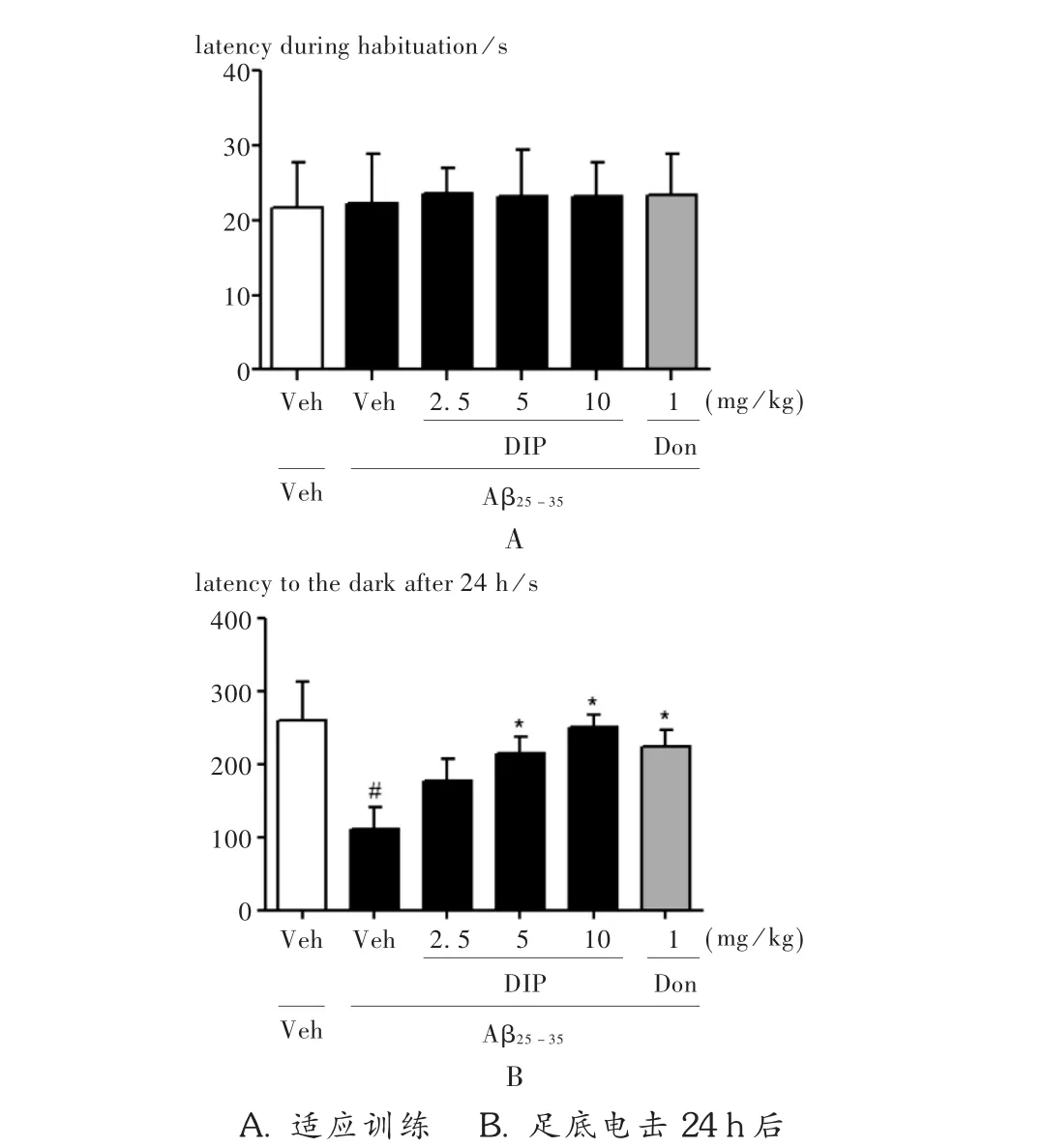
圖3 雙嘧達莫對AD大鼠避暗試驗進入暗室潛伏期的影響(n=10)
ELISA試驗結果顯示,與假手術組相比,Aβ25-35注射顯著降低大鼠海馬內cAMP的水平(P<0.01)。雙嘧達莫連續給藥增加大鼠海馬內cAMP水平,且增加呈劑量依賴性,其中,中、高劑量組的效果與模型組比較,差異有統計學意義(P<0.01,P<0.05)。詳見圖4。
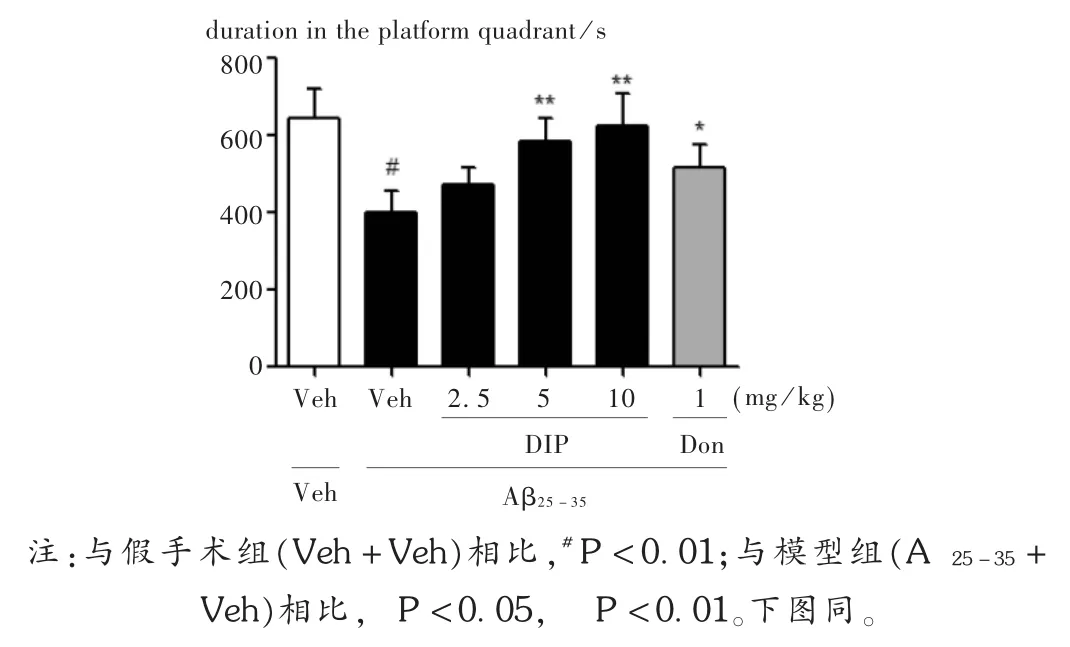
圖4 雙嘧達莫對AD大鼠海馬內cAMP水平的影響(n=4)
2.5 對海馬內磷酸化CREB和NF-αB p65蛋白表達的影響
由于雙嘧達莫對cAMP具有明顯的調控作用,而p-CREB和NF-κB p65為下游重要因子,故采用免疫印跡法檢測兩者在海馬內的表達情況。由圖5可見,與假手術組比較,模型組大鼠海馬內p-CREB蛋白表達明顯降低,而NF-κB p65蛋白的表達則顯著上升(P<0.01)。說明Aβ25-35對cAMP/CREB通路產生了抑制作用,同時激活了NF-κB通路。不同劑量的雙嘧達莫均呈現一定程度的逆轉作用,其中中、高劑量雙嘧達莫可顯著增加p-CREB的蛋白表達,減少NF-κB p65的蛋白表達(P<0.05,P<0.01)。
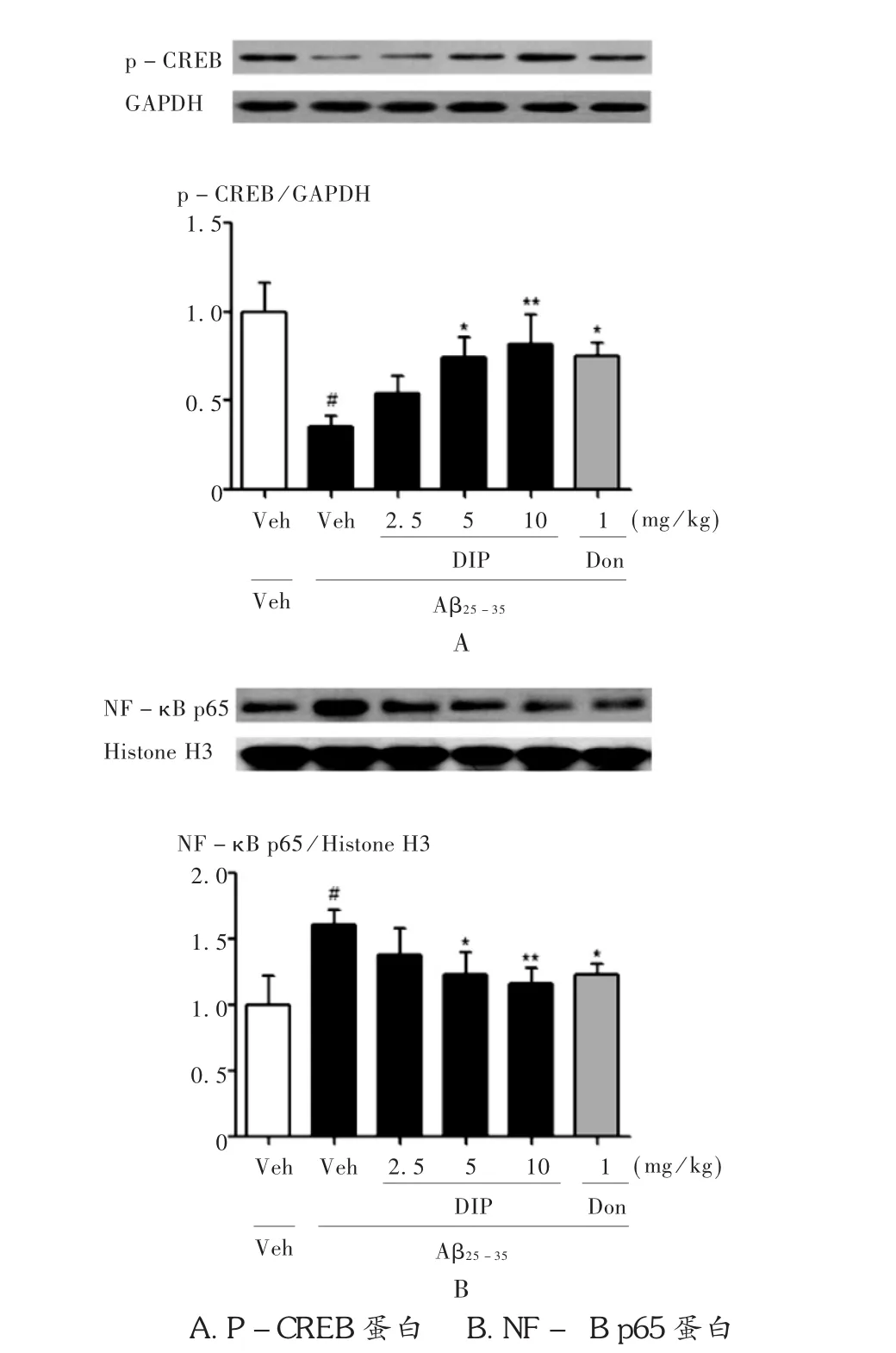
圖5 雙嘧達莫對AD大鼠海馬內p-CREB和NF-αB p65蛋白表達的影響(n=3)
2.6 對海馬內 BDNF,TNF-α,IL-1α和 IL-6的mRNA表達的影響
RT-PCR試驗結果顯示,與假手術組比較,模型組大鼠海馬內BDNF的mRNA表達水平明顯下降,炎癥相關因子TNF-α,IL-1β,IL-6 mRNA的表達則顯著增加,詳見圖6。與模型組相比,雙嘧達莫各劑量均能顯著增加AD大鼠海馬內BDNF mRNA的表達(P<0.05,P<0.01),對炎癥因子具有不同程度的抑制作用。其中,雙嘧達莫中、高劑量可顯著減少大鼠海馬內TNF-α 和IL-1β mRNA水平(P<0.05,P<0.01),高劑量對IL-6 mRNA表達有明顯的抑制作用(P<0.05)。
3 討論
本研究中首先采用經典的Morris水迷宮試驗和避暗試驗對雙嘧達莫進行藥效學評價。試驗結果表明,雙嘧達莫能有效改善Aβ25-35造成的大鼠學習記憶障礙。海馬為與學習記憶功能高度相關的腦區[4],通過分子生物學方法試驗進一步發現,雙嘧達莫增強大鼠學習記憶力的機制可能與激活海馬cAMP/CREB/BDNF通路和抑制NF-κB的抗炎作用有關。
針對AD的發病機制,目前公認研究得最透徹的是β-淀粉樣蛋白假說[5]。基于該假說開發的經典AD動物模型一般采用Aβ進行側腦室或海馬注射[6]。本研究中通過海馬注射Aβ成功建立了AD大鼠模型,行為學試驗結果表現為,Morris水迷宮中大鼠穿越平臺次數和原有平臺象限探索時間減少,避暗試驗大鼠進入暗室潛伏期縮短。雙嘧達莫連續給藥2周后(行為學期間保持給藥)可有效逆轉上述指標的下降,表明雙嘧達莫具有逆轉AD大鼠學習記憶功能損傷的作用。
雙嘧達莫為嘧啶吡啶類衍生物,作為非選擇性磷酸二酯酶(PDE)抑制劑和核苷轉運體抑制劑,具有抗血小板及舒張血管的雙重特性,臨床常與低劑量阿司匹林聯用于腦卒中的二級預防[2]。腦卒中患者恢復期常會出現認知或記憶障礙的后遺癥,雙嘧達莫增強學習記憶功能的發現是對腦卒中二次預防策略的重要補充研究。雙嘧達莫不僅可抑制細胞內腺苷的攝取,還可抑制PDE對cAMP的水解,提高細胞內cAMP的水平,激活其下游相關信號通路[7]。有研究顯示,cAMP/CREB/BDNF通路與學習記憶密切相關,該通路的缺失或受損可能參與了AD的發生[8]。而關于雙嘧達莫用于神經系統退行性疾病(尤其是AD)的研究報道較少。
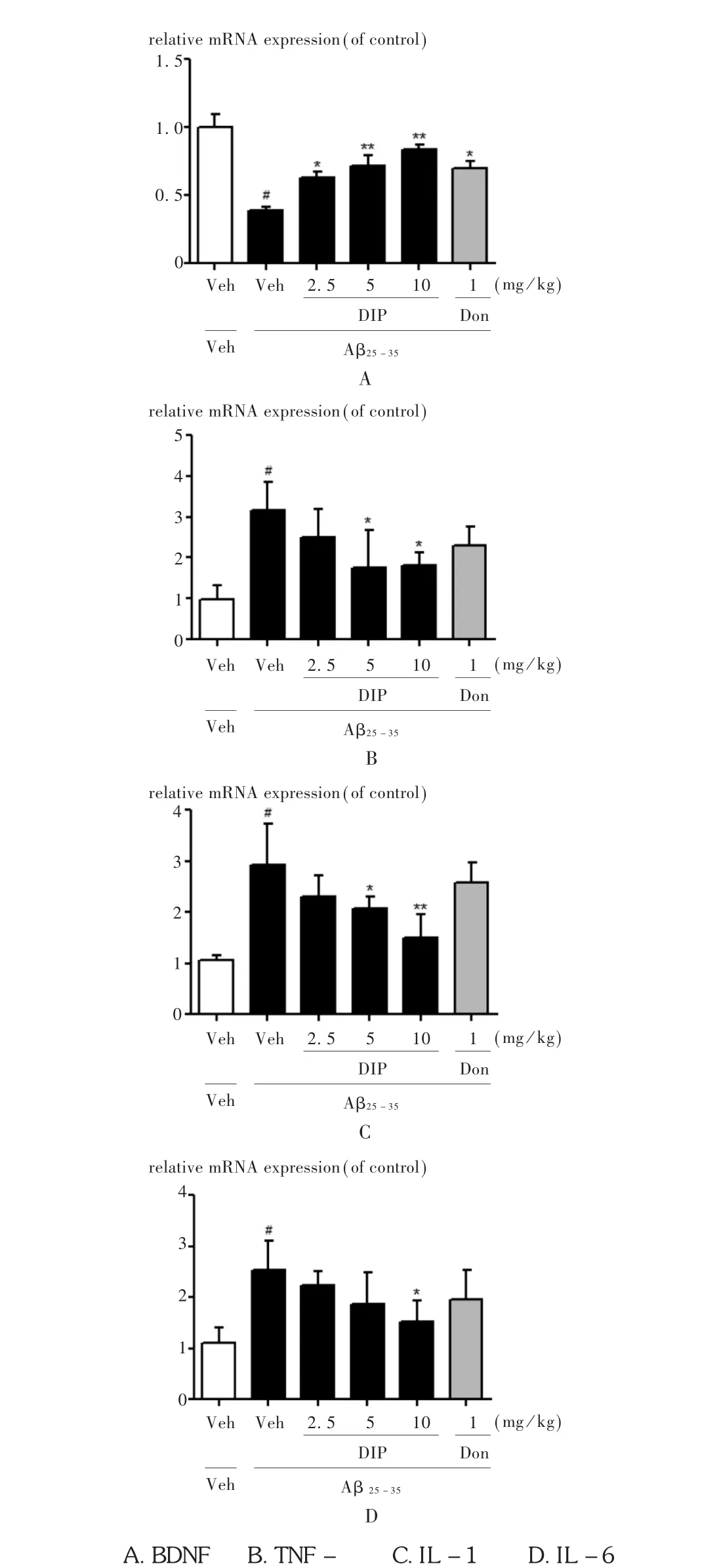
圖6 雙嘧達莫對AD大鼠海馬內相關mRNA表達水平的影響(n=3)
本研究中發現,雙嘧達莫可增加海馬內cAMP水平,進而通過磷酸化CREB,介導BDNF的轉錄,可能是雙嘧達莫增加學習記憶最重要的機制之一。隨著對AD發病機制的研究,有研究者提出新的理論,認為AD患者大腦神經元的破壞不是簡單的細胞外Aβ沉淀,大腦慢性炎性反應是發病過程的一個關鍵環節[9]。雙嘧達莫抑制大鼠海馬內NF-κB的活化,并在不同程度上對致炎因子TNF-α,IL-1β,IL-6有較好的抑制作用。因此,雙嘧達莫的抗神經炎癥效應可能是其延緩AD進展的另一作用機制。
綜上所述,雙嘧達莫在Aβ誘導的AD動物模型上具有顯著增強學習記憶功能的作用,其作用機制可能與通過激活海馬cAMP/CREB/BDNF信號通路和抑制NF-κB的核轉錄有關。
[1]Vital TM,Hernandez SS,Stein AM,et al.Depressive symptoms and level of physicalactivity in patients with Alzheimer′s disease[J].Geriatr Gerontol Int,2012,12(4):637-642.
[2]Li X,Zhou G,Zhou S,et al.The efficacy and safety of aspirin plus dipyridamole versus aspirin in secondary prevention following TIA or stroke:a meta-analysis of randomized controlled trials[J].J Neurol Sci,2013,332(1-2):92-96.
[3]Bortolotto JW,Melo GM,Cognato GD,et al.Modulation of adenosine signaling prevents scopolamine-induced cognitive impairment in zebrafish[J].Neurobil Learn Mem,2015,118:113-119.
[4]Elfman KW,Aly M,Yonelinas AP.Neurocomputational account of memory and perception:Thresholded and graded signals in the hippocampus[J].Hippocampus,2014,24(12):1672-1686.
[5]Barage SH,Sonawane KD.Amyloid cascade hypothesis:Pathogenesis and therapeutic strategies in Alzheimer′s disease[J].Neuropeptides,2015,52:1-18.
[6]Bergin DH,Jing Y,Zhang,H,et al.A single intracerebroventricular Aα25-35 infusion leads to prolonged alterations in arginine metabolism in the rat hippocampus and prefrontal cortex[J].Neuroscience,2015,298:367-379.
[7]Liu Y,Oh SJ,Chang KH,et al.Antiplatelet effect of AMP-activated protein kinase activator and its potentiation by the phosphodiesterase inhibitor dipyridamole[J].Biochemical Pharmacology,2013,86(7):914-925.
[8]Lee D.Global and local missions of cAMP signaling in neural plasticity,learning,and memory[J].Front Pharmacol,2015,6:161.
[9]Eikelenboom P,Veerhuis R,Scheper W,et al.The significance of neuroinflammation in understanding Alzheimer′s disease[J].J Neural Transm(Vienna),2006,113(11):1685-1695.
Improvement Effects and Mechanism of Dipyridamole on Learning and M emory in Rats with Alzheimer′s Disease
Zhong Shujuan,Zheng Sichao,Li Yongmei,Li Hangshan,Su Ruizhen,Qiu Xiuyu
(The Fifth Affiliated Hospital of Guangzhou Medical University,Guangzhou,Guangdong,China 510700)
Objective To investigate the preventive and therapeutic effects of Dipyridamole in Alzheimer′s disease(AD)and the mechanism of action.M ethods The AD model was developed by mircoinjection of Aβ25-35into hippocamups of rats.Open field test,Morris water maze test and step-through passive avoidance test were used to evaluate the anti-dementia effects of Dipyridamole.The hippocampal cAMP content were detected by using enzyme linked immunosorbent assay(ELISA).The mRNA expression of BDNF,TNF-α,IL-1β and IL-6 in hippocampus were examined by RT-PCR.The protein expression of p-CREB and NF-κB p65 were examined by immunoblotting test(IBT).Results Dipyridamole continuously treatment didn′t affect the crossing scores and rearing scores in rats.In the Morris water maze test,it evidently increased the swimming time and crossing times in platform quadrant in AD rats,and it significantly prolonged latency to the dark compartment in AD rats.The biochemical resutls indicated that compared with the sham group,cAMP contents,p-CREB expression and BDNF mRNA decreased significantly in Aβ25-35injected rats,while the NF-κB p65 expression,TNF-α mRNA,IL-1β mRNA and IL-6 mRNA increased significantly.The changes of Aβ25-35could be reversed at the different levels by Dipyridamole.Conclusion Dipyridamole can significantly enhance learning and memory function in AD rats,the mechanism may be related to the activation of cAMP/CREB/BDNF signaling pathway and inhibition of NF-κB mediated inflammatory response.
Dipyridamole;Alzheimer′s disease;β-amyloid;learning and memory;mechanism of action
R965.2;R971
A
1006-4931(2017)06-0020-05
2016-12-08)
10.3969/j.issn.1006-4931.2017.06.006
鐘淑娟(1975-),女,大學本科,主管藥師,研究方向為神經藥理學,(電話)020-82288145(電子信箱)843118547@qq.com。
△通訊作者:鄭思超,博士研究生,研究方向為雜環化合物的多組分合成及其活性,(電話)020-82288145(電子信箱)sichaozheng@126.com。

