天麻素制劑的研究概況
欽富華+蔡雁+計竹娃
[摘要] 天麻素片劑、注射劑等傳統制劑的生物利用度和腦靶向性低,臨床給藥劑量大且給藥頻繁,患者耐受性差。天麻素速釋、緩控釋及鼻腔給藥等新制劑的研究開發,為解決臨床給藥過程中存在的缺陷,提高藥物的生物利用度及腦靶向性提供了新的理論支持和技術支撐。
[關鍵詞] 天麻素;理化性質;制劑;鼻腔給藥
[中圖分類號] R282 [文獻標識碼] A [文章編號] 1673-7210(2017)03(a)-0032-04
Research progress on pharmaceutical preparation of Gastrodin
QIN Fuhua1 CAI Yan2 JI Zhuwa1
1.School of Pharmaceutics Engineering, Zhejiang Pharmaceutical College, Zhejiang Province, Ningbo 315100, China; 2.Department of Pharmacy, the Ninth Hospital of Ningbo City, Zhejiang Province, Ningbo 315020, China
[Abstract] The large dosage and frequent use of Gastrodin traditional preparation with low bioavailability and brain targeting has led to poor patient tolerance. Research and development of quick release, controlled release and intranasal drug delivery system of Gastrodin provide theoretical and technical support for improving the bioavailability and brain targeting of drug, so as to solve the problems in clinic medication.
[Key words] Gastrodin; Physical and chemical properties; Pharmaceutical preparation; Intranasal drug delivery
天麻素為我國傳統名貴中藥材天麻的主要有效成分,化學名為4-羥甲基苯-β-D吡喃葡萄糖苷,又名天麻苷。天麻素藥理作用廣泛,具有鎮痛、降壓、鎮靜、抗驚厥、保護神經、增強免疫等諸多作用。其中對中樞神經系統的作用尤為引人關注,大量研究表明,天麻素可恢復大腦皮質興奮與抑制過程間的平衡失調,能增加腦血流量并保護腦缺血/再灌注損傷,對神經性疼痛有明顯抑制作用以及對帕金森病與老年性癡呆癥具有防治作用等[1]。臨床上多用于暈眩、頭痛、神經衰弱、椎基底動脈供血不足、前庭神經元炎等癥的治療[2-4]。天麻素毒性低,消除快,不良反應小,一直以來作為神經系統疾病防治的有效藥物之一,藥用價值較高。目前臨床上主要的劑型為片劑、膠囊和注射劑,這些傳統制劑在給藥過程中存在給藥劑量大、給藥頻繁、藥物靶向性差等缺陷。近年來,天麻素新劑型的開發成為研究的熱點,研究人員利用新的制劑技術對天麻素注射劑、口服速釋、緩控釋制劑及鼻腔給藥制劑等多方向進行了探索,本文就天麻素新制劑的研究狀況進行總結概括。
1 天麻素的理化及生物學性質
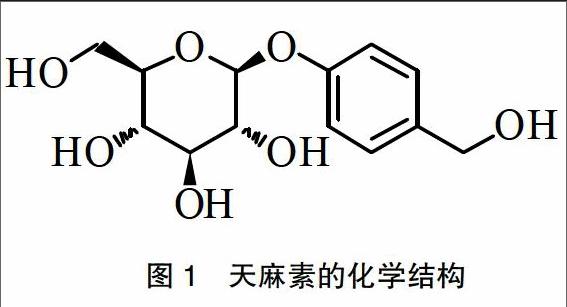
藥物的理化性質及穩定性,在制劑處方前設計中具有非常重要的意義。天麻素為白色針狀結晶,熔點154~156℃,分子量為286,結構中含有醇羥基和酚羥基(圖1),屬于親水性小分子藥物。
研究表明,天麻素易溶于純化水、pH 1.2的鹽酸及不同pH的磷酸鹽緩沖液(0.3~0.4 mg/mL),易溶于甲醇,微溶于丙酮、異丙醇,在氯仿中則幾乎不溶[5]。天麻素的溶解度滿足制劑開發是對普通制劑及緩控釋制劑溶解度的要求,且穩定性良好,有利于其制劑的開發。但是其脂溶性差,在很大程度上影響了藥物的吸收,降低了生物利用度。天麻素的正辛醇-水分配系數(lgP)隨pH增加而呈現增大趨勢,但總體偏小,滲透性較差,其透膜的能力成為吸收的主要障礙之一。
隨著研究的不斷深入,天麻素在動物及人體內的動力學過程的報道也越來越多。為天麻素制劑的開發提供了更充分的依據。李丁等[6]采用大鼠在體循環方法研究天麻素在不同濃度和不同腸段下的吸收情況,結果表明,在10.0~200.0 mg/L范圍內天麻素在各小腸段的吸收速率無顯著性差異,吸收呈現一級動力學過程,機制為被動擴散。楊園等[7]則采用灌胃的方式給藥后對天麻素在大鼠體內的藥動學進行研究,結果顯示,在低劑量(50 mg/kg)、中劑量(100 mg/kg)時,藥動學參數無顯著差異,天麻素大鼠體內符合線性動力學過程,而高劑量(200 mg/kg)時,半衰期(t1/2)、平均駐留時間(MRT)等發生變化,表現出非線性動力學特征。給家兔、大鼠和狗靜脈注射天麻素后,體內藥動學符合二室模型。天麻素靜注后人體藥動學顯示,藥-時間曲線經擬合后符合二室模型,達峰時間(tmax)和t1/2分別為1.0、4.16 h,藥物分布速度快,主要分布于細胞外液[8]。口服天麻素膠囊的藥動學研究結果顯示,天麻素在人體內的吸收分布較為迅速,能快速起效,與前述的研究結果基本一致[9]。
2 天麻素新制劑
2.1 注射劑
天麻素注射液臨床的給藥途徑為肌內注射或靜脈滴注。注射劑在生產過程中常因原輔料的質量、生產環境與生產工藝控制不嚴等導致可見異物不合格,使用過程中出現各種不良反應,因此如何避免可見異物特別是內源性可見異物的出現是天麻素注射劑制備的關鍵。沈紅賓等[10]公開了一種天麻素注射液及其制備方法,注射液中加入金屬離子絡合劑,避免了天麻素的氧化;加入穩定劑氯化鈉,避免了注射液中天麻素的析出,保證了天麻素注射液的穩定性。與之類似,葛海濤等[11]公開的專利中采用金屬離子絡合劑、穩定劑及緩沖液三者來聯用更好地提高了天麻素注射劑的穩定性。而陳彥等[12]則采用新型的制劑技術將天麻素包封于多相脂質體中提高其穩定性。該發明以大豆磷脂酰肌醇、膽固醇、吐溫80、聚氧乙烯40氫化蓖麻油海藻糖和乙二胺四乙酸二鈉(EDTA-2Na)組成多相脂質體,天麻素的包封率高,脂質體粒徑小且分布均勻,制劑的穩定性良好,符合靜脈注射的要求。
除了解決天麻素注射液的穩定性問題外,研究人員對提高注射劑的腦靶向性進行了進一步的探索。研究者基于天麻素的腦部及中樞神經系統的藥理活性及體內特點,利用脂質體為載體,制備了天麻素納米脂質體注射液,以期提高其腦靶向性。梅華[13]采用逆向蒸發法制備的天麻素納米脂質體,外形圓整,平均粒徑為77 nm,體外釋藥具有明顯的緩釋性。黃靜等[14]制備了天麻素納米脂質體并進行了腦靶向性的初步評價。經優化后的脂質體平均粒徑為(97.52±0.79) nm,Zeta電位為(-1.36±0.7) mV,平均包封率為(29.8±0.14)%,體外釋藥符合一級速率方程。小鼠尾靜脈給藥后,天麻素納米脂質體與同劑量的天麻素注射液相比,其靶向指數> 1,腦靶向作用顯著提高。
2.2 口服速釋制劑
口服速釋制劑是指服用后能快速崩解或迅速溶解的固體制劑,因速崩、速溶而具有吸收快、生物利用度高、服用方便等特點,成為制劑研究開發的熱點之一。天麻素速釋制劑的開發可提高老年患者的用藥順應性以及天麻素的口服生物利用度提供新的思路和選擇。
2.2.1 口腔崩解片 口腔崩解片新型的速釋片劑類型,可在無水或僅有少量水存在的條件下于口腔中快速崩解,隨吞咽動作進入消化道而吸收。與普通片相比,有服用方便、吸收快、生物利用度高等優點,尤其適用于嬰幼兒、老年和吞服困難的患者。有研究采用粉末直接壓片制備了天麻素口腔崩解片并建立其質量控制方法[15]。研究以口感為評價指標,采用單因素法優選矯味劑,以崩解時限為指標,正交試驗篩選天麻素口腔崩解片最優處方,制備的崩解片體內外崩解時間相關性良好,均在20 s以內,2 min溶出度達98.0%。王錦剛等[16]公開了一種天麻素口腔崩解片及制備方法,以丙烯酸樹脂和乙基纖維素為包衣材料制備天麻素微囊;甘露醇用聚維酮(PVP-K30)作黏合劑制成顆粒,兩者混合后加入低取代羥丙基纖維素(L-HPC)、交聯聚維酮(PVPP)等崩解劑及其他組分混勻,壓片。所得崩解片口感良好,硬度合適,在1 min內能完全崩散。
2.2.2 分散片 分散片是指在水中能迅速崩解均勻分散的片劑,它結合了片劑和液體制劑的特點,相比普通片劑有更高的生物利用度。經嘉[17]對天麻素分散片進行了實驗研究,優化得天麻素分散片的最佳處方和工藝。所制備的三批樣品均在3 min內全部崩解并通過2號篩;在pH 6.8的磷酸鹽緩沖液中30 min溶出量均>標示量的80%,優于市售天麻素片。葛海濤等[18]則采用熔融法以腸溶性載體與水溶性載體聯用,將天麻素制成固體分散體,將速釋和緩釋有機地相結合,改善了天麻素口服吸收差,生物利用度低的缺陷。
2.2.3 泡騰片 泡騰片是通過片內有機酸及無機堿發生反應產生氣體從而促使片劑在水中快速崩解分散后再吞服的片劑,服用方便且生物利用度高。王超志[19]公開了一種天麻素泡騰片的制備方法,將200目天麻素粉與150目乳糖粉,等量遞增混合均勻;將填充劑、有機酸、無機堿、矯味劑、掩味劑、著色劑和潤滑劑混合均勻后過200目篩;加入天麻素和乳糖混合粉末中混合均勻,直接壓片即得。
此外,研究報道的天麻素速釋制劑還包括滴丸[20]、軟膠囊[21]等。
2.3 口服緩控釋制劑
目前的天麻素片每日給藥3次,制成緩釋制劑可減少給藥次數,提高患者用藥的順應性。同時,天麻素的體內半衰期為3~4 h,制成緩釋制劑可延長藥物的作用時間并降低藥物在體內濃度的波動性。李菲等[22]以45%羥丙甲纖維素(HPMC K15M)為骨架材料,10%十八醇為阻滯劑制備了天麻素緩釋骨架片,體外持續釋藥12 h,釋藥動力學符合Higuchi方程,具有明顯的緩釋效果。劉輝等[23]則采用滲透泵技術制備天麻素滲透泵片,以氯化鈉為滲透壓活性物質,以乙基纖維素(EC)為包衣材料,片劑激光致孔而得。這一新型滲透泵制劑具有顯著的零級釋藥特征。洪燕龍等[24]采用擠出滾圓法天麻素效應組分速釋微丸,以Eudragit RS100為主要包衣材料,流化床包衣法制備天麻效應組分緩釋微丸。所得微丸粉體學性質良好,體外釋放曲線符合Higuchi動力學方程,在12 h內具有緩慢的釋藥作用。此外,蔡錚等[25]公開了一種天麻素時辰給藥制劑應用于早醒型失眠癥的治療,該制劑為包衣片,片芯由天麻素、乳糖、微晶纖維素等組成,以HPMC為隔離層,EC為控釋層進行包衣,通過調節隔離層和控釋層包衣的重量,控制天麻素的釋放時滯,實現了天麻素服用4~6 h后釋藥的目的。
2.4 鼻腔給藥制劑
天麻素對中樞神經系統的作用尤為顯著,其主要部位為腦[26]。因此如何提高藥物在腦內的分布是發揮藥物療效所需解決的首要問題,天麻素水溶性強,透過血腦屏障能力弱且消除快,臨床需頻繁給藥,劑量大,患者難以耐受。近年來,在研究者對藥物腦靶向的不斷探索和深入研究下,發現鼻腔給藥或可成為有效遞送藥物入腦的一種方式。鼻腔中存在通向腦部的特殊通路——嗅神經通路或嗅黏膜上皮通路,藥物可經此特殊的通路進入中樞神經系統發揮作用[27-28]。鼻腔給藥方便,能在維持腦內有效濃度的同時減少給藥劑量和給藥次數,患者依從性高。曾昭氚等[29]公開了一種天麻素鼻噴制劑,為天麻素、吐溫、聚乙二醇、丙二醇、EDTA-2Na、苯扎氯銨和純化水組成的澄清透明溶液。呼吸道霧滴分布和霧滴顆粒度分布實驗結果顯示,該制劑噴霧粒徑合適,基本消除進入呼吸道的可能性,用藥安全性較好。
理想的經鼻腦靶向給藥系統需克服鼻纖毛的清除作用,提高在鼻腔中的滯留時間。相比于傳統的滴鼻溶液,生物黏附性微粒制劑在該方面顯示出一定的優勢。石森林等[30]以淀粉為黏附材料,采用復乳化交聯法研制了天麻素淀粉微球,借助淀粉良好的生物黏附性,使微球黏附在鼻黏膜表面,克服鼻纖毛的清除作用,顯著延長藥物的滯留時間。研究結果顯示,無黏附性粉末的平均滯留時間為(176.92±23.25)s,而天麻素淀粉微球的平均滯留時間延長至(944.33±68.29)s,折算為人體鼻黏膜滯留時間約為3 h。此外,如何提高水溶性藥物的鼻黏膜滲透性能也成為實現經鼻腦靶向需要克服的關鍵問題之一,在給藥系統中添加吸收促進劑是其中一種方式。李希等[31]對天麻素經鼻給藥制劑的吸收促進劑種類和用量進行了篩選,研究采用家兔鼻黏膜進行了體外促滲實驗,比較了冰片、丙二醇、水溶性氮酮的促滲透效果,結果顯示,氮酮的促滲效果最好,增滲約達2倍。
蔡錚等[32]采用結冷膠為基質材料制備了離子敏感型天麻素原位凝膠,并進行了凝膠體外釋放行為考察和體內腦靶向性的評價。凝膠釋藥速度較快,符合鼻腔內釋藥時間有限的特點;研究測定了溶液靜注和原位凝膠鼻腔給藥后血漿中天麻素和腦內天麻苷元的濃度。結果顯示,鼻腔給藥后大鼠大腦、小腦及嗅球的藥時曲線下面積(AUC)分別增加了1.16、0.77、3.34倍,腦靶向指數分別為2.66、2.18和5.34,表明鼻腔給藥后藥物的腦靶向性提高,證實鼻腔給藥可有效遞送天麻素入腦。
3 討論
天麻素因其藥理作用廣泛,不良反應小,在臨床上中樞神經系統相關疾病的防治中起著積極的作用,其制劑仍然為常規片劑、膠囊劑和注射劑。但天麻素水溶性強,滲透能力差,導致制劑的生物利用度和腦靶向性低,臨床給藥劑量大且給藥頻繁,患者耐受性差。隨著新制劑技術的不斷開發,目前已有天麻素速釋、緩控釋及鼻腔給藥等新劑型的探索研究,為解決臨床給藥過程中存在的缺陷,提高藥物的生物利用度及腦靶向性,提高患者用藥的順應性等各方面提供了新的理論支持和技術支撐。目前大部分研究工作仍處于實驗室階段,離臨床應用還有距離且存在諸多的困難需克服。天麻素雖藥理作用廣泛且安全性較高,但其活性不強。對天麻素及其苷元進行結構修飾和結構優化,研發出具有更強藥理作用的化合物,是天麻素開發的另一個重要方向[33]。相信隨著研究的不斷深入,天麻素新衍生物和新制劑能在將來開發成功,為患者帶來福音。
[參考文獻]
[1] 龔其海,石京山,楊丹莉,等.天麻素在中樞神經系統的藥理作用及其機制[J].中國新藥與臨床雜志,2011,30(3):176-179.
[2] Natoli JL,Manack A,Dean B,et al. Global prevalence of chronic migraine:a systematic review [J]. Cephalalgia,2010, 30(5):599-609.
[3] 許偉.腦靶向鼻腔給藥的研究進展[J].沈陽藥科大學學報,2012,29(7):575-580.
[4] 章正祥,曹克剛,范吉平.天麻素對多巴胺、硝酸甘油誘發的血管舒縮異常模型大鼠血流調節作用[J].中華中醫藥雜志,2012,27(11):2959-2962.
[5] 李曉琦,張光霽,申力,等.高效液相色譜法研究天麻素的理化性質及溶液穩定性[J].中華中醫藥雜志,2014,29(3):851-854.
[6] 李丁,于飛千,孫天慧.天麻素在大鼠小腸內吸收動力學的研究[J].中國藥劑學雜志,2006,4(5):217-221.
[7] 楊園,杜鵬,陳勇,等.不同劑量天麻提取物中天麻素在大鼠體內的藥動學研究[J].中醫藥學報,2010,38(5):94-97.
[8] 羅軍,吳中亮,王惠先.天麻素注射液人體藥動學的研究[J].解放軍藥學學報,2006,22(5):391-393.
[9] 華雯妍,朱藝芳,張全英.天麻素血藥濃度測定及藥動學研究[J].中國現代應用藥學,2010,27(7):634-636.
[10] 沈紅賓,靳奉會,吳雙俊,等.一種天麻素注射液及其制備方法:CN103156808A[P].2013-06-19.
[11] 葛海濤,唐俊.天麻素注射液制劑及其制備方法:CN1031 26980A[P].2013-06-05.
[12] 陳彥,陶靈剛.一種天麻素多相脂質體注射液:CN102626390A[P].2012-08-08.
[13] 梅華.天麻素納米脂質體的制備及其體外釋藥特性研究[J].中國藥師,2011,14(4):480-483.
[14] 黃靜,何文,李秀芳,等.天麻素納米脂質體的研制及其腦靶向性的初步研究[J].廣東藥學院學報,2011,27(4):345-350.
[15] 鄒萍,齊同珍,劉輝,等.天麻素口腔崩解片的制備和質量控制[J].中國藥業,2013,22(23):39-41.
[16] 王錦剛,蔣海松.一種天麻素口腔崩解片及其制備方法:CN1923185A[P].2007-03-07.
[17] 經嘉.天麻素分散片的實驗研究[D].濟南:山東大學藥學院,2013.
[18] 葛海濤,唐俊.一種天麻素固體分散片制劑及其制備方法:CN102038660A[P].2011-01-06.
[19] 王超志.一種改進的天麻素泡騰片及其制備方法:CN10 1332189A[P].2008-12-31.
[20] 候德華.天麻素滴丸制備工藝研究[J].疾病監測與控制雜志,2009,3(2):93-94.
[21] 邵愛霞,崔秋菊,付會,等.天麻素軟膠囊及其制備方法:CN1875949A[P].2006-12-31.
[22] 李菲,王建筑,畢研平,等.天麻緩釋片的制備[J].中成藥,2014,36(8):1626-1630.
[23] 劉輝,張蕓,樊光輝,等.天麻素緩釋片的制備及其體外釋藥特性研究[J].中國醫院藥學雜志,2013,33(18):1490-1494.
[24] 洪燕龍,林曉,徐德生,等.流化床包衣法制備天麻效應組分緩釋微丸的研究[J].中藥材,2009,32(9):1444-1447.
[25] 蔡錚,劉中秋,楊兆祥,等.一種天麻素時辰給藥制劑:CN102228449A[P].2011-11-02.
[26] 游金輝,譚天秩,匡安仁,等.3H-天麻苷元和3H-天麻素在小鼠體內的分布和代謝[J].華西醫科大學學報,1994, 25(3):325-328.
[27] Manda P,Hargett JK,Vaka SR,et al. Delivery of cefotaxime to the brain via intranasal administration [J]. Drug Dev Ind Pharm,2011,37(11):1306-1310.
[28] Ruan Yeping,Yao Li,Zhang Bingbing,et al. Nanoparticle-mediated delivery of Neurotoxin-Ⅱ to the brain with intranasal administration:an effective strategy to improve antinociceptive activity of neurotoxin [J]. Drug Dev Ind Pharm,2012,38(1):123-128.
[29] 曾昭氚,田杰,夏春秀.天麻素鼻噴制劑:CN101467969A[P].2009-07-01.
[30] 石森林,李曉琦,施笑暉,等.天麻素淀粉微球的制備及其鼻黏膜黏附性與體外釋藥特性考察[J].中草藥,2016, 47(4):585-590.
[31] 李希,易曉霞,黃嫣,等.天麻素經鼻給藥制劑的吸收促進劑篩選[J].中國實驗方劑學雜志,2013,19(24):25-27.
[32] 蔡錚,侯世祥,楊兆祥,等.天麻素鼻用原位凝膠腦靶向性研究[J].四川大學學報:醫學版,2008,39(3):438-440.
[33] 白飛,宋立明,楊兆祥,等.天麻素及天麻苷元結構修飾研究進展[J].化學試劑,2014,36(5):419-422,464.

