升降散對DM大鼠雙歧桿菌、大腸桿菌及IL—6的影響
杜芬芬+孫曉澤+劉愛華
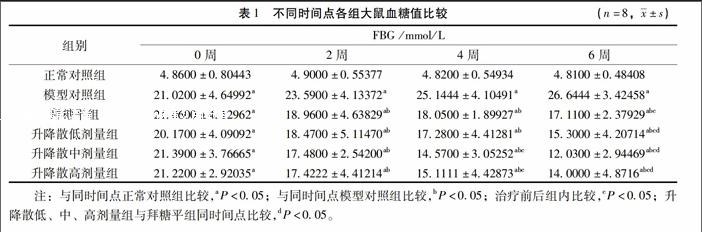
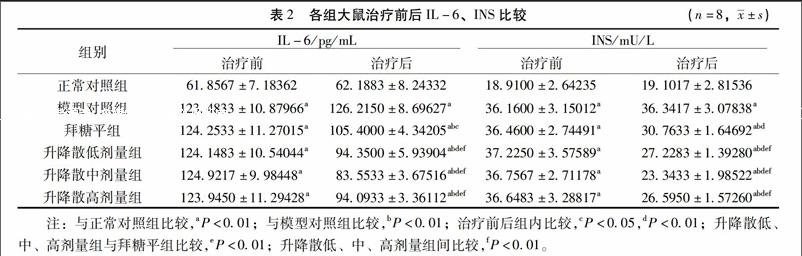
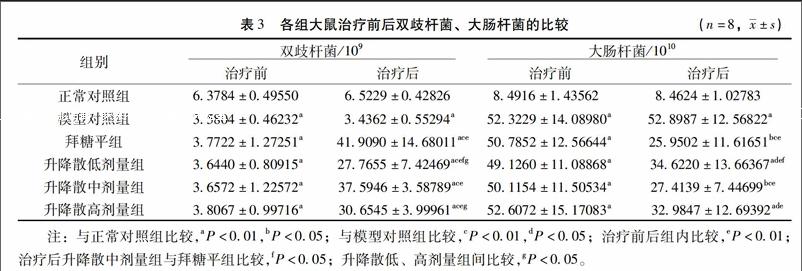
【摘要】目的:觀察升降散對糖尿病大鼠雙歧桿菌、大腸桿菌及IL-6的影響,探討其作用機制。方法:取70只SD雄性大鼠,隨機取10只作為正常對照組,余60只用高脂飼料喂養配合小劑量鏈脲佐菌素誘導建立糖尿病模型,取成模大鼠50只分為模型對照組、拜糖平組、升降散低劑量組、升降散中劑量組和升降散高劑量組,共分6組,每組10只,各組按相應藥物劑量干預6周后,每組取8只大鼠樣本采用Elisa法檢測IL-6、INS,Realtime PCR技術進行細菌定量測定。結果:治療前,模型對照組、拜糖平組、升降散低、中、高三個劑量組較正常對照組空腹血糖(FBG)、IL-6、INS及大腸桿菌數量均明顯升高,但雙歧桿菌數量明顯減少;治療前后,正常對照組及模型對照組組內各指標無明顯變化。治療后,拜糖平組及升降散低、中、高劑量FBG在2周、4周及6周均逐漸降低,且高于同時間正常對照組,低于同時間模型對照組(P<005);IL-6、INS、大腸桿菌數量較模型對照組明顯減少,但同時高于正常對照組(P<005);雙歧桿菌數量較模型對照組、正常對照組明顯增多(P<001)。尤以升降散中劑量組增加雙歧桿菌數量、降低大腸桿菌數量,抑制炎癥因子、降低胰島素含量效果明顯。結論:升降散能通過增加益生菌數量,降低致病菌數量達到調整腸道菌群結構的目的,從而抑制炎癥狀態,降低血糖。其部分作用機制可能是通過調整腸道菌群、抑制炎癥因子而減輕胰島素抵抗(IR),增加胰島素利用率實現的。
【關鍵詞】升降散;糖尿病;雙歧桿菌;大腸桿菌;IL-6 大鼠
【中圖分類號】R285【文獻標志碼】 A【文章編號】1007-8517(2017)08-0035-04
Abstract:Objective To observe the effect and the mechanism of Chinese herbal medicine on Bifidobacterium, Escherichia coli and IL-6 in diabetic rats Methods 70 SD male rats, 10 rats as normal control group, only more than 60 high fat diet combined with low dose of streptozotocin induced diabetic model was established, the model 50 rats were divided into model group, Bai Tangping group, Shengjiangsan low dose group, middle dose group Shengjiangsan Shengjiangsan and high dose groups were divided into 6 groups, 10 rats in each group, each group according to the corresponding dose of drug for 6 weeks, 8 rats from each group of samples was detected by Elisa IL-6, INS Realtime, PCR technology for quantitative determination of bacteria Results Before treatment, model group and acarbose group, Shengjiangsan low, medium and high dose groups compared with normal control group, fasting blood glucose (FBG), IL-6, INS and the number of Escherichia coli were significantly increased, but the number of bifidobacteria was significantly reduced; before and after the treatment, the normal control group and model control group each index in the group had no obvious change After treatment, acarbose Shengjiangsan group and low, middle and high dose of FBG in 2 weeks, 4 weeks and 6 weeks were gradually decreased, and higher than that of the normal control group, compared with model control group (P<005); IL-6, INS, the number of Escherichia coli than the model control group was significantly reduced, but at the same time higher than the normal control group (P<005); the number of bifidobacteria compared with model control group, normal control group increased significantly (P<001) Especially in the middle dose group, the number of bifidobacteria increased, the number of Ecoli decreased, the inflammatory factors and insulin content were decreased significantly Conclusion By increasing the number of probiotic bacteria, reducing the number of pathogens to adjust the structure of intestinal flora, thereby inhibiting the inflammatory state, reducing blood glucose Part of its mechanism may be to reduce insulin resistance (IR) and increase insulin utilization by regulating intestinal flora and inhibiting inflammatory factors
Keywords:Shengjiangsan; DM rats; bifidobacterium; e Coli; IL-6
隨著大量實驗研究證實腸道菌群與肥胖、糖尿病等代謝性疾病密切相關,腸道菌群已成為代謝性疾病防控的新方向。研究表明,腸道菌群失調可誘發慢性炎癥進而誘發胰島素抵抗,從而導致糖尿病發生,但其機制尚未十分明確。Zhang等[1]運用16Sr DNA高通量測序方法,發現機體代謝參數和菌群多樣性兩者間有明顯的關聯性。此為腸道菌群的結構可調控糖尿病的發病機制研究提供了證據。現有關于腸道菌群失調導致肥胖及2型糖尿病發生的研究,多數觀點集中認為腸道乳酸菌、雙歧桿菌等益生菌的減少與糖耐量異常密切相關[2-4]。中藥升降散為臨床調理脾胃氣機的常用治療大法,前期研究證實,其改善糖尿病的癥狀及降低血糖效果頗佳。本研究通過制作DM大鼠模型,觀察升降散對DM大鼠腸道菌群(大腸桿菌、雙歧桿菌)結構變化及相關炎癥因子(IL-6)的影響,探討其部分作用機制,為升清降濁法調整腸道菌群、改善糖尿病炎癥狀態、改善糖尿病臨床預后提供理論依據。
1儀器與材料
11動物SD雄性大鼠70只,SPF級,體重140~160g,由鄭州大學動物實驗中心提供,合格證號:41003100002297。清潔環境中飼養,室內溫度維持在25℃左右,自由攝水。
12藥品與試劑升降散藥物組成(僵蠶10g,蟬蛻6g,姜黃6g,大黃3g),藥物購自河南省中醫院,由三九顆粒制藥提供,顆粒劑總重量為7g;拜糖平/阿卡波糖片(德國拜耳公司);鏈脲佐菌素(STZ)(美國Sigma公司);SYBR Green/Flourescein qPCR Master Mix(2X))Fermentas公司);Ex TaqTM、DL2000 DNA Marker、DL15000 DNA Marker(TAKARA公司);引物合成,擎科新業生物技術有限公司提供;基因組DNA提取試劑盒(北京天根生化科技有限公司,批號:DP328);大鼠IL-6 Elisa檢測試劑盒(河南天馳生物有限公司,批號:CK-E30646R)。
13儀器血糖測定儀:穩豪倍優型血糖儀(強生醫療器械有限公司);實時熒光定量PCR儀、熒光定量PCR管(ABI);水平電泳儀、紫外分析儀(北京君意東方電泳設備有限公司)。
2方法
21動物造模70只大鼠普通飼料適應性喂養1周后,隨機取10只作為正常對照組,標準飼料喂養,余60只予高脂飼料喂養至滿8周后,腹腔注射STZ30mg/kg,正常組對照組注射等體積01mol/L無菌枸櫞酸緩沖液。72h后測大鼠空腹血糖(禁食8~10h),空腹血糖≥111mmol/L認為糖尿病大鼠造模成功[5]。剔除未成模及死亡大鼠10只。
22分組與給藥50只成模大鼠按隨機數字表法分為模型對照組、拜糖平組、升降散高、中、低劑量組及未造模的正常對照組,共6組,每組10只。拜糖平組每日灌胃70 mg·kg-1;升降散低、中、高劑量組,每日灌胃升降散(0753,1506,3012 g·kg-1),模型對照組與正常組每日灌胃等量生理鹽水。每3天稱體重1次,根據體重調整給藥量。藥物干預6周后進行各指標的觀察檢測。
23標本采集與指標檢測
231一般情況治療期間觀察大鼠精神狀態、皮毛色澤、飲水量、尿量、體重等。
232生化指標檢測每周血糖儀測空腹血糖值;治療第6周末,4%的水合氯醛動物麻醉后取血標本,每組取8只樣本進行ELISA法檢測血清IL-6、INS。
233Realtime PCR技術測定雙歧桿菌、大腸桿菌每組取8只大鼠新鮮糞便樣本進行檢測,按試劑盒說明書每只大鼠取02g新鮮糞便進行基因組DNA提取,以其為模板做PCR擴增,擴增片段引物Ecoli (95bp):Ecoli F:CATGCCGCGTGTATGAAGAA,Ecoli R:CGGGTAACGTCAATGAGCAAA ;Bifidobacterium genus (398bp):Bifi F:CAAGGGCATCTCCGTCA, Bifi R:GCGTTCAGGGTCTTCTCC。在PCR反應體系中,加入SYBR熒光染料,利用熒光信號的變化實時檢測PCR擴增反應中每一個循環擴增產物量的變化,通過Ct值和標準曲線的分析對起始模板進行定量分析。
24統計學方法采用SPSS 170軟件,計量數據采用(x±s)表示,組內比較采用t檢驗,多組間比較采用單因素方差分析,P<005 為差異有統計學意義。
3結果
31一般情況觀察正常組大鼠精神狀況良好,反應靈敏,飲食及尿量正常,毛色有光澤,體重穩定增加。其余各組注射STZ后明顯消瘦,并出現多飲、多食、多尿、精神萎靡,毛色發黃無關澤等癥狀。
32各組大鼠不同時間點FBG的比較治療前后,正常對照組及模型對照組組內血糖無明顯變化,升降散低、中、高劑量組及拜糖平組血糖在2周、4周及6周逐漸降低,且均高于同時間正常對照組,低于同時間模型對照組,差異均有統計學意義(P<005)。 見表1。
33各組大鼠治療前后IL-6、INS的比較治療前,模型對照組、拜糖平組及升降散低、中、高劑量組較正常組IL-6、INS水平均明顯升高(P<001);治療前后,正常對照組及模型對照組組內IL-6、INS水平無明顯變化;治療后,拜糖平組及升降散低、中、高劑量組IL-6、INS較模型對照組明顯減少,但同時高于正常對照組,差異均有統計學意義(P<001)。其中尤以升降散中劑量組IL-6、INS減少明顯。見表2。
34雙歧桿菌、大腸桿菌Realtime PCR定量分析治療前,模型對照組、拜糖平組及升降散低、中、高劑量組較正常組雙歧桿菌明顯降低、大腸桿菌量明顯升高(P<001);治療前后,正常對照組及模型對照組組內乳酸桿菌、大腸桿菌量無明顯變化;治療后,模型對照組、拜糖平組及升降散低、中、高劑量組雙歧桿菌量較模型對照組、正常對照組均明顯升高,差異均有統計學意義(P<001),大腸桿菌數量較模型對照組明顯減少,但同時高于正常對照組(P<005);其中尤以升降散中劑量組及拜糖平組升高乳酸桿菌量、降低大腸桿菌量明顯。見表3。
4討論
腸道菌群做為人體最大微生態系統,參與并影響著人體物質與能量代謝,目前多項研究表明,腸道菌群與糖尿病的發生發展密切相關,其作用機制可能為[6-9]:首先,腸道細菌可提高能量轉化效率,能將食物中宿主自身不能分解的碳水化合轉化為代謝終產物—短鏈脂肪酸(SC-FAs),腸道菌群失調可誘發機體內SCFAs水平和構成發生異常,如此腸道抗炎癥反應能力、腦腸肽激素分泌功能等受到影響,會引起胰島細胞功能受損、胰島素抵抗的發生;其次,高脂飲食可改變腸道細菌的環境,腸道菌群失調導致革蘭陰性菌比例的增多、腸壁通透性增加或者腸道菌群移位,通過產生和吸收更多的 LPS,激活胰島的低度慢性炎癥,炎癥可能通過多種途徑導致胰島β細胞結構受損與功能障礙,促進β細胞凋亡。同時,2型糖尿病本身亦會導致腸道菌群紊亂,削弱腸道屏障作用,刺激機體免疫系統所產生的IL-6、TNF-α等細胞因子,促使胰島細胞功能進一步受損,如此形成惡性循環。因此,通過調控腸道菌群的組成或許能為糖尿病的治療提供新策略。
中醫強調以整體辨證論治,對此單方面的研究甚少,對其病因病機的研究散見于消渴病的文獻中。總結前人對其病因的認識大致為稟賦虛弱、飲食失節、情致失調及勞欲過度,其病機以陰虛燥熱為主。但疾病是發展的,病因病機亦是發展的。劉愛華教授基于多年對DM臨床觀察和總結的基礎上,應用中醫病因病機學基本理論、繼承脾胃學家李東垣、國醫大師李振華 “升清降濁”學說,并在查閱相關的文獻資料,運用類比、歸納、演繹多種方法,經過較嚴密的邏輯思維過程,創新提出“脾失升清,濁毒下陷”之假說,認為DM的發病與脾胃氣機升降失常、痰濁瘀毒逆亂有關,而且認為“脾失升清,濁毒下陷”氣機升降是根本。故用升降散,以僵蠶、蟬蛻、姜黃、大黃,共研細末,以黃酒、蜂蜜為引導,蟬蛻、僵蠶升陽中之清陽;片姜黃、制大黃降陰中之濁陰,則雜氣之流毒頓消矣。現代藥理亦研究證實升降散具有抗炎、抗病毒、抗過敏、解痙,利膽,抗驚厥,調節免疫等功能[10]。
本實驗結果顯示:治療前,模型對照組、拜糖平組、升降散低、中、高三個劑量組較正常對照組空腹血糖(FBG)、IL-6、INS及大腸桿菌數量均明顯升高,但雙歧桿菌數量明顯減少;治療前后,正常對照組及模型對照組組內各指標無明顯變化。治療后,拜糖平組及升降散低、中、高劑量FBG在2周、4周及6周均逐漸降低,且高于同時間正常對照組,低于同時間模型對照組(P<005);IL-6、INS、大腸桿菌數量較模型對照組明顯減少,但同時高于正常對照組(P<005);雙歧桿菌數量較模型對照組、正常對照組明顯增多(P<001)。尤以升降散中劑量組增加雙歧桿菌數量、降低大腸桿菌數量,抑制炎癥因子、降低胰島素含量效果明顯。由此推測,升降散能通過增加益生菌數量,降低致病菌數量達到調整腸道菌群結構的目的,從而抑制炎癥狀態,減輕胰島素抵抗,增加胰島素利用率而降低血糖。參考文獻
[1]Zhang X,Shen D,Feng Z,et al.Human gut microbiota changes reveal the progression of glucose intolerance [J].PLoS one,2013,8(8):e71108.
[2]Gills,Mihai P,Robert T,et al. Metagenomic analysis of the human distal gut[J]. Science,2006,312(1355):1355-1359.
[3]Larsen N,Vogensen FK,van den Berg FW,et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J].PLoS One,2010,5(2):e 9058.
[4] Rabot S,Membrez M,Bruneau A,et al.Germ-free C57BL/6J mice are resistant to high-fat-diet-induced insulin resistance and have altered cholesterol metabolism [J].FASEB J,2010,24(12):4948-4959.
[5]魏占英,沈麗,馮曉慧,等. 高脂飼料喂養時間和STZ劑量對建立2型糖尿病大鼠模型的影響[J]. 醫學研究雜志,2014(02):42-46.
[6] Samuel BS,Shaito A,Motoike T,et al. Effects of the gut micorbiota on host adiposity are modulated by the short -chanfatty-acid binding G protror,Gpr41[J].ProcNatl Acad Sci USA,2008,105(43):16767-16772.
[7] Velagapudi VR,Hezaveh R,Reigstad CS,et al. The gut microbiota modulate shostenergyand lipid metabolism in mice[J].J Lipid Res,2010,51(5):1101-1112.
[8]Guarner F,Malagelada JR. GUT flora in helth and disease[J].Lancet,2003,361(9356):512-519.
[9]Lu YC,wc,Ohashi PS. LPS/TLP4 signal transductionpathway[J]. Cytokine,2008,42(7):145-151.
[10]劉文軍,薛燕星,胡東鵬. 升降散的現代藥理機制研究進展[J]. 北京中醫藥,2012(12):939-943.
(收稿日期:2017-2-20編輯:陶希睿)

