食管、胃雙源癌外科治療的研究進展
梁健 黃杰 付印


[摘要]食管、胃雙源癌是指食管、胃同時發生的位置獨立的原發腫瘤。因腫瘤切除后消化道重建存在困難,臨床上對食管癌合并胃癌患者的治療,大多采用非手術治療方案。本文結合臨床經驗以及閱讀文獻報道,將臨床上對于食管癌合并胃癌的外科手術治療予以綜述,對于不同部位的食管、胃雙源癌,選擇不同的手術入路以及重建消化道的器官,從而做到手術治療胃食管雙源癌。
[關鍵詞]食管癌;胃癌;雙源癌;外科治療;消化道重建
[中圖分類號] R735 [文獻標識碼] A [文章編號] 1674-4721(2017)03(b)-0019-08
[Abstract]Esophageal and gastric cancer refers to the location independent primary tumor of the esophagus and stomach.Reconstruction of digestive tract after tumor resection is difficult,clinical treatment of patients with esophageal cancer and gastric cancer,most used non surgical treatment.This paper based on the clinical experience and reading reports,summarize the surgical treatment of esophageal cancer and gastric cancer in clinic.For different parts of the concurrent cancer of esophagus and stomach cancers,choosing a different surgical approach and reconstruction of digestive organs to make the surgical treatment of esophageal and gastric cancer.
[Key words]Esophageal cancer;Gastric cancer;Concurrent cancer;Surgical treatment;Digestive tract reconstruction
食管癌、胃癌是人類常見的消化道腫瘤,臨床上對于食管癌、胃癌有其各自的治療方案,但是臨床上存在食管癌合并胃癌的患者,對于這類患者,普外科醫師及胸外科醫師處理起來都存在一定的制約,故如今大多采用非手術治療的方案。本文結合與食管癌合并胃癌治療相關的研究報道以及臨床的治療體會,對食管癌合并胃癌的外科手術治療進行綜述。
1食管、胃雙源癌的定義及診斷標準
食管癌常見的病理類型為鱗狀細胞癌[1]。食管鱗狀細胞癌常合并其他器官的多原發癌(multiple primary carcinoma,MPC),其中以同時性發生的MPC常見,以頭頸部及胃部MPC常見[2-5]。根據Warren等[6]對MPC的定義標準:①每個腫瘤都必須證實為原發的惡性腫瘤;②腫瘤具有自己的組織起源,且相互間彼此分界清楚;③每個腫瘤均不是轉移瘤。將同一個體先后或者同時發生的食管癌與胃癌定義為食管、胃雙源癌。
2食管、胃雙源癌的流行病學特征
食管、胃雙源癌的發病率存在明顯的地域性差異分布,高發區與低發區發病率可相差500倍左右[7-9];其發病率存在明顯的性別差異,有研究表明,男女發病率之比可達4~5.12∶1[8-10],與單發食管癌、胃癌的性別之比有明顯差異;同時有研究表明,雙源癌的死亡率高于單發食管癌/胃癌[8,10];雙源癌隨著年齡增加,發病率隨之增高。目前,隨著檢查技術的進步,食管、胃雙源癌的檢出處于上升趨勢[11]。
3食管、胃雙源癌的發病原因
食管、胃雙源癌的發病原因尚不完全清楚,食管、胃有相似的暴露因素,其可能的發病原因有以下幾種。
3.1遺傳因素和基因
有報道表明,食管、胃雙源癌有顯著的家族聚集現象,報道稱雙源癌家族史陽性率可達43.13%。對食管、胃雙源癌組織的腫瘤相關基因表達的研究表明,Rb、P21waf1、Bcl-2、BAX、P53和PCNA等基因的表達,與雙源癌的發病率有一致性表達,提示食管、胃雙源癌的發病原因可能與此基因的表達相關[12-15]。
3.2飲食習慣
有報道表明,食管、胃雙源癌的發病因素,可能與長期飲酒以及吸煙相關[16];飲食中長期缺乏蔬菜水果等以及長期的過熱、過快飲食也是其發病的可能原因[17-19]。
3.3營養不良及微量元素的缺乏
相關食管、胃雙源癌的研究報告顯示,飲食中缺乏相關的微量元素,如維生素C、鋅、硒等,以及長期的營養不良,都是食管、胃雙源癌的可能發病因素[16,20]。
3.4化學因素
亞硝胺、多環芳香烴、真菌毒素等同樣是導致食管、胃雙源癌的相關發病因素[21-23]。
3.5慢性炎癥
有相關報道表明,長期的食管、胃的慢性炎癥,是食管、胃雙源癌發生的一個相關因素[15, 24-25]。
3.6其他因素
食管、胃黏膜損傷,如化學腐蝕傷、賁門失弛緩癥、Barrett食管以及Hp感染等都是其他相關的食管、胃雙源癌的發病因素。
4食管、胃雙源癌的診斷
目前,胃鏡及上消化道鋇餐造影是確診食管、胃雙源癌的主要方法,此外還有包括病理切片檢查、胸腹部CT、PET/CT等檢查方法也常用于食管、胃雙源癌的診斷,以下對此做簡單介紹。
4.1胃鏡及超聲胃鏡檢查
食管纖維胃鏡檢查可直接觀察病變的形態及病變部位,并可行組織活檢。超聲胃鏡可判斷腫瘤的浸潤深度、腫瘤周圍組織及結構有無受累以及局部淋巴結的轉移情況等。在臨床胃鏡檢查中,應仔細檢查整個上消化道,以免發生漏診的情況。
4.2上消化道鋇餐造影
對于食管腫瘤過大導致胃鏡無法通過檢查胃部情況的患者,上消化道鋇餐造影檢查可作為主要的診斷方法[26]。食管癌的鋇餐造影表現為食管黏膜的充盈缺損或者龕影,嚴重狹窄的病例,可見近端食管擴張的征象;鋇餐造影通過對胃的形態、黏膜變化、蠕動情況以及排空時間等觀察以確立診斷,胃癌在鋇餐的表現主要為充盈缺損、龕影以及彌漫性浸潤等。
4.3胸腹部CT
胸腹部CT可以了解食管管壁以及胃壁的厚度以及食管癌、胃癌向管腔外浸潤的范圍以及周圍淋巴結的轉移情況等,對于手術切除腫塊可能性的判斷提供幫助。
4.4正電子發射斷層顯像/X線計算機體層成像儀(positron emission tomography/computedtomography,PET/CT)
PET/CT的發展為嚴重的食管狹窄患者以及無法耐受胃鏡等檢查的患者提供了另外的選擇,并且,PET/CT對于全身腫瘤的發現和診斷都有重要作用[27-28]。
4.5纖維支氣管鏡檢查
當食管腫瘤位于隆突上方水平時,應行纖維支氣管鏡檢查以明確腫瘤是否侵及氣管以及協助評估食管腫瘤是否可切除。
5食管、胃雙源的外科治療
結合臨床上對于食管、胃雙源癌的治療經驗,對于可行手術的患者,根治性的手術切除食管、胃雙源癌并輔助放化療的綜合治療仍是主要(首要)的治療方法。
5.1食管、胃雙源癌手術的適應證
①患者全身條件好,各主要臟器可耐受全麻手術:術前完善心電圖、心臟彩超、肺功能等檢查正常或基本正常;②未發生遠處轉移:術前相關檢查肝膽胰脾、雙腎腎上腺等檢查排除遠處轉移的情況;③腫瘤估計可切除者:根據患者胸腹部CT檢查,結合腫瘤與周圍組織關系,初步判斷腫瘤可完整切除;④無頑固性胸背疼痛:當出現頑固性胸背部疼痛時,應考慮食管腫瘤已侵及食管外組織,可結合胸部CT檢查以作為判斷;⑤無聲嘶及刺激性嗆咳:出現聲嘶及刺激性嗆咳時,食管腫瘤多已侵犯喉返神經,此時可行纖維喉鏡檢查明確。
5.2食管、胃雙源癌手術的禁忌證
①食管、胃癌有明顯的外侵,腫瘤侵及臨近臟器或者存在遠處轉移的情況:術前完善相關臟器的檢查可明確是否存在外侵;②患者身體狀況無法耐受手術者:患者心肺功能、相關血液檢查指標無法耐受手術者,不應考慮手術治療;③惡病質:惡病質患者因身體無法承受手術的打擊,故不考慮手術治療。
5.3食管、胃雙源癌的手術入路選擇
食管、胃雙源癌的手術入路選擇需結合食管癌、胃癌的大小、部位以及手術醫師的經驗以及習慣個性化的選擇。常用的手術入路:①左后外側開胸徑路:左胸后外側切口適用于下段食管癌合并胃癌,并可于左胸內做吻合的患者;②右后外側開胸加開腹切口徑路:適用于中段食管癌合并胃癌,吻合位置過高的患者;③右胸后外側、腹部加頸部切口徑路:適用上段食管癌合并胃癌的患者或者中段食管癌切除后于無法行胸內吻合的患者;④左胸腹聯合切口徑路:適用于下段食管癌合并胃癌腫瘤過大,無法經左胸手術的患者。
5.4食管、胃雙源癌的手術方法
5.4.1經左胸切口胃代食管術
適用于下段食管癌合并賁門癌病變較局限的患者:患者取右側臥位,經左后外側切口進胸,探查食管癌位置、大小,游離下段食管,并清理縱隔淋巴結;確定食管癌上緣上方4~5 cm處離斷食管,并在此層面以上游離4~5 cm,以保證吻合;打開膈肌,探查腹腔,無明顯腹腔內轉移征象,游離胃周血管、組織,保留胃網膜右動脈,并清理胃周淋巴結;經胃管負壓吸引胃內容物,并退胃管至賁門上方3~4 cm處,兩把腸鉗鉗夾離斷賁門食管,保護斷端,將胃上提至胸腔,保證賁門腫瘤切除范圍足夠、切緣病理陰性的情況下,自小彎側切除多余胃組織制作管胃,切緣行間斷垂直褥式縫合包埋;退胃管至吻合口層面以上3~4 cm,在食管腫瘤上緣4~5 cm處荷包鉗鉗夾,做荷包縫合,離斷食管,取出離斷的食管,并消毒近端食管殘端,置入機械吻合器抵釘座,打緊荷包;自賁門置入吻合器器身,在管胃最高點后壁與近端食管行端側吻合,注意避免造成扭轉;取出吻合器,將包含腫塊的胃組織離斷,并予以間斷縫合包埋殘端;至此吻合完成。將管胃固定于縱隔胸膜,關閉膈肌,管胃經膈肌裂孔固定不宜過窄,防止發生狹窄;清洗胸腔,留置胸腔引流管,逐層關胸,術畢。可見既往相關文獻報道[29]。示意圖見圖1。
5.4.2經左胸腹聯合切口結腸間置或者空腸間置術
適用于下段食管合并賁門癌或者胃竇癌病變較大需行胃大部分切除的患者:患者取左胸抬高45°體位,經左胸腹聯合切口進左胸及腹腔,探查腹腔,賁門腫瘤較大,在保證腫瘤切除范圍足夠、切緣病理陰性的情況下,殘胃無法制成管胃以代替食管重建消化道,此時應考慮行近端胃大部切除或者全胃切除并使用空腸或結腸代食管術。近端胃大部切除:游離胃周血管、組織,保留胃網膜右動脈,清理胃周淋巴結;探查結腸血管弓,選定血供良好的腸段,無創傷血管鉗鉗夾預計要切斷的動脈,并將擬切斷的腸管兩端使用腸鉗鉗夾,觀察15 min,如血供良好,則可用作代食管器官;游離選用的結腸,并結扎切斷經過測試的血管,將選取的腸管切斷,待用;并完成結腸結腸端端吻合;同時游離下段食管,游離足夠的范圍,并清理縱隔淋巴結,切除食管腫瘤以及賁門腫瘤;將準備好的腸管提至胸腔,行近端食管結腸端端吻合以及結腸殘胃端側吻合。關閉膈肌,清洗胸腔及腹腔,留置引流管,逐層關胸關腹,可見相關文獻報道[29]。示意圖見圖2。
同時,有研究表明,亦可使用空腸間置于食管與殘胃之間[30-31],此種手術方法在于對空腸的游離,選擇距屈氏韌帶15~25 cm處選取帶血管蒂的遠端空腸,具體長度根據手術需要決定,保證長度足夠的情況下,離斷空腸,余下殘端行空腸空腸端端吻合;將切取的空腸段經結腸前或結腸后上提至胸腔,行近端食管空腸端端吻合,遠端空腸與殘胃行端側吻合,帶蒂血管與胸廓內動脈相吻合,至此吻合完成。示意圖見圖3。觀察腸管供血情況,血供良好,清洗胸腔及腹腔,留置引流,關閉膈肌,逐層關胸關腹。
對于合并胃竇癌需行遠端胃大部分切除的患者,保留胃左血管,切除胃竇腫瘤以及遠端大部分胃組織,消毒十二指腸殘端,給予縫合封閉,空腸或者結腸腸段間置于食管與殘胃之間,方法同前,主要區別在于殘端的處理,使用空腸間置的患者,空腸遠端斷端與殘胃行吻合,近段殘端與空腸遠端行端側吻合,至此吻合完成;結腸間置的患者,行胃與空腸襻側側吻合,并空腸近段遠端空腸襻側側吻合,至此吻合完成,余處理同前。示意圖見圖4。
5.4.3經左胸腹聯合切口空腸代食管術或者結腸代食管術
適用于下段食管癌合并賁門癌病變較大或者胃體、胃竇癌需行全胃切除的患者:患者取左胸抬高45°體位,經左胸腹聯合切口進左胸及腹腔,探查腹腔無明顯轉移,探查胃部病變較大,在保證切除范圍足夠的情況下殘胃無法制作管胃,評估后需行全胃切除,予以游離胃周血管、組織,并清理胃周淋巴結,腸鉗鉗夾幽門與十二指腸,離斷,消毒殘端,將十二指腸殘端縫合關閉,胃殘端保護。游離空腸,保留一定的血管,保證空腸的供血。離斷游離食管,并清理縱隔淋巴結,保證食管腫瘤切除范圍足夠,離斷食管,取出切除的胃及食管;在距屈氏韌帶30~35 cm處離斷空腸,遠端空腸經結腸前或者結腸后上提至胸腔與遠端食管行食管空腸端端吻合或者端側吻合(縫合關閉空腸殘端),近段空腸殘端與遠端空腸行端側吻合,至此吻合完成,可見文獻中相關報道[29]。示意圖見圖5。
另有一種方法可不離斷空腸,此種方法,離斷胃十二指腸后,縫合關閉十二指腸殘端;離斷食管,取出切除食管胃組織;游離空腸,將空腸襻經結腸前或結腸后上提至胸腔與食管行食管空腸端側吻合,在空腸遠端行空腸襻側側吻合,至此吻合完成。清理胸腔、腹腔,放置引流,逐層關閉胸腔、腹腔。此種情況亦可使用結腸代替食管重建消化道,切除食管胃組織,取血供良好的結腸腸段,上提至胸腔行食管結腸端端吻合,并遠端結腸與空腸行結腸空腸端側吻合,兩結腸斷端行結腸結腸端端吻合,至此吻合完成。示意圖見圖6。
5.4.4經左胸腹聯合切口保留殘胃并行空腸代食管術
適用于下段食管癌合并胃竇癌病變較局限可行遠端胃大部切除的患者:患者取左胸抬高45°體位,經左胸腹聯合切口進左胸及腹腔,探查腹腔,探查胃竇腫瘤局限,保證切除范圍足夠、切緣病理陰性,可行遠端胃大部切除,并殘胃可保留的患者,予以游離胃周血管、組織,保留胃左動脈,行遠端胃大部切除,十二指腸殘端縫合關閉;游離食管,切除下段食管癌足夠范圍,將殘胃上提與遠端食管行食管胃端側吻合;游離空腸并離斷,遠端空腸斷端與遠端胃體行吻合,近段空腸與空腸遠端行端側吻合,至此吻合完成,同樣,空腸可與遠端胃行吻合,并空腸襻行側側吻合。示意圖見圖7。5.4.5經右胸后外側切口及腹部正中切口胃代食管術
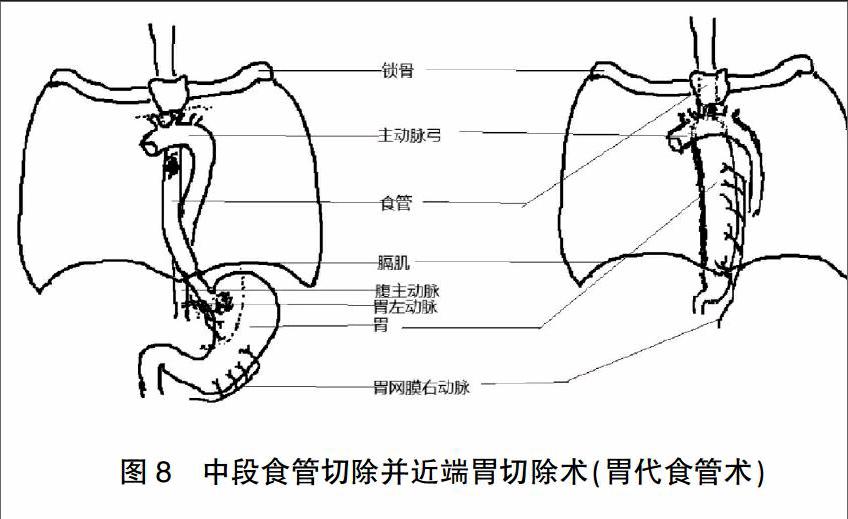
適用于中段食管癌合并有賁門癌病變較局限的患者:患者取仰臥位,經正中開腹,探查腹腔,探查賁門病變局限,保證腫瘤切除范圍足夠、切緣病理陰性的情況下,胃體可制作管胃以上提至胸腔代食管重建消化道,予以游離胃體周圍血管、組織,保留胃網膜右血管,退胃管,在賁門處兩把腸鉗鉗夾食管與賁門,離斷,消毒殘端,自胃小彎側制作管胃,并間斷垂直褥式包埋切緣,將食管與賁門臨時縫合,清洗腹腔,放置引流管,逐層關腹。變換患者體位胃左側臥位,經右側后外側切口進胸,游離食管,游離范圍足夠,結扎奇靜脈及胸導管,并清理縱隔淋巴結,將胃體由裂孔提至胸腔;退胃管,在擬切斷食管位置使用荷包鉗鉗夾,行荷包縫合,離斷食管,取出切除食管組織;消毒殘端,在食管遠端置入消化道吻合器抵釘座,打緊荷包;由賁門置入消化道吻合器器身,在胃體最高點穿出,與抵釘座結合,避免胃體扭轉,行吻合;將胃體固定于食管床,清洗胸腔,留置引流管,逐層關胸,術畢。示意圖見圖8。
5.4.6經左頸、右胸、腹部三切口結腸代食管術
5.4.6.1全胃切除、結腸代食管術 適用于中段食管癌以及上段食管合并胃癌在切除胃部腫瘤之后殘胃無法用作代食管器官重建消化道的患者:患者取仰臥位,上腹部正中切口進胸,切除劍突,探查腹腔,胃部腫瘤的部位、大小,判斷胃部腫瘤可切除,未侵犯周圍組織,需行全胃切除;探查結腸血管弓,判斷血管弓的長度及完整性,選取擬用作代食管重建消化道的結腸腸段,選取足夠長的腸段,游離結腸,無損傷血管鉗鉗夾擬切斷的血管,并用無損傷腸鉗鉗夾擬切取的腸段兩端,觀察腸管血供情況15 min;游離胃周血管組織、血管,并清理胃周淋巴結。退胃管,在膈下腸鉗鉗夾食管賁門,離斷,消毒兩殘端;食管殘端予以結扎封閉;胃遠端離斷,取出全胃,并消毒十二指腸近段,十二指腸殘端予以縫合封閉。開左側頸部,暴露頸部食管,術者雙手由腹部及頸部相對鈍性分離胸骨后間隙,如雙手無法觸及,則使用環鉗緊貼胸骨體后壁分離,直至雙側可觸及。將經過測試的腸管在兩端離斷,結腸兩斷端行結腸結腸端端吻合;由頸部切口經胸骨后間隙送入一尿管到腹部切口,將尿管尖端與擬上提至頸部的結腸一端用絲線固定,由頸部牽拉尿管,結腸腸管隨尿管經由胸骨體后間隙上提至頸部,如牽拉過程中有阻力,應將腸管退出胸骨后間隙,并重新檢查胸骨后通道是否有纖維條索梗阻,予以通暢之后再將結腸腸管上提至頸部。退胃管,切除上段食管,行食管結腸斷端吻合術,行單層間斷縫合,完成后壁縫合后,將胃管送入結腸腸管,并完成前壁的縫合。并將結腸腸壁與胸廓入口周圍組織縫合固定,防止出現吻合口瘺,經由胸廓入口造成縱隔感染。留置引流管,至此逐層縫合,關閉頸部切口。腹部游離空腸,行結腸空腸端側吻合術,并行空腸襻側側吻合術,至此,吻合完成。于屈氏韌帶下40 cm處行空腸造口術,固定空腸營養管于腹壁皮膚;清洗腹腔,留置引流管,逐層關腹。同期或擇期行右后外側切口經胸切除胸段食管:患者取左側臥位,經右后外側切口進胸,結扎奇靜脈、胸導管,游離切除全胸段食管,并清理縱隔淋巴結,清洗胸腔,留置引流,逐層關胸。示意圖見圖9。如條件允許,亦可使用電視胸腔鏡下全胸段食管切除。
5.4.6.2胃大部切除、結腸代食管術 適用于中段食管癌或者上端食管癌合并賁門癌或者胃竇癌,可行胃大部分切除術的患者:患者取仰臥位,上腹部正中切口進胸,切除劍突,探查腹腔,賁門(幽門)腫瘤部位、大小,保證腫瘤切除范圍足夠的情況下,可行近端胃大部分切除(遠端胃大部分切除),游離胃周血管、組織,保留胃網膜右血管(胃左血管),并清理胃周淋巴結,行近段胃大部分切除(遠端胃大部分切除)。結腸切取腸段處理以及頸部食管結腸端端吻合處理如前所述;結腸遠端與殘胃行端側吻合,示意圖見圖10,遠端胃大部分切除需行胃空腸吻合,示意圖見圖11,留置空腸營養管,方法同前;清洗腹腔,留置引流管,逐層關腹。同期或擇期切除全胸段食管。
5.4.7經右胸后外側切口及腹部切口行空腸間置術或結腸間置術
適用于中段食管癌合并賁門癌或者幽門癌,可行胃大部分切除術的患者:患者取仰臥位,上腹部正中切口進腹,探查腹腔、賁門癌(幽門癌)位置、大小,在保證腫瘤切除范圍足夠的情況下,判斷病變可行近(遠)端胃大部分切除,游離胃周血管、組織,保留胃網膜右血管(胃左血管),清理胃周淋巴結。行近(遠)端胃大部分切除(遠端胃大部切除后,離斷食管與賁門),游離擬用作代食管的空腸或者結腸。手術臺向左側抬高,行右胸后外側切口進胸,游離食管足夠的范圍,切除食管腫瘤,并清理縱隔淋巴結,將游離的空腸或者結腸保留良好的血供,切取足夠長度,經由食管裂孔上提至胸腔與食管行端端吻合,并固定于縱隔胸膜;下端與殘胃行端側吻合,完成空腸或者結腸間置于食管與殘胃之間。近端胃大部分切除的患者將空腸(結腸)近端與遠端行端端吻合(遠端胃大部分切除術后使用空腸間置術的患者,行遠端空腸斷端與殘胃吻合,近端空腸斷端與遠端空腸行端側吻合;使用結腸間置術的患者,則結腸兩端段行端端吻合,殘胃遠端與空腸行吻合,并空腸襻行側側吻合)。吻合完成,留置空腸營養管。沖洗腹腔,留置引流管,逐層關腹;胸腔清洗,留置引流,逐層關胸。術畢。
5.4.8胸、腹腔鏡輔助下食管、胃雙源癌切除術
此類方法對于腫瘤病變的大小、部位以及手術醫師的手術操作水平都有著一定的要求,此類手術方法可在對患者造成更小的損傷的情況下以期獲得相同的手術效果,曾有相關文獻報道過此類手術方法的處理[32]。此種術式對于患者損傷較小,利于患者術后的恢復。
5.5食管、胃雙源癌術后常見并發癥
食管、胃雙源癌由于其吻合口較多、術后早期無法經消化道進食、靜脈營養、患者整體情況較差無法自主咳嗽排痰等情況,術后常發生吻合口瘺、低蛋白血癥、心功能不全、肺部感染等并發癥。當發生術后并發癥后,積極有效的處理對于患者的預后是存在積極的影響的。有報道表明,術后早期靜脈營養支持,控制補液的速度與總量以及對于患者心臟功能相關功能的監測能夠有效的防止心功能不全的發生;有報道表明,術中留置空腸營養管,術后早期行空腸營養注入對于患者消化道功能的恢復以及減少術后低蛋白血癥的發生都有著積極的作用;對于術后出現吻合口瘺并發癥,應積極應對,禁飲食、腸內營養支持、補液、糾正低蛋白血癥、積極換藥等處理,可以有較好的愈合效果;對于術后合并肺部感染的患者,予以積極的吸痰、刺激咳嗽咳痰、抗生素支持等,能夠取得較好的治療效果。
6食管、胃雙源癌治療的現狀及進展
如今臨床上治療食管、胃雙源癌仍是以放化療為主的非手術治療,本文通過對文獻研究以及臨床治療經驗的總結,提出對可手術的食管、胃雙源癌,臨床上應更多地考慮以根治性手術切除為主的治療方案,以使患者獲得更好的遠期生存以及生活質量。
[參考文獻]
[1]丁廣成.河南食管癌高發區單發食管癌、賁門癌及同一個體食管/賁門雙源癌人乳頭瘤病毒檢測和p53、p16、p21~(WAF1)及MDM2蛋白變化研究[D].鄭州:鄭州大學,2010.
[2]賀舜,劉勇,劉曉,等.食管鱗癌相關多原發癌的臨床特點分析[J].中華醫學雜志,2015,95(35):2868-2870.
[3]Goodner JT,Watson WL.Cancer of the esophagus;its associ?鄄ation with other primary cancers[J].Cancer,1956,9(6):1248-1252.
[4]Goldstein HM,Zornoza J.Association of squamous cell carci?鄄noma of the head and neck with cancer of the esophagus[J].AJR Am J Roentgenol,1978,131(5):791-794.
[5]Cahan WG,Castro EB,Rosen PP,et al.Separate primary carcinomas of the esophagus and head and neck region in the same patient[J].Cancer,1976,37(1):85-89.
[6]Warren S,Gates O.Multiple primary malignant tumors:a survey of the literature and a statistical study[J].Am J Cancer,1932,16:1358-1414.
[7]付文靜.食管/賁門雙原發癌(雙源癌)患者家族史、臨床病理、生存期及甲基化分析[D].鄭州:鄭州大學,2012.
[8]付文靜,李吉林,郭二濤,等.1011例食管/賁門雙原發癌(雙源癌)患者的家族史、臨床病理及生存期分析[J].河南大學學報(醫學版),2012,31(3):206-209.
[9]彭秀青,黃佳,張鵬飛,等.311例同一個體食管/賁門(胃)雙源癌患者臨床病理特征及生存影響因素分析[J].腫瘤基礎與臨床,2014,27(3):248-252.
[10]韓鎖利,王立東,李吉林,等.食管癌高發區食管/賁門雙源癌臨床病理特征分析[J].腫瘤學雜志,2010,16(5):347-349.
[11]孫喜斌,劉志才,劉曙正,等.河南省林州市人群食管癌、胃癌發病水平及時間趨勢描述[A]//中南地區食管癌綜合治療研討會暨河南省第二屆食管癌學術會議論文集[C].新鄉,2007.
[12]王寧博.河南食管癌高發區食管賁門雙源癌Rb,P21waf1,Bcl-2,BAX,P53和PCNA變化分析[D].鄭州:鄭州大學,2005.
[13]Malik MA,Upadhyay R,Modi DR,et al.Association of NAT2 gene polymorphisms with susceptibility to esophageal and gastric cancers in the Kashmir Valley[J].Arch Med Res,2009,40(5):416-423.
[14]Bozbora A,Coskun H,Barbaros U,et al.The effects of gastric bands of different synthetic materials on the gastric and esophageal mucosa:an experimental study[J].Obes Surg,2004,14(2):246-252.
[15]Savage SA,Abnet CC,Mark SD,et al.Variants of the IL8 and IL8RB genes and risk for gastric cardia adenocarcinoma and esophageal squamous cell carcinoma[J].Cancer Epid?鄄emiol Biomarkers Prev,2004,13(12):2251-2257.
[16]Melhado RE,Alderson D,Tucker O.The changing face of esophageal cancer[J].Cancers (Basel),2010,2(3):1379-1404.
[17]Yang CX,Wang HY,Wang ZM,et al.Risk factors for esophageal cancer: a case-control study in South-western China[J].Asian Pac J Cancer Prev,2005,6(1):48-53.
[18]Navarro SS,Mayne ST,Gammon MD,et al.Diet and lifestyle factors and risk of subtypes of esophageal and gastric cancers:classification tree analysis[J].Ann Epidemiol,2014,24(1):50-57.
[19]Carr JS,Zafar SF,Saba N,et al.Risk factors for rising inc?鄄idence of esophageal and gastric cardia adenocarcinoma[J].J Gastrointest Cancer,2013,44(2):143-151.
[20]Yang WX.Exposure level of N-nitrosamines in the gastric juice and its inhibition by vitamin C in high risk areas of esophageal cancer[J].Zhonghua Zhong Liu Za Zhi,1992,14(6):407-410.
[21]Keszei AP,Goldbohm RA,Schouten LJ,et al.Dietary N-nitroso compounds,endogenous nitrosation,and the risk of esophageal and gastric cancer subtypes in the Netherlands Cohort Study[J].Am J Clin Nutr,2013,97(1):135-146.
[22]Mirvish SS.Role of N-nitroso compounds (NOC) and N-nitr?鄄osation in etiology of gastric,esophageal,nasopharyn?鄄geal and bladder cancer and contribution to cancer of known exposures to NOC[J].Cancer Lett,1995,93(1):17-48.
[23]Lu SX.N-nitrosamines in gastric juice of subjects from high incidence area of esophageal cancer[J].Zhonghua Zhong Liu Za Zhi,1988,10(5):322-325.
[24]Fucci A,Colangelo T,Votino C,et al.The role of peroxisome proliferator-activated receptors in the esophageal,gastric,and colorectal cancer[J].PPAR Res,2012,2012:242498.
[25]Verbeke H,Geboes K,Van Damme J,et al.The role of CXC chemokines in the transition of chronic inflammation to esophageal and gastric cancer[J].Biochim Biophys Acta,2012,1825(1):117-129.
[26]Paslawski M,Zlomaniec J,Rucinska E,et al.Synchronous primary esophageal and gastric cancers[J].Ann Univ Mariae Curie Sklodowska Med,2004,59(1):406-410.
[27]Miyazaki T,Sohda M,Higuchi T,et al.Effectiveness of FDG-PET in screening of synchronous cancer of other organs in patients with esophageal cancer[J].Anticancer Res,2014,34(1):283-287.
[28]Chen SH,Chan SC,Chao YK,et al.Detection of sync?鄄hronous cancers by fluorodeoxyglucose positron emission tomography/computed tomography during primary staging workup for esophageal squamous cell carcinoma in Taiwan[J].PLoS One,2013,8(11):e82812.
[29]王德才,李俊杰,張長江.同時性食管及食管胃交界區重復癌的外科治療[J].中國藥物經濟學,2014,9(2):285-286.
[30]葉芃.賁門癌近端胃切除空腸間置術預防反流性食管炎[D].杭州:浙江大學,2005.
[31]張偉.近端胃切除空腸間置在賁門癌手術中的應用[D].鄭州:鄭州大學,2013.
[32]Honda M,Daiko H,Kinoshita T,et al.Minimally invasive resection of synchronous thoracic esophageal and gastric carcinomas followed by reconstruction:a case report[J].Surg Case Rep,2015,1(1):12.
(收稿日期:2017-01-12 本文編輯:許俊琴)

