N2H4分子取代基效應的量子化學研究
郭雅瓊, 高小童, 賈亞蘭, 張 懿, 毛 雙*
(1. 四川師范大學 化學與材料學院, 四川 成都 610066; 2. 武警警官學院, 四川 成都 610213)
N2H4分子取代基效應的量子化學研究
郭雅瓊1,2, 高小童1, 賈亞蘭1, 張 懿1, 毛 雙1*
(1. 四川師范大學 化學與材料學院, 四川 成都 610066; 2. 武警警官學院, 四川 成都 610213)
計算了甲基(—CH3)和羥基(—OH)對N2H4的取代基效應.引入甲基后,N2H4的N—N鍵長變長,電荷密度變小.羥基的引入,使得N—N鍵長變短,其中1,1,2,2-四羥基N2H4的N—N鍵長顯著變化.通過NBO計算,N—N鍵的鍵級隨著取代基個數的增加逐漸減小,超共軛作用在決定構型相對穩定性方面起了重要作用.引入取代基后,N原子的孤對電子與N—C(N—O)鍵之間發生相互作用,使得整個分子的超共軛作用增強.隨著取代基數目的增多,分子的總能量和生成熱均降低,取代基數目與分子相對穩定性之間具有較好的相關性.
量子化學; 取代基效應; 氮氫化合物; 異構體; 相對穩定性
20世紀90年代初,高能量密度材料(HEDM)正式進入發展階段.隨著時間的推移以及高科技技術的不斷進步,因為可用作制造炸藥、推進劑或火工品的材料,高能量密度材料幾乎被所有武器系統所使用,在現代科技工業中發揮了極為重要的作用[1-3].由于氮氫化合物(NnHm)中存在N—N基團,氮原子的孤對電子產生相互排斥作用,使得氮氫化合物不穩定且具有高的生成焓,在自然界中比較罕見,大多數都以反應中間體或裂解產物形式存在[4-5].但是因為此類化合物在含能材料方面的重要性,從20世紀50年代,人們開始著手對氮氫化合物的理論和實驗研究[6-7].目前,關于其研究主要是以理論為主.W. B. David[8-9]對N4H4和N4H6系列分子的幾何構型構象變化以及質子親和勢等方面進行了理論研究.高氮化合物作為新型的含能材料,Los Alamos國家實驗室的Hiskey研究小組[10]對其合成以及應用也曾進行了大量的研究.文獻也報道過運用G3B3方法探索N4H4、N3H3的幾何構型、生成熱、穩定性和互變異構現象[11-12].總之,對氮氫化合物的研究,隨著體系的增大,數量會越來越多.肼(N2H4,hydrazine)在氮氫化合物中是比較簡單的一種物質,它與它的衍生物構成了一系列很重要的含能化合物,既可用作鋼鐵的防腐劑材料,又能用作衛星和火箭推動器的燃料[13-15].借助已有的對氮氫化合物的理論研究,發現在其上引入其他基團后,分子的部分性質會發生變化.本文主要探索N2H4的H分別被甲基、羥基取代后的衍生物相對于N2H4的幾何構型及能量的變化規律.
1 計算方法
應用密度泛函理論的B3LYP方法在6-311++g**基組下對N2H4可能存在的甲基和羥基取代異構體進行了幾何優化和振動分析.結果表明,計算所得到的構型均為勢能面上的穩定點.同時用AIM 2000程序包[16]對化合物的鍵臨界點電荷密度進行了計算,明確了化學鍵的性質.在相同基組水平上采用自然鍵軌道(NBO)[17]分析方法對幾何構型進行了分析,揭示了超共軛作用對于取代物構型穩定性的影響.最后采用G3MP2方法對分子能量進行校正,并計算了各異構體在298 K時的生成熱,所有計算都采用Gaussian 09程序[18]完成.
2 結果與討論
2.1 幾何性質 圖1列出了N2H4及甲基異構體,其中(a)為鍵長(nm),(b)為鍵臨界點處的電荷密度ρ(a.u.),(c)為2ρ(a.u.),(d)為鍵級.在這里選擇下列構型:1-甲基N2H4(B),1,1-二甲基N2H4(C),1,1,2-三甲基N2H4(E)和1,1,2,2-四甲基N2H4(F),來討論取代基的加入對N2H4分子的影響.在這4個構型中H原子逐步被甲基(—CH3)所取代.
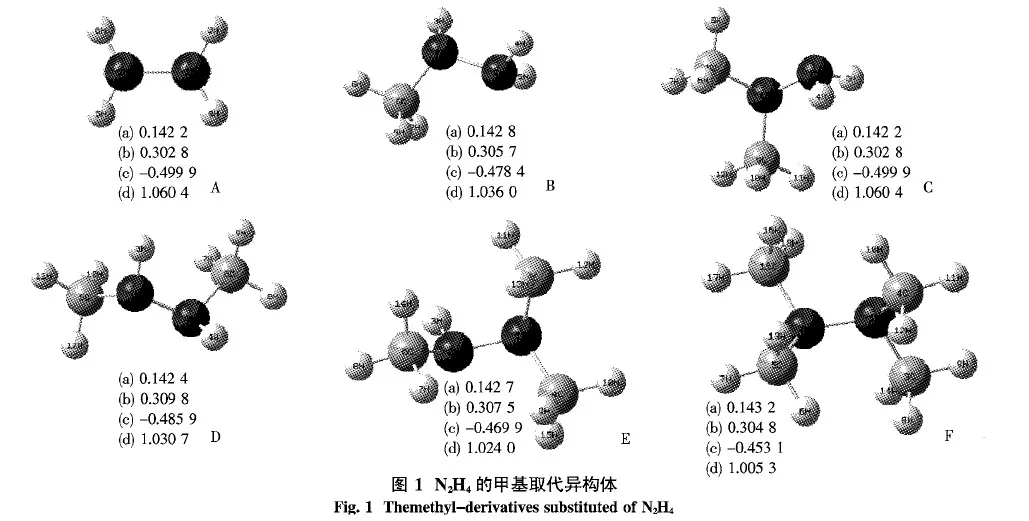
表 1 化合物異構體的主要二階穩定化能分析參數

化合物BD-LPE(2)/(kJ/mol)A(N3)—(N2—H6)5.98(N2)—(N3—H5)6.02B(N1)—(C6—H7)7.18(N1)—(N2—H5)5.59(N2)—(N1—H3)4.86C(N1)—(C9—H10)8.46(N1)—(N2—H4)7.40(N2)—(N1—C9)6.12D(N1)—(C5—H10)7.37(N1)—(N2—C6)6.34(N2)—(C6—H9)7.23E(N1)—(C5—H13)8.46(N1)—(C4—H9)8.13(N2)—(N1—C5)7.43(N1)—(C3—H8)8.31F(N2)—(C15—H16)8.30(N2)—(C5—H13)8.28
圖1中分別列出了N2H4及4種甲基(—CH3)取代物的鍵長、AIM和鍵級分析.從鍵長數據可以看出,隨著甲基(—CH3)數目的增多,N—N的鍵長呈逐漸增大的趨勢,甲基(—CH3)取代異構體的N—N鍵長均大于N2H4(A)的N—N鍵長,同時經AIM分析發現其所有構型的2ρ<0,表明所有的化學鍵均為共價鍵.通過NBO計算了鍵級,發現隨著取代基個數的增加,2個N原子間的鍵級在逐漸減小.
為了進一步了解超共軛作用的實質,進行了二階穩定化能的分析.由表1可知,N2H4分子中的超共軛作用主要體現在N原子孤對電子與相鄰的N—H鍵、N—N鍵之間.而當H原子被甲基逐步取代后,分子中就產生了N原子孤對電子與相鄰的N—C鍵、N—H鍵、N—N鍵之間的相互作用,隨著甲基數目的增多,二階穩定化能呈增大的趨勢.
2.2 能量性質 表2中列出了計算所得的各異構體的能量,其中ENL為離域能,EL為LUMO軌道能,EH為HOMO軌道能,△E:=EL-EH,E(L)為超共軛缺失的總能,△fH0為生成熱.從表2的數據可以看出,隨著取代基數目的增多,分子總能量逐漸降低,每增加一個甲基(—CH3),分子總能量就相應降低39.3 a.u..N2H4(A)的二取代物有2種(C,D),其中C的分子能量較低,是穩定構型.分子的總能量與其相對穩定性有關,而生成熱則是衡量高能材料爆炸性能的重要參數.因此采用G3MP2方法,在Pθ、298 K下計算了各個異構體的生成熱.由計算數據可以看出,這些異構體的生成熱均為正,它們都是吸熱材料,均具有了含能材料候選物的基本條件,是可能的含能材料候選物.通過比較各個分子的△E能量值,發現取代后的分子能量差值均高于N2H4(A),由分子前線軌道理論[19-20]可知取代后的分子的穩定性增強.計算所得異構體的總能量與生成熱的變化趨勢是一致的.當分子總能量越高,其生成熱就越大.為進一步研究影響異構體穩定性的因素,還應用NBO方法對它們的超共軛作用進行了計算.通過對比發現,分子的超共軛作用會使體系能量降低,當扣除分子超共軛作用后,體系能量會升高.還發現分子的超共軛作用與甲基的個數成正比,隨著甲基數目的增加,分子的超共軛作用能逐漸增大.

表 2 化合物異構體的能量參數

3 羥基(—OH)的取代
3.1 幾何性質 圖2列出了N2H4的羥基(—OH)異構體,其中(a)為鍵長(nm),(b)為鍵臨界點處的電荷密度ρ(a.u.),(c)為2ρ(a.u.),(d)為鍵級.選擇以下構型:1-羥基N2H4(G),1,1-二羥基N2H4(H),1,1,2-三羥基N2H4(J)和1,1,2,2-四羥基N2H4(K),來分別討論取代基的加入對N2H4分子的影響.在這4個構型中H原子逐步被羥基(—OH)所取代.
圖2中分別列出了4種羥基(—OH)取代物的鍵長、AIM和鍵級分析.從鍵長數據可以看出,隨著羥基(—OH)數目的增多,N—N的鍵長呈逐漸減小的趨勢,電荷密度逐漸增大.其中,1,1,2,2-四羥基N2H4(K)的N—N鍵長為0.144 9 nm,大于乙氮烷的N—N鍵長,但經AIM分析發現其2ρ<0,表明所有的化學鍵仍為共價鍵.仍然通過NBO方法計算了其鍵級,發現鍵級也同樣發生了改變.
通過對分子NBO的計算,發現分子中的超共軛作用也與羥基的個數成正比,隨著羥基個數增加,分子的離域化能逐漸增大.由表3可知:當分子中的H原子逐漸被取代后,分子中就產生了N原子孤對電子與相鄰的N—N鍵、N—O鍵、O—H鍵之間的相互作用.隨著取代基數目的增多,二階穩定化能呈逐漸增大的趨勢,且能量普遍高于甲基異構體.—OH取代所產生的超共軛作用能也高于甲基—CH3取代的超共軛作用能.

表 3 化合物異構體的主要二階穩定化能分析參數
3.2 能量性質 表4列出了計算所得的各異構體的能量參數.可以看出:同樣隨著取代基數目的增加,總能量逐漸降低.其中二取代物仍有2種:1,1-二羥基N2H4(H)和1,2-二羥基N2H4(I).通過分析能量所得1,1-二羥基N2H4(H)為更穩定的構型.由表2中數據可得當H原子逐步被—OH取代后,分子的總能量與羥基個數呈現很好的線性關系,隨著取代羥基數目的增加分子總能量會逐漸降低,每增加一個—OH,分子總能量相應降低75.2 a.u.,比—CH3取代多降低35.9 a.u..比較各個分子的△E能量值同樣發現取代后的分子能量差值均高于N2H4(A),且羥基取代的分子能量差△E高于甲基取代的分子,進一步表明羥基取代的產物相比于甲基取代物分子要更穩定一些.生成熱作為考察含能物質的一個重要數據,也對它進行了計算,結果表明分子的生成熱隨著羥基數目的增多呈降低的趨勢.—OH取代異構體的生成熱低于—CH3取代異構體.通過比較各個分子的△E能量值,發現取代后的分子能量差值均高于N2H4(A),由分子前線軌道理論[17-18]可知取代后的分子的穩定性增強.

表 4 化合物異構體的能量參數
4 結束語
采用密度泛函理論研究了N2H4可能存在的異構體及異構體中的氫原子被甲基和羥基逐步取代后,對原有分子的幾何構型、電荷密度、異構體的相對穩定性和生成熱造成的影響.通過幾何構型優化和振動分析表明,所有異構體均為勢能面上的穩定點.通過對AIM及鍵級分析,發現N—N鍵長與鍵臨界點電荷密度及鍵級存在線性關系,研究了其化學鍵的本質.同時,經過NBO的超共軛作用計算及分子前線軌道理論發現,它們在決定構型穩定性方面均起了重要作用.當引入甲基或羥基后,N原子的孤對電子會與相應的N—C(N—O)鍵之間發生相互作用,使整個分子的超共軛作用增強.隨著取代基數目的增多,總能量和生成熱均降低,取代基數目與分子能量的降低值具有很好的相關性.
[1] FOLTZ M F, HOLTZ E V, ORNELLAS D O, et al. The solubilityo-fCL-20 in selected materials[J]. Prop Expl Pyro,1994,19(4):206-295.
[2] FRIED L E, MANAA M R, PAGORIA P F, et al. Design and synthhes is ofenergeticm at erials[J]. Mater Res,2001,31:291-295.
[3] 周世光,吳文健. 高能量密度材料[J]. 化工時刊,1997,11(12):1-6.
[4] 毛雙,蒲雪梅,李來才,等. N6H6結構和性質的理論研究[J]. 化學學報,2006,64(14):1429-1436.
[5] 譚英雄. 含能材料分子N6H6及—CH—等電子取代的理論研究[J]. 四川師范大學學報(自然科學版),2009,32(7):998.
[6] GIGUERE P A, LIU I D. On the infraredspectrum of hydrazine[J]. Chem Phys,1952,20(1):136-140.
[7] SCHURATH U, SCHINDLER R N. The photolysis of hydrazine at 206.2 nm in the presence of ethylene[J]. Phys Chem,1970,74(17):188-194.
[8] DAVID W B. High-level ab initio calculations on hydrogen compounds:thermochemistry of tetrazetidine N4H4[J]. Mol Struct:Theo Chem,2002,619(1/2/3):37-43.
[9] DAVID W B. Hartree fock Gaussian -2 and -3 and complete basis set predictions of some thermochemical properties of N4H6[J]. Phys Chem,2001,105(2):465-470.
[10] MY H V, HUYNH D, MICHAEL A, et al. Polyazido high-nitrogen compounds:hydrazo-and-azo-1,3,5-triazine[J]. Angewandte Chemie,2004,43(7):4924-4928.
[11] LI L C, SHANG J. A G3B3 study of N4H4isomers[J]. Mol Struct:Theo Chem,2007,807:207-211.
[12] 郭雅瓊,毛雙,李強根. N3H3分子取代基效應的量子化學研究[J]. 四川師范大學學報(自然科學版),2014,37(5):703-708.
[13] SYAGE J A, COHEN R B, STEADMAN J. Spectroscopy and dynamics of jet-cooled hydrazines and ammonia. I. Single-photon absorption and ionization spectra[J]. Chem Phys,1992,97(9):6072.
[14] ZEMAN S. Sensitivities of high energy compounds[J]. Struct Bond,2007,125:195-271.
[15] 尚靜. 含能材料分子N<,n>H<,n>(n=4~6)系列穩定性分析及其互變異構的理論研究[D]. 成都:四川師范大學,2007.
[16] BIEGLER K F, SCHONBOHM J, DERDAN R, et al. AIM 2000[S]. 2nd ed. Hamilton:McMaster University,2000.
[17] REED A E, WEINHOLD F, CURTISS L A, et al. Natural bond orbital a nalysis of molecular interactions:theoretical studies of binary complexes of HF, H2O, NH3, N2, O2, F2, CO, and CO2with HF, H2O and NH3[J]. Chem Phys,1986,84:5687-5706.
[18] FRISCH M J, TRUCK G W, SCHLEGEL H B, et al. Gaussian 09[S]. 2nd ed. Wallingford:Gaussian Inc,2009.
[19] CREED D, CALDWELL R A, HIROYUKI O, et al. A frontier molecular orbital rationale[J]. J Am Chem Soc,1977,99:277-278.
[20] HOUK K N. Frontier molecular orbital theory of cycloaddition reactions[J]. Acc Chem Res,1975,8:361-369.
(編輯 周 俊)
Quantum Chemistry Study on the Substituent Effect of N2H4
GUO Yaqiong, GAO Xiaotong, JIA Yalan, ZHANG Yi, MAO Shuang
( 1.CollegeofChemistryandMaterialsScience,SichuanNormalUniversity,Chengdu610066,Sichuan;2.CollegeofArmedPoliceOfficer,Chengdu610213,Sichuan)
Studies on substituent effects of the methyl (—CH3) and hydroxyl (—OH) group on hydrazine were performed. For derivatives substituted methyl, the N—N bond length of hydrazine was increased, and charge dengsity was lessened. For derivatives substituted hydroxyl, the N—N bond length of hydrazine was shortened. By NBO (nature bond orbit), the bond order of N—N bond was decreased with the increase of the number of the substituent. The hyperconjugation played a important role in the relative stability of isomers. The hyperconjugation from the lone pair electrons of atom N to the N—C (N—O) bond was increased by the introduction of substituent. The total energy and formation heat were decreased with the addition of substituents. A good correlation was found between the numher of substituent and molecular relative stability.
quantum chemsity; substituent effect; hydronitrogen; isomer; relative stability
2015-06-01
四川省教育廳自然科學重點基金(10ZA011)
O641
A
1001-8395(2017)01-0101-05
10.3969/j.issn.1001-8395.2017.01.017
*通信作者簡介:毛 雙(1972—),男,副教授,主要從事物理化學的研究,E-mail:wlhxms@sohu.com

