ICR小鼠下頜第一磨牙牙胚發育的動態組織學觀察
董 寧,劉 巖,張田田,阮建平
(陜西省顱頜面精準醫學研究重點實驗室,西安交通大學口腔醫學院口腔預防科,西安,陜西 710004)
研究報告
ICR小鼠下頜第一磨牙牙胚發育的動態組織學觀察
董 寧,劉 巖,張田田,阮建平
(陜西省顱頜面精準醫學研究重點實驗室,西安交通大學口腔醫學院口腔預防科,西安,陜西 710004)
目的 了解ICR小鼠下頜第一磨牙牙胚的發育時序特點,為使用小鼠研究牙齒發育機制和相關影響因素提供實驗基礎。 方法 分別取E(胚胎)11.5、E12.5、E13.5、E14.5、E15.5、E16.5、E17.5和E18.5 d的胎鼠和PN(出生后)2 d的新生小鼠的頭部或下頜骨,固定脫鈣包埋后行連續切片,進行HE染色,在顯微照相系統下進行觀察記錄,分析ICR小鼠磨牙牙胚發育的動態變化規律。 結果 E11.5 d為牙胚發育始動,E12.5 d牙胚向蕾狀期過渡,E13.5 d進入蕾狀期,帽狀期為E14.5~E15.5 d,鐘狀期開始于E16.5 d,出生后2 d牙體硬組織開始逐漸形成。結論 ICR小鼠胚胎11 d至出生后第2天是研究下頜第一磨牙牙胚發育機制的最佳時機。
牙齒發育;ICR小鼠;下頜第一磨牙;
牙齒的發育是外胚層來源的上皮細胞及顱神經脊來源的間充質細胞相互作用的結果,因此牙齒是研究上皮-間充質反應的重要器官模型之一,也是研究器官發育分子機制的一個經典模型系統[1]。然而,不同于一般的器官發生,牙齒的形成經歷了發育、礦化和萌出3個不同的階段,其復雜性遠遠甚于其他組織。從而使人們對其發育機制的了解和認識程度遠遠低于其他組織。因此,了解ICR小鼠下頜第一磨牙牙胚的發育時序特點,為進一步研究牙齒的發育形成機制和相關影響因素提供模式實驗動物就顯得尤為重要。
1 材料和方法
1.1 實驗動物及實驗環境
SPF級鼠齡為4周的ICR小鼠,體重18~20 g,購自于西安交通大學醫學部醫學實驗動物中心[SCXK(陜)2012-003],實驗于西安交通大學醫學部醫學實驗動物中心動物房進行[SYXK(陜)2012-005],常規飼食飲水。
1.2 儀器與試劑
SW-CJ-1F超凈工作臺(蘇凈安泰,中國蘇州);TOMY ES-315型高壓蒸汽消毒器(Tomy,日本);石蠟切片機(Leica,德國);恒溫培養箱(Memmert,德國);Nikon DXM1200顯微照相系統(Nikon,日本)。
多聚甲醛、10% EDTA、無水乙醇、二甲苯、雙氧水、氯化鈣、碳酸氫鉀、碳酸氫鈉、磷酸二氫鈉、蘇木素伊紅(HE)染色試劑盒。以上試劑均為國產市售分析純。
1.3 動物實驗
ICR小鼠以雌雄比2:1合籠,觀察陰道栓出現的當日中午定為胚胎發育的0.5 d(E0.5),新生鼠鼠齡計算以出生當天中午定為出生后第0.5天 (PN0.5)。對孕鼠分籠飼養,分別取樣本為E11.5、E12.5、E13.5、E14.5、E15.5、E16.5、E17.5和E18.5的胎鼠和PN1、PN2的新生小鼠。每組30個樣本,分別產自3個不同母體,且保證取材時各組孕鼠生命體征平穩無異常,胎鼠分離后測量頭徑,組內各標本誤差不超過1 mm。孕鼠及新生小鼠脫頸處死后,分離胎鼠頭部(E11.5、E12.5、E13.5、E14.5、E15.5)或下頜骨(E16.5、E17.5、E18.5、PN1、PN2)用PBS清洗后置于4%多聚甲醛液中,4℃固定24~48h。梯度脫水,石蠟包埋。E16.5~PN2標本需先經過pH 7的10% EDTA脫鈣,隔日換液至完全脫鈣(即探針刺穿無阻力)。將石蠟標本,以5 μm厚度進行連續切片,頭部標本作冠狀切片,下頜骨標本行矢狀切片。撈片,60℃烤箱烘干備用;切片預熱,經二甲苯脫蠟后,梯度酒精(100%、95%、80%、70%)脫水,流水沖洗5 min,PBS洗3次;行HE染色組織切片。光學顯微照相系統觀察并記錄結果,統計各發育期內不同牙胚形態特征出現的頻次,計算百分率。
2 結果
2.1 ICR小鼠下頜第一磨牙牙胚形態學觀察
所有的ICR孕鼠均在E19.5d生產,即PN1d。
E11.5:口腔上皮局部增生下陷,形成牙板上皮(圖1A)。
E12.5:上皮細胞增殖聚集,牙板上皮進一步增厚,向蕾狀期過渡(圖1B)。
E13.5:增厚的牙板上皮內陷入間充質,形成上皮蕾,周圍有增生的間充質細胞集聚包繞,進入蕾狀期(圖1C)。
E14.5:上皮蕾繼續向間充質中生長,體積增大,上皮基底部向內凹陷,表明牙胚發育開始向帽狀期發育(圖1D)。
E15.5:牙胚進入帽狀期。上皮繼續延伸,基底凹陷進一步加深,形如帽子,即為成釉器。成釉器可見三層細胞結構:外釉上皮層、內釉上皮層和星網狀層。成釉器中央基底上方可見釉結。下方的間充質細胞形成球形凝聚區,構成牙乳頭。外周可見明顯的細胞及結締組織包繞構成牙囊(圖1E)。
E16.5:牙胚進入鐘狀早期。成釉器繼續生長,星網狀層增厚,其與內釉上皮層之間出現中間層細胞,上皮凹陷更深,其周緣繼續生長,上皮轉折處為頸環,成釉器形似吊鐘,即為鐘狀期(圖1F)。
E17.5:牙胚進入鐘狀期。上皮繼續伸長,頸環結構更加明顯,中間層細胞清晰可辨,牙尖處可見繼發釉結形成(圖1G)。
E18.5:牙冠形態已可辨認,內釉上皮層內陷加深,內釉上皮層極化明顯,逐漸變為高柱狀,對應牙乳頭有間充質細胞層誘導分化為可辨的成牙本質細胞層。未見牙體硬組織產生(圖1H)。
PN1(E19.5):牙體硬組織開始分泌形成,牙胚發育進入鐘狀晚期。內釉上皮細胞向高柱狀形態分化成為成釉細胞,中間層更加明顯可見。牙尖處可見逐漸發育成熟的成釉細胞和成牙本質細胞開始分泌形成釉基質和前期牙本質(圖1J)。
PN2:牙體組織繼續形成中。牙冠形態更加清晰可辨,各層結構明確。前期牙本質繼續沉積增厚,其上可見薄層牙本質和新生牙釉質,牙尖處尤為明顯(圖1K)。
2.2 統計分析
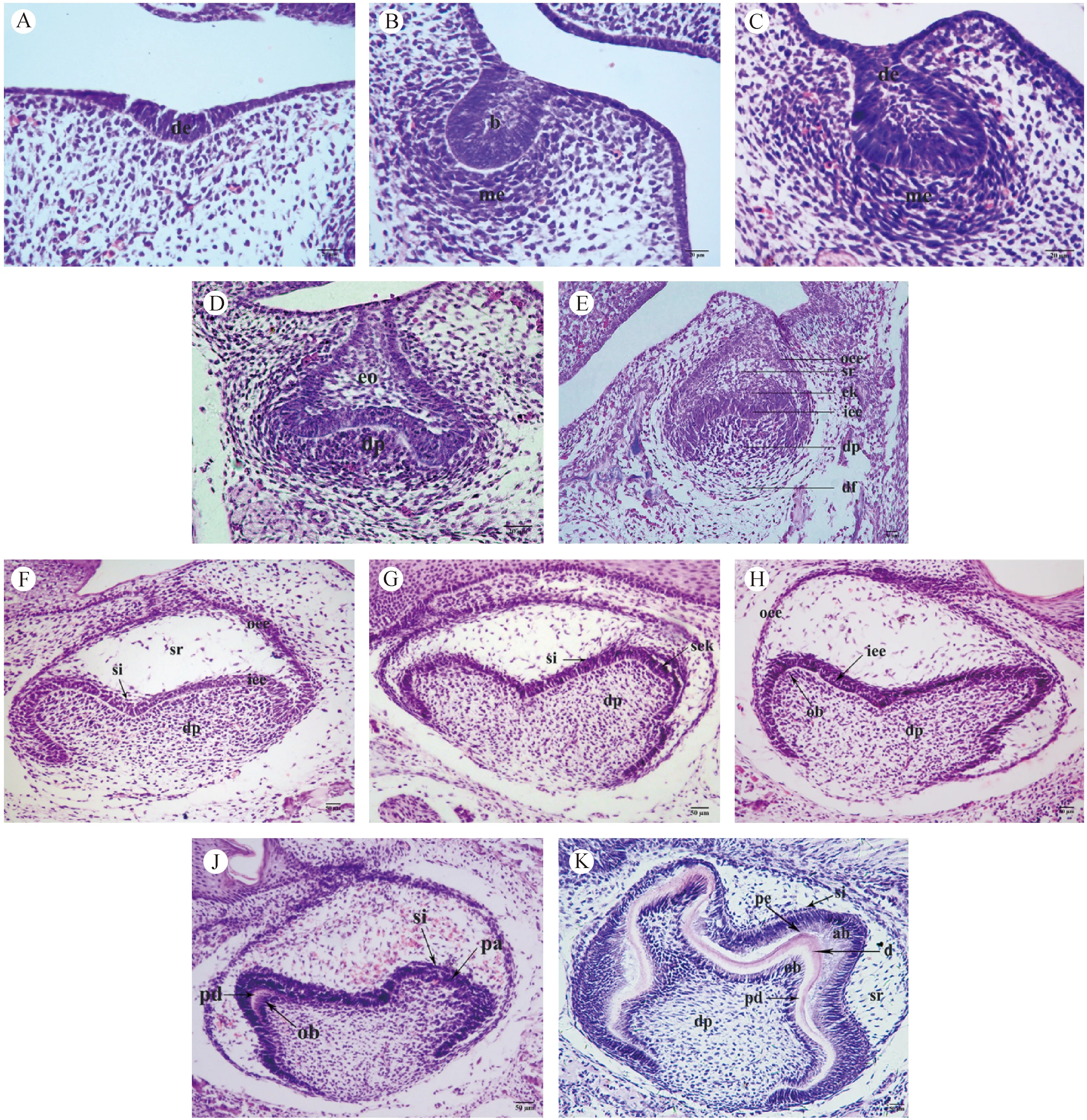
注:A:E11.5牙板上皮增厚、內陷;B:E12.5牙胚向蕾狀期發育;C:E13.5進入蕾狀期;D:E14.5帽狀期;E:E15.5帽狀期;F:E16.5鐘狀早期;G:E17.5鐘狀期;H:E18.5鐘狀期;J:PN1(E19.5)鐘狀晚期;K:PN2進入牙體組織形成期。de,牙板上皮;b,上皮蕾;me,間充質細胞層;eo,成釉器;dp,牙乳頭;oee,外釉上皮層;sr,星網狀層;ek,釉結;iee,內釉上皮層;df,牙囊;si,中間層;sek,繼發釉結;ob,成牙本質細胞;pa,前成釉細胞;pd,前期牙本質;ab,成釉細胞;pe,前期牙釉質;d,牙本質。圖1 不同發育階段ICR小鼠下頜第一磨牙牙胚HE染色形態學觀察(A-E標尺=20 μm; F-K標尺=50 μm)Note. A:Proliferation of dental sheet at E11.5;B:Tooth germ developing to bud stage at E12.5;C:Bud stage at E13.5;D:Cap stage at E14.5;E:Cap stage at E15.5;F:Early bell stage at E16.5;G:Bell stage at E17.5;H:E18.5 during bell stage;J:Late bell stage at PN1(E19.5);K:Presence of dentin and enamel at PN2. de,dental epithelium;b,bud;me,mesenchyme;eo,enamel organ;dp,dental papilla;oee,outer enamel epithelium;sr,stellate reticulum;ek,enamel knot;iee,inner enamel epithelium;df,dental follicle;si,stratum intermedium;sek,secondary enamel knot;ob,odontoblasts;pa,pre-ameloblasts;pd,pre-dentin;ab,ameloblasts;pe,pre-enamel;d,dentin.Fig.1 Morphological characteristics of the ICR mouse first mandibular molar tooth germ during developmental stages(A-E, Bar=20 μm; F-K,Bar=50 μm)
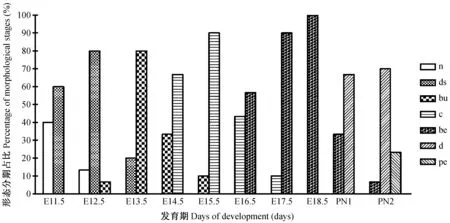
注:n,無改變;ds,牙板;bu,蕾狀期;c,帽狀期;be,鐘狀期;d,牙本質;pe,前期牙釉質。圖2 各發育期的牙胚形態學特征分布Note. n, none; ds, dental sheet; bu, bud stage; c, cap stage; be, bell stage; d, dentin; pe, pre-enamel.Fig.2 Distribution of morphological features during the first mandibular molar tooth germ development stages of the ICR mouse
對各發育期內觀察到的形態學特征進行匯總,以出現頻次計算百分比。結果顯示(圖2),60%的樣本在E11.5 d觀察到了牙板上皮增厚,可以明確ICR小鼠下頜第一磨牙牙胚發育始動于胚胎11.5d。而80%的樣本在E13.5 d觀察到蕾狀期牙胚形態特征,E14.5 d到E15.5 d組具備帽狀期形態特征的樣本分別占66.7%和90%。與之類似,一半以上的樣本在E16.5 d進入鐘狀期,并在PN1d到達鐘狀晚期,開始分泌牙體硬組織(66.7%);而PN2d90%以上的樣本觀察到牙本質及早期牙釉質的分泌形成。
3 討論
牙齒的形成是一連續過程,包括三個主要階段:牙胚的發育、牙體組織形成和牙齒萌出。從口腔外胚層的增厚起始,牙胚發育歷經蕾狀期、帽狀期,最終在鐘狀期形成牙冠的形態,此階段為牙胚形態發生完成期;隨后牙齒發育進入牙本質及牙釉質等組織分化形成階段,當牙冠接近發育完全時,牙根開始發生,其間伴隨牙周組織逐漸形成,直至萌出后。與其他胚胎器官相似,牙胚的發育也是口腔上皮和外胚間充質之間相互誘導、時序性作用的結果,是一個復雜的、多因素調控的生物學過程[2]。許多生物分子被證實參與了牙胚發育中的細胞分化和牙形態發生的調控,如各種生長因子、粘附分子、轉錄因子、信號分子、細胞外基質分子等[3-5]。但是關于牙胚發育確切機制的研究仍在深入進行中,這個過程中仍有新的因子不斷地被發現報道出來。
發育生物學的基礎性研究中,一直采用小鼠牙齒作為動物模型之一來研究上皮-間充質交互反應、組織分化、模式發育等[6]。與小鼠相比,豬、狗乃至猴等大型動物的生理基礎和牙齒發育再生模式與人類更為接近,且RETN基因同源性分析結果顯示這些大型動物與人類的親緣關系更近[7]。其中,小型豬不僅被證實為是較為理想的異種移植供體,且在口腔醫學研究領域也有應用小型豬建立牙髓壞死模型及頜骨改建方面的研究[8,9]。然而,大型動物昂貴的使用成本、繁殖及研究周期長、基因組信息不完善等缺點使其在基因水平和分子機制研究領域的應用遠不及小型嚙齒類動物模型應用廣泛[10-12]。而小鼠牙胚獲取方便、易于基因操控及體外培養,同時可異位移植發育分化為牙齒樣器官[13]。更重要的是,盡管與人的牙列不同,但小鼠的磨牙牙胚發育與人類牙齒發育階段類似,并在發育早期具有相似的分子調控機制和基因表達[14]。證明小鼠磨牙可以被當作研究人類牙齒生理及病理性發育的良好模型,因此確定小鼠磨牙的發育時序對于進一步從分子生物學角度研究牙齒生長發育規律有著重要的意義。然而研究發現不同品系小鼠不僅繁殖能力及行為學表現不同,且主要臟器和器官的重量和長度均存在顯著性差異[15,16],ICR小鼠的胃和大腦、心、脾較KM小鼠和NIH小鼠更大[17,18]。在牙齒發育中,不同品系的小鼠其磨牙胚發育階段亦略有不同[19,20]。ICR小鼠由于其繁殖力強、遺傳操控性好等特點,已成為國際上最為通用的實驗品系之一。而對ICR小鼠磨牙胚發育的時相規律目前尚未見有報道。
本研究動態觀察了ICR小鼠牙胚從開始發育到硬組織形成這一過程的形態學變化。發現ICR小鼠的妊娠期為19.5 d,這與BALB/c近交系小鼠[21]和ICR/Jcl系小鼠[19]的妊娠時間一致,接近于albino系小鼠的20 d[22]。嚙齒類動物磨牙發育中首個出現的可觀察到的形態學特征是牙板的形成,表現為E11-E12 d出現口腔上皮的局部增厚[23]。實驗觀察到ICR小鼠在E11.5 d出現上皮增厚,牙胚開始發育,這與BALB/c近交系小鼠和albino系小鼠和Swiss小鼠的E11到E12 d的發育開始時間基本一致[24],而比ICR/Jcl系小鼠的E12.5 d稍早。牙胚的發育始動于上皮與間充質的反應,調控因素非常繁雜,上皮中特異性表達的信號分子Shh、Wnt、BMP等,間充質中轉錄因子Msx1和Pax9等,以及FGF與BMP信號通路間的拮抗反應都決定著牙胚早期發育的時序和方向[25-27],而不同物種的調控機制不盡相同。聯系本研究觀察到的結果可以推斷,不同品系小鼠之間,其牙胚發育早期涉及的信號調控機制也并不完全相同。隨后的發育過程中,牙板上皮不斷向內折疊,形成成釉器,而周圍包繞細胞不斷聚集形成牙齒間充質,二者開始相互誘導促使牙胚不斷發育,經歷蕾狀期、帽狀期、鐘狀期直至發育完成。本實驗觀察到,ICR小鼠牙胚在E13.5 d處于蕾狀期,E14.5 d開始向帽狀期過渡;E15.5 d可觀察到明顯的原發性釉結,顯示此時期牙胚進入牙尖形態分化期;E16.5 d進入鐘狀早期,隨著牙胚不斷發育,牙尖位置及牙冠形態愈加成型,至鐘狀晚期,上皮來源的成釉細胞和間充質來源的成牙本質細胞逐漸分化形成并明顯分層排列;PN1開始出現硬組織礦化;此結果與BALB/c近交系小鼠和C57小鼠較為一致,而均略早于ICR/Jcl系小鼠(蕾狀期E13-E14、帽狀期E15~E16、鐘狀早期E17),可能與時間點的計算方式不同有關。
本實驗通過觀察ICR小鼠的下頜第一磨牙牙胚動態發育過程,表明:E11.5d為牙胚發育的起始階段,蕾狀期為E13.5,帽狀期為E14.5-E15.5,鐘狀期開始于E16.5,出生后兩天牙體硬組織開始逐漸形成,預示著牙胚發生的完成,牙齒發育進入組織形成期。實驗結果為將來針對牙胚特定發育時期的研究提供了可靠依據。
[1] Thesleff I. Current understanding of the process of tooth formation: transfer from the laboratory to the clinic [J]. Aust Dent J, 2014, 59 (Suppl 1): 48-54.
[2] Thesleff I. Epithelial-mesenchymal signaling regulating tooth morphogenesis [J]. Cell Sci, 2003, 116: 1647-1648.
[3] Zhang YD, Chen Z, Song YQ, et al. Making a tooth: growth factors, transcription factors, and stem cells [J]. Cell Res, 2005,15: 301-316.
[4] Pispa J, Thesleff I. Mechanisms of ectodermal organogenesis [J]. Dev Biol, 2003, 262: 195-205.
[5] Li L, Yuan G, Liu C, et al. Exogenous fibroblast growth factor 8 rescues development of mouse diastema vestigial tooth ex vivo [J]. Dev Dyn, 2011, 240: 1344-1353.
[6] Thesleff I, Pispa J. The teeth as models for studies on the molecular basis of the development and evolution of organs [M]. In: CM Chuong, RG Landes, eds. Molecular Basis of Epithelial Appendage Morphogenesis. Austin, TX 1998: 157-179.
[7] 魯帥堯,龍海亭,禹文海,等. 人類與部分實驗動物RETN基因同源性分析 [J]. 中國實驗動物學報,2012, 20(5): 69-73.
[8] 龐琳琳,張會永,楊關林. 巴馬小型豬在醫學研究中的應用進展 [J]. 中國實驗動物學報,2014, 22(1): 94-98.
[9] 陳華. 小型豬在醫學研究領域的應用進展 [J]. 中國實驗動物學報,2008, 16(5): 366-367.
[10] Tuker AS, Fraser GJ. Evolution and developmental diversity of tooth regeneration [J]. Semin Cell Dev Biol, 2014, 25-26: 71-80.
[11] 王福, 吳志芳, 李陽, 等.利用大型動物模型研究牙發育及再生的優劣勢 [J]. 口腔醫學研究,2015, 31(6): 549-554.
[12] 劉新玉,董偉,張連峰. 小鼠的遺傳分析技術及疾病模型 [J]. 中國比較醫學雜志, 2005(1): 45-47.
[13] Zhang YD, Chen Z, Song YQ, et al. Making a tooth: growth factors, transcription factors, and stem cells [J]. Cell Res. 2005, 15(5): 301-316.
[14] Lan Y, Jia S, Jiang R. Molecular patterning of the mammalian dentition [J]. Semin Cell Dev Biol, 2014, 25-26: 61-70.
[15] 李騰飛,孫秀萍,石哲,等. 不同品系小鼠在三種常見抑郁檢測方法中的行為學表現 [J]. 中國比較醫學雜志, 2011, 21(8): 20-23.
[16] 殷昆侖,張長勇,王天奇,等. GDF-9和BMP-15在不同品系小鼠中的多態性和生殖能力關聯分析 [J]. 中國比較醫學雜志, 2013, 23(3): 8-13.
[17] 胡一江,李輝,劉海燕,等. 三個不同品種小鼠主要器官重量及長度的比較 [J]. 中國比較醫學雜志, 1997, 7(2): 100-101.
[18] 盧勝明,胡建武,車路平,等. 10種常用SPF級實驗大、小鼠體重及主要臟器的測定 [J]. 實驗動物科學, 2007, 24(3): 12-16.
[19] Gaete M,Lobos N,Torres-Quitana MA.Mouse tooth development time sequence determination for the ICR/Jcl strain [J]. J Oral Sci, 2004, 46(3): 135-141.
[20] Gaunt, WA. The development of the molar pattern of the mouse (Mus musculus) [J]. Acta Anat (Basel), 1955; 24(3-4): 249-68.
[21] 陳筑, 高波, 李明云. BALB/c小鼠下頜第一磨牙的動態組織學觀察 [J]. 貴州醫藥,2012, 36(9): 776-778.
[22] Cohn SA. Development of the molar teeth in the albino mouse [J]. Am J Anat, 1957, 101: 295-320.
[23] Ruch JV. Tooth morphogenesis and differentiation [M]. In Dentin and Dentinogenesis, A. Linde, ed. (Boca Raton, FL: CRC Press), 1984, pp. 47-79.
[24] Dassule HR, MacMahon AP. Analysis of epithelial-mesenchymal interactions in the initial morphogenesis of the mammalian tooth [J]. Dev Biol, 1998, 202: 215-227.
[25] Chen J, Lan Y, Baek JA, et al. Wnt/beta-catenin signaling plays an essential role in activation of odontogenic mesenchyme during early tooth development [J]. Dev Biol, 2009, 334: 174-185.
[26] Neubüser A, Peters H, Ballings R, et al. Antagonistic interactions between FGF and BMP4 signaling pathways: A mechanism for positioning the sites of tooth formation [J]. Cell, 1997, 90: 147-55.
[27] O’Connell DJ, Ho JW, Mammoto T, et al. A Wnt-bmp feedback circuit controls intertissue signaling dynamics in tooth organogenesis [J]. Sci Signal, 2012; 5(206): ra4.
Establishment of first mandibular molar development of the time sequence in ICR mice
DONG Ning, LIU Yan, ZHANG Tian-tian, RUAN Jian-ping
(Clinical Research Center of Shaanxi Province for Dental and Maxillofacial Diseases, Department of Preventive Dentistry, College of Stomatology, Xi’an Jiaotong University, Xi’an 710004, China)
Objective This study aims to understand the characteristics of the time sequence of ICR mouse first mandibular molar tooth germ development through dynamic observation. Methods Tooth germ of Embryos (E11.5, E12.5, E13.5, E14.5, E15.5, E16.5, E17.5 and E18.5) and postnatal (PN1, PN2) mice were obtained. The heads (E11.5-E15.5) and mandibles (E16.5-PN2) of mice were dissected, fixed and embedded for serial sections and HE staining. All the results were assessed under light microscopy. Results The tooth germ underwent various development stages including the bud, cap and bell stages. Mouse odontogenesis was initiated at E11.5. Proliferation of oral epithelium formed the bud stage at E13.5. Then the cap stage was observed at E14.5- E15.5 and the bell stage was appeared beginning from E16.5. The pre-dentin was observed at PN1, as well as the dentin at PN2. Conclusions Establishing the regular development pattern of the first mandibular molar of ICR mice will provide a reliable basis for the future use in the specific tooth germ developmental research.
Odontogenesis; ICR Mouse; First mandibular molar tooth; Development
陜西省科技計劃項目(2015SF-153)。
董寧(1981-),男,研究方向:口腔預防醫學。Email: donnin@163.com。
阮建平(1959-),男,研究方向:牙齒發育及氟化物對牙齒的影響。Email: ruanjp@mail.xjtu.edu.cn。
R-33
A
1671-7856(2017) 04-0063-06
10.3969.j.issn.1671-7856. 2017.04.011
2016-11-01

