L35楊微體快繁技術的研究
李景濤 ,劉英軍 ,解小鋒 ,段春玲 ,趙文超 ,沈善超 ,周彩琴 ,范志強 *
(1.山東省林木種苗和花卉站,山東 濟南250014;2.山東省經濟林管理站;3.諸城市萬景源農業科技有限公司)
L35楊為歐美楊,雌株,干直,抗逆性強,適應范圍廣,育苗及造林成活率高,速生。楊樹作為我省人工栽培面積最大的樹種,目前普遍出現了種質退化以及病毒病嚴重的情況,造成這一現象最重要的原因是以苗繁苗、繁育種苗所用的種條老化,病毒積累嚴重,造成種條質量差。利用微體快繁技術,可部分脫去病毒,使楊樹良種復幼復壯,利用組培苗建設標準化采穗圃,用采穗苗的種條做為繁殖材料來建設良種繁育圃,可提高種苗的質量,對于推動良種的產業化健康發展具有重要意義。
1 材料與方法
1.1 材料的選擇
供試品種為L35楊,取春季大田生長的頂芽和帶腋芽的莖段作為外植體。
1.2 實驗方法
1.2.1 無菌體系的建立和外植體的誘導
取帶腋芽的莖段,剪去葉片,留葉柄基部,用流水沖洗干凈,在超凈工作臺上,用75%的酒精浸30秒,根據材料的幼嫩程序,0.1%的升汞溶液處理7~15min、無菌水沖洗5遍。切取頂芽和莖段接種到1/2MS空白培養基中。培養條件:溫度25℃,光照度2000~2500LX,光照每天12小時。
1.2.2 分化培養基的篩選
基本培養基為MS附加3%蔗糖,激素采用三因素 (6-BA,GA3,NAA,), 三水平 (6-BA 0.05、0.1、0.15 mg/L ;GA3 0、0.1、0.2 mg/L ;NAA 0.01、0.02、0.03 mg/L)的正交實驗設計,以分化系數為主要觀測指標,同時觀測愈傷組織的大小。實驗設計如下表
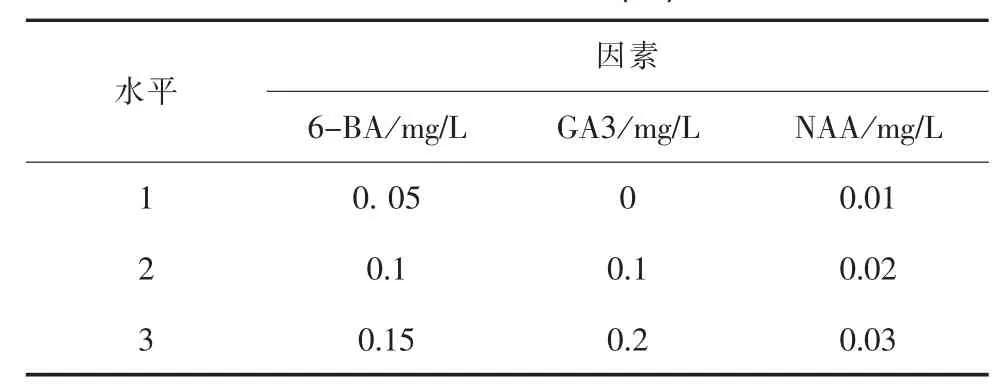
表1 不同濃度激素對L35楊試管苗增殖影響正交實驗設計L9(33)
切取誘導培養形成的頂芽和腋芽,切取2~3cm的嫩梢,轉入上述9種不同培養基中,每個組合25株,培養條件同上,培養25天后統計實驗結果。
1.2.3 生根培養基的篩選
基本培養基為1/2MS附加2%蔗糖,添加不同濃度 IBA(0.1、0.5、1.0、2.mg/L),研究單一生長素 IBA對生根率和愈傷情況的影響。
從繼代MS培養基中選取發育正常的長2.0cm以上的新梢作為生根材料,插入上述生根培養基中。每種處理25株生根苗,培養條件同上,觀察統計生根率和愈傷組織狀況。
2 實驗結果與分析
2.1 無菌體系的建立和外植體的誘導
實驗結果表明:L35楊外植體最適升汞處理時間為9min,經升汞表面消毒轉到1/2MS空白培養基中,平均污染率為75%。成活的外植體在培養基中培養7~9天后,頂芽開始生長,腋芽萌動,20天后長成2cm左右的嫩梢。
2.2 分化培養基的篩選
外植體在9個分化培養培養基中培養10天左右均開始誘導出不定芽,25天后各組合均誘出不定芽和愈傷組織,具體結果如表2:

表2 不同濃度激素對L35楊試管苗增殖影響結果
通過對實驗結果的統計分析表明:L35楊試管苗理論最適分化培養基為:MS+6-BA0.15mg/L+NAA0.03mg/L,與組合7相同,分化系數可達到4.6,愈傷組織偏大。實際最適分化培養基為MS+6-BA0.1mg/L+NAA0.02mg/L,分化系數可達4.0,愈傷組織大小適中。同時通過極差分析,三種激素對對L35楊試管苗分化的影響程度為 6-BA>NAA>GA3,6-BA對L35楊的分化系數影響最大。
鑒于在實際生產中,愈傷組織偏大會造成基部易褐化,在接種時會造成較大的工作量,因而在實際生產上采用的分化培養基為:MS+IBA0.1mg/L+NAA0.02mg/L+3%蔗糖。通過連續的分化培養,驗證分化培養基的穩定性。

表3 不同IBA濃度對L35楊試管苗生根的影響
2.3 生根培養基的篩選
接種到上述四種生根培養基中小苗培養15天左右長出放射狀不定根,20天后統計4個組合的生根率,結果如表3:
由上述實驗結果可知,L35楊的生根對IBA的反應較為敏感,四個不同濃度處理生根率均較高,但愈傷都較大,不利于馴化。根據這一實驗結果,將IBA 的濃度降為(0.01、0.02、0.05mg/L)三個梯度,以0.1做對照。實驗結果如下:

表4 低濃度IBA對L35楊試管苗生根的影響
實驗結果表明:L35楊試管苗最適生根培養基為1/2MS+IBA0.02mg/L+2%蔗糖生根率為97.22%,誘導的根系較多,呈白色放射狀,愈傷大小合適,長勢良好,馴化后成活率高。
3 結論
本實驗通過對L35楊微體快繁體系的研究,確定了最佳分化培養基為MS+6-BA0.1mg/L+NAA0.02mg/L+3%蔗糖,分化系數為4.0,分化系數較高,分化苗生長勢較好,愈傷適中。最適生根培養基為1/2MS+IBA0.02mg/L+2%蔗糖 ,生根率為97.22%,生根率較高,生根質量好,根系呈放射狀,愈傷組織小,有利于馴化成活。L35楊微體快繁體系的建立,為L35楊的工廠化和規模化育苗打下了基礎。

