XBP1在白癜風皮損及應激HaCaT細胞中的表達
李舒麗 楊鈺琪 張偉剛 朱冠男 高天文 李春英
?
·論著·
XBP1在白癜風皮損及應激HaCaT細胞中的表達
李舒麗 楊鈺琪 張偉剛 朱冠男 高天文 李春英
目的: 檢測XBP1在白癜風皮損組織及H2O2誘導的HaCaT細胞中的表達。方法: H2O2處理體外培養的HaCaT細胞。Real time PCR檢測白癜風皮損中及應激HaCaT細胞中XBP1的表達;ELISA檢測應激HaCaT細胞中特異性抑制劑抑制XBP1活化前后IL-6和IL-8的表達。結果: 白癜風皮損和應激HaCaT細胞中XBP1 mRNA顯著高于正常對照;應激HaCaT細胞中IL-6和IL-8水平高于空白對照組,抑制XBP1活化后兩者分泌減少。結論: XBP1在白癜風皮損組織中顯著上調,促進應激的HaCaT細胞分泌IL-6、IL-8。
XBP1; 角質形成細胞; 白癜風
白癜風是一種常見的自身免疫性疾病,我們及國外多項研究表明內質網應激在啟動白癜風自身免疫中發揮關鍵作用。內質網應激導致內質網內未折疊或錯誤折疊的蛋白蓄積,引起未折疊蛋白反應(unfolded protein response,UPR)。UPR主要表現為激活PERK-eIF2α,IRE1α-XBP1,ATF6三條信號通路,最終減輕或中止內質網應激反應,恢復細胞內環境穩態[1]。國內外多項遺傳學研究表明XBP1基因多態性顯著增加白癜風發病風險[2,3],但機制不清。當細胞發生UPR時IRE1α激活,能從XBP1 mRNA中特異剪切26個堿基的內含子,改變XBP1 mRNA閱讀框,其翻譯產物XBP1-s(活化型XBP1)可作為轉錄因子進入細胞核,調控UPR下游靶基因及多種細胞因子的表達,參與疾病發生及進展[4]。最近有研究發現,在氧化應激條件下,黑素細胞中XBP1表達活化促進炎癥介質釋放,參與白癜風發病[5]。事實上,白癜風表皮角質形成細胞也存在內質網應激損傷[6,7],基于其在表皮分布的數量及其產生炎癥介質的能力,我們推測其在白癜風局部免疫微環境中也發揮重要作用。因此,本課題旨在明確XBP1在白癜風組織及應激角質形成細胞中的表達,進一步研究其對白癜風局部免疫微環境的影響。
1 材料與方法
1.1 主要儀器與試劑 HaCaT細胞系本室常規保存,1640培養基和胎牛血清購自美國Gibco公司。細胞總RNA提取試劑盒購自日本Takara公司。兔抗人XBP1抗體購自美國Abcam公司,兔抗人XBP1-s抗體購自Protein Teq公司,鼠抗人β-actin 單克隆抗體購自Sigma公司,辣根過氧化物酶標記的山羊抗兔及山羊抗小鼠IgG購自康為世紀生物科技公司。水楊酸(SA)、雷帕霉素(RA)購自Sigma公司。IL-6、IL-8 ELISA檢測試劑盒購自美國RD公司。
1.2 方法
1.2.1 組織樣本的收集與保存 收集6例進展期白癜風患者皮損組織樣本,所有入選患者未伴發其他自身免疫性疾病且局部皮損無感染,患者皮損標本均于我科皮膚病理中心采用皮膚活檢的方法切取約1.0 cm×0.5 cm全層皮組織,健康皮膚對照組織來源于西京醫院整形科接受美容手術的非曝光部位正常全層皮組織。所有入組患者及對照均簽署知情同意并得到第四軍醫大學西京醫院倫理委員會同意。所有樣本于液氮中凍存待后續實驗。
1.2.2 HaCaT細胞培養及處理 HaCaT使用含10% FBS的1640培養基于37℃、5% CO2條件下培養。待HaCaT細胞生長至50%~60%融合時更換無血清培養基,16 h后予以0.5 mM H2O2處理24 h,收集細胞裂解液及上清用于后續檢測;為了抑制XBP1活化,采用其特異性抑制劑水楊酸(RA)[8]及雷帕霉素(RA)[9]預處理,即對HaCaT細胞予以SA(100 μM)、RA(100 nM)預處理6 h,對照組予以DMSO處理,之后予以0.5 mM H2O2處理24 h,收集細胞裂解液及上清用于后續檢測。
1.2.3 Real-time PCR檢測 Trizol試劑提取組織及細胞總RNA,按照試劑盒說明反轉錄成cDNA后進行Real-time PCR檢測,以β-actin表達量為內參照,采取2-△△CT方法計算各基因表達變化的相對倍數。內質網應激相關分子引物設計如下:PERK:正向引物5'-GGAAACGAGAGCCGGATTTATT-3'及反向引物5'-ACTATGTCCATTATGGCAGCTTC-3';IRE1α:正向引物5'-CACAGTGACGCTTCCTGAAAC-3'及反向引物5'-GCCATCATTAGGATCTGGGAGA-3';ATF6:正向引物5'-TCCTCGGTCAGTGGACTCTTA-3'及反向引物5'-CTTGGGCTGAATTGAAGGTTTTG-3';eIF2α:正向引物5'-CCGCTCTTGACAGTCCGAG-3'及反向引物:5'-GCAGTAGTCCCTTGTTAGTGACA-3';XBP1:正向引物5'-TATCCTGTTGGGCATTCTGGAC-3'及反向引物:5'-AGAAAGGGAGGCTGGTAAGGA-3';XBP1-s:正向引物5'-GCTGAGTCCGCAGCAGG-3'及反向引物5'-GTCCAGAATGCCCAACAGGA-3'。
1.2.4 XBP1活化檢測:提取細胞總RNA,采用PCR擴增獲得XBP1 mRNA產物,XBP1引物序列為:正向引物5'-CTGAAAAACAGAGTAGCAGCTCA-3'及反向引物5'-TGGGTAGACCTCTGGGAGCTCCT-3'。由于XBP1比活化型XBP1-s多26個堿基,該26個堿基序列上含有Apa-LI特異酶切位點,因此對擴增的XBP1 mRNA進行酶切反應,所得產物凝膠電泳,非活化型XBP1則被酶切為兩個片段,分別為278 bp和195 bp,而活化型XBP1(XBP1-s)則為447 bp大小的一個片段。
1.2.5 Western blot檢測 收集實驗處理組及對照組HaCaT細胞,RIPA裂解液裂解細胞提取總蛋白,經BCA法測定蛋白含量后進行聚丙烯酰胺凝膠電泳(5%濃縮膠,12%分離膠)。PVDF膜經甲醇激活后轉膜。轉膜后用TBST稀釋的5%脫脂奶粉室溫封閉1~4 h,予XBP1、XBP1-s及β-actin等一抗4℃孵育過夜。次日予以辣根過氧化物酶標記山羊抗兔IgG、山羊抗小鼠IgG二抗室溫孵育50 min。使用化學發光儀檢測結果。
1.2.6 ELISA檢測 收集實驗組及對照組細胞上清,嚴格按照ELISA檢測試劑盒操作說明檢測IL-6、IL-8分泌水平。
1.2.7 統計學方法 采用Graphpad Prism 5統計軟件進行分析。組間檢驗采用one-way anova檢驗法,各組數據兩兩比較,P<0.05差異有統計學意義。
2 結果
2.1 白癜風皮損組織中內質網應激相關分子表達情況 采用Real-time PCR檢測內質網應激相關分子PERK、eIF2α、ATF6、IRE1α、XBP1、活化型XBP1(XBP1-s) mRNA表達變化。結果顯示,白癜風皮損周ATF6表達下降,PERK、eIF2α、IRE1α、XBP1 mRNA表達水平均升高,但以XBP1及XBP1-s上調最顯著,分別為13.36±2.10倍和7.63±1.03倍(圖1)。
2.2 H2O2誘導HaCaT細胞XBP1及細胞因子IL-6、IL-8表達分泌情況 以H2O2處理HaCaT細胞24 h后,Real-time PCR結果顯示XBP1及XBP1-s分別上調14.84±3.26倍和13.32±2.71倍(圖2a),進一步Western blot檢測確定XBP1及其活化型XBP1-s表達也升高(圖2b);采用ELISA檢測細胞上清中分泌細胞因子IL-6、IL-8的水平,發現H2O2處理后,HaCaT細胞分泌的IL-6由(28.75±5.40)pg/mL上調至(63.50±8.99)pg/mL,IL-8由(46.47±5.65)pg/mL上調至(294.4±15.25)pg/mL(圖2c、d)。以上研究提示,應激的角質形成細胞中,XBP1表達升高且其活性增強,并可促進細胞因子IL-6、IL-8的分泌。
2.3 抑制XBP1活化對H2O2誘導HaCaT細胞分泌IL-6、IL-8的影響 我們在HaCaT細胞接受H2O2處理前,使用XBP1活化的特異性抑制劑預處理6 h發現水楊酸SA及雷帕霉素RA預處理均可明顯抑制H2O2誘導的XBP1活化(圖3a),且能顯著抑制H2O2對IL-6、IL-8的誘導效應(圖3b、c)。以上結果提示XBP1活化是促進角質形成細胞分泌細胞因子IL-6、IL-8的關鍵。
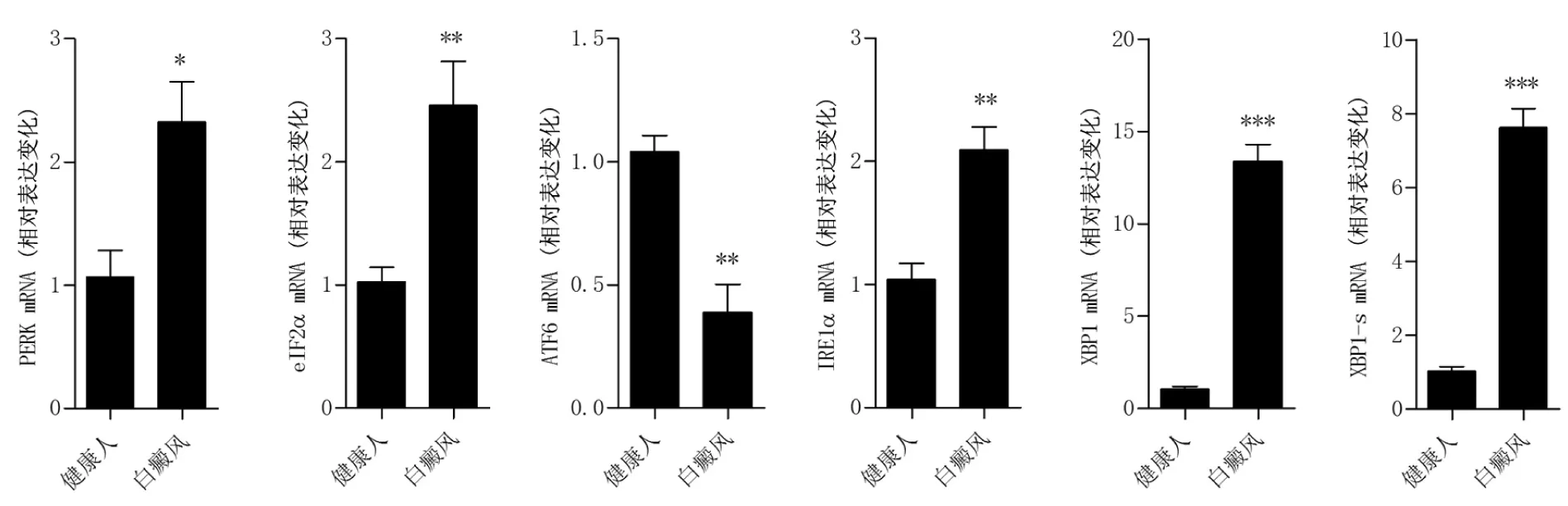
圖1 白癜風皮損周內質網應激關鍵分子表達水平變化(n=5,*P<0.05,**P<0.01,***P<0.001)
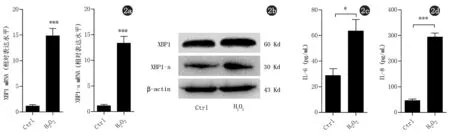
圖2 a:H2O2處理HaCaT細胞后XBP1 mRNA及XBP1-s mRNA水平(n=4,***P<0.001);b:蛋白表達活化水平;c:細胞因子IL-6分泌水平(n=4,*P<0.05);d:IL-8(n=4,***P<0.001)分泌水平

圖3 a:XBP1活化抑制劑SA、RA的抑制效率;b、c:SA、RA對H2O2誘導HaCaT細胞分泌IL-6(n=4,*P<0.05,**P<0.01)和IL-8(n=4,**P<0.01,***P<0.001)的影響
3 討論
大量研究證實,氧化應激是白癜風發病的重要原因,其引起的T細胞自身免疫反應是表皮黑素細胞破壞的關鍵效應環節[10],然而氧化應激啟動T細胞免疫應答的具體機制尚不完全清楚。近年來有學者提出,氧化應激可播散至內質網,形成內質網應激激活未折疊蛋白反應UPR,適度的UPR維持內質網內環境穩態,促進細胞生存;而過度激活的UPR促進下游一系列炎癥因子、趨化因子的表達及分泌,導致局部免疫微環境紊亂,參與疾病的發生發展[1,4]。以往有研究證實白癜風患者黑素細胞、角質形成細胞內質網均有損傷,表明白癜風表皮存在內質網應激[6,7]。我們通過檢測UPR的3條信號通路關鍵分子表達,首次發現PERK-eIF2α、IRE1α-XBP1信號在白癜風皮損組織均顯著升高,以XBP1上調最顯著。
國內外GWAS研究表明,XBP1基因多態性與白癜風發病密切相關[2,3]。以往有研究報道XBP1可激活MHC II類基因表達,調控漿細胞分化及炎癥因子表達,參與多種自身免疫反應以及腫瘤免疫的調控[2]。Toosi等發現酚劑處理誘導黑素細胞發生內質網應激,可激活未折疊蛋白反應UPR,啟動一系列炎癥因子表達[5]。除了黑素細胞,我們的研究首次發現,應激的角質形成細胞也發生內質網應激,其標志分子XBP1表達顯著上調,并進一步證實XBP1活化促進角質形成細胞促炎介質IL-6、IL-8的釋放。以往有研究證實IL-6可以上調黑素細胞ICAM表達,促進T細胞與黑素細胞的接觸,增強其殺傷效應[11]。IL-8也被證實在白癜風皮損高表達[12],可能促進皮損局部T細胞遷移,放大炎癥反應。綜合以上研究我們推測,應激的角質形成細胞激活XBP1,促進IL-6、IL-8的分泌,加重白癜風局部免疫紊亂,放大炎癥反應。此外,基于角質形成細胞在表皮中的分布數量及其釋放炎癥因子的能力,我們推測應激的角質形成細胞相較于黑素細胞,在白癜風免疫微環境中可能發揮更重要的作用。
綜上,本研究證實XBP1在白癜風組織表達顯著上調,且證實角質形成細胞在氧化應激條件下,活化XBP1信號促進炎癥因子IL-6、IL-8的釋放。我們的研究為XBP1參與白癜風發病提供了新的證據,進一步證實了XBP1活化在氧化應激誘導白癜風異常免疫中起重要作用。
[1] Hetz C. The unfolded protein response: controlling cell fate decisions under ER stress and beyond[J]. Nat Rev Mol Cell Biol,2012,13(2):89-102.
[2] Ren Y, Yang S, Xu S, et al. Genetic variation of promoter sequence modulates XBP1 expression and genetic risk for vitiligo[J]. PLoS Genet,2009,5:e1000523.
[3] Birlea SA, Jin Y, Bennett DC, et al. Comprehensive association analysis of candidate genes for generalized vitiligo supports XBP1, FOXP3, and TSLP[J]. J Invest Dermatol,2011,131(2):371-381.
[4] Wang S, Kaufman RJ. The impact of the unfolded protein response on human disease[J]. J Cell Biol,2012,197(7):857-867.
[5] Toosi S, Orlow SJ, Manga P. Vitiligo-inducing phenols activate the unfolded protein response in melanocytes resulting in upregulation of IL-6 and IL-8[J]. J Invest Dermatol,2012,132(11):2601-2609.
[6] Boissy RE, Liu YY, Medrano EE, et al. Structural aberration of the rough endoplasmic reticulum and melanosome compartmentalization in long-term cultures of melanocytes from vitiligo patients[J]. J Invest Dermatol,1991,97:395-404.
[7] Im S, Hann SK, Kim HI, et al. Biologic characteristics of cultured human vitiligo melanocytes[J]. Int J Dermatol,1994,33:556-562.
[8] Volkmann K, Lucas JL, Vuga D, et al. Potent and selective inhibitors of the inositol-requiring enzyme 1 endoribonuclease[J]. J Biol Chem,2011,286:12743-12755.
[9] Pfaffenbach KT, Nivala AM, Reese L, et al. Rapamycin inhibits postprandial-mediated X-box-binding protein-1 splicing in rat liver[J]. J Nutr,2010,140:879-884.
[10] Xie H, Zhou F, Liu L, et al. Vitiligo: How do oxidative stress-induced autoantigens trigger autoimmunity?[J]. J Dermatol Sci,2016,81(1):3-9.
[11] Kirnbauer R, Charvat B, Schauer E, et al. Modulation of intercellular adhesion molecule-1 expression on human melanocytes and melanoma cells: evidence for a regulatory role of IL-6, IL-7, TNF beta, and UVB light[J]. J Invest Dermatol,1992,98:320-326.
[12] Kemp EH, Waterman EA, Weetman AP. Autoimmune aspects of vitiligo[J]. Autoimmunity,2001,34:65-77.
(收稿:2016-09-07 修回:2016-11-10)
Expression of XBP1 in vitiligo lesions and stressed keratinocytes
LIShuli,YANGYuqi,ZHANGWeigang,ZHUGuannan,GAOTianwen,LIChunying.
DepartmentofDermatology,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032,China
LIChunying,E-mail:lichying@fmmu.edu.cn
Objective: To detect the expression level of XBP1 in vitiligo lesions and stressed HaCaT cells. Methods: The cultured HaCaT cells were treated by H2O2. The levels of XBP1 mRNA in the lesions of vitiligo and stressed HaCaT cells were detected by Real-time PCR. The level of IL-6 and IL-8 secretion were detected by ELISA in stressed HaCaT cells before and after treatment with XBP1 inhibitors. Results: The levels of the XBP1 mRNA expression in the lesions of vitiligo and stressed HaCaT cells were higher than that in the control group. The levels of IL-6 and IL-8 in the stressed HaCaT cells were higher than those in the normal HaCaT cells and decreased after the activation of XBP1 was inhibited. Conclusion: The expression level of XBP1 is up-regulated and promote the secretion of IL-6 and IL-8 in the stressed keratinocytes.
XBP1; keratinocytes; vitiligo
國家自然科學基金資助項目(編號:81602764,81502863)
第四軍醫大學西京皮膚醫院,西安,710032
李春英,E-mail: lichying@fmmu.edu.cn

