毒力因子乙酰基轉移酶抑制金黃色葡萄球菌感染引起的巨噬細胞死亡
馮世源 劉真真 胡桂秋 于水星 楊勇軍 杜崇濤 陳 巍
(吉林大學動物醫學學院,長春130062)
毒力因子乙酰基轉移酶抑制金黃色葡萄球菌感染引起的巨噬細胞死亡
馮世源 劉真真 胡桂秋 于水星 楊勇軍 杜崇濤 陳 巍
(吉林大學動物醫學學院,長春130062)
目的:探討毒力因子OatA在金黃色葡萄球菌感染中的作用。方法:在體外應用金黃色葡萄球菌野生菌株USA300、OatA基因缺失菌株和OatA基因回補菌株感染小鼠骨髓來源巨噬細胞,檢測細胞死亡情況;在體內應用滴鼻的方式構建金黃色葡萄球菌肺部感染模型,分離肺泡巨噬細胞,檢測細胞死亡情況。結果:體內和體外實驗均顯示,相比野生菌株和回補菌株,OatA基因缺失菌株能誘導顯著的巨噬細胞死亡。結論:在金黃色葡萄球菌感染中,OatA能抑制金黃色葡萄球菌感染引起的巨噬細胞死亡。
金黃色葡萄球菌;OatA;巨噬細胞;細胞死亡
金黃色葡萄球菌(Staphylococcus aureus)屬于葡萄球菌屬,革蘭陽性菌、條件致病菌,是一種常見的能夠引起人和動物感染的病原體[1-3]。金黃色葡萄球菌是引起化膿性疾病的重要致病菌,并且是毒力最強的化膿菌,常寄居于皮膚和軟組織中,引起創傷感染、膿腫、蜂窩織炎、乳腺炎[4,5];也是血液感染最常見的病原菌之一,常引起感染性心內膜炎、化膿性關節炎、敗血癥和膿毒癥等[6-8];此外,被金黃色葡萄球菌污染的食物或飼料能引起人類或動物的食物中毒[9,10]。
金黃色葡萄球菌致病過程非常復雜,涉及大量的毒力因子:細菌分泌的毒素和酶,如殺白細胞素、溶血毒素、腸毒素、中毒休克綜合征毒素、耐熱核酸酶、凝固酶、表皮剝脫毒素等,以及某些細胞壁結構,如葡萄球菌蛋白A、莢膜和纖連素結合蛋白等[11]。金黃色葡萄球菌的毒力因子眾多,仍有許多毒力因子未知或研究不深入,如乙酰基轉移酶(O-acetyltransferase A,OatA),該毒力因子雖然不是金黃色葡萄球菌治病的主要毒力因子,但是在抵抗宿主免疫反應中起著重要作用[12]。早在50年前,細菌細胞壁的肽聚糖和其他多糖的乙酰基轉移作用就被提出對細菌生存具有重要作用[13],而在金黃色葡萄球菌研究中,首次發現修飾肽聚糖使其具有溶菌酶抗性[14]。近代分子生物化學技術詳細闡明,乙酰基轉移酶的生物酶功能為將肽聚糖的N-乙酰胞壁酸殘基N端的乙酰基轉移至N-乙酰葡萄糖胺殘基的羧基上,從而空間結構上阻止細胞溶菌酶活性中心與肽聚糖結合,因此金黃色葡萄球菌具有抗溶菌酶抗性[15]。OatA為一種跨膜蛋白,普遍存在于革蘭陽性菌中,而在革蘭陰性菌中也存在結構不同作用類似的酶[16]。研究發現,金黃色葡萄球菌的OatA具有可溶性C端,在分子內部具有非典型的 Ⅰ 型信號肽裂酶解位點[17],而該信號肽酶一般作用于分泌性蛋白,提示OatA除了使金黃色葡萄球菌具有溶菌酶抗性,還可能存在其他功能。
在機體固有免疫應答中,OatA有怎樣的調節作用?目前研究發現,OatA基因缺失的金黃色葡萄球菌更易被宿主TLRs識別,且巨噬細胞對細菌的作用增加[18],NLRP3炎性體活化,IL-1β分泌增加[19]。OatA缺陷株毒力增強?其他細菌不一樣。在其他細菌如單核細胞增生性李斯特菌中,OatA缺失株能誘導易感細胞炎癥因子和趨化因子的早期分泌[20]。這些都表明OatA在病原菌抵抗宿主宿主固有免疫應答中具有重要作用。
因此,本實驗在前期構建金黃色葡萄球菌USA300 OatA基因缺失菌株和回補菌株的基礎上[21],在體外感染骨髓來源巨噬細胞 (Bone marrow derive macrophage,BMDM) ,在體內采用金黃色葡萄球菌肺部感染模型,初步探討,毒力因子OatA在金黃色葡萄球菌感染宿主過程中的作用。
1 材料與方法
1.1 材料 腦心浸出液肉湯 (BHI) 購自青島海博生物技術有限公司;瓊脂粉 (agar) 購自Santacruze 公司;細菌平板購自NEST公司;RPMI Medium 1640 購自Gibco公司;胎牛血清 (FBS) 購自Hyclone公司;雙抗和慶大霉素購自Amresco公司;溶菌酶 (Lysozyme)、溴化丙啶(Propidium iodide,PI) 購自Sigma公司;F4/80流式染料購自Biolegend公司。
1.2 方法
1.2.1 細菌及培養條件 金黃色葡萄球菌 USA300-TCH1516 本實驗室保存、OatA基因缺失菌株和回補菌株由本實驗構建[21], BHI培養基37℃、200 r/min培養至OD≈0.9(約為3.6×107CFU/ml),調整至2×109CFU/ml (3 ml OD=0.9細菌培養液,PBS洗2次,300 μl重懸,10倍稀釋測OD,計算原液CFU濃度,調整至2×109CFU/ml), 用于細胞實驗。
1.2.2 小鼠 C57BL/6J 小鼠購自北京華阜康生物技術股份有限公司,本實驗所用小鼠均為雌鼠,6~8周齡,體重為18~22 g,SPF (Specific pathogen free)級別,飼養于本實驗小鼠獨立通風式正壓/負壓飼養系統中。
1.2.3 溶菌酶抗性實驗 取100 μl上述三株菌種(100 μl/1.5 tube,2×109CFU/ml),均勻涂布于BHI瓊脂糖平板中;直徑為5 mm打孔器高壓滅菌后在BHI瓊脂糖平板中央打孔;向孔內加入50 μl 100 mg/ml溶菌酶;培養約16 h,測量抑菌環直徑。
1.2.4 細菌生長曲線測定 取30 μl保存菌種,接種于3 ml BHI 培養基中,每種細菌接3支。按實驗設置時間點,取50 μl,加入96孔板,使用酶標儀,在波長600 nm下,測定細菌OD值。
1.2.5 BMDM分離與培養 頸椎脫臼處死小鼠,75%酒精消毒;無菌分離小鼠后腿后,剝離后腿股骨和脛骨;每根骨頭用5 ml含0.1%雙抗的1640(RPMI medium 1640)不完全培養液沖洗骨髓;收集沖洗液,1 000 r/min離心10 min后,用1 ml 1640不完全培養基重懸細胞,靜置幾分鐘,待骨頭碎片沉淀,吸取上清。配置MGM條件培養基,即含10% FBS,0.1% 雙抗,25% L929細胞制備的條件培養液(LCCM)的1640完全培養液。一只小鼠分離的細胞平均分入10個90 mm細胞培養皿,加8 ml 1640完全培養液,37℃,5%CO2培養4 d換液。繼續培養至第6天,用1%胰酶消化細胞,計數。
1.2.6 細菌感染實驗 細胞準備:BMDM計數后,6孔板每孔接入1 ml含3×106個細胞的10% FBS 1640培養液,24孔板接入含0.5×106個細胞的0.5 ml 培養液,培養過夜;用不含血清的1640洗滌1次并加入對應培養液。
細菌準備:取30 μl上述三種菌種(100 μl/1.5 tube,2×109CFU/ml)接入3 ml BHI液體培養基中;37℃,200 r/min培養2.5 h至細菌生長對數早期(OD≈0.9);1640不完全培養液洗滌2次,并調整至2×109CFU/ml (過程見1.2.1),備用。
感染過程:細菌按MOI=20感染細胞1 h,用無菌PBS洗2次,換成含10% FBS ,0.2%雙抗,0.2%慶大的1640(注:若做LDH實驗,血清含量不超過5%),繼續培養5 h。
1.2.7 流式細胞儀檢測細胞死亡情況 實驗分組: 空白組(Blank)、陽性對照組(Positive Control)、未處理組(NT組)、野生菌株感染組(WT組)、基因缺失菌株感染組(ΔoatA組)、回補株感染組(Δ::OatA組)(處理方式見下文)。6孔板內巨噬細胞感染后,每孔加入1 ml不含EDTA的胰酶37℃消化3~5 min;每孔加入100 μl血清終止消化,輕柔吹下細胞,1 500 r/min離心5 min;500 μl PBS 洗滌1次,100 μl結合液(10 mmol/L HEPES、pH7.4;140 mmol/L NaCl;1 mmol/L MgCl2;5 mmol/L KCl;2.5 mmol/L CaCl2)重懸。 Positive control組60℃水浴5 min后10 μl PI染色10 min,空白組不做任何處理,其他每組加100 μl結合液重懸細胞,避光加入10 μl PI,染色10 min。染色后,每組加入200 μl PBS,經200目銅網過濾,流式細胞儀檢測。
1.2.8 LDH檢測細胞死亡 實驗分組:空白組,無細胞實驗孔,在相同培養條件下,收集培養液;最大LDH釋放組,未感染實驗孔細胞反復凍融3次,收集培養上清;陰性組:未感染實驗組;實驗組:細菌感染實驗孔。按上述細菌感染實驗方法,于24孔板中感染細胞,感染1 h后,用無菌PBS洗2次,換成含1640完全培養液繼續培養5 h,收集培養上清。
于96孔板中,每孔加入50 μl上述培養上清,再避光加入50 μl DH作用底物(詳見試劑盒),室溫避光靜置30 min,加入50 μl終止液(詳見試劑盒),酶標儀590 nm波長測OD值。LDH試劑盒購自普邁格Promega公司,詳細方法參考說明書。
1.2.9 小鼠肺部感染模型構建 培養細菌至OD≈0.9,PBS洗2次,調整至1×109CFU/ml;小鼠 (每組n=3) 麻醉后,滴鼻感染,每只小鼠滴20 μl細菌加10 μl PBS,即2×107CFU/只。感染48 h后,每只小鼠均用1 ml PBS 灌洗肺泡2次,共計2 ml小鼠肺泡灌洗液,1 000 r/min離心5 min收集細胞,用F4/80抗體和PI雙染計數各組巨噬細胞死亡數量比例[22]。
1.2.10 肺部感染組織荷菌情況測定 C57BL/6J 雌鼠(n=5),6~8周齡,體重為18~22 g,按上述實驗方法,麻醉后,以每只小鼠滴CFU=2×107劑量,滴鼻感染。感染48 h后,取肺泡灌洗液、血液和灌洗后的肺臟勻漿液,進行平板菌落數統計。
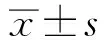
2 結果
2.1 溶菌酶抗性實驗檢測金黃色葡萄球菌毒力因子OatA具有抗溶菌酶特性 根據本實驗前期工作,利用同源重組, 成功構建金黃色葡萄球菌USA300毒力因子OatA基因缺失菌株;利用過表達載體pLI50成功回補OatA基因[21]。金黃色葡萄球菌毒力因子OatA 是金黃色葡萄球菌具有溶菌酶抗性的分子基礎。本實驗通過溶菌酶平板擴散實驗證明,金黃色葡萄球菌OatA基因使金黃色葡萄球菌具有溶菌酶抗性,圖1A、B所示。同時,PCR擴增OatA基因結果證實實驗使用的三種菌株的基因型正確(圖1C),且經測定,三株菌生長曲線一致(圖1D )。這些實驗數據為接下來的實驗提供了實驗基礎。
2.2 在體外OatA基因缺失菌株引起巨噬細胞大量死亡 為了探討在金黃色葡萄球菌感染巨噬細胞中OatA是否存在作用,本實驗首先在體外以MOI=20劑量的野生菌株、OatA基因缺失菌株和OatA基因回補菌株分別感染BMDMs 6 h,檢測細胞LDH釋放量。LDH為乳酸脫氫酶,當細胞死亡細胞膜破裂時,會釋放到細胞外,LDH釋放量即能說明細胞死亡情況。如圖2A所示,與野生菌株比,金黃色葡萄球菌OatA基因缺失株感染引起BMDMs大量死亡,而OatA基因回補株感染細胞,細胞死亡情況與野生株相似。進一步流式細胞術檢測細胞死亡情況,如圖2B、C所示,得到與圖2A相一致的結果。綜上所述,在體外實驗中, OatA基因與金黃色葡萄球菌感染引起的細胞死亡有關。
2.3 在體內OatA基因缺失菌株不利于細菌在體內生存 為了進一步驗證OatA基因缺失菌株在體內是否也同樣能誘導巨噬細胞大量死亡,本實驗采用滴鼻的方式構建金黃色葡萄球菌肺部感染模型,在體內探討OatA的作用。在小鼠麻醉后,每只小鼠緩慢滴入20 μl菌液,CFU為2×107,然后再滴10 μl BS,感染后2 d取小鼠肺泡灌洗液,PI和F480雙染后,流式細胞術檢測巨細胞死亡情況。如圖3所示,相比野生菌株,感染后,OatA基因缺失菌株能誘導肺泡巨噬細胞大量死亡,而OatA回補引起的細胞死亡的數量與野生菌株無差異(圖3A、B),與體外實驗結果一致。為了進一步探究OatA基因對細菌在體內生存的影響,在小鼠肺部感染金黃色葡萄球菌后,分析了血液、肺泡灌洗液和灌洗后肺臟的細菌負荷情況。結果顯示, 相比野生株和OatA基因回補株,OatA基因缺失株在血液和肺泡灌洗液中的負荷量顯著降低(圖3C~E)。該結果表明OatA基因缺失不利于金黃色葡萄球菌在體內生存。
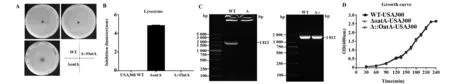
圖1 OatA基因使金黃色葡萄球菌USA300具有溶菌酶抗性Fig.1 OatA makes S.aureus resistant against lysozymeNote: A.Lysozyme resistance assay;B.Statistics of diameter of lysozyme bacteriostatic ring (n=3);C.Identification of OatA gene of three used bacteria in research by PCR;D.Bacterial growh curve.WT.Wild type of S.aureus USA300;ΔoatA(or Δ),OatA gene deletion strain;Δ::OatA(or Δ::),OatA gene complemented strain.
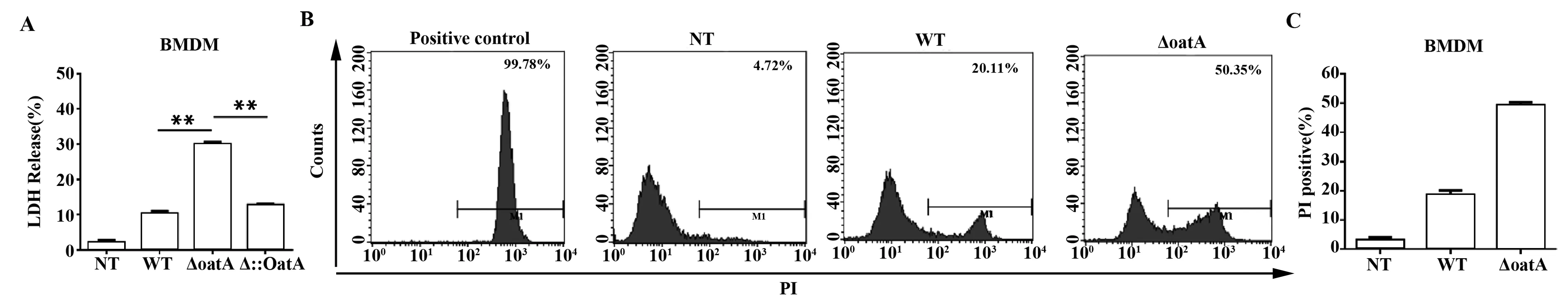
圖2 體外檢測巨噬細胞死亡Fig.2 Detection of macrophages death in vitroNote: A.Macrophages death was detected by lactate dehydrogenase (LDH) release assay;B.Macrophages death was detected by flow cytometry;C.Statistics of the data of flow cytometry.WT,wild type of S.aureus USA300;ΔoatA,OatA gene deletion strain;Δ::OatA,OatA gene complemented strain.**.P<0.01.
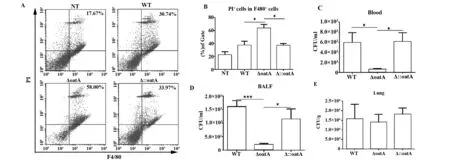
圖3 體內檢測巨噬細胞死亡Fig.3 Detection of macrophages death in vivoNote: A.Alveolar macrophages death was detected by flow cytometry;B.Statistics of the data of flow cytometry.C-E.Bacterial burden in the model of pulmonary infection with S.aureus.WT,wild type of S.aureus USA300;ΔoatA,OatA gene deletion strain;Δ::OatA,OatA gene complemented strain.*.P<0.05;***.P<0.001.
3 討論
病原菌入侵宿主后,巨噬細胞吞噬消化是天然免疫防御系統的第一道防線。巨噬細胞通過吞噬溶酶體裂解細菌,使細菌表面配體完全暴露,細菌內部配體大量釋放,有利于模式識別受體 (Pattern recognition receptor,PRRs)對細菌的識別,從而啟動全面的免疫反應,加快宿主對病原菌的清除或殺傷[23]。然而,為了在宿主中完成必要的生命周期,細菌如金黃色葡萄球菌已經具有許多逃避宿主免疫系統的機制,如摧毀白細胞、改變白細胞募集或功能及抑制補體系統和抗菌肽等[24,25],從而利于其定殖、感染、擴散。細菌毒力因子是其逃避機制的分子基礎。金黃色葡萄球菌成功建立感染是對抗巨噬細胞是必經之路。在眾多毒力因子中,乙酰轉移酶OatA在細菌逃避宿主免疫反應中具有重要[14,20,26]。本實驗和文獻[10]證明,在金黃色葡萄球菌感染中,毒力因子OatA使細菌具有抗溶菌酶能力,抗溶菌酶和巨噬細胞功能有直接關系嗎?從而,提高金黃色葡萄球菌在宿主中的存活能力(圖2)。
逃逸巨噬細胞殺傷不一定要殺死巨噬細胞,巨噬細胞死亡對細菌生存并不有利。如在沙門菌感染宿主細胞中,沙門菌外膜蛋白能夠維持SCVs (Salmonella-containing vacuoles) 的穩定性,持續活化Akt信號從而維持宿主細胞存活,利于細菌在胞內生存[27]。最近有文獻報道,被吞噬的金黃色葡萄球菌能夠在巨噬細胞內復制[28]。因此,在抑制巨噬細胞免疫反應的同時,維持巨噬細胞存活對于細菌是最好的結果。本實驗結果顯示,金黃色葡萄球菌能夠通過毒力因子OatA抑制巨噬細胞死亡。預示在金黃色葡萄球菌感染中,OatA參與維持巨噬細胞存活,而具體機制仍需要進一步闡明。但是,OatA是通過怎么樣的方式抑制巨噬細胞死亡,是直接還是間接,需要進一步證明。
在臨床應用方面,有文獻報道,OatA有望成為治療單核細胞增生性李斯特菌感染的候選靶點,通過某些物質靶向OatA提高單核細胞增生性李斯特菌對某些抗菌藥物(不局限于溶菌酶)的敏感性,從而治療細菌感染[29]。目前此方法只在治療單增李斯特菌感染中提出,在金黃色葡萄球菌感染中是否可行仍然未知。本實驗表明,缺失OatA能使金黃色葡萄球菌喪失溶菌酶抗性,誘導更多的巨噬細胞死亡,從而并破壞復制場所,加強機體對細菌的清除。因此,OatA有可能作為治療金黃色葡萄球菌感染的靶點,但仍需要進一步研究。
[1] McGuinness WA,Kobayashi SD,DeLeo FR.Evasion of neutrophil killing by staphylococcus aureus[J].Pathogens,2016,5(1):32-44.
[2] Melo TA,Dos Santos TF,de Almeida ME,etal.Inhibition of Staphylococcus aureus biofilm by Lactobacillus isolated from fine cocoa[J].BMC Microbiol,2016,16(1):250.
[3] Sakwinska O,Giddey M,Moreillon M,etal.Staphylococcus aureus host range and human-bovine host shift[J].Applied Environmental Microbiol,2011,77(17):5908-5915.
[4] Missiakas D,Schneewind O.Staphylococcus aureus vaccines: Deviating from the carol[J].J Exp Med,2016,213(9):1645-1653.
[5] Buzzola FR,Alvarez LP,Tuchscherr LP,etal.Differential abilities of capsulated and noncapsulated Staphylococcus aureus isolates from diverse agr groups to invade mammary epithelial cells[J].Infect Immunity,2007,75(2):886-891.
[6] de Lassence A,Hidri N,Timsit JF,etal.Control and outcome of a large outbreak of colonization and infection with glycopeptide-intermediate Staphylococcus aureus in an intensive care unit[J].Clin Infect Disea,2006,42(2):170-178.
[7] Hines AJ,Rawlins PV.Staphylococcus aureus Septicemia with a fatal transmural myocardial infarction in a 27-week-gestation twin infant: a case study[J].Neonatal Network,2010,29(2):75-85.
[8] McAdow M,Kim HK,Dedent AC,etal.Preventing Staphylococcus aureus sepsis through the inhibition of its agglutination in blood[J].PLoS Pathogens,2011,7(10):e1002307.
[9] 李彥媚,趙喜紅,徐澤智,等.金黃色葡萄球菌引起食物中毒的作用機制與其耐藥性的研究進展[J].現代生物醫學進展,2011,11(14):2786-2792.
[10] Le Loir Y,Baron F,Gautier M.Staphylococcus aureus and food poisoning[J].Gene Mole Res,2003,2(1):63-76.
[11] 陳菲菲,狄紅霞,藍樂夫.金黃色葡萄球菌重要毒力因子的功能及其抑制劑研究進展[J].科學通報,2013,58(36):3743-3752.
[12] Zecconi A,Scali F.Staphylococcus aureus virulence factors in evasion from innate immune defenses in human and animal diseases[J].Immunol Letters,2013,150(1-2):12-22.
[13] Abrams A.O-acetyl groups in the cell wall of Streptococcus faecalis[J].J Biological Chem,1958,230(2):949-959.
[14] Bera A,Herbert S,Jakob A,etal.Why are pathogenic staphylococci so lysozyme resistant? The peptidoglycan O-acetyltransferase OatA is the major deter minant for lysozyme resistance of Staphylococcus aureus[J].Mol Microbiol,2005,55(3):778-787.
[15] Pushkaran AC,Nataraj N,Nair N,etal.Understanding the structure-function relationship of lysozyme resistance in staphyl-ococcus aureus by peptidoglycan O-acetylation using molecular docking,dynamics,and lysis assay[J].J Chem Informat Modeling,2015,55(4):760-770.
[16] Moynihan PJ,Clarke AJ.Substrate specificity and kinetic characterization of peptidoglycan O-acetyltransferase B from Neisseria gonorrhoeae[J].J Biological Chem,2014,289(24):16748-16760.
[17] Schallenberger MA,Niessen S,Shao C,etal.Type I signal peptidase and protein secretion in Staphylococcus aureus[J].J Bacteriol,2012,194(10):2677-2686.
[18] Wolf AJ,Arruda A,Reyes CN,etal.Phagosomal degradation increases TLR access to bacterial ligands and enhances macrophage sensitivity to bacteria[J].J Immunol,2011,187(11):6002-6010.
[19] Shimada T,Park BG,Wolf AJ,etal.Staphylococcus aureus evades lysozyme-based peptidoglycan digestion that links phagocytosis,inflammasome activation,and IL-1beta secretion[J].Cell Host Microbe,2010,7(1):38-49.
[20] Aubry C,Goulard C,Nahori MA,etal.OatA,a peptidoglycan O-acetyltransferase involved in Listeria monocytogenes immune escape,is critical for virulence[J].J Infect Disea,2011,204(5):731-740.
[21] 張曉靜,馮世源,杜崇濤,等.金黃色葡萄球菌OatA基因敲除菌株及其回補菌株的構建[J].現代生物醫學進展,2015,15(15):2815-2819.
[22] Kitur K,Parker D,Nieto P,etal.Toxin-induced necroptosis is a major mechanism of Staphylococcus aureus lung damage[J].PLoS Pathogens,2015,11(4):e1004820.
[23] Faro-Trindade I,Willment JA,Kerrigan AM,etal.Characterisation of innate fungal recognition in the lung[J].PLoS One,2012,7(4):e35675.
[24] Reddick LE,Alto NM.Bacteria fighting back: how pathogens target and subvert the host innate immune system[J].Mol Cell,2014,54(2):321-328.
[25] Veldkamp KE,van Strijp JA.Innate immune evasion by staphylococci[J].Advan Exp Med Biol,2009,666:19-31.
[26] Bera A,Biswas R,Herbert S,etal.Influence of wall teichoic acid on lysozyme resistance in Staphylococcus aureus[J].J Bacteriol,2007,189(1):280-283.
[27] Mallo GV,Espina M,Smith AC,etal.SopB promotes phosphatidylinositol 3-phosphate formation on Salmonella vacuoles by recruiting Rab5 and Vps34[J].J Cell Biol,2008,182(4):741-752.
[28] Flannagan RS,Heit B,Heinrichs DE.Intracellular replication of Staphylococcus aureus in mature phagolysosomes in macrophages precedes host cell death,and bacterial escape and disse mination[J].Cell Microbiol,2016,18(4):514-535.
[29] Krawczyk-Balska A,Markiewicz Z.The intrinsic cephalosporin resistome of Listeria monocytogenes in the context of stress response,gene regulation,pathogenesis and therapeutics[J].J Applied Microbiol,2016,10(21):251-265.
[收稿2016-11-08 修回2017-01-22]
(編輯 許四平)
Virulence factor O-acetyltransferase A inhibits Staphylococcus aureus infection-induced macrophage death
FENGShi-Yuan,LIUZhen-Zhen,HUGui-Qiu,YUShui-Xing,YANGYong-Jun,DUChong-Tao,CHENWei.
CollegeofVeterinaryMedicine,JilinUniversity,Changchun130062,China
Objective:To explore the effect of the virulence factor OatA during Staphylococcus aureus infection.Methods: In vitro,wild type of Staphylococcus aureus USA300,OatA gene deletion strain or OatA gene complemented strain were used to infect mice bone marrow divided macrophages (BMDMs).Subsequently BMDMs were separated and the case of cell death were detected.In vivo,mice pulmonary infection model was constructed with nasal inhalation of Staphylococcus aureus.Alveolar macrophages were isolated and the case of cell death were detected.Results: In contrast to wild type and OatA gene complemented strain,OatA gene deletion strain induced severer macrophage death both in vitro and in vivo.Conclusion: The virulence factor OatA inhibits Staphylococcus aureus infection-induced macrophage death.
Staphylococcus aureus;OatA;Macrophages;Cell death
10.3969/j.issn.1000-484X.2017.05.009
馮世源(1991年-), 男,在讀碩士,主要從事病原微生物與免疫方面的研究。
及指導教師:陳 巍(1972年-),女,碩士,碩士生導師,主要從事動物生理學和免疫學方面的研究,E-mail:chew-cc@jiu.edu.cn.
R378.11
A
1000-484X(2017)05-0679-05