NETs在自身免疫性疾病發病機制中的作用研究進展①
肖 芳 鄭成云 蔣衛東 綜述 陳 麗 審校
(山東大學第二醫院干部保健科,濟南250033)
NETs在自身免疫性疾病發病機制中的作用研究進展①
肖 芳 鄭成云②蔣衛東 綜述 陳 麗③審校
(山東大學第二醫院干部保健科,濟南250033)
中性粒細胞作為人體固有免疫系統的哨兵,在血液的非特異性細胞免疫系統中起著十分重要的作用,它們由骨髓分化發育成熟后,進入血液或組織,當微生物病原體特別是化膿性細菌入侵、炎癥發生時,在多種炎癥和細胞因子的介導下,它們便會被迅速招募并趨化至炎癥部位,通過分泌細胞因子、脫顆粒和吞噬作用等殺滅并清除病原體。在2004年,Zychlinsky等研究發現12-豆蔻酸-13-乙酸佛波醇(Phorbol 12-myristate 13-acetate,PMA)可誘導中性粒細胞活化并釋放出包裹著組蛋白、彈性蛋白酶等多種胞內物質的網狀DNA纖維結構,該結構具有包裹、限制及殺傷病原菌的作用。這一中性粒細胞釋放的防御反應性網狀DNA纖維結構被命名為NETs[1,2]。隨著NETs在病原微生物所致的感染炎癥性疾病的抗病作用機制逐漸闡明的同時,NETs釋放引起胞內成分外露、清除缺陷及隨后反應過程的調節失衡在諸如系統性紅斑狼瘡、類風濕關節炎、脈管炎等多種自身免疫性疾病病程中的致病作用也不斷被人們揭示。目前對NETs導致自身免疫性疾病發病和進展的具體機制仍不明確,本文就NETs特點及其產生機制和NETs在自身免疫疾病發病機制中的作用方面的研究進展進行綜述。
1 NETs的產生及分子機制
中性粒細胞形成NETs的過程稱為NETosis,這是一種有別于細胞壞死和凋亡的特殊細胞死亡過程[3],可以被多種有機和或無機因素始動,如脂多糖(LPS)、PMA、免疫復合物、一氧化氮、過氧化氫等[4,5]。活化后的中性粒細胞在細胞形態學上首先表現為核染色質解聚,其后常染色質和異染色質變得難以區分,同時,細胞核分葉的特征也逐漸消失;在這一過程中,中性粒細胞彈性蛋白酶(Neutrophil elastase,NE)從胞漿內的嗜天青顆粒釋放出來并被轉運至細胞核,附著并降解組蛋白;隨后,顆粒蛋白膜及核膜逐漸趨于崩解,髓過氧化物酶(Myeloperoxidase,MPO)便通過疏松的核膜進入細胞核與解聚的染色質混合并繼續降解核染色質;最后細胞膜崩解破裂,使包裹著組蛋白、MPO、NE等多種胞內蛋白質的網狀染色質纖維釋放至細胞外基質[6,7](圖1為LPS誘導人中性粒細胞活化釋放NETs的實驗結果,網狀綠色熒光結構為NETs)。
研究表明,NETosis的分子機制可能有以下幾個方面:活性氧簇(Reactive oxygen species,ROS)打亂了NE和蛋白多糖矩陣的聯系,而后者在細胞靜息狀態下可以下調蛋白酶活性,從而導致了NE及后續MPO從顆粒蛋白內釋放,ROS還可以促使脂質過氧化,在離子而非大分子誘導劑存在下使膜通透性增加[8];NADPH氧化酶及其后續raf-MEK-ERK通路的活化也與NETosis發生有關[9];另外,Wang等[10]研究發現組蛋白的瓜氨酸脫亞氨化修飾是NETosis發生的另一可能機制,通過阻斷這一修飾過程的關鍵酶PAD4可以阻止NETs產生。大量證據表明組蛋白的瓜氨酸化為自身抗原的主要來源,阻斷PAD4可以遏制小鼠關節炎和炎癥性腸病等小鼠模型病程的發展[11,12]。新近有研究直接證實PAD4阻斷劑Cl-amidine抑制自發狼瘡小鼠模型發生NETosis,從而減少了自身抗體產生,降低了抗原抗體免疫復合物在模型鼠腎臟的沉積,改善內皮細胞功能及削弱疾病活動[13]。因此,NETosis涉及多因素、多環節的共同參與,其具體機制人們目前了解甚少。
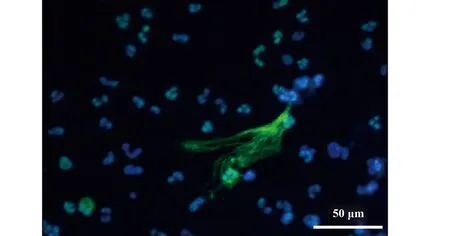
圖1 體外LPS誘導健康人中性粒細胞NETs形成Fig.1 LPS can elicit NETs release from healthy human neutrophils in vitro system
2 NETosis成為自身抗原的潛在來源
隨著NETs及NETosis過程的不斷闡明,人們對中性粒細胞參與免疫反應的機制有了新的認識。Brinkmann等[14]研究結果已表明在暴露于細菌、LPS、PMA等環境下中性粒細胞可以發生NETosis,這一過程導致中性粒細胞胞內成分外露,包括核染色質和胞內多種蛋白成分。通過電鏡可以觀察到細菌被包裹在含有DNA和組蛋白的NETs網狀纖維中,這種現象很容易讓人們聯想到狼瘡免疫復合物中的自身抗原與細菌佐劑對自身免疫反應的激活作用。如果機體對NETs中自身抗原不能建立穩固的免疫耐受,則針對于NETs內含有的核染色質和其他蛋白成分的自身抗體就會相繼出現。
值得注意的是,在NETosis發生過程NETs中的自身抗原已經在多種酶和ROS作用下進行了修飾變型。組蛋白去亞氨化發生于NE、MPO等蛋白酶裂解組蛋白的過程中,大大降低了DNA和組蛋白的相互作用使得原本緊密的核染色質變得疏松[10]。另外,酪氨酸和色氨酸殘基被氧化也改變了多種核內自身抗原的功能[15]。對這些蛋白的修飾能夠產生很多潛在的自身抗原表位,如果免疫耐受沒能相應形成就可能引發自身免疫反應。
3 NETs在自身免疫疾病中的作用
自身免疫性疾病是指機體對自身抗原發生免疫反應而導致自身組織損害所引起的疾病。研究表明,NETosis發生導致的胞內結構暴露已成為機體自身抗原的主要來源,而與B細胞相互作用誘導自身抗體的產生在自身免疫疾病易感性的個體中發揮著重要致病或誘導疾病發生的作用。
3.1 NETs與系統性紅斑狼瘡 系統性紅斑狼瘡(Systemic lupus erythematosus,SLE)是一種累及多系統、多器官的自身免疫性疾病,患者體內有針對DNA、核染色質、DNA聯合蛋白及包括NETs成分在內的大量致病性自身抗體和免疫復合物,能夠造成多種組織損傷。狼瘡免疫復合物中的自身DNA含有多肽抗菌素LL-37,能夠激活漿細胞樣樹突狀細胞(plasmacytoiddendriticcell,pDC)表面的Toll樣受體9(Toll like receptor 9,TLR9),促使IFN-α合成并保護核酸不被核酸酶降解。在SLE患者,這些DNA-抗菌復合物釋放出胞外的NETosis過程顯著加強,從而介導機體自身抗體的大量產生[16,17]。多年來,DNA-抗DNA抗體免疫復合物被認為是導致狼瘡腎炎(Lupus nephritis,LN)腎臟損害的主要免疫復合物之一,電鏡和免疫熒光可以觀察到LN腎臟內皮下和上皮下存在大量染色質、抗DNA的IgG抗體、補體組成的免疫復合物。針對自身核成分的自身抗體的產生機制及免疫復合物中核染色質的來源仍不明確,而NETs顯然成為了導致狼瘡腎臟、皮膚損害和其他自身免疫性疾病靶器官損害的免疫復合物中自身抗原的源頭[18]。近來研究表明,活化的中性粒細胞可能為循環和原位免疫復合物中核染色質的重要來源。狼瘡患者血清中的免疫復合物包含中性粒細胞抗菌蛋白LL-37、MPO、蛋白酶-3(PR-3)及自身DNA[17],與NETs中含有的成分高度相似,而對狼瘡患者和小鼠動物模型腎臟活檢的結果已驗證了NETs存在[18,19]。關于免疫復合物中NETs是如何沉積于腎小球局部及免疫復合物是如何形成仍需要進一步研究,而這對闡明狼瘡腎臟損害機制至關重要。
3.2 NETs與類風濕關節炎 類風濕關節炎(Rheumatoid arthritis,RA)是一種慢性的,表現為外周關節非特異性炎癥的自身免疫性疾病。患病關節及其周圍組織呈現進行性破壞,滑膜炎持久反復發作,可導致關節內軟骨和骨的破壞,關節功能障礙,甚至殘疾。目前RA的病因仍不清楚,但已經有大量的研究證據表明RA的發生與抗瓜氨酸肽抗體(Anti-citrullinated protein antibodies,ACPAs)有關,其中抗環瓜氨酸肽抗體(CCP)已成為目前診斷RA的重要指標之一。ACPAs存在于超過2/3的RA病人血清中,并且比類風濕因子(Rheumatoid factors,RF)更具特異性[20]。Khandpur等[21]發現在RA患者循環和關節滑液的中性粒細胞比健康對照更容易發生NETosis,并且NETosis與ACPAs及系統炎癥指標的存在及水平相關,這可能與IL-17α和TNF-α對NETs的激活作用有關,同時瓜氨酸化的波形蛋白及α-烯醇化酶均能在RA患者來源的NETs中檢出,其形成的自身抗體又能反過來誘導NETs生成,而NETs大量生成后又可以促進成纖維細胞IL-8的產生。另有研究表明,瓜氨酸化H4組蛋白抗體能夠在約64% RA患者血清中檢測到并與抗CCP滴度相關,同時瓜氨酸化H4組蛋白在NETs存在并成為RA患者血清自身抗體的靶抗原,建立了NETs作為攜載自身抗原的形式參與RA疾病發病的可能相關關系[22]。因此,NETs可以作為自身抗原的來源,由此形成的自身抗體ACPAs又能反過來誘導NETs形成并繼發后續炎癥反應。
3.3 NETs與ANCA相關性小血管炎 ANCA相關性小血管炎(Small-vessel vasculitis,SVV)也是一種系統性自身免疫性疾病,其基本病理改變為壞死性小血管炎癥。ANCA的靶抗原存在于白細胞胞漿中,中性粒細胞的主要顆粒和單核細胞溶酶體含有兩種主要靶抗原:MPO和PR-3。由于在NETs也大量存在這兩種蛋白,因此推測ANCA相關性血管炎可能與NETosis發生有關。Kessenbrock等[23]報道了SVV患者血清來源的IgG在體外比對照組血清IgG更容易誘導NETs產生,并且這些抗體以NETs含有的MPO和PR3蛋白為靶抗原,而循環中MPO-DNA免疫復合物能夠在患者特別是處于疾病活動期的病人血清中檢測出,后對患者腎臟進行針刺活檢證實了NETs在病損的腎小球和基質間的沉積,上述證據均表明NETs形成能夠引起血管炎及促進針對NET內成分的自身免疫反應。另外,SVV患者罹患靜脈血栓事件風險很高,而NETs很可能成為聯結血小板和血液促凝成分的載體促進血栓形成。近來有研究發現SVV患者中性粒細胞能夠釋放NETs和含有組織因子(TF)的微囊泡,NETosis在處于活動期的患者更加顯著,而來源于患者和活動期病人血清樣本及從這些病例獲得的IgG能夠誘導表達TF的NETs和微囊泡大大生成[24]。尸檢顯示在SVV肺泡出血的患者中伴有中性粒細胞浸潤和嚴重新月體型腎小球腎炎,NETs不僅大量出現在腎臟組織,也存在于血栓中。在顯微鏡下多血管炎(MPV)患者血栓NETs檢出率要比MPV無關的血栓高的多[25]。正因為NETs攜載的MPO、PR-3自身抗原為ANCAs靶抗原,結合多項研究可以看出NETosis在自身免疫小血管炎的發病機制中起了關鍵作用,而由此可以推測NETosis和ANCAs的調節系統異常可能存在著惡性循環。
3.4 NETs與Felty綜合征 Felty綜合征是指除有典型的類風濕關節炎臨床表現外,還伴有脾臟腫大和白細胞計數減少的一種嚴重型類風濕關節炎,該病患者血清中能夠檢測到針對組蛋白脫亞氨化修飾的自身抗體,并能夠誘導NETosis發生[26],提示NETs可能在該疾病病程中發揮一定作用,但具體機制尚不清楚。
4 總結
自身免疫性疾病是一類發病機制復雜、病程遷延難愈的疾病,對于自身免疫領域的研究從未間斷,而新近NETs的發現可以被視為自身免疫異常發生機制的重大突破。自NETs被發現后,其生物學意義就一直都是研究的熱點。NETs可能是通過釋放自身抗原,與B細胞相互作用等誘導自身抗體的產生,參與自身免疫性疾病的發生和發展。目前關于NETs的致病作用主要集中在SLE、RA等系統性自身免疫性疾病中,對于器官特異性自身免疫性疾病如橋本氏甲狀腺炎、1型糖尿病、潰瘍性結腸炎等發生和進展是否也有NETs參與有待進一步探索,為進一步揭示自身免疫性疾病的發病機制、尋找預防和精準治療該類疾病奠定基礎。
[1] Brinkmann V,Reichard U,Goosmann C,etal.Neutrophil extracellular traps kill bacteria [J].Science,2004,303(5663):1532-1535.
[2] Kobayashi Y.Neutrophil biology:an update [J].EXCLI J,2015,14:220-227.
[3] Yipp BG,Kubes P.NETosis:how vital is it? [J].Blood,2013,122(16):2784-2794.
[4] Cheng OZ,Palaniyar N.NET balancing:a problem in inflammatory lung diseases [J].Front Immunol,2013,4:1.
[5] Branzk N,Papayannopoulos V.Molecular mechanisms regulating NETosis in infection and disease [J].Semin Immunopathol,2013,35(4):513-530.
[6] Pruchniak MP,Kotula I,Manda-Handzlik A.Neutrophil extrace-llular traps (Nets) impact upon autoimmune disorders [J].Cent Eur J Immunol,2015,40(2):217-224.
[7] Kaplan MJ,Radic M.Neutrophil extracellular traps:double-edged swords of innate immunity [J].J Immunol,2012,189(6):2689-2695.
[8] Papayannopoulos V,Metzler KD,Hakkim A,etal.Neutrophil elastase and myeloperoxidase regulate the formation of neutrophil extracellular traps [J].J Cell Biol,2010,191(3):677-691.
[9] Hakkim A,Fuchs TA,Martinez NE,etal.Activation of the Raf-MEK-ERK pathway is required for neutrophil extracellular trap formation [J].Nat Chem Biol,2011,7(2):75-77.
[10] Wang Y,Li M,Stadler S,etal.Histone hypercitrullination mediates chromatin decondensation and neutrophil extracellular trap formation [J].J Cell Biol,2009,184(2):205-213.
[11] Willis VC,Gizinski AM,Banda NK,etal.N-alpha-benzoyl-N5-(2-chloro-1-iminoethyl)-L-ornithine amide,a protein arginine deiminase inhibitor,reduces the severity of murine collagen-induced arthritis [J].J Immunol,2011,186(7):4396-4404.
[12] Chumanevich AA,Causey CP,Knuckley BA,etal.Suppression of colitis in mice by Cl-amidine:a novel peptidylarginine deiminase inhibitor [J].Am J Physiol Gastrointest Liver Physiol,2011,300(6):G929-G938.
[13] Knight JS,Zhao W,Luo Wetal.Peptidylarginine deiminase inhibition is immunomodulatory and vasculoprotective in murine lupus [J].J Clin Invest,2013,123(7):2981-2993.
[14] Brinkmann V,Zychlinsky A.Beneficial suicide:why neutrophils die to make NETs [J].Nat Rev Microbiol,2007,5(8):577-582.
[15] Heinecke JW.Mass spectrometric quantification of amino acid oxidation products in proteins:insights into pathways that promote LDL oxidation in the human artery wall [J].FASEB J,1999,13(10):1113-1120.
[16] Garcia-Romo GS,Caielli S,Vega B,etal.Netting neutrophils are major inducers of type I IFN production in pediatric systemic lupus erythematosus [J].Sci Transl Med,2011,3(73):73ra20.
[17] Lande R,Ganguly D,Facchinetti V,etal.Neutrophils activate plasmacytoid dendritic cells by releasing self-DNA-peptide complexes in systemic lupus erythematosus [J].Sci Transl Med,2011,3(73):73ra19.
[18] Knight JS,Kaplan MJ.Lupus neutrophils:′NET′ gain in understanding lupus pathogenesis [J].Curr Opin Rheumatol,2012,24(5):441-450.
[19] Pisitkun P,Ha HL,Wang H,etal.Interleukin-17 cytokines are critical in development of fatal lupus glomerulonephritis [J].Immunity,2012,37(6):1104-1115.
[20] Alexiou I,Germenis A,Ziogas A,etal.Diagnostic value of anti-cyclic citrullinated peptide antibodies in Greek patients with rheumatoid arthritis [J].BMC Musculoskelet Disord,2007,8:37.
[21] Khandpur R,Carmona-Rivera C,Vivekanandan-Giri A,etal.NETs are a source of citrullinated autoantigens and stimulate inflammatory responses in rheumatoid arthritis [J].Sci Transl Med,2013,5(178):178ra140.
[22] Pratesi F,Dioni I,Tommasi C,etal.Antibodies from patients with rheumatoid arthritis target citrullinated histone 4 contained in neutrophils extracellular traps [J].Ann Rheum Dis,2014,73(7):1414-1422.
[23] Kessenbrock K,Krumbholz M,Schonermarck U,etal.Netting neutrophils in autoimmune small-vessel vasculitis [J].Nat Med,2009,15(6):623-625.
[24] Kambas K,Chrysanthopoulou A,Vassilopoulos D,etal.Tissue factor expression in neutrophil extracellular traps and neutrophil derived microparticles in antineutrophil cytoplasmic antibody associated vasculitis may promote thromboinflammation and the thrombophilic state associated with the disease [J].Ann Rheum Dis,2014,73(10):1854-1863.
[25] Nakazawa D,Tomaru U,Yamamoto C,etal.Abundant neutrophil extracellular traps in thrombus of patient with microscopic polyangiitis [J].Front Immunol,2012,3:333.
[26] Dwivedi N,Upadhyay J,Neeli I,etal.Felty′s syndrome autoantibodies bind to deiminated histones and neutrophil extracellular chromatin traps [J].Arthritis Rheum,2012,64(4):982-992.
[收稿2016-05-27 修回2016-06-12]
(編輯 張曉舟)
10.3969/j.issn.1000-484X.2017.05.032
①本文受山東省自然科學基金(ZR2016HP19)和山東省重點研發計劃(2015GSF118033)資助。
肖 芳(1985年-),女,碩士,主治醫師,主要從事自身免疫甲狀腺疾病的基礎及臨床研究,E-mail:xiaofangqshdd@163.com。
及指導教師:陳 麗(1957年-),女,教授,博士生導師,主要從事內分泌疾病的基礎與臨床研究,E-mail:chenli3@medmail.com.cn。
R392.1
A
1000-484X(2017)05-0781-04
②山東大學第二醫院血液內科,濟南250033。
③山東大學齊魯醫院內分泌科,濟南250012。