左乙拉西坦注射液與3種注射液的配伍穩定性考察
黃鳳玲,宋艷霞,李直,馬曉黎,楊明波,李波(抗生素研究與再評價四川省重點實驗室/成都大學四川抗菌素工業研究所,成都610052)
左乙拉西坦注射液與3種注射液的配伍穩定性考察
黃鳳玲*,宋艷霞,李直,馬曉黎,楊明波,李波#(抗生素研究與再評價四川省重點實驗室/成都大學四川抗菌素工業研究所,成都610052)
目的:考察左乙拉西坦(Lev)注射液與3種注射液的配伍穩定性。方法:取Lev注射液各1 000 mg分別與0.9%氯化鈉注射液100 mL、5%葡萄糖注射液100 mL和乳酸鈉林格注射液100 mL配伍,在25℃未避光條件下,分別于配制后24 h不同時間點觀察各配伍液的顏色和澄清度,測定其pH值和不溶性微粒數,并采用高效液相色譜法測定各配伍液中相關雜質(雜質A、B、C、D和2-羥基吡啶)和Lev的含量。結果:在上述條件下,各配伍液在24 h內均為無色澄清液體,pH值無明顯變化(RSD<1%,n=7),不溶性微粒數均未超出2015年版《中國藥典》規定的范圍;未檢出雜質B和雜質C,其余雜質的含量均符合國外各藥典的限度要求;Lev的相對百分含量無明顯變化(RSD<1%,n=7)。結論:Lev注射液與0.9%氯化鈉注射液、5%葡萄糖注射液和乳酸鈉林格注射液配伍后,在25℃未避光條件下24 h內保持穩定。
左乙拉西坦注射液;氯化鈉注射液;葡萄糖注射液;乳酸鈉林格注射液;配伍;穩定性;高效液相色譜法
左乙拉西坦(Levetiracetam,Lev)為吡咯烷酮衍生物,于2000年4月獲FDA批準上市,主要用于治療局限性和繼發性全身性癲癇,具有較強的抗癲癇作用,可有效地控制癲癇發作[1-4]。目前,Lev注射液的原研制劑(商品名:Keppra)尚未獲準進入我國市場,國產Lev注射液也正在進行生產報批。鑒于此,本研究參考美國藥典(USP)的方法[5],對國產Lev注射液與3種常用注射液[0.9%氯化鈉注射液(0.9%NS)、5%葡萄糖注射液(5% GS)和乳酸鈉林格注射液]的配伍穩定性進行考察,以期為其質量管理和臨床應用提供參考。
1 材料
1.1 儀器
LC-2010 CHT型液相色譜系統、LC-20AD型液相色譜系統(日本島津公司);FE20型pH計(上海梅特勒-托利多儀器有限公司);YB-Ⅱ型澄明度檢測儀(天津大學精密儀器廠);GWJ-4型智能微粒檢測儀(天津天大天發科技有限公司)。
1.2 藥品與試劑
Lev注射液[成都天臺山制藥有限公司,批號:130402(Ⅱ),規格:5 mL∶500 mg];0.9%NS(四川科倫藥業股份有限公司,批準文號:國藥準字H51021158,規格:500 mL∶4.5 g);5%GS(批準文號:國藥準字H51022443,規格:500 mL∶25 g)和乳酸鈉林格注射液(批準文號:國藥準字H20043897,規格:500 mL)均購自四川美大康佳樂藥業有限公司。
Lev對照品(美國藥典委員會,批號:1359404,純度:99.8%);Lev工作對照品(用Lev對照品自標化,海南萬特制藥有限公司,批號:S130402,純度:100.6%);2-羥基吡啶對照品(上海阿拉丁生化科技股份有限公司,批號:1040918,純度:97%);(S)-2-(2-吡咯烷酮-1)丁酸對照品(歐洲藥品質量管理局,以下簡稱雜質A,批號:Y0001254,純度:100%);(2Z)-2-(2-吡咯烷酮-1)丁酰胺對照品(歐洲藥品質量管理局,以下簡稱雜質B,批號:Y0001255,純度:100%);(S)-N-(1-氨-1-丁酮-2)-4-氯丁酰胺對照品(美國藥典委員會,以下簡稱雜質C,批號:1359426,純度:100%);(S)-2-氨基丁酰胺對照品(美國藥典委員會,以下簡稱雜質D,批號:1359437,純度:100%);雜質D工作對照品[(S)-2-氨基丁酰胺鹽酸鹽(用雜質D自標化),海南萬特制藥有限公司,批號:ABAH-1211170,純度:100%];輔料[氯化鈉(江蘇省勤奮藥業有限公司,批號:20120827,純度:99.9%);氫氧化鈉(湖南爾康制藥股份有限公司,批號:20111105,純度:99.7%);冰乙酸(廣東省臺山市新寧制藥有限公司,批號:20130203,純度:99.8%)]。乙腈為色譜純,水為純凈水。
2 方法與結果[5]
2.1 色譜條件
2.1.1 色譜條件一色譜柱:Agilent Zorbax SB-C18(250 mm×4.6 mm,5μm);流動相(簡稱流動相一):癸烷磺酸鈉溶液(取癸烷磺酸鈉1.22 g,用水適量溶解,加磷酸1.3 mL,用水稀釋至1 000 mL,用20%氫氧化鉀溶液調節pH值至3.0)-乙腈(82∶18,V/V);檢測波長:200 nm;流速:1.0 mL/min;柱溫:30℃;進樣量:50μL。
2.1.2 色譜條件二色譜柱:Welchrom C18(150 mm× 4.6 mm,5μm);流動相:乙腈-2.7 g/L磷酸二氫鉀水溶液(用2%氫氧化鉀調節pH值至5.5)(1∶19,V/V)混合溶液(A)-乙腈(B),梯度洗脫(0~3 min,100%A;>3~20 min,100%A→71%A;>20~25 min,71%A→100% A;>25~30 min,100%A);檢測波長:205 nm;流速:0.9 mL/min;柱溫:35℃;進樣量:10μL。
2.2 溶液的制備
2.2.1 配伍液模擬國外臨床常用劑量,在25℃未避光條件下,取Lev注射液6支,各取2支(1 000 mg)加至0.9%NS 100 mL、5%GS 100 mL和乳酸鈉林格注射液100 mL中,得Lev質量濃度均為9 090μg/mL的配伍液。
2.2.2 對照品貯備液(1)雜質D對照品貯備液:精密稱取雜質D工作對照品10.0 mg,置20 mL量瓶中,用流動相一溶解并定容,再用流動相一稀釋成質量濃度為50μg/mL的溶液。(2)2-羥基吡啶對照品貯備液:精密稱取2-羥基吡啶對照品10.0 mg,置50 mL量瓶中,用色譜條件二中的流動相A相(以下簡稱“流動相二”)溶解并稀釋成質量濃度為200μg/mL的溶液。(3)雜質A對照品貯備液:精密稱取雜質A對照品15.0 mg,置50 mL量瓶中,用流動相二溶解并稀釋成質量濃度為300μg/mL的溶液。(4)雜質B對照品貯備液:精密稱取雜質B對照品10.0 mg,置100 mL量瓶中,用流動相二溶解并稀釋成質量濃度為100μg/mL的溶液。(5)雜質C對照品貯備液:精密稱取雜質C對照品10.0 mg,置100 mL量瓶中,用流動相二溶解并稀釋成質量濃度為100μg/mL的溶液。(6)Lev對照品貯備液:精密稱取Lev工作對照品25.0 mg,置25 mL容量瓶中,加流動相二溶解并稀釋成質量濃度為1 000μg/mL的溶液。
2.2.3 供試品溶液(1)雜質D供試品溶液:精密量取Lev注射液適量,用流動相一稀釋成Lev質量濃度為2 000 μg/mL的溶液。(2)有關物質供試品溶液:精密量取Lev注射液適量,用流動相二稀釋成Lev質量濃度為5 000 μg/mL的溶液。(3)Lev供試品溶液:精密量取Lev注射液適量,用流動相二稀釋成Lev質量濃度為100μg/mL的溶液。
2.2.4 對照品溶液(1)雜質D對照品溶液:精密量取雜質D對照品貯備液適量,用流動相一稀釋配制成雜質D質量濃度為2μg/mL的溶液。(2)有關物質對照品溶液:精密量取Lev對照品貯備液適量,用流動相二稀釋成Lev質量濃度為5μg/mL的溶液。(3)Lev對照品溶液:精密量取Lev對照品貯備液適量,用流動相二稀釋成Lev質量濃度為100μg/mL的溶液。
2.2.5 空白溶液除不加Lev外,其他輔料正常加入,并按“2.2.1”項下方法配制,即得空白對照。精密量取上述空白對照適量,按“2.2.3”項下雜質D供試品溶液稀釋方法配制空白溶液A;精密量取上述空白對照適量,按“2.2.3”項下有關物質供試品溶液稀釋方法配制空白溶液B。
2.2.6 混合溶液(1)混合溶液A:精密量取2-羥基吡啶、雜質A、雜質B、雜質C和Lev對照品貯備液各適量,用流動相二配制成雜質限度濃度(2-羥基吡啶1.25μg/mL、雜質A 15μg/mL、雜質B 2.5μg/mL、雜質C 2.5μg/mL)和Lev 100μg/mL的溶液。(2)混合溶液B:精密量取2-羥基吡啶、雜質A、雜質B、雜質C對照品貯備液各適量,用流動相二配制成各雜質限度濃度(同混合溶液A)的溶液。
2.3 測定方法
2.3.1 雜質D測定按“2.1.1”項下色譜條件一,分別精密量取“2.2”項下雜質D供試品溶液和雜質D對照品溶液各50μL,進樣分析,記錄色譜圖。按外標法以峰面積計算供試品溶液中雜質D的含量(%)。
2.3.2 有關物質檢查按“2.1.2”項下色譜條件二,分別精密量取“2.2”項下有關物質供試品溶液和有關物質對照品溶液各10 μL,進樣分析,記錄色譜圖。按加校正因子的主成分對照法計算2-羥基吡啶、雜質A、雜質B和雜質C的含量(%)(以Lev對照品線性回歸方程斜率與各雜質對照品線性回歸方程斜率的比值來計算各雜質的校正因子,校正因子分別為1.10、0.77、0.27、1.85)。
2.3.3 Lev含量測定按“2.1.2”項下色譜條件二,精密量取“2.2”項下Lev供試品溶液和Lev對照品溶液各10 μL,進樣分析,記錄色譜圖。按外標法以峰面積計算Lev的含量(%)。
2.4 方法學考察
2.4.1 專屬性考察在“2.1”項色譜條件下,各待測物峰形良好,雜質D、有關物質(2-羥基吡啶、雜質A、雜質B、雜質C)和Lev的保留時間分別為9.733、3.972、5.831、7.939、14.779和11.590 min,詳見圖1、圖2。
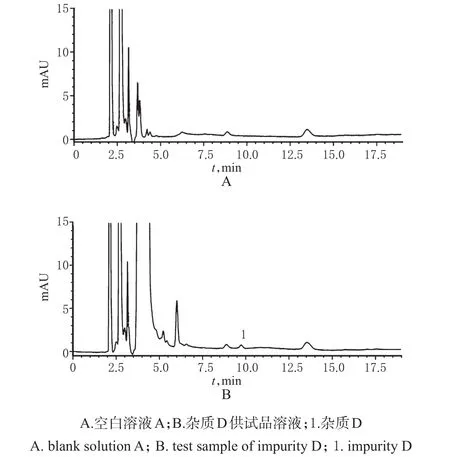
圖1 HPLC色譜圖(色譜條件一)Fig 1 HPLC chromatograms(chromatogram condition one)
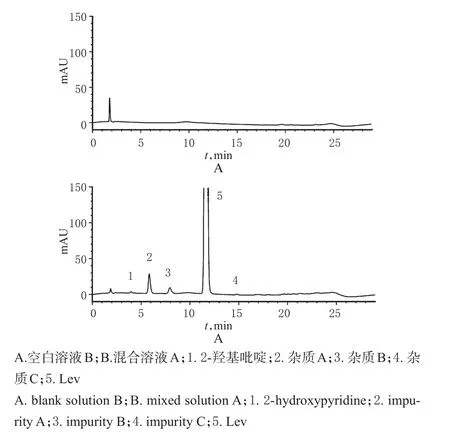
圖2 HPLC色譜圖(色譜條件二)Fig 2 HPLC chromatograms(chromatogram condition two)
2.4.2 標準曲線的繪制與定量下限的考察(1)雜質D:精密量取“2.2.2”項下雜質D對照品貯備液適量,用流動相一稀釋成質量濃度分別為0.15、0.38、0.76、1.52、3.79、15.18μg/mL的雜質D系列溶液。(2)有關物質:精密量取“2.2.2”項下2-羥基吡啶對照品貯備液適量,用流動相二稀釋成質量濃度分別為0.06、1.00、5.00、10.00、50.00、100.00μg/mL的2-羥基吡啶系列溶液;精密量取“2.2.2”項下雜質A、雜質B、雜質C對照品貯備液各適量,用流動相二稀釋成質量濃度分別為0.08、1.50、3.00、15.00、60.00、150.00μg/mL的雜質A系列溶液,質量濃度分別為0.04、0.40、4.00、10.00、25.00、50.00μg/mL的雜質B系列溶液,質量濃度分別為0.60、1.20、10.00、12.00、25.00、50.00μg/mL的雜質C系列溶液。(3)Lev:精密量取“2.2.2”項下Lev對照品貯備液適量,用流動相二稀釋成質量濃度分別為0.05、0.25、0.50、5.00、50.00、500.00 μg/mL的Lev系列溶液。取上述系列溶液各適量,分別按“2.1.1”和“2.1.2”項下色譜條件進樣分析,記錄峰面積。以待測物質量濃度(c)為橫坐標、相應色譜峰峰面積(A)為縱坐標,進行線性回歸。將各對照品溶液逐級稀釋,以確定檢測限(信噪比為3.0)。結果顯示,雜質D、2-羥基比啶、雜質A、雜質B、雜質C和Lev的質量濃度分別在0.15~15.18、0.06~100.00、0.08~150.00、0.04~50.00、0.60~50.00、0.05~500.00μg/mL范圍內線性關系良好(r>0.999 0),定量下限分別為0.15、0.06、0.08、0.04、0.60、0.05μg/mL,檢測限分別為0.03、0.01、0.04、0.01、0.30、0.03μg/mL,詳見表1。
2.4.3 重復性試驗(1)雜質D:按“2.2.4”項下雜質D對照品溶液的配制方法,重復配制6份;按“2.1.1”項下色譜條件進樣分析,記錄峰面積。結果顯示,雜質D的平均峰面積為41 105(RSD=1.80%,n=6),表明該方法重復性良好。(2)有關物質:按“2.2.6”項下混合溶液B的配制方法,重復配制6份;按“2.1.2”項下色譜條件進樣分析,記錄峰面積。結果顯示,2-羥基吡啶、雜質A、雜質B和雜質C的平均峰面積分別為21 565、452 408、204 813和6 389(RSD分別為0.95%、2.61%、3.55%和0.92%,n=6),表明該方法重復性良好。(3)Lev:按“2.2.4”項下Lev對照品溶液的配制方法,重復配制6份。按“2.1.2”項下色譜條件進樣分析,記錄峰面積。結果顯示,Lev的平均峰面積為2 454 867(RSD=0.80%,n=6),表明該方法重復性良好。
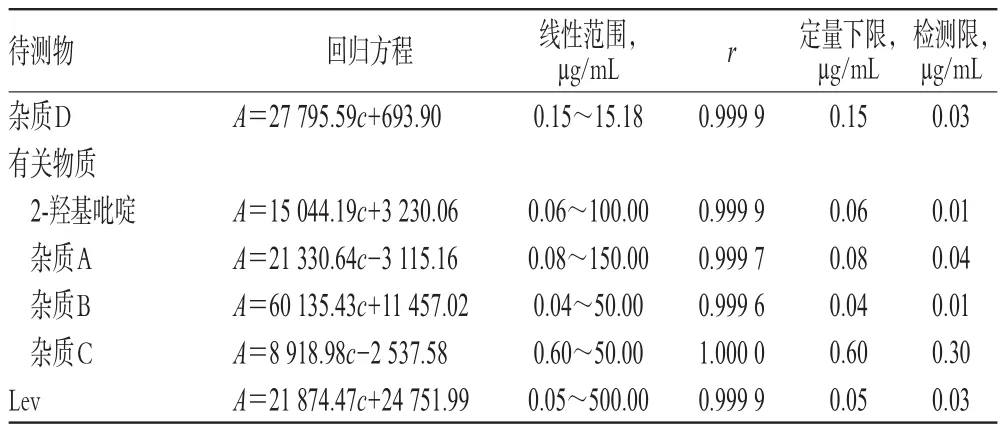
表1 各待測物的回歸方程、定量下限和檢測限Tab 1 Regression equations,limit of quantitation and limit of detection
2.4.4 回收率試驗(1)雜質D:精密量取“2.2.2”項下雜質D對照品貯備液各適量,加至Lev注射液中,用流動相一分別稀釋成含Lev 2 000μg/mL和雜質D 1.6、2.0、2.4μg/mL的混合溶液各3份,按“2.1.1”項下色譜條件進樣分析,記錄色譜圖。結果顯示,雜質D的回收率為97.89~101.74%(RSD=1.50%,n=9)。(2)有關物質:精密量取“2.2.2”項下2-羥基吡啶對照品貯備液各適量,加入至Lev注射液中,用流動相二分別稀釋成含Lev 5 000 μg/mL和2-羥基吡啶1.00、1.25、1.50μg/mL的混合溶液各3份;精密量取“2.2.2”項下雜質A、雜質B和雜質C對照品貯備液各適量,同法配制成含Lev 5 000μg/mL和雜質A 12、15、18μg/mL,含Lev 5 000μg/mL和雜質B 2.0、2.5、3.0μg/mL,含Lev 5 000μg/mL和雜質C 2.0、2.5、3.0μg/mL的混合溶液各3份。按“2.1.2”項下色譜條件進樣分析,記錄色譜圖。結果顯示,2-羥基吡啶、雜質A、雜質B、雜質C的回收率分別為99.77~101.48%、99.35~101.62%、98.49~99.58%、95.93~104.33%(RSD分別為0.68%、0.76%、0.32%和3.07%,n=9)。(3)Lev:精密稱取Lev工作對照品適量,用流動相二稀釋,配制成質量濃度為80、100、120 μg/mL的溶液各3份,按“2.1.2”項下色譜條件進樣分析,記錄色譜圖。結果顯示,Lev的回收率為99.40~100.70%(RSD=0.46%,n=9)。
2.4.5 穩定性試驗(1)雜質D:配制雜質D低、高質量濃度(雜質D 2 μg/mL,Lev 2 000 μg/mL)的溶液,考察其在室溫條件下的穩定性。結果顯示,各樣品在室溫下放置1 h穩定(RSD<5%,n=6)。(2)有關物質:配制有關物質低、高質量濃度(2-羥基吡啶1.25μg/mL、雜質A 15μg/mL、雜質B 2.5μg/mL、雜質C 2.5μg/mL,Lev 5 000 μg/mL)的溶液,考察其在室溫條件下的穩定性。結果顯示,各樣品在室溫下放置17 d穩定(RSD<5%,n= 6)。(3)配制Lev高質量濃度(Lev 100 μg/mL)的溶液,考察其在室溫條件下的穩定性。結果顯示,樣品在室溫下放置50 h穩定(RSD<1%,n=6)。
2.5 配伍穩定性試驗
2.5.1 顏色、澄清度和pH值的變化取“2.2.1”項下配伍液各適量,在25℃未避光條件下,分別于配制后0、1、2、4、6、8、24 h時參照2015年版《中國藥典》(四部)通則中“溶液顏色檢查法”、“澄清度檢查法”和“pH值測定法”對其顏色、澄清度和pH值進行檢查[6]。結果顯示,配制后24 h內,各配伍液均為無色澄清液體,pH值無明顯變化(RSD<1%,n=7),詳見表2。
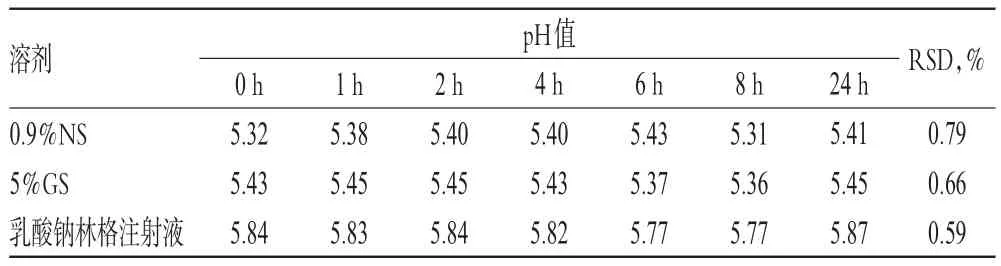
表2 各配伍液pH值的測定結果Tab 2 Determination results of pH values of mixtures
2.5.2 不溶性微粒檢查取“2.2.1”項下配伍液各適量,在25℃未避光條件下,分別于配制后0、1、4、24 h時參照2015年版《中國藥典》(四部)通則中“不溶性微粒檢查法”(光阻法)檢查其不溶性微粒數是否符合藥典相關規定[每1 mL中含10μm及10μm以上(≥10 μm)的微粒數不得超過25粒,含25μm及25μm以上(≥25 μm)的微粒數不得超過3粒][6]。結果顯示,配制后24 h內,各配伍液中的微粒數均符合藥典規定,詳見表3。
表3 各配伍液中不溶性微粒數的檢查結果(±s,n=3,粒/mL)Tab 3 Determination results of insoluble particles of mixtures(±s,n=3,grain/mL)
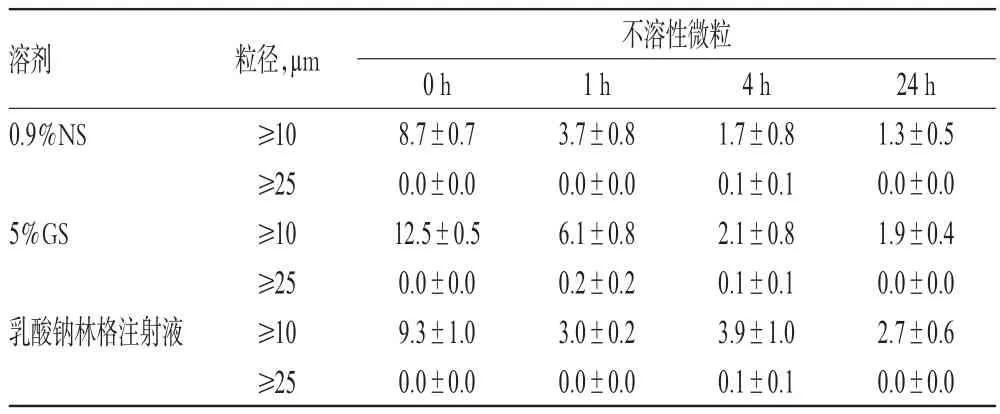
表3 各配伍液中不溶性微粒數的檢查結果(±s,n=3,粒/mL)Tab 3 Determination results of insoluble particles of mixtures(±s,n=3,grain/mL)
溶劑粒徑,μm 不溶性微粒0.9%NS 5%GS乳酸鈉林格注射液≥10≥25≥10≥25≥10≥25 0 h 8.7±0.7 0.0±0.0 12.5±0.5 0.0±0.0 9.3±1.0 0.0±0.0 1 h 3.7±0.8 0.0±0.0 6.1±0.8 0.2±0.2 3.0±0.2 0.0±0.0 4 h 1.7±0.8 0.1±0.1 2.1±0.8 0.1±0.1 3.9±1.0 0.1±0.1 24 h 1.3±0.5 0.0±0.0 1.9±0.4 0.0±0.0 2.7±0.6 0.0±0.0
2.5.3 雜質D含量的變化取“2.2.1”項下配伍液各適量,在25℃未避光條件下,用流動一稀釋成含Lev 2 000 μg/mL的供試品溶液,分別于配制后0、1、2、4、6、8、24 h時按“2.1.1”項下色譜條件進樣分析,按“2.3.1”項下方法測定,計算雜質D的含量。結果顯示,配制后24 h內,各配伍液中雜質D的含量無明顯變化,符合USP的限度要求(雜質D限度為0.1%)[5],詳見表4。
2.5.4 有關物質的含量變化取“2.2.1”項下配伍液各適量,在25℃未避光條件下,用流動二稀釋成含Lev 5 000 μg/mL的供試品溶液。分別于配制后0、1、2、4、6、8、24 h時按“2.1.2”項下色譜條件進樣分析,按“2.3.2”項下方法測定,計算有關物質的含量。結果顯示,配伍后24 h內,各配伍液均未檢出雜質B和雜質C,2-羥基吡啶和雜質A的含量符合國外各藥典的限度要求(2-羥基吡啶的限度為0.025%,雜質A的限度為0.3%)[5,7-8],詳見表5。
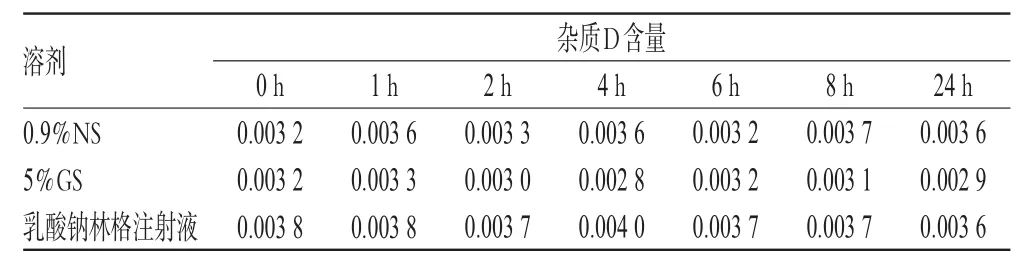
表4 各配伍液中雜質D含量的測定結果(%%)Tab 4 Determination results of the content of impurity D in mixtures(%%)
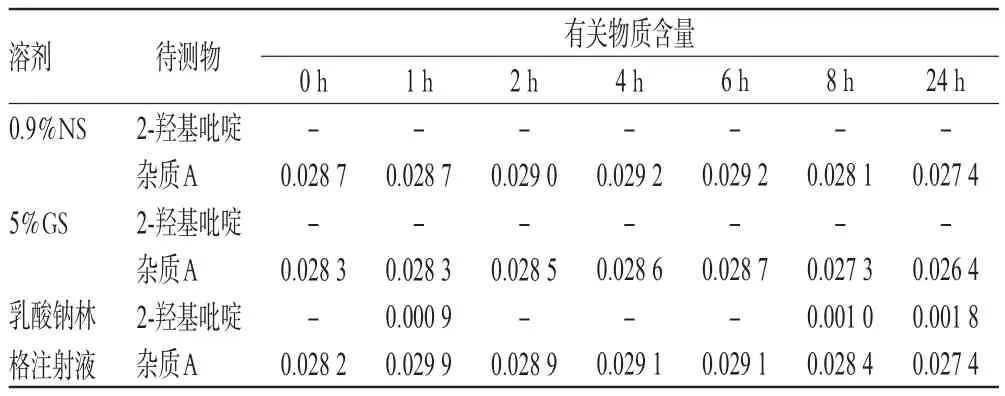
表5 各配伍液中有關物質含量的測定結果(%%)Tab 5 Determination results of the content of related substance in mixtures(%%)
2.5.5 Lev相對百分含量的變化取“2.2.1”項下配伍液各適量,在25℃未避光條件下,用流動二稀釋成含Lev 100μg/mL的供試品溶液。分別于配制后0、1、2、4、6、8、24 h時按“2.1.2”項下色譜條件進樣分析,按“2.3.3”項下方法測定,計算Lev的含量。以配制0 h時Lev的含量為100%,換算出其他時間點的相對百分含量。結果顯示,配制后24 h內,各配伍液中Lev的相對百分含量無明顯變化(RSD<1%,n=7),詳見表6。
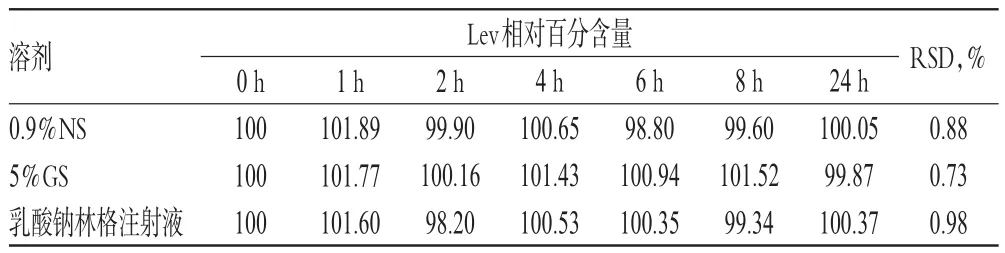
表6 各配伍液中Lev相對百分含量的測定結果(%%)Tab 6 Determination results of relative percentage contents of Lev in mixtures(%%)
3 討論
配制已知雜質2-羥基吡啶、雜質A、雜質B、雜質C、雜質D對照品混合溶液,分別在以1.96 g/L硫酸水溶液-乙腈(7∶93,V/V)和(4∶96,V/V)[《歐洲藥典》(EP)和《英國藥典》(BP)]為流動相的正相色譜法[7-8]、以磷酸鹽溶液(取磷酸二氫鈉1.56 g和庚烷磺酸鈉1.01 g,加水1 000 mL,用氫氧化鈉試液調pH值至7.0)-乙腈(90∶10,V/V)為流動相的離子對色譜法(USP)[5]和參考USP方法并優化的反相色譜法(“2.1.2”項下色譜條件二)等多種流動相體系下進樣分析,結果顯示,本研究優化的色譜條件二對已知雜質和Lev的分離效果更好。因此,本研究選擇色譜條件二進行有關物質的檢查和Lev的含量測定。而雜質D由于極性較大,在色譜條件二下保留時間短,與溶劑峰難以完全分離,故本研究建立了色譜條件一,使其分配系數增大,保留時間延長,有利于待測物的分離和定量,因此單獨采用色譜條件一測定雜質D。
各國藥典對雜質和有關物質的含量作出了限度要求。其中,2-羥基吡啶、雜質A在USP、EP和BP中限度分別為0.025%和0.3%,雜質B在EP和BP中限度均為0.05%,雜質C和雜質D在USP中限度分別為0.05%和0.1%[5,7-8]。本課題組前期進行的強制降解試驗和穩定性試驗表明,Lev注射液中雜質A和雜質B為降解產生,雜質C和雜質D分別為合成Lev的中間體和起始原料,2-羥基吡啶為原料中引入的雜質。因此,為全面了解Lev注射液與0.9%NS、5%GS和乳酸鈉林格注射液配伍液中的雜質含量情況,本研究對雜質D、2-羥基吡啶、雜質A、雜質B和雜質C的含量進行了考察。
本試驗的目的是考察Lev注射液與3種注射液配伍的穩定性,為其質量管理和臨床應用提供依據。因此,配伍液均按臨床常用劑量、在25℃未避光條件下配制。在實際操作過程中,由于Lev注射液會因注射器的抽吸動作而產生較多的氣泡,影響不溶性微粒的準確測定。因此,本研究將配制后靜置20 min時的測定結果作為配制后0 h時的結果,以消除抽吸所致氣泡的干擾。
本試驗參考了配伍穩定性的相關研究[9-11],將穩定性考察時間延長至24 h。結果顯示,Lev注射液與0.9% NS、5%GS和乳酸鈉林格注射液配伍后24 h內,各配伍液無色澄清,不溶性微粒數均符合2015年版《中國藥典》的規定,pH值無明顯變化。3種配伍液中雜質D和雜質A的含量遠低于各國藥典的限度要求。雖然,Lev注射液與乳酸鈉林格注射液配伍24 h后2-羥基吡啶的含量從無增加至0.001 8%,但仍遠低于各國藥典中0.025%的限度要求,故認為是安全、合格的。Lev相對百分含量的RSD值均符合2015年版《中國藥典》(四部)通則中“待測成分含量為100%,測定結果的RSD值應低于1%”的規定[6],提示各配液中Lev的含量均無明顯變化。
綜上所述,在25℃未避光條件下,Lev注射液與0.9%NS、5%GS和乳酸鈉林格注射液配伍后24 h內,穩定性良好。但由于近年來隨著糖代謝異常患者的不斷增加,木糖醇注射液、果糖注射液在臨床上也被廣泛應用[12-14],而本試驗僅參照原研Lev注射液的藥品說明書,對其與0.9%NS、5%GS和乳酸鈉林格注射液的配伍穩定性進行考察,故該制劑與其他溶劑(如木糖醇注射液、果糖注射液等)的配伍穩定性還有待進一步研究。
[1]Ben-Menachem E,Gilland E.Efficacy and tolerability of levetiracetam during 1-year follow-up in patients with refractory epilepsy[J].Seizure,2003,12(3):131-135.
[2]宋艷玲,孫歡,李柏娜.西坦類藥物研究進展[J].中國藥業,2015,24(1):4-7.
[3]劉俊杰.左乙拉西坦臨床應用研究進展[J].首都醫藥,2011(12):12-13.
[4]應義,崔虓,張慧.抗癲痛藥物研究現狀及新進展[J].中國藥業,2012,21(20):110-112.
[5]美國藥典委員會.美國藥典/國家處方集[S].USP36-NF31.華盛頓:美國藥典委員會,2013:4084-4086.
[6]國家藥典委員會.中華人民共和國藥典:四部[S].2015年版.北京:中國醫藥科技出版社,2015:77-78、111-115、378.
[7]歐洲藥典委員會.歐洲藥典[S].8.0版.斯特拉斯堡:歐洲藥品質量管理局,2013:2604-2606.
[8]英國藥典委員會.英國藥典[S].2014年版.倫敦:英國藥典委員會,2014:2313-2316.
[9]林小明.丹參注射劑的配伍穩定性研究[J].中國藥物評價,2016,33(1):20-23.
[10]楊小玲,程帆,劉艷紅,等.喜炎平注射液與15種藥物配伍穩定性考察[J].中國新藥雜志,2013,22(20):2374-2378.
[11]黃艷,何海霞,周遠大,等.注射用奧美拉唑鈉與4種常用溶劑的配伍穩定性考察[J].中國藥房,2015,26(14):1948-1949.
[12]呂芳,葉正良,蘭淑玲,等.注射用益氣復脈(凍干)與木糖醇注射液的配伍穩定性研究[J].時珍國醫國藥,2013,24(5):1124-1126.
[13]林淑瑜,楊昌云,潘丹婷,等.7種糖尿病常用藥與木糖醇注射液的配伍穩定性研究[J].藥學服務與研究,2016,16(3):234-237.
[14]史長城,朱慧,李亞芳,等.臨床常用藥物與果糖注射液配伍穩定性的文獻分析[J].中國藥房,2015,26(5):718-720.
(編輯:張元媛)
Compatible Stability of Levetiracetam Injection with Three Injections
HUANG Fengling,SONG Yanxia,LI Zhi,MA Xiaoli,YANG Mingbo,LI Bo(Sichuan Provincial Key Laboratory of Antibiotics Research and Re-evaluation/Sichuan Industrial Institute of Antibiotics,Chengdu University,Chengdu 610052,China)
OBJECTIVE:To investigate the compatible stability of Levetiracetam(Lev)injection with 3 injections.METHODS:Each Lev injection 1 000 mg mixed with 0.9%Sodium chloride injection 100 mL,5%Glucose injection 100 mL or Sodium lactate Ringer’s injection 100 mL respectively.Under the light condition,at 25℃,the color and clarification degree of mixtures were observed at different time points within 24 h after mixing;pH value and the number of insoluble particles were determined.The contents of related impurities(impurity A,B,C,D,2-hydroxypyridine)and Lev in mixtures were determined by HPLC.RESULTS:Under above condition,all mixtures were colorless clear liquid within 24 h;pH value had no significant change(RSD<1%,n=7);the number of insoluble particles was no more than the range stated in Chinese Pharmacopeia(2015 edition).Impurity B and C were not detected;the contents of other impurities were in line with the requirements of foreign pharmacopeia.No marked change was noted for relative content of Lev(RSD<1%,n=7).CONCLUSIONS:After mixing with 0.9%Sodium chloride injection,5%Glucose injection or Sodium lactate Ringer’s injection,Lev injection keep stable at 25℃within 24 h under the light condition.
Levetiracetam injection;Sodium chloride injection;Glucose injection;Sodium lactate Ringer’s injection;Compatiblity;Stability;HPLC
R969.2;R971
A文章編號1001-0408(2017)14-1911-06
2016-05-30
2017-02-23)
*碩士研究生。研究方向:藥品質量控制。電話:028-84216020。E-mail:260396601@qq.com
#通信作者:研究員,碩士生導師。研究方向:藥品質量控制。電話:028-84216020。E-mail:ckcdlibo@163.com
DOI10.6039/j.issn.1001-0408.2017.14.11

