膽管細胞癌與不同分化程度肝細胞癌CEUS特征的對比研究
楊伯文,廖錦堂,王譯斌,田 婷
(中南大學湘雅醫院超聲影像科,湖南 長沙 410008)
膽管細胞癌與不同分化程度肝細胞癌CEUS特征的對比研究
楊伯文,廖錦堂*,王譯斌,田 婷
(中南大學湘雅醫院超聲影像科,湖南 長沙 410008)
目的 比較肝內膽管細胞癌(ICC)和不同分化程度肝細胞癌(HCC)CEUS表現對ICC和不同分化程度HCC的鑒別診斷價值。方法 回顧性分析經病理證實的34例ICC(ICC組)和136例不同分化程度的HCC患者高、中、低分化(HCC組)的常規超聲及CEUS表現,并評價CEUS始退時間對ICC的診斷效能。結果 ICC組在門靜脈早期開始消退的比例(24/34,70.59%)均高于各HCC組,在門靜脈中期開始消退的比例(0/34)和在門靜脈晚期/延遲期開始消退的比例(4/34,11.76%)均低于中、高分化HCC組,差異均有統計學意義(P均<0.008)。低分化HCC組在門靜脈中期開始消退的比例(16/41,39.02%)高于高分化HCC組(P<0.008)。CEUS診斷ICC的敏感度、特異度、陽性預測值、陰性預測值、準確率、陽性似然比及陰性似然比分別為82.35%(28/34)、91.18%(124/136)、70.00%(28/40)、95.38%(124/130)、89.41%(152/170)、9.4、0.2。ICC及低、中、高分化HCC組病灶CEUS始增時間分別為(13.03±3.49)s、(13.80±3.04)s、(14.89±4.12)s、(16.00± 3.38)s,差異有統計學意義(F=4.369,P<0.05),ICC組始增時間早于高分化HCC組(P<0.05)。結論 不同分化程度HCC和ICC的CEUS表現存在差異,CEUS對其鑒別診斷有一定的參考價值。
膽管癌;癌,肝細胞;超聲檢查;造影劑;細胞分化
原發性肝癌病理分為肝細胞癌(hepatocellular carcinoma, HCC)、膽管細胞癌(intrahepatic cholangiocarcinoma, ICC)和混合細胞癌。肝內ICC發生于肝內2級及以上膽管分支,約占原發性肝癌的5%~30%[1],目前ICC的發病率和病死率仍不斷上升,HCC和ICC的生物學行為和預后不同,因此鑒別診斷對指導臨床治療有重要意義。ICC的常規超聲表現缺乏特異度,難以與HCC相鑒別。近年來,CEUS廣泛應用于肝占位性病變的診斷和鑒別診斷,并取得了良好的效果。本研究通過分析經病理證實的ICC和HCC的CEUS特征,探討其對兩者的鑒別診斷價值。
1 資料與方法
1.1一般資料 收集2012年1月—2016年6月我院經手術或穿刺病理證實的34例ICC患者和136例HCC患者。ICC組(n=34),男26例,女8例,年齡34~67歲,平均(52.8±10.2)歲;根據Edmondson腫瘤病理分級法將HCC患者分為3組,包括低分化HCC組(Ⅳ級;n=41),男38例,女3例,年齡32~67歲,平均(48.9±7.4)歲;中分化HCC組(Ⅱ、Ⅲ級;n=64),男55例,女9例,年齡20~78歲,平均(51.4±12.4)歲;高分化HCC組(Ⅰ級;n=31),男25例,女6例,年齡18~73歲,平均(52.6±10.2)歲。對多發病灶者選取最大腫塊為研究對象。所有患者于術前或穿刺前1周內行CEUS檢查,檢查前患者均未行放療或化療等治療。
1.2儀器與方法 采用Siemens S2000超聲診斷儀,4C1探頭,頻率2~5 MHz,配備脈沖反向諧波成像技術。先行二維及彩色多普勒超聲掃查,記錄病變位置、最長徑、回聲、數目(單發/多發)、邊界(清楚/不清)及CDFI血流分級[2]等,隨后行CEUS,造影劑使用聲諾維(SonoVue,Bracco公司)。經肘部淺靜脈團注 2.4 ml造影劑,隨即注入5 ml生理鹽水,同時啟動動態錄像記錄并連續觀察6 min。
1.3圖像分析 由2名從事CEUS 5年以上的醫師協商分析造影圖像。據CEUS指南[3]將研究時相分為動脈期(0~30 s)、門靜脈期(31~120 s)和延遲期(121~240 s)。門靜脈期進一步分門靜脈早期(31~60 s)、中期(61~90 s)和晚期(91~120 s)。消退定義為緊隨動脈相高增強后出現的門靜脈相和/或延遲相的低增強。記錄病灶的始增及始退時間,并分析每個病灶的增強模式。
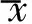
2 結果
ICC組與低、中、高分化HCC組患者性別構成比差異無統計學意義(χ2=4.354,P=0.217),年齡分布差異無統計學意義(F=1.088,P=0.356)。
2.1常規超聲 ICC及不同分化HCC組腫瘤最大徑、血流分級及回聲差異無統計學意義(P均>0.05)。ICC組病灶多表現為形態不規則(29/34,85.29%)、邊界不清(19/34,55.88%)的低回聲(14/34,41.18%)腫塊。各組病灶常規超聲表現見表1。
2.2 CEUS ICC組在動脈期增強過程中,17例(17/34,50.00%)表現為周邊厚環/薄環狀高/等增強,并于部分病灶中可見“樹枝狀”由周邊向中央延伸的增強,此種增強方式的病灶最長徑為(63.53±26.37)mm。7例(7/34,20.59%)為均勻高增強,3例(3/34,8.82%)為均勻等增強,1例(1/34,2.94%)為均勻低增強,均勻增強的病灶最長徑為(40.36±22.50)mm。周邊環狀增強最長徑大于均勻增強病灶,差異有統計學意義(t=2.399,P=0.024)。另外6例(6/34,17.65%)為不均勻高增強。所有ICC病灶均在延遲期呈低/等增強。HCC組的病灶均于動脈期呈現典型的均勻或不均勻高/等增強,門靜脈或延遲期呈低/等增強。
ICC組與不同分化HCC組在動脈期、門靜脈各期及延遲期開始消退的比例差異均有統計學意義 (P<0.05),見圖1、2。其中,ICC組門靜脈早期開始消退的比例均顯著高于各分化HCC組(P<0.008),門靜脈中期開始消退的比例均顯著低于低、中分化HCC組(P<0.008),門靜脈晚期/延遲期開始消退的比例均顯著低于中、高分化HCC組(P<0.008)。低分化HCC組在門靜脈中期開始消退的比例顯著高于高分化HCC組(P<0.008),見表2。ICC組始退時間集中于門靜脈早期(24/34,70.59%),并有4例(4/34,11.76%)于動脈期即開始消退。
以動脈期或門靜脈早期開始消退診斷為ICC,門靜脈中、晚期及延遲期開始消退為HCC,診斷ICC的敏感度、特異度、陽性預測值、陰性預測值、準確率、陽性似然比及陰性似然比分別為82.35%(28/34)、91.18%(124/136)、70.00%(28/40)、95.38%(124/130)、89.41%(152/170)、9.4、0.2。
ICC組及低、中、高分化HCC組病灶造影始增時間分別為(13.03±3.49)s、(13.80±3.04)s、(14.89±4.12)s、(16.00±3.38)s,差異有統計學意義(F=4.369,P<0.05)。兩兩比較,ICC組始增時間早于高分化HCC組,差異具有統計學意義(P=0.007),余各組之間差異無統計學意義(P均>0.05)。
3 討論
ICC臨床表現及實驗室檢查缺乏特異性,發現時多已處于中晚期,由于治療方法與其他肝腫瘤不同[3],因此早發現、早診斷十分重要。超聲造影劑是純血池顯像劑,可顯示病灶的微循環血流灌注情況[4]。觀察分析病灶的造影增強模式可為疾病的診斷和鑒別診斷提供更多的信息和依據。
本研究顯示ICC組多表現為形態不規則、邊界不清的低回聲占位,血流信號多為點狀或短線狀,Ⅲ級血流較少見(4/34,11.76%),有研究[2]顯示其阻力指數(resistance index, RI)>0.6,是相對有鑒別價值的常規超聲表現。CEUS時,ICC主要以周邊環狀高或等增強(17/34,50.00%)為主,與既往研究[5-6]報道相符,ICC的此種增強模式與其組織學特征相關,研究[6]顯示典型ICC的中央主要由不同程度的纖維壞死組織組成,而周邊由富有活性的腫瘤細胞組成,血供較豐富。周邊典型環狀增強的病灶最長徑大于均勻增強的病灶(t=2.399,P=0.024)。本研究肝門部ICC(n=4)均未見典型的周邊環狀增強,而顯示為均勻或不均勻強化,此類型ICC樣本數較少,有待于進一步研究。

表1 ICC和不同分化程度HCC常規超聲表現
注:*:采用Fisher精確概率法

表2 ICC與不同分化程度的HCC始退時期比較[例(%)]
注:*:采用Fisher精確概率法

圖1 患者女,66歲,右肝后葉,ICC A.CEUS動脈期呈環狀增強(箭); B.動脈期(25 s)開始消退(箭); C.門靜脈期為低增強(箭); D.病理圖(HE,×200) 圖2 患者男,61歲,右肝前葉,中分化HCC A.CEUS動脈期增強(箭); B.門靜脈晚期(94 s)開始消退(箭); C.延遲期為低增強(箭); D.病理圖(HE,×200)
既往報道[7]ICC和HCC的CEUS始增時間無明顯差異,且未納入不同分化程度HCC與ICC進行比較。本研究顯示ICC和高分化HCC始增時間差異有統計學意義(P=0.007),且ICC及低、中、高分化HCC病灶造影始增時間均值逐步遞增。有研究[8-9]表明ICC始退時間早于HCC,約50%的ICC在注入造影劑后60 s內開始消退。另有報道[10]發現87.9%的ICC在注入造影劑后60 s內消退,而HCC僅為16%。本研究結果顯示82.35%(28/34)的ICC在60 s內消退,與上述研究[10]結果相似,但上述研究未納入不同分化程度HCC的病例。由于病灶生物學活性不同,其造影劑消退時間會產生差異。本研究結果表明ICC組始退時間主要集中于門靜脈早期(24/34,70.59%),并有4例ICC于動脈期即開始消退;低、中、高分化HCC組始退時間分別集中于門靜脈中期(16/41,39.02%)、延遲期(27/64,42.19%)、延遲期(17/31,54.84%)。分析原因為ICC以侵襲方式生長為主,侵犯門靜脈使其管腔閉塞,當其未侵犯動脈時可見動脈血供代償性增加,故造影動脈期呈高增強;門靜脈期因管腔閉塞無造影劑灌注,表現為低增強;部分無門靜脈管腔閉塞者造影表現與HCC相似。而大部分HCC是多步驟演變的過程,在此過程中腫瘤的新生血管增多,隨分化程度的降低,腫瘤肝動脈供血增加而門靜脈供血減少[11],且腫瘤常合并動靜脈瘺,造影劑直接經動靜脈瘺廓清[12]。因此,低、中、高HCC的始增及始退時間均依次延長。本研究以動脈期或門靜脈早期開始消退作為ICC的診斷標準,診斷ICC的敏感度82.35%、特異度91.18%、陽性預測值70.00%、陰性預測值95.38%、準確率89.41%,有較高的鑒別診斷價值。
綜上所述,不同分化程度的HCC和ICC的CEUS表現存在差異,分析造影參數,結合常規超聲表現,有助于提高對ICC的診斷能力,對肝腫瘤的定性診斷及病理分化程度判定有一定幫助。
[1] Aljiffry M, Abdulelah A, Walsh M, et al. Evidence-based approach to cholangiocarcinoma: A systematic review of the current literature. J Am Coll Surg, 2009,208(1):134-147.
[2] 毛楓,王文平,李超倫,等.彩色多普勒超聲診斷周圍型肝內膽管細胞癌的價值.中華肝膽外科雜志,2012,18(10):750-752.
[3] Kim SA, Lee JM, Lee KB, et al. Intrahepatic mass forming cholangiocarcinomas: Enhancement patterns at multiphasic CT, with special emphasis on arterial enhancement pattern—correlation with clinicopathologic findings. Radiology, 2011,260(1):148-157.
[4] Claudon M, Dietrich CF, Choi BI, et al. Guidelines and good clinical practice recommendations for Contrast Enhanced Ultrasound (CEUS) in the liver-update 2012: A WFUMB-EFSUMB initiative in cooperation with representatives of AFSUMB, AIUM, ASUM, FLAUS and ICUS. Ultrasound Med Biol, 2013,39(2):187-210.
[5] 毛楓,張興偉,李超倫,等.周圍型肝內膽管細胞癌:超聲造影與增強CT對照.中國醫學影像技術,2013,29(9):1477-1480.
[6] 孫燦輝,李子平,徐輝雄,等.周圍型肝內膽管細胞癌的CT和超聲雙期增強的比較研究.中國醫學影像技術,2008,24(1):101-103.
[7] 林學英,林禮務,高上達,等.實時雙幅灰階超聲造影在肝細胞癌與膽管細胞癌鑒別診斷中的價值.中華超聲影像學雜志,2006,15(6):425-427.
[8] Vilana R, Forner A, Bianchi L, et al. Intrahepatic peripheral holangiocarcinoma in cirrhosis patients may display a vascular pattern similar to hepatocellular carcinoma on contrast-enhanced ultrasound. Hepatology, 2010,51(6):2020-2029.
[9] Galassi M, Iavarone M, Rossi S, et al. Patterns of appearance and risk of misdiagnosis of intrahepatic cholangiocarcinoma in cirrhosis at contrast enhanced ultrasound. Liver Int, 2013,33(5):771-779.
[10] Li R, Yuan MX, Ma KS, et al. Detailed analysis of temporal features on contrast enhanced ultrasound may help differentiate intrahepatic cholangiocarcinoma from hepatocellular carcinoma in cirrhosis. PLoS One, 2014,9(5):e98612.
[11] Jang HJ, Kim TK, Burns PN, et al. Enhancement patterns of hepatocellular carcinoma at contrast-enhanced US: Comparison with histologic differentiation. Radiology, 2007,244(3):898-906.
[12] 范智慧,陳敏華,戴瑩,等.原發性肝細胞癌不同分化程度超聲造影模式分析.中華醫學超聲雜志(電子版),2006,3(3):152-154.
Comparasion of contrast-enhanced ultrasound in diagnosis of cholangiocarcinoma and different differentiated hepatocellular carcinoma
YANGBowen,LIAOJintang*,WANGYibin,TIANTing
(DepartmentofUltrasound,XiangyaHospital,CentralSouthUniversity,Changsha410008,China)
Objective To compare the characteristics of intrahepatic cholangiocarcinoma (ICC) and different differentiated hepatocellular carcinoma (HCC) by CEUS and evaluate the diagnostic value of CEUS. Methods The cases who underwent CEUS and were pathologically demonstrated as ICC (n=34) and HCC (n=136) were observed. The characteristics of ICC and different differentiated HCC in conventional ultrasound and CEUS were analyzed, and the diagnostic efficiency of washout time were calculated. Results ICC had higher percentage (24/34, 70.59%) of washout emerging in early portal phase than those of HCC. And ICC had lower percentage (0; 4/34, 11.76%) of washout emerging in middle and late portal phase than poorly and moderate differentiated HCC. Poorly differentiated HCCs had higher percentage (16/41, 39.02%) of washout emerging in middle portal phase than well differentiated HCC. The sensitivity, specificity, positive predictive value, negative predictive value, accuracy, positive likelihood ratio and negative likelihood ratio of washout time in diagnosis of ICC were 82.35% (28/34), 91.18% (124/136), 70.00% (28/40), 95.38% (124/130), 89.41% (152/170), 9.4, 0.2, respectively. The rise time of ICC and well, moderate and poorly differentiated HCC were (13.03±3.49)s, (13.80±3.04)s, (14.89±4.12)s, (16.00±3.38)s, respectively, and the difference was significant (F=4.369,P<0.05). The rise time of ICC was significantly higher than that of well differentiated HCC (P<0.05). Conclusion The CEUS performances are different significantly among ICCs and different differentiated HCCs, which has value for the differential diagnosis.
Cholangiocarcinoma; Carcinoma, hepatocellular; Ultrasonography; Contrast media; Cell differentiation
楊伯文(1991—),女(滿族),遼寧丹東人,在讀碩士,醫師。研究方向:腹部及介入超聲。E-mail: 1227103245@qq.com
廖錦堂,中南大學湘雅醫院超聲影像科,410008。E-mail: 1078360278@qq.com
2016-10-01
2017-02-21
10.13929/j.1003-3289.201610003
R735.7; R445.1
A
1003-3289(2017)05-0713-05

