未來的電池之星
——鋰-空氣電池
詹 澍
(中國人民大學附屬中學分校,北京 100080)
未來的電池之星
——鋰-空氣電池
詹 澍
(中國人民大學附屬中學分校,北京 100080)
鋰空氣電池具有極高的理論比容量,應用在電動汽車中可以獲得和汽油相當的續航能力,因而獲得了人們廣泛的關注。在最近十幾年的研究中,人們對于鋰空氣電池的理解逐漸深入,制備得到的電池性能也得到了極大的提高。本文從鋰空氣電池的發展歷史入手,介紹了其基本原理,以及最近幾年在電解質、空氣電極、催化劑等方面的最新研究成果。對目前的研究現狀進行了簡單的剖析,并對未來的應用前景進行了展望。
鋰空氣電池;原理;電解質;空氣電極;催化劑
在環境保護越來越受到重視的背景下,電動汽車得到了全世界的普遍支持,但由于各種二次電池體系的理論比能量遠低于汽油在內燃機中燃燒的比能量,難以滿足電動汽車長距離行駛的要求,限制了電動汽車的大規模運用。圖1列出了目前各種電池的理論和實際的比能量,以及和汽油的對比[1]。從圖1可以看到,目前商用的鋰離子電池的實際比能量大約為160Wh/kg,已經遠高于傳統的鉛酸電池(40Wh/kg),但距離汽油(1 700Wh/kg)仍有較大的差距。而鋰空氣電池之所以受到人們的廣泛關注,就是因為其理論比能量能夠達到11 140Wh/kg(不計算空氣的質量),幾乎與汽油的理論比能量相當。就算計入O2的質量,按反應生成Li2O2計算,其理論比能量也可以達到3 622Wh/kg,是鋰離子電池理論容量的近10倍。并且其成本低廉,綠色無污染,被普遍認為是下一代的二次電池技術,未來的電池之星。
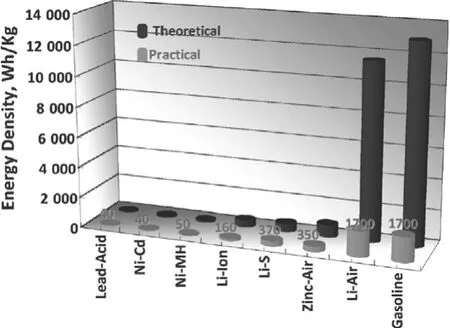
圖1 各種電池的比能量以及和汽油的對比
1 鋰空氣電池的發展歷程和基本原理
鋰空氣電池最早由Littauer和Tsai在1976年提出[2],但由于無法避免負極鋰與水性電解液之間的反應,這個想法一直難以取得切實的進展。直到1996年,Abraham等[3]第一次成功地在鋰空氣電池中引入有機電解質,避免了鋰的反應,從根本上解決了這一問題,使得對于鋰空氣電池的研究重新變得火熱了起來。
鋰空氣電池主要由負極鋰,電解質,多孔正極組成,根據需要可能還會有負極保護膜,電解質隔膜,正極催化劑等,其基本結構和充放電過程如圖2所示[1]:
鋰空氣電池的電極反應隨電解質體系的不同而不同,針對目前常見的水基電解質和有機電解質,它們的電極反應原理如下[4]:
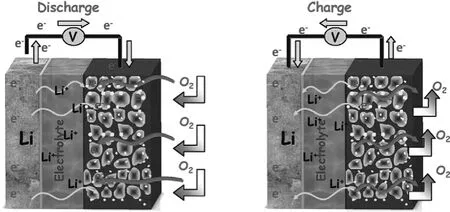
圖2 鋰空氣電池的基本結構和充放電過程
1.1 水基電解質

使用水基電解質時,由于電解質中水的存在,O2一般會發生4e-的還原反應,生成OH-,并在電解質中與負極產生的Li+結合生成LiOH,整個反應的電勢差為3.45 V。
1.2 有機或固體電解質
在有機或固體電解質中,沒有了水的參與,發生的電極反應為:

從陽極反應2和陽極反應3可以看到,在有機電解質中,可以發生兩種陽極反應,其產物分別為Li2O2和Li2O,兩個電極反應的電勢比較接近。相比較而言,Li2O2發生逆反應生成Li和O2會相對更容易。因此,在有機電解質體系中,需要通過控制電位或使用催化劑等方式,使得反應的產物盡量是Li2O2,在計算電池理論容量時,一般也是使用Li2O2來計算。
2 鋰空氣電池的電解質體系
電解質是在充放電過程中在正極和負極之間傳遞鋰離子的媒介,并且氧氣也必須首先溶解在電解質中,才能進一步參與后續的氧化還原過程。因此,電解質是鋰空氣電池中非常關鍵的一個組成部分。目前應用與鋰空氣電池中的電解質可以分為水基電解質、有機液體電解質、復合電解質和固體電解質四大類,分別對應的電池結構如圖3所示[1],下面分別對其進行簡要介紹。
2.1 水基電解質
由于金屬鋰與水能發生劇烈的氧化還原反應,因此需要在負極金屬鋰的表面包覆一層對水穩定的鋰離子導通膜,如LTAP。但它與鋰之間的接觸并不穩定,反應產物會使二者之間的阻抗增大。2008年,Zhang等[5]使用[PEO18Li(CF3SO2)2N]作為負極與電解質之間的隔膜,LTAPLiCl(aq)作為電解質,60℃時電池阻抗為540Ω·cm2,電池開路電壓保持在3.7V達到兩個月的時間,使得這個研究方向取得了極大的進展。
水體系鋰空氣電池的概念提出得比較早,它解決了有機體系中電極反應產物賭賽空氣電極的問題,但在負極鋰金屬的保護上還沒有比較完善的解決方案,LTAP膜在水溶液中的穩定性也有待進一步的提高。
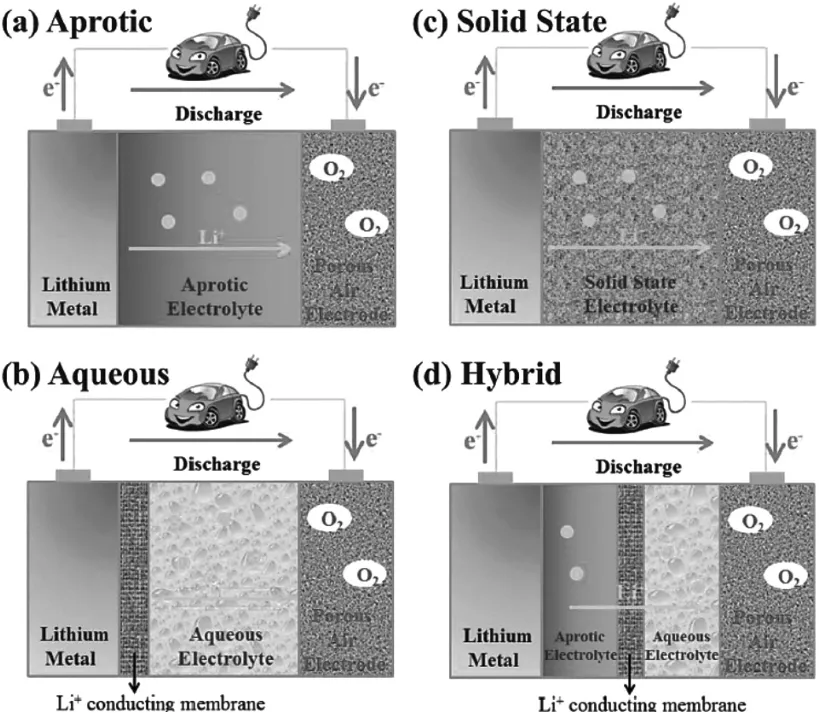
圖3 不同類型的電解質對應的電池結構
2.2 有機液體電解質
非水鋰空氣電池的電解液主要由非水溶劑和鋰鹽組成,從根本上杜絕了負極鋰金屬和電解質之間的反應,從而極大的提高了鋰空氣電池的穩定性。然而,放電產物Li2O2和Li2O均難溶于有機電解液中,易在正極孔隙中沉積,最終導致有機電解質的鋰空氣電池的容量偏小。
目前應用于非水鋰空電池中的電解液溶劑主要有碳酸酯類、酰胺類、醚類、砜類等。2012年,Bruce等使用基于DMSO的電解液,以納米金作為電極,制備的鋰空氣電池具有較好的穩定性,100次循環以后,仍然能夠保留95%的初始容量,并且發現在正極生成的電極產物中Li2O2占99%。但是DMSO和負極鋰之間仍然會在一定程度上發生反應,導致鋰負極還是需要進行保護,并且正極使用的納米金過于昂貴難以實用化。
2.3 復合電解質
如上所述,無論是水基電解質還是有機電解質,都有各自的優點和缺點,于是將兩者組合在一起,作為復合電解質,以發揮兩者的優點,便成為一種行之有效的思路。
2009年,Wang等使用復合電解質制備了鋰空氣電池,在負極金屬鋰一側使用有機電解質,在空氣正極一側使用水基電解質,中間使用超級鋰離子導通玻璃膜(LISICON)隔開。電池以0.5mA·cm-2的電流密度連續放電500 h,放電比容量達到50 000mAh·g-1(碳+催化劑+黏結劑)。
但復合電解質的關鍵問題是必須要找合適的隔膜將兩種電解質分開,對隔膜的要求包括:能夠有效的傳導鋰離子、并阻止H2O和O2進入負極、對有機電解質和水相都有良好的抗腐蝕性以及具有一定的機械強度。
2.4 固體電解質
與其他類型的電解質相比,固體電解質具有穩定性高、工作溫度寬、使用壽命長以及安全性好等獨特優點。具體來說,在固態鋰空氣電池中,致密的固態電解質將空氣正極側和鋰金屬負極側分離,能夠完全防止大氣成份和鋰金屬的直接反應;同時,還具有更高的機械強度來防止鋰枝晶的穿透,具有更高的安全性。2013年Zhou等使用LTAP作為固態電解質,配合使用凝膠狀的多孔空氣電極材料,得到鋰空氣電池的比容量可以達到56 800mAh/g,庫侖效率大于95%。
全固態鋰空氣電池不存在漏液問題,安全性有所提高,但固態電解質與鋰負極、空氣電極、包括固態電解質內部的接觸不會像液體電解質那樣緊密,這就可能造成電池內阻增大。
3 鋰空氣電池的空氣電極
正極中的固-氣-液三相界面是所有反應主要的發生區,直接影響著電池的容量、充放電電壓和庫倫效率,因此,鋰空氣電池正極材料選擇與制備至關重要,其基本結構如圖4所示[1]。

圖4 鋰空氣電池的空氣電極的基本結構
由于在鋰空氣電池正極生成的電極產物Li2O2或Li2O較為穩定,在對電池充電時,往往需要較高的電位才能使得逆向反應得以發生。因此在鋰空氣電池的正極材料中,還需要添加合適的催化劑,來促進反應的發生,降低充放電時的過電勢,提高效率。鋰空氣電池的正極空氣電極一般由多孔基體、催化劑和粘結劑組成。
多孔基體通常由多孔的碳材料構成,比如炭黑、乙炔黑、活性炭、Super P等。對于多孔材料而言,其孔徑和孔容至關重要,當多孔基體具有合適的孔徑時,電池的放電比容量和孔容量的大小成近似的正相關性。雖然碳材料在鋰空氣電池中運用非常普遍,但是碳材料在放電過程中容易極化造成過電壓升高,當電壓超過3.5V 時就會導致碳基體發生分解,產生Li2CO3等副產物。為了解決這個問題,也有人嘗試用多孔金代替碳材料作為鋰空氣電池的空氣電極,但是多孔金的成本高,且密度大,不利于商業化的大量生產。對于另一種重要成份催化劑而言,通常使用的催化劑包括碳材料催化劑、金屬氧化物催化劑、貴金屬催化劑和其他可溶性催化劑等,使用不同的催化劑,會對鋰空氣電池的比容量以及充放電電位都會有比較明顯的影響。
在最近幾年,關于空氣電極的研究取得了長足的進步。Yang等使用PtAu復合納米粒子,負載在碳多孔電極上作為催化劑,將充電電壓降低到了3.4V左右,甚至優于單獨使用Pt的效果;Bruce等則另辟蹊徑,使用四硫富瓦烯(TTF)來作為電極反應中氧化還原的媒介。在充電時,TTF首先在正極的表面被氧化成TTF+,然后TTF+再氧化Li2O2生成O2,TTF則得到還原。通過這樣的一個過程,使得電極的極化被大幅削弱,最終實現了1mA/cm2的大電流充放電,并且在100次循環后容量幾乎沒有衰減。
盡管有了這些進步,但也應注意到,目前鋰空氣電池的空氣電極仍然有較大的不足,比如難以大功率充放電,循環穩定性還不夠理想,過電勢較高等。距離真正的實用化,目前的空氣電極研究仍然任重而道遠。
4 總結與展望
進入21世紀以來,鋰空氣電池因為其超高、足以比肩汽油的理論比容量,而受到人們的廣泛關注,被看作解決電動汽車電能儲存的理想電源,作為未來的電池之星。但我們仍然需要看到,目前對于鋰空氣電池的研究仍然處于比較初級的階段,目前仍然有許多問題亟待解決,包括:對目前的電解質體系作進一步的優化,兼顧鋰離子的傳輸性能、穩定性和安全性;目前仍然有多孔正極被反應生成的Li2O2阻塞的問題,需要開發出新的電極或催化劑來降低Li2O2阻塞的影響;對于能夠同時催化ORR和OER過程的雙功能催化劑,目前還沒有理想的選擇,仍需進一步尋找。
盡管還有諸多的不足,但仍然不能阻止我們對鋰空氣電池這個未來的電池之星的想象和希冀。在不遠的將來,如果鋰空氣電池能夠真正走向實用化的話,一定會徹底地改變我們的生活。
[1] Girishkumar G,Mccloskey B,Luntz AC,etal. J.Phys.Chem. Lett.2010,1(14),2193-2203.
[2] Littauer E L, Tsai K C. ChemInform Abstract: Anodic Behavior of Lithium in Aqueous Electrolytes. Iv. Influence of Temperature[J]. Journal of the Electrochemical Society, 1976, 11(28):no-no.
[3] Jiang Z, Abraham K M. Preparation and Electrochemical Characterization of Micron‐Sized Spinel LiMn2 O 4[C]// Computers in Power Electronics, 1990 IEEE Workshop on. IEEE, 1996:251-260.
[4] Gu D,Zhang C,Gu S,etal. Acta Chim.Sinica 2012,70(20),2115.
[5] Zhang T,Imanishi N,Hasegawa S,etal. J.Electrochem.Soc.2008,155(12),A965-A969.
The Future of the Battery Star-Lithium Air Battery
Zhan Shu
Lithium air battery has a very high theoretical capacity,can be used in electric vehicles and gasoline can be compared to the endurance,which has been widespread concern.In the recent ten years of research,the understanding of lithium air battery has been deepened,and the performance of the battery has been greatly improved.In this paper,the development history of lithium air battery is introduced.The basic principle and the latest research achievements in the field of electrolyte,air electrode and catalyst are introduced.A brief analysis of the current status of the study,and prospects for future applications.
lithium air battery;principle;electrolyte;air electrode;catalyst
TM912
A
1003–6490(2017)05–0187–03
2017–04–16
詹澍(2000—),男,北京人,主要研究方向為鋰–空氣電池。

