單增李斯特菌prfA基因缺失菌株的構建及其生物學特性鑒定
郭 亮,陳國薇,謝曼曼,劉武康,丁承超,王淑娟,羅 勤,劉 箐
單增李斯特菌prfA基因缺失菌株的構建及其生物學特性鑒定
郭 亮,陳國薇,謝曼曼,劉武康,丁承超,王淑娟,羅 勤,劉 箐*
(上海理工大學醫療器械與食品學院,上海 200093)
單核細胞增生性李斯特菌(Listeria monocytogenes,Lm)是一種風險較高的食源性致病菌,其絕大多數毒力基因的表達均受到由prfA基因編碼的PrfA(positive regulatory factor A)蛋白全部或部分調控。使用同源重組的方法敲除Lm野生菌株EGDe的prfA基因,并通過測定生長曲線、毒力基因表達和侵襲Caco-2細胞能力等探討單缺失菌株EGDe-ΔprfA生 物學特性。通過測定生長曲線顯示prfA敲除株和野生型EGDe二者生長狀態無差異;運用實時定量熒光聚合酶鏈式反應檢測EGDe-ΔprfA的主要毒力基因表達,結果顯示plcA、plcB毒力基因的表達量分別上升至原來的2.5 倍和2 倍,inlA、inlB、inlC、actA、vip等均呈下降趨勢,prfA基因表達量趨向于零;侵襲Caco-2細胞結果顯示EGDe-ΔprfA侵襲數為野生株的1/5。該基因缺失菌株的構建及生物學特性研究對食源性致病菌EGDe致病機理研究具有重要意義并且提供了重要材料。
單核細胞增生性李斯特菌;prfA;基因敲除;生物學特性
單核細胞增生性李斯特菌(Listeria monocytogenes,Lm)是普遍存在的一種微生物,廣泛分布在各種環境中,人類通過攝入感染Lm的乳制品、肉類、魚類、蔬菜等發生李氏桿菌病,李氏桿菌病主要影響免疫力低下的老年人、孕婦和新生兒,具有較高的致死率(20%~30%)[1-3]。單核細胞增生李斯特氏菌可以在較寬的溫度范圍內(1~45 ℃)生長,最佳溫度為30~37 ℃;此外,它可以在惡劣環境下生存,例如低pH值和高質量分數鹽(10% NaCl)[4]。不管是人類還是動物,Lm均可以感染多種組織,包括脾、肝、腦,一般認為Lm穿過腸道屏障進入淋巴和血液,在肝細胞或脾細胞中復制然后通過血液可以到達大腦和胎盤[5-7]。
Lm致病過程由多種不同的毒力基因編碼的毒力因子調控,前期研究表明,Lm通過觸發兩種膜表面蛋白內化素A(internalin A,InlA)和內化素B(internalin B,InlB),和宿主細胞的特異性受體結合,引導Lm被吞噬細胞吞噬后[8-9],細胞溶解素酶O(listeriolysin O,LLO,由hly編碼)在plcA和plcB編碼的磷脂酰肌醇特異性磷脂酶(phosphatidylinositol-specific phospholipase C,PIPLC)和卵磷脂酶(phosphatidylcholine-PLC,PC-PLC)協助下裂解吞噬胞膜,幫助Lm逃離吞噬小體[10-11];Lm利用磷酸己糖(hexose phosphate,HP)在細胞漿中繁殖,HP的攝取是由hpt編碼的己糖磷酸鹽轉運蛋白 (hexose phosphate transporter,Hpt)完成,Hpt酶的缺失會導致Lm毒力受損和侵入小鼠能力下降,Hpt是第一個被確定參與細胞內病原菌增值的毒力因子[12];與此同時,actA基因編碼的肌動蛋白A(actin assembly-inducing protein,ActA)誘導宿主細胞肌動蛋白纖絲聚合在細菌末端,推動細菌移動,進入新的細胞裂解繁殖[13]。上述所有毒力基因的表達均受到PrfA蛋白全部或部分調控[14-16]。hly、plcA、plcB、mpl、actA和prfA基因組成的基因簇是Lm入侵宿主的關鍵因素,它的轉錄表達依賴PrfA蛋白[17]。Fang Chun等[18]將菌株EGDe和M7的prfA基因進行相互替換得到EGDe-prfAM7和M7-prfAEGDe,發現較低致病性的M7攜帶的prfA基因替換到EGDe后,菌株的InlA、InlB、LLO和ActA蛋白表達量上調,同時細胞的侵襲和黏附能力上升。除此之外,prfA基因的缺失也會導致細菌菌膜形成能力下降[19]。
為了解毒力基因prfA對EGDe菌株起到的作用,本研究使用溫敏型穿梭質粒pKSV7,運用同源重組技術構建單缺失菌株EGDe-ΔprfA[20],該基因缺失菌株的構建及生物學特性研究為食源性致病菌Lm致病機理研究提供重要依據。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株、質粒和細胞
野生株EGDe、結腸癌Caco-2細胞株為上海理工大學系統生物醫學研究中心保存;pKSV7(溫度敏感性穿梭載體,含有氯霉素(chloramphenicol,Cam)標記)由華中師范大學副教授羅勤饋贈;大腸桿菌感受態細胞DH5α和pMD19-T Vector購自大連寶生物公司。
1.1.2 試劑
限制性內切酶(SmaⅠ、XbaⅠ和SalⅠ)、Taq DNA聚合酶、dNTPs、DNA Ladder Marker、T4 DNA連接酶大連寶生物公司;腦心浸液(brain heart infusion,BHI)培養基、LB培養基 北京陸橋技術股份有限公司;細胞培養基、胎牛血清 上海賽齊生物工程有限公司;氨芐青霉素(ampicillin,Amp)、Cam 上海朝瑞生物科技有限公司;細菌基因組抽提試劑盒、核酸凝膠回收試劑盒、質粒抽提試劑盒 天根生化科技(北京)有限公司。
1.2 儀器與設備
9500型普通聚合酶鏈式反應(polymerase chain reaction,PCR)儀、7500型實時熒光定量PCR儀 美國ABI公司;SpectraMax M2型多功能全波長酶標儀 美國Molecular Devices公司;核酸電泳設備、電轉化儀、凝膠成像儀及相關軟件 美國Bio-Rad公司;Nano Drop微量生化測定儀 美國Thermo Fisher Scienti c公司;臺式離心機 德國Eppendorf公司。
1.3 方法
1.3.1 引物序列
引物設計是根據NCBI相關報道使用DNAman軟件設計,由生工生物工程(上海)股份有限公司合成,序列見表1。

表 1 EGDe-ΔprfA構建及鑒定所需引物Table 1 Primer sequences used in the construction and identification of EGDe-ΔprfA
1.3.2 EGDe基因組DNA和總RNA的提取
EGDe基因組DNA和總RNA提取分別用凍融法和苯酚法。
1.3.3 prfA基因上下游同源臂的擴增及連接
分別用引物A1/A2和A3/A4擴增prfA基因的上下游片段,產物進行1.5%瓊脂糖凝膠電泳,割膠回收并測定濃度,以OD260nm/OD280nm判斷純度,割膠回收具體步驟參考核酸凝膠回收試劑盒說明書。
割膠回收產物使用限制性內切酶XbaⅠ單酶切處理,37 ℃水浴5~6 h,電泳后割膠回收;酶切產物使用T4DNA連接酶16 ℃金屬浴14~16 h進行上下游同源臂連接,電泳并割膠回收。
1.3.4 同源臂連接T載體并導入DH5α感受態細胞
DH5α感受態細胞制備:取過夜培養的DH5α E. coli
轉接到100 mL LB培養基中,培養至OD600nm0.4~0.6;用0.1 mol/L CaCl210 mL洗滌2 次,離心;使用10 mL含10%~20%甘油的0.1 mol/L CaCl2重懸;1.5 mL離心管每管200 μL分裝,冰浴5 h后-80 ℃保存。
連接pMD19-T vector:pMD19-T vector、上下游連接產物、solubionⅠ置于16 ℃金屬浴30 min,轉入DH5α感受態細胞中,冰浴30 min;42 ℃ 90 s熱激,再冰浴1 min;加入890 μL LB培養基37 ℃搖床培養60 min;離心棄上清液,剩余100 μL重懸,涂布含100 μg/mL Amp的LB平板上,37 ℃培養。
1.3.5 陽性克隆鑒定
將抗性平板上的單菌落挑下,于含100 μg/mL Amp的LB培養基中搖床培養;取菌液使用引物A1/A4進行PCR鑒定上下游連接片段,電泳后將陽性克隆對應的菌液擴大培養抽提質粒。
1.3.6 同源臂與pKSV7連接
以pKSV7和連有同源臂的T載體為樣本,使用兩種內切酶,37 ℃水浴5~6 h,電泳后分離產物并割膠回收;割膠回收后的產物使用T4 DNA連接酶16 ℃金屬浴15~16 h,后導入DH5α感受態細胞中,涂布含100 μg/mL Amp的LB平板并鑒定,方法同T載體;脫鹽的質粒樣本約20 μL送測序并比對。
1.3.7 重組質粒電轉化EGDe感受態細胞
EGDe感受態細胞制備:用終質量濃度為5 μg/mL的青霉素G和3.5×SMHEM溶液(952 mmol/L蔗糖、3.5 mmol/L MgCl2和7 mmol/L HEPES溶于50 mL雙蒸水,使用0.22 μm濾膜過濾除菌)處理EGDe菌體,將感受態細胞濃度控制在1.1×1011個/mL 左右,并以200 μL每管分裝至小離心管中,-80 ℃保存。
電轉參數:電擊杯加入8 μL質粒和200 μL Lm感受態細胞,電轉場強2.5 kV,時間4 ms;電轉后菌體移入3~5 mL BHI中,37 ℃培養1~2 h,離心棄上清液重懸涂布于含10 μg/mL Cam BHI平板,30 ℃搖床培養48~72 h。1.3.8 prfA基因缺失突變株的篩選與鑒定
挑取平板中單菌落于含10 μg/mL Cam BHI培養基中培養41 ℃過夜,按1∶100(V/V)轉接8~10 次,一天兩次仍在41 ℃條件下培養,末代細菌劃線接種于含10 μg/mL Cam BHI平板,41 ℃過夜培養;挑取上述平板中的單菌落于BHI液體中培養,30 ℃過夜后按1∶100(V/V)轉接6~8 次,一天兩次在相同條件下培養;末代培養物劃線BHI平板30 ℃培養,挑單菌落使用引物A1/A4和A5/A6 PCR鑒定上下游連接片段和prfA基因片段,并將疑似株分別劃線抗性和無抗性平板培養,抗性平板不生長、無抗性平板生長的為可疑突變株,擴增相應基因片段進行測序。
1.3.9 突變株生長曲線
將EGDe、EGDe-ΔprfA接種于BHI液體培養基中過夜培養,次日取1 mL飽和菌液轉接到100 mL新鮮BHI液體培養基中搖床培養,每隔1 h取200 μL菌液加入96 孔板中測定OD600nm,共測定12 h,設置3 個平行組,重復3 次實驗,用數據處理軟件繪制生長曲線。
1.3.10 RT-PCR
將提取的EGDe、EGDe-ΔprfA總RNA反轉錄獲得cDNA(反轉錄試劑盒中含有去除基因組DNA的相關試劑)、以cDNA為模板進行SYBR Green熒光染料法實時定量熒光PCR(real time-polymerase chain reaction,RTPCR),以EGDe的16S rRNA為內參基因,測定EGDe的9個主要毒力基因表達變化,以2-ΔΔCt表示所有基因的表達量,即EGDe所有基因的表達量均為1,EGDe-ΔprfA的各基因表達量大于1的為表達上調,小于1的為表達下調。
1.3.11 EGDe、EGDe-ΔprfA侵襲Caco-2細胞
將Caco-2細胞轉移到12 孔板中培養,顯微鏡觀察生長至鋪滿孔板;挑取EGDe、突變株單菌落過夜培養,調菌至OD600nm為0.3,菌數約108CFU/mL;孔板廢液取出加入2 mL非完全培養基,加100 μL菌液,37 ℃培養箱4 h;吸掉廢液用生理鹽水洗滌,加慶大霉素1 mL/孔,放37 ℃培養箱30 min;1% Triton室溫處理30 min,裂解后溶液取出放入1.5 mL離心管振勻,稀釋10 倍涂BHI平板37 ℃培養并計數。
1.4 數據處理
本實驗數據經Microsoft Excel與GraphPad Prism 5處理。
2 結果與分析
2.1 prfA基因上下游同源臂的擴增

圖 1 上下游同源臂擴增Fig. 1 Electrophoretogram of amplification products of the upstream and downstream flanking sequences
以EGDe基因組為模板擴增prfA基因的上下游同源臂,進行電泳后結果見圖1。上游同源臂626 bp,下游同源臂636 bp,擴增的片段與預期的片段大小相符且特異性良好無雜帶。
2.2 prfA基因上下游同源臂的連接

圖 2 上下游同源臂連接Fig. 2 Electrophoretogram showing successful ligation of the upstream and downstream flanking sequences
上下游同源臂連接結果見圖2。上下游連接片段大小為1 262 bp,由圖2可知,prfA基因上下游同源臂均連接成功。
2.3 導入DH5α感受態細胞
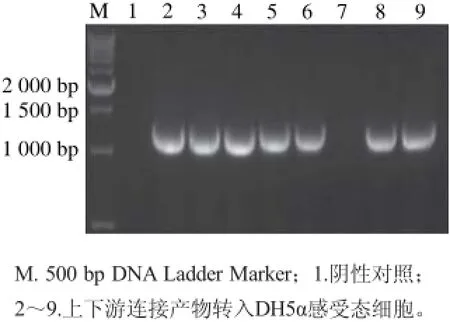
圖 3 導入DH5α感受態細胞鑒定Fig. 3 Identi fication of DH5α competent cells
上下游連接產物轉入DH5α感受態細胞中鑒定結果見圖3。圖3為菌落PCR鑒定,其中陽性片段大小1 200 bp左右,為篩選菌株,進行擴大培養并-80℃凍存。
2.4 pKSV7重組質粒的構建
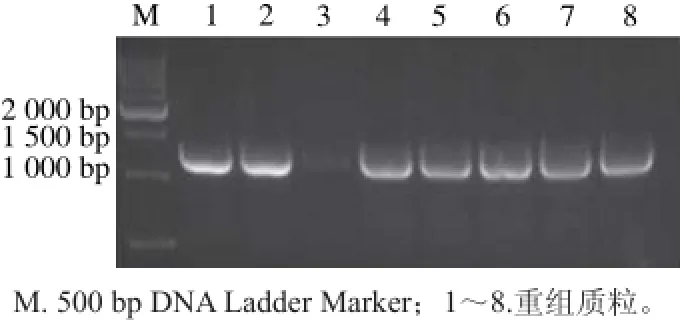
圖 4 pKSV7重組質粒鑒定Fig. 4 Identification of recombinant plasmid PKSV7
pKSV7重組質粒的鑒定結果見圖4。泳道陽性片 段在1 200 bp附近,表明prfA上下游連接片段成功插入質粒pKSV7中。提取質粒送測序,比對結果顯示序列相似度為100%,可以進行后續實驗。
2.5 prfA基因缺失突變株的篩選與鑒定
電轉后的菌體在一定條件下進行培養篩選,預期得到篩去質粒的目的菌株,挑取單菌落使用同源臂引物和目的基因引物進行PCR鑒定,鑒定結果見圖5。同源臂引物A1/A4結合位點位于目的基因的外側,即目的基因缺失后擴增產物應明顯小于EGDe野生株為模板的陽性對照擴增產物;A5/A6位于目的基因內側,目的基因缺失后無法擴增出相應片段,疑似菌株的電泳結果應為空白。

圖 5 prfA基因缺失菌株的篩選Fig. 5 Identification of the deletion mutant ΔprfA
圖5 中,2號泳道為以EGDe基因組DNA作為模板的陽性對照,19號同源臂引物擴增產物比陽性對照片段小約1 000 bp左右,而用A5、A6引物則未擴增出任何產物,說明19號泳道菌株可能為突變菌株。將疑似突變菌株擴大培養涂布抗性平板和無抗性平板,結果抗性平板無菌落生長,將產物進行測序結果表明prfA基因已經缺失,prfA基因缺失菌株構建完成,并命名為EGDe-ΔprfA,菌液凍存-80 ℃用于后續實驗。
2.6 生長曲線
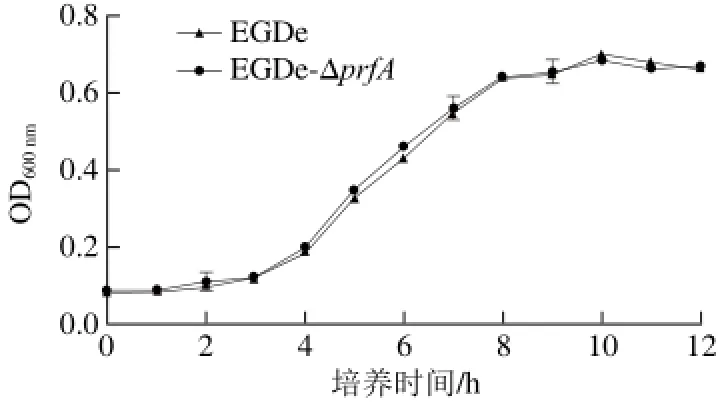
圖 6 EGDe、EGDe-ΔprfA生長曲線Fig. 6 Growth curves of EGDe and EGDe-ΔprfA
取EGDe、EGDe-ΔprfA 1 mL飽和菌液轉接到100 mL新鮮BHI液體培養基中搖床培養測定OD600nm比較2 種菌株的活力是否不同,結果見圖6。根據圖6顯示,prfA基因缺失后的菌株生長趨勢與野生株并無明顯差異。
2.7 RT-PCR結果
EGDe-ΔprfA的9 個主要毒力基因RT-PCR實驗結果見圖7。以野生EGDe毒力基因的表達水平1為基準,EGDe-ΔprfA中的prfA基因幾乎沒有表達,說明基因缺失菌株構建成功;inlA、inlB、inlC、actA、vip表達量均有明顯下調(P<0.05);sigB基因的表達量無明顯變化;plcA、plcB表達量分別上升至原來的2.5 倍和2 倍。由于基因調控的復雜性和本實驗中RT-PCR針對的毒力基因有一定的局限性,EGDe-ΔprfA毒力的具體變化情況,還需要進行后續的細胞侵襲實驗進行驗證。
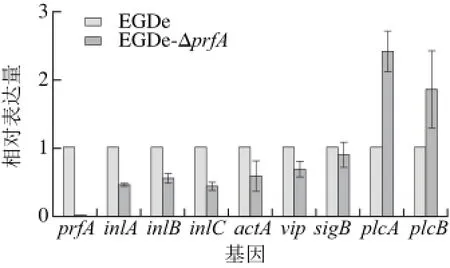
圖 7 EGDe-ΔprfA毒力基因RT-PCRFig. 7 RT-PCR amplification of virulence genes of EGDe-ΔprfA
2.8 EGD e、EGDe-ΔprfA侵襲Caco-2細胞

圖 8 各菌株菌落總數Fig. 8 Numbers of bacterial colonies of EGDe and EGDe-ΔprfA after invasion into Caco-2 cells
分別對EGDe、EGDe-ΔprfA侵襲Caco-2細胞后細胞裂解液稀釋涂平板,對單菌落計數結果見圖8。細胞侵襲實驗結果表明,與EGDe侵襲能力相比,EGDe-ΔprfA基因缺失株的侵襲能力明顯下降,EGDe-ΔprfA細菌侵襲數量僅為野生株1/5,說明prfA基因敲除會降低EGDe的毒力。
3 結 論
InlA 、InlB、LLO、PlcA、PlcB、Mpl、Hpt、ActA、InlC 9 個主要的毒力因子嚴格受PrfA調控,除此之外多達145 個其他的單核細胞增生李斯特菌基因在轉錄組學和蛋白組學分析中受到PrfA影響,這些間接調控的基因包括轉運、代謝、調節、應激反應調控和其他未知功能蛋白[21-24]。目前對PrfA的功能有了一定的了解,但是很多機理尚不清楚,有待進一步的研究。
PrfA對毒力基因的調控是一個復雜的機制,用EGDe-ΔprfA、EGDe-ΔinlA、EGDe-ΔinlB和EGDe-Δhly(hly,編碼LLO蛋白)幾種毒力基因缺失株感染雞胚
胎,發現prfA基因缺失和hly基因缺失降低了EGDe的毒力,然而EGDe-ΔinlA和EGDe-ΔinlB兩種基因缺失株對雞胚胎的致死率與野生株相比并未下降,這證明了PrfA對
EGDe毒力起到調控作用[25]。本研究通過同源重組技術成功對prfA基因進行了敲除,同時研究了單缺失菌株EGDe-ΔprfA部分生物學特性。生長曲線結果表明prfA基因缺失后的菌株生長趨勢與野生株并無太大差別,生長能力沒有影響;但prfA基因缺失造成多個毒力基因表達下降,細胞侵襲實驗表明prfA基因的缺失使EGDe的毒力有明顯的下降,證明了prfA基因的調控作用,為深入研究prfA基因介導EGDe入侵宿主細胞過程中的作用機制的研究提供基礎參考數據。
[1] MAGALH?ES R, MENA C, FERREIRA V, et al. Bacteria: Listeria monocytogenes[J]. Encyclopedia of Food Safety, 2014, 1: 450-461. DOI:10.1016/B978-0-12-378612-8.00101-3.
[2] GRAY M J, FREITAG N E, BOOR K J. How the bacterial pathogen Listeria monocytogenes mediates the switch from environmental Dr. Jekyll to pathogenic Mr. Hyde[J]. Infection and Immunity, 2006, 74(5): 2505-2512. DOI:10.1128/IAI.74.5.2505-2512.2006.
[3] 丁建英, 韓劍眾. 食品中單增李斯特菌的存在現狀及檢測方法研究進展[J]. 食品研究與開發, 2008, 29(12): 171-174. DOI:10.3969/ j.issn.1005-6521.2008.12.050.
[4] CHATURONGAKUL S, RAENGPRADUB S, WIEDMANN M, et al. Modulation of stress and virulence in Listeria monocytogenes[J]. Trends in Microbiology, 2008, 16(8): 388-396. DOI:10.1016/j.tim.2008.05.006.
[5] COSSART P, TOLEDO-ARANA A. Listeria monocytogenes, a unique model in infection biology: an overview[J]. Microbes and Infection, 2008, 10(9):1041-1050. DOI:10.1016/j.micinf.2008.07.043.
[6] 李文艷, 董明倩, 王亞光, 等. 單增李斯特菌感染過程中炎性體激活的研究進展[J]. 微生物學通報, 2016, 43(3): 634-639. DOI:10.13344/ j.microbiol.china.150487.
[7] 任防振, 徐國勛. 兼氧/好氧膜生物反應器處理食品廢水研究[J].上海理工大學學報, 2007, 29(3): 285-288. DOI:10.3969/ j.issn.1007-6735.2007.03.018.
[8] COSSART P, PIZARRO-CERDA J, LECUIT M. Invasion of mammalian cells by Listeria monocytogenes: functional mimicry to subvert cellular functions[J]. Trends in Cell Biology, 2003, 13(1): 23-31. DOI:10.1016/S0962-8924(02)00006-5.
[9] 殷月蘭, 董慧, 焦新安, 等. 產單核細胞李斯特菌actA基因在大腸桿菌中的表達及其單克隆抗體的研制[J]. 微生物學報, 2006, 46(6): 999-1002. DOI:10.3321/j.issn:0001-6209.2006.06.027.
[10] VAZQUEZ-BOLAND J A, KUHN M, BERCHE P, et al. Listeria pathogenesis and molecular virulence determinant[J]. Clinical Microbiology Reviews, 2001, 14(3): 584-640. DOI:10.1128/ CMR.14.3.584-640.2001.
[11] BAVDEK A, KOSTANJSEK R, ANTONINI V, et al. pH dependence of listeriolysin O aggregation and pore-forming ability[J]. FEBS Journal, 2012, 279(1): 126-141. DOI:10.1111/j.1742-4658.2011.08405.x.
[12] CHICO-CALERO I, SUAREZ M, GONZALEZ-ZORN B, et al. Hpt, a bacterial homolog of the microsomal glucose-6-phosphate translocase, mediates rapid intracellular proliferation in Listeria[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(1): 431-436. DOI:10.1073/pnas.012363899.
[13] KNOWLES H, HEIZER J W, LI Y, et al. Transient receptor potential melastatin 2 (TRPM2) ion channel is required for innate immunity against Listeria monocytogenes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(28): 11578-11583. DOI:10.1073/pnas.1010678108.
[14] SCORTTI M, MONZO H J, LACHARME-LORA L, et al. The PrfA virulence regulon[J]. Microbes and Infection, 2007, 9(10): 1196-1207. DOI:10.1016/j.micinf.2007.05.007.
[15] HERAS A D L, CAIN R J, BIELECKA M K, et al. Regulation of Listeria virulence: PrfA master and commander[J]. Current Opinion in Microbiology, 2011, 14(2): 118-127. DOI:10.1016/j.mib.2011.01.005. [16] SWAMINATHAN B, GERNER-SM IDT P. The epidemiology of human listerio sis[J]. Microbes and Infection, 2007, 9(10): 1236-1243. DOI:10.1016/j.micinf.2007.05.011.
[17] KREFT J, VAZQUEZ-BOLAND J A. Regulation of virulence genes in Listeria[J]. International Journal of Medical Microbiology, 2001, 291(2): 145-157. DOI:10.1078/1438-4221-00111.
[18] FANG C, CAO T, CHENG C Y, et al. Activation of PrfA results in overexpression of virulence factors but does not rescue the pathogenicity of Listeria monocytogenes M7[J]. Journal of Medical Microbiology, 2015, 64(8): 818-827. DOI:10.1099/jmm.0.000101.
[19] LUO Q, SHANG J L, FENG X Q, et al. PrfA led to reduce d bio lm formation and contributed to altered gene expression patterns in biofilm-forming Listeria monocytogenes[J]. Current Microbiology, 2013, 67: 372-378. DOI:10.100 7/s00284-013-0377-7.
[20] HUANG Y Y, SUO Y J, SHI C L, et al. Mutations in gltB and gltC reduce oxativeid stress tolerance and biofilm formation in Listeria mono cytogenes 4b G[J]. International Journal of Food Microbiology, 2013, 163(2/3): 223-230. DOI:10.1016/j.ijfoodmicro.2013.02.023.
[21] XAYARATH B, SMART J I, M UELLER K J, et al. A novel C-terminal mutation resulting in constitutive activation of the central virulence regulatory factor PrfA[J]. Microbiology, 2011, 157(Pt 11): 3138-3149. DOI:10.1099/mic.0.049957-0.
[22] 馬婷, 李芳, 單大亞. 基于物聯網技術的食品冷鏈物流跟蹤及追溯問題研究[J]. 上海理工大學學報, 2013, 35(6): 557-562. DOI:10.3969/j.issn.1007-6735.2013.06.009.
[23] BéCAVIN C, BOUCHIER C, LECHAT P, et al. Comparison of widely used Listeria monocytogenes strains EGD, 10403S, and EGD-e highlights genomic variations underlying differences in pathogenicity[J]. mBio, 2014, 5(2): e00969-14. DOI:10.1128/ mBio.00969-14.
[24] CHE N J, CHEN Q, JIANG L, et al. Internalin pro ling and multilocus sequence typing suggest four Listeria innocua subgroups with different evolutionary distances from Listeria monocytogenes[J]. BMC Microbiology, 2010, 10(1): 97. DOI:10.1186/1471-2180-10-97.
[25] ANDERSSON C, GRIPENLAND J, JOHANSSON J. Using the chicken embryo to assess virulence of Listeria monocytogenes and to model other microbial infections[J]. Nature Protocols, 2015, 10(8): 1155-1164. DOI:10.1038/nprot.2015.073.
Construction and Biological Activity of a Strain of Listeria monocytogenes Deleted for Positive Regulatory Factor A Gene (prfA)
GUO Liang, CHEN Guowei, XIE Manman, LIU Wukang, DING Chengchao, WANG Shujuan, LUO Qin, LIU Qing*
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
Among the known Listeria strains, only Listeria monocytogenes (Lm) can cause human disease. The expression of most virulence genes is regulated fully or partially by positive regulatory factor A (PrfA) protein encoded by prfA gene. In this study, we adopted homologous recombination method to knock out the prfA gene of the wild strain EGDe, and investigated the biological characteristics of EGDe-ΔprfA by testing growth state, virulence gene expression and Caco-2 cell invasion. There was no difference in the growth status of EGDe-ΔprfA and EGDe as demonstrated by the growth curves. Real time quantitative PCR results showed that the expression levels of plcA and plcB genes increased by 2.5 times and twice, respectively, while the expression levels of inlA, inlB, inlC, actA and vip declined. The expression level of prfA gene was nearly zero. The invasion of Caco-2 cells by EGDe-ΔprfA was onefth as high as that by the wild strain. The gene-deleted strain can provide an important tool for studying the pathogenic mechanism of the foodborne pathogen Listeria monocytogenes.
Listeria monocytogenes; prf A; gene knock-out; biological characteristics
10.7506/spkx1002-6630-201710003
TS201.3
A
1002-6630(2017)10-0012-06
郭亮, 陳國薇, 謝曼曼, 等. 單增李斯特菌prfA基因缺失菌株的構建及其生物學特性鑒定[J]. 食品科學, 2017, 38(10): 12-17. DOI:10.7506/spkx1002-6630-201710003. http://www.spkx.net.cn
GUO Liang, CHEN Guowei, XIE Manman, et al. Construction and biological activity of a strain of Listeria monocytogenes deleted for positive regulatory factor A gene (prfA)[J]. Food Science, 2017, 38(10): 12-17. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201710003. http://www.spkx.net.cn
2016-07-22
國家自然科學基金面上項目(31371776);上海市科委“科技創新行動計劃”長三角科技聯合攻關領域項目(15395810900);上海理工大學研究生創新基金資助項目;上海理工大學微創勵志創新基金項目
郭亮(1992—),男,碩士研究生,研究方向為食源性致病菌致病機理。E-mail:guoliangyxh@163.com
*通信作者:劉箐(1970—),男,教授,博士,研究方向為食源性致病菌致病機理及快速檢測技術。E-mail:liuq@usst.edu.cn

