NF-κB 下游炎癥因子在非肥胖 OSAS 患者外周血中的表達及臨床意義
唐婷玉 李志軍 俞李羚 黃勍棟
讀者·作者·編者
NF-κB 下游炎癥因子在非肥胖 OSAS 患者外周血中的表達及臨床意義
唐婷玉 李志軍 俞李羚 黃勍棟
目的 分析 NF-κB 下游炎癥因子在非肥胖阻塞性睡眠呼吸暫停綜合征(OSAS)患者外周血中的表達及其與 OSAS患者疾病嚴重程度的相關性,以評價其臨床價值。 方法 選擇夜間打鼾憋氣伴日間嗜睡的非肥胖人群,進行多導睡眠監測(PSG),根據 AHI指數分為非 OSAS 組 98 例,OSAS 組 100 例(輕度 45 例、中度 30 例、重度 25 例),所有入組對象抽取外周靜脈血,采用 ELISA法檢測外周血 IL-6、TNF- α、C 反應蛋白(CRP),分析兩組間上述指標的差異,并與呼吸暫停低通氣指數(AHI)進行相關性分析。 結果 與非 OSAS 組相比,OSAS 組外周血 IL-6、TNF- α、CRP 升高(均 P<0.05);輕度 OSAS 患者 AHI與 TNF- α、CRP 不相關(r=0. 170、0.239,均 P >0.05),與 IL-6 呈低度相關(r=0.330,P<0.05),中度患者 AHI與 IL-6、TNF- α、CRP 呈中度相關(r=0.637、0.644、0.705,均 P<0.05),重度患者 AHI與 IL-6、TNF- α、CRP 呈高度相關 (r=0.821、0.805、0.854,均 P<0.05)。 結論 非肥胖人群OSAS 患者外周血炎癥指標的表達較非 OSAS 者升高,并在中、重度患者中與 AHI相關,這些指標對 OSAS 的診斷及嚴重程度的評價有一定的臨床價值。
非肥胖 阻塞性睡眠呼吸暫停綜合征 核因子-κB 炎癥因子
【 Abstract 】 Objective To investigate the expression of NF- κB downstream inflammatory factors in non-obese patients with obstructive sleep apnea syndrome(OSAS)and its relation to the disease severity. Methods One hundred and ninety eight non-obese subjects with nocturnal snoring with daytime somnolence were monitored with polysomnography(PSG),according to apnea hypopnea index(AHI),100 subjects were classified as OSAS and 98 as non-OSAS.Serum IL-6,TNF- α and CRP levels were measured with ELISA method.Results Compared with the non-OSAS group,serum IL-6,TNF- α and CRP were elevated significantly(P<0.05).In OSAS AHI score and TNF alpha,mild group were not associated with CRP(r=0.170、0.239,P >0.05) associated with IL-6 mild(r=0.330,P<0.05)and OSAS moderate group AHI index and IL-6,TNF alpha,moderately correlated to the CRP(r=0.637、0.644、0.705,P<0.05),severe group and IL-6,TNF alpha,CRP was highly correlated(r=0.821、0.805、0.854, P <0.05). Conclusion Non-obese people the expression of peripheral blood in patients with OSAS group inflammation index than in OSAS group increases,and in the middle and severe population associated with AHI index,evaluation of diagnosis and severity of OSAS has certain clinical value.
【 Key words 】 Non-obese OSAS NF- κappa B Inflammation factors
阻塞性睡眠呼吸暫停綜合征(OSAS)可引起慢性炎癥反應,其病理損傷核心因素是體內長期存在的間歇低氧/再氧合環境。間歇低氧可以優先激活炎癥通路,促進下游炎性細胞因子、趨化因子和黏附分子的表達,造成機體全身性炎癥反應,從而導致血管內皮損傷和功能紊亂,促進各種心血管疾病的發生、發展。間歇低氧引起的炎癥通路機制包括 NF-κB 通路、細胞外調解蛋白激酶通路、p38 絲裂原活化蛋白激酶通路。近幾年,國內外學者對炎癥通路的研究熱點正是 NF-κB 通路,重點是其下游產物即外周血 IL-6、TNF-α、C 反應蛋白 (CRP)在體內的表達。呼吸暫停低通氣指數(AHI)是反映 OSAS病情嚴重程度的主要指標,無論患者有無日間癥狀,該指標均可能與心血管疾病的發病率顯著相關[1],而炎癥反應在 OSAS 及其并發癥發病機制中的作用也越來越
受到重視。目前對于 OSAS 患者外周血指標與 AHI是否有相關性,可否用該指標判斷 OSAS患者的嚴重程度,尚有不同的觀點,部分分歧在于肥胖對 OSAS 的炎癥指標水平有影響。此外,OSAS 與肥胖的共存以及缺氧、炎癥和脂肪之間的相互關系,均可使炎癥表型的評價復雜化[2-3]。有研究發現中國人頜骨畸形的發生率較高,這可能是導致 OSAS 發生的重要因素。本研究在排除肥胖因素后研究 NF-κB 下游炎癥因子在 OSAS 患者中的表達,以期為臨床判斷 OSAS 病情的嚴重程度提供參考。
1 對象和方法
1.1 對象 選擇本院 2014 年 6 月至 2016 年 6 月因夜間睡眠打鼾、憋氣及日間嗜睡為主訴就診的非肥胖患者(BMI<28kg/m2)198 例,其 中男 128 例 ,女 70 例 ,年 齡45~77(61±13)歲。根據 AHI分組,非 OSAS 組 98 例,男60 例 ,女 38 例 ,年 齡 45 ~70(59 ±11)歲;BMI 23kg/m2。OSAS 組 100 例,男 68 例,女 32 例,年齡 47~77(63±13)歲;BMI 26kg/m2。兩組對象性別、年齡、BMI 比較差異均無統計學意義(均 P >0.05)。OSAS 診斷符合 2011 年中華醫學會呼吸病學分會睡眠呼吸障礙學組修訂的《阻塞性睡眠呼吸暫停低通氣綜合征診治指南》。排除標準:合并心功能、腎功能衰竭,嚴重的感染性疾病,血液系統疾病,惡性腫瘤,中重度嗜酒,長期使用精神類藥物,有風濕性疾病及其他全身炎癥性疾病,使用吸入、口服或靜脈輸注激素的患者;有哮喘、過敏性鼻炎或過敏體質的患者,需要手術治療的 OSAS 患者。
1.2 方法
1.2.1 多導睡眠監測(PSG) 采用睡眠生理儀(美國Alice5),按國際標準方法記錄腦電圖、眼電圖、下頜肌電圖、心電圖、血氧飽和度、鼻呼吸氣流、胸腹呼吸運動、鼾聲及體位。監測時間為 22∶00 至次日 6∶00,一般需要整夜不少于 7h 的睡眠,睡眠分期、AHI、血氧飽和度低于 90%的時間(OLT90%)由計算機自動分析。AHI為每小時呼吸暫停次數和睡眠低通氣次數之和。低通氣定義為口鼻氣流較基線水平降低>50%且氣流持續至少10s,并伴有氧飽和度下降>3%。呼吸暫停指口鼻氣流消失或明顯減弱,持續時間>10s。
1.2.2 評價標準 根據 AHI評判 OSAS 病情程度,5<AHI≤15 次/h 為輕度,15<AHI≤30 次/h 為中度,>30次/h 為重度。以此為依據將 OSAS 患者分為輕度、中度、重度3組。
1.2.3 標本的采集及測定 在獲得所有研究對象知情同意后,清晨空腹抽取肘靜脈血 5ml,2h 內分離血清,-70℃低溫保存。采用 ELISA 法檢測 IL-6、TNF-α、CRP,操作嚴格按照說明書要求進行。
1.3 統計學處理 采用 SPSS19.0 統計軟件,正態分布的計量資料以表示,組間比較采用獨立樣本t檢驗,相 關 性 分 析 采 用 Pearson 相 關 ,r≥0.8 為 高 度 相 關 ,0.5≤r<0.8 為中度相關,0.3≤r<0.5 為低度相關,r<0.3 為不相關。
2 結果
2.1 兩組血清 CRP、TNF-α、IL-6 水平比較 見表 1。
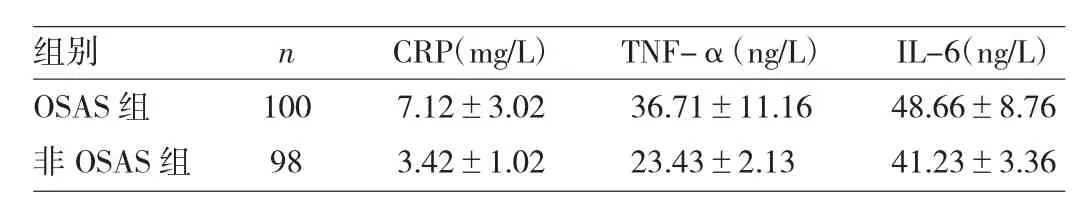
表1 兩組血清 CRP、TNF-α、IL-6 水平比較
由表 1 可見,與非 OSAS 組相比,OSAS 組血清 IL-6、TNF-α、CRP 水平均升高,差異均有統計學意義(均P<0.05)。
2.2 OSAS 組患者 AHI與 CRP、TNF-α、IL-6 的相關性分析 見圖 1-3,表 2。
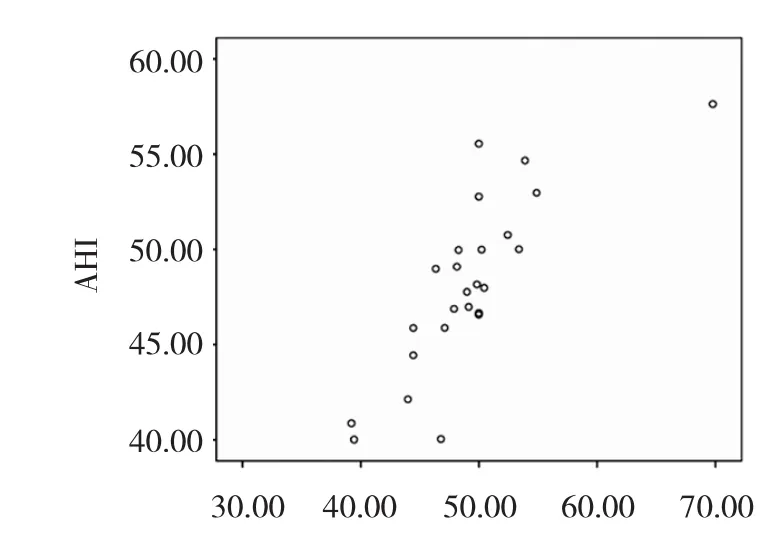
圖1 AHI與 TNF-α 相關性散點圖
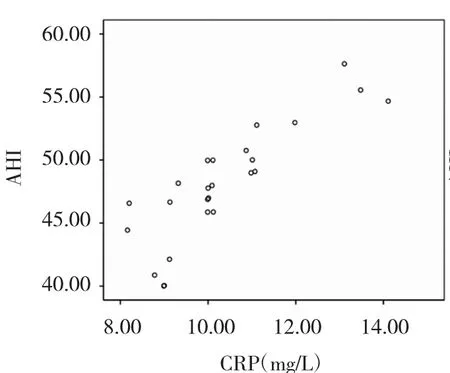
圖2 AHI與 CRP 相關性散點圖
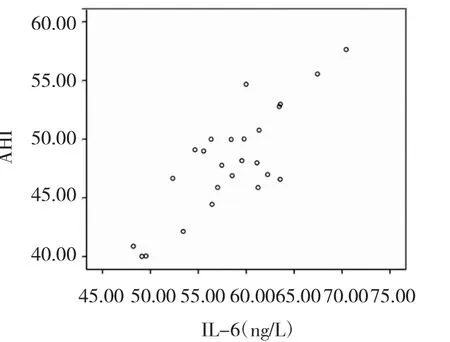
圖3 AHI與 IL-6 相關性散點圖
由圖 1-3、表 2 可見,輕度 OSAS 患者 AHI 與 TNF- α、CRP 不相關(r=0.170、0.239,均 P >0.05),與 IL-6 呈低度相關 (r=0.330,P<0.05),中度患者 AHI 與 IL-6、TNF-α、CRP 呈中度相關(r=0.637、0.644、0.705,均 P<0.05),重度患者 AHI與 IL-6、TNF-α、CRP 呈高度相關(r=0.821、0.805、0.854,均 P<0.05)。
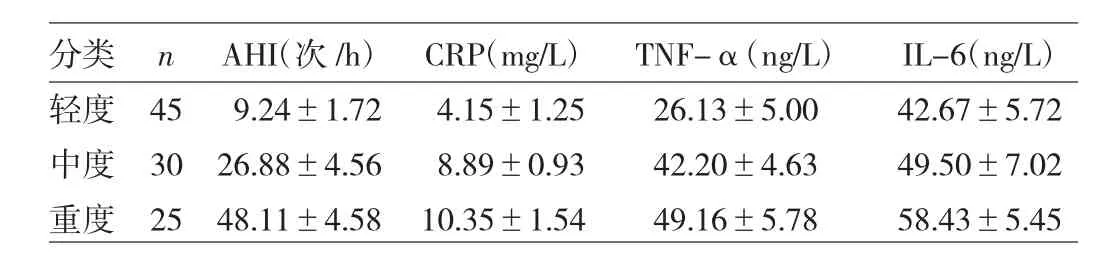
表2 不同程度 OSAS 患者 AHI、CRP、TNF-α、IL-6 指標比較
3 討論
OSAS 是指睡眠時反復發生上呼吸道部分或完全阻塞,導致氣流中斷或減少,引起血氧飽和度和高碳酸血癥,隨后發生微覺醒的睡眠呼吸障礙性疾病。患者一般表現為疲勞和白天嗜睡,注意力和記憶力減退及睡眠打鼾史[4]。OSAS 是一個全球性的健康問題,在發達國家和亞洲發展中國家均存在[5]。OSAS 極易發生并發癥,是多種疾病發生、發展的獨立危險因素,如心臟疾病、糖尿病、性功能障礙、認知功能障礙及慢性阻塞性肺疾病等[6-8]。OSAS 診斷的金標準是 PSG。但 PSG 檢查存在一定的局限性,首先由于檢查過程繁瑣,需要消耗大量的人力、物力及時間,因此基層醫院不具備完成該檢查的設備及技術;其次,對于醫從性較差的患者,如兒童、阿爾茨海默病患者、精神障礙患者等,PSG 無法實施。因此,從 OSAS 的病理生理過程及多系統損傷的層面出發,尋找變化顯著并簡便易行的生物學標志物來診斷疾病及判斷療效將成為研究重點之一。
OSAS 反復發作的呼吸暫停和低通氣可激活一系列炎癥相關機制如慢性間歇缺氧條件下 NF-κB 的活化[9]。NF-κB 是炎癥反應的關鍵調節因子,是 Rel家族蛋白的成員之一。有觀點認為,間歇低氧/再氧合導致活性氧(ROS)和炎癥因子的高表達[10],進而引起 OSAS 炎癥聯級反應[11]。ROS 水平增高通過影響炎癥核心因子NF-κB 信號通路,提高單核細胞趨化蛋白-1(MCP-1)分泌水平[12]。MCP-1 具有單核細胞趨化活性,能激活單核細胞和巨噬細胞,使其胞漿 Ca2+濃度升高,產生和釋放超氧陰離子,引起炎癥因子 TNF-α、IL-6 水平增高。TNF-α、IL-6 又是合成血清 CRP 的重要調節因子。同一個體的 CRP 水平在 24h 內相當穩定,可以用來反映炎癥反應的嚴重程度[13]。NF-κB 和 NF-κB 介導的炎癥通路激活后,其下游產物 TNF-α、IL-6 等細胞因子又可作為重要的生物因子刺激活化 NF-κB,使整個炎癥反應過程呈現聯級放大效應。
目前,國內外評估 OSAS 患者的炎癥反應基因的研究進展迅速,范斯坦醫學研究所報道,NF-κB 的 P50 亞組基因被敲除后導致間歇低氧及高脂喂養的大鼠不能產生動脈粥樣硬化,由此可以證明 NF-κB 在間歇低氧及高脂飲食導致動脈粥樣硬化中是一個重要的通路[14]。Zhang 等[15]發現 IL-6 基因啟動子區位點的基因多態性可影響其基因表達;Larkin 等[16]認為 IL-6 在非裔美國人群有6種基因分型,同時發現無論是否調整體重指數,該基因編碼區的同義突變均可顯著降低 OSAS 的發病風險。據此,該學者認為無論肥胖與否,IL-6 基因多態性均可影響 OSAS 的發病風險。Kaditis 等[17]發現相同人群中,IL-6 基因和 CRP 基因改變可增加 OSAS 的發生風險。Riha 等[18]發現 TNF-α 基因多態性的存在可導致循環血液中與 OSAS 發生相關的 TNF-α 水平升高,Bhushan 等[19]研究發現 印度 OSAS 患者 TNF-α A 等位基因的頻率較高,并且 TNF-α 與 OSAS 的嚴重程度直接相關。國內亦有報道顯示,NF-κB、TNF-α、IL-8 及IL-6 在間歇低氧中的表達得到上調[20]。本研究檢測數據來自外周血,以 NF-κB 的炎癥通路為研究方向,得到的結果與上述遺傳學基因研究等一致,并有實際臨床意義。非肥胖 OSAS 組外周血 IL-6、TNF-α、CRP 較非OSAS 組明顯升高,并且中、重度 OSAS 患者上述指標與AHI呈正相關,說明在排除了肥胖因素后,NF-κB 下游炎癥因子的表達在 OSAS 人群明顯升高,并且與疾病的嚴重程度相關。如能以此為依據對于部分不能進行 PSG的患者,通過外周血的測定判斷 OSAS,并及早干預,可以在患者健康及經濟影響方面有獲益。
[1] Young T,Peppard P E,Gottlieb D J.Epidemiology of obstructive sleep apnea:apopulation health perspective[J].Am J RespirCrit Care Med,2002,165(9):1217-1239.doi:10.1164/rccm.2109080
[2] Clement K,Langin D.Regulation of inflammation-related genes in human adipose tissue[J].J Intern Med,2007,262(4):422-430. doi:10.1111/j.1365-2796.2007.01851.X
[3] Taylor C T,Kent B D,Crinion S J,et al.Human adipocytes are highly sensitive to intermittent hypoxia induced NF-KappaB activity and subsequent inflammatory gene expression[J].BiochemBiophys Res Commun,2014,447(4):660-665.doi:10.1016/j. bbrc.2014.04.062
[4] Azagra-Calero E,Espinar-Escalona E,Barrera-Mora J M,et al. Obstructive sleep apnea syndrome(OSAS).Review of the literature[J].Med Oral Patol Oral Cir Bucal,2012,17(6):e925-e929. doi:10.4317/medoral.17706
[5] Jordan A S,McSharry D G,Malhotra A.Adult obstructive sleep apnoea[J].Lance,2014,383(9918):736-747.
[6] McNicholas W T.Chronic obstructive pulmonary disease and obstructive sleep apnea:overlaps in pathophysiology,systemic inflammation,and cardiovascular disease[J].American Journal of Respiratory and CriticalCare Medicine,2009,180(8):692-700.
[7] Parati G,Lombardi C,Narkiewicz K.Sleep apnea:epidemiology, pathophysiology,and relation to cardiovascular risk[J].Am J PhysiolRegulIntegr Comp Physiol,2007,293(4):R1671-R1683.
[8] Lal C,Strange C,Bachman D.Neurocognitive impairment in obstructive sleep apnea[J].Chest,2012,141(6):1601-1610.
[9] Arnardottir E S,Mackiewicz M,Gislason T,et al.Molecular signatures of obstructive sleep apnea in adults:a review and perspective[J].Sleep,2009,32(4):447-470.
[10] Lavie L.Obstructive sleep apnoea syndrome-an oxidative stress disorder[J].Sleep Med Rev,2003,7(1):35-51.
[11] Ye J,Gao Z,Yin J,et al.Hypoxia is a potential risk factor for chronic inflammation and adiponectin reduction in adipose tissue of ob/ob and dietary obese mice[J].Am J Physiol EndocrinolMetab,2007,293(4):e1118-e1128.
[12] Friedman J K,Nitta C H,Henderson K M,et al.Intermittent hypoxia-induced increases in reactive oxygen species activate NFATc3 increasing endothelin-1 vasoconstrictor reactivity[J]. VasculPharmacol,2013,60(1):17-24.
[13] Baessler A,Nadeem R,Harvey M,et al.Treatment for sleep apnea by continuous positive airway pressure improve lelves of inflammatory markers-a meta-analysis[J].J Inflamm(Lond), 2013,10:13.doi:10.1186/1476-9255-10-13
[14] Song D,Fang G,Mao S Z,et al.Chronic intermitenthypoxia induces atherosclerosis by NF- κB-dependent mechanisms[J]. Biochim Biophys Acta,2012,1:1650-1659.
[15] Zhang X,Liu R Y,Lei Z,et al.Genetic variants in interleukin-6 modified risk of obstructive sleep apnea syndrome[J].Int J Mol Med,2009,23(4):485-493.doi:10.3892/ijmm_00000155.
[16] Larkin E K,Patel S R,Zhu X,et al.Study of the relationship between the interleukin-6 gene and obstructive sleep apnea [J].ClinTransl Sci,2010,3(6):337-339.doi:10.1111/j.1752-8062.2010.00236.x
[17] Kaditis A G,Gozal D,Khalyfa A,et al.Variants in C-reactive protein and IL-6 genes and susceptibility to obstructive sleep apnea in children:a candidate-gene association study in European American and SoutheastEuropean populations[J]. SleepMed,2014,15(2):228-235.doi:10.1016/j.sleep.2013.08. 795
[18] Riha R L,Brander P,Vennelle M,et al.Tumour necrosis factoralpha(-308)gene polymorphism in obstructive sleep apnoeahypopnoea syndrome[J].EurRespir J,2005,26(4):673-678.doi:10.1183/09031936.05.00130804
[19] Bhushan B,Guleria R,Misra A,et al.TNF-alpha gene polymorphism and TNF-alpha levels in obese Asian Indians with obstructive sleep apnea[J].Respir Med,2009,103(3):386-392. doi:10.1016/j.rmed.2008.10.001
[20] Li S,Qian X H,Zhou W,et al.Time-dependent inflammatory factorproduction and NF- κB activation in a rodent model of intermittent hypoxia[J].Swiss Med Wkly,2011,141:w13309.
Expression of NF- κB downstream inflammatory factors in non-obese patients with obstruction sleep apnea syndrome
TANG Tingyu,LI Zhijun,YU Liling,et al.
Department of Respiratory Medicine,Zhejiang Hospital,Hangzhou 310013,China
2016-09-12)
(本文編輯:馬雯娜)
10.12056/j.issn.1006-2785.2017.39.7.2016-1407
310013 杭州,浙江醫院呼吸內科
黃勍棟,E-mail:zjyyhqd@163.com

