典型胞外呼吸細菌的胞內(nèi)電子轉(zhuǎn)移機制研究進展
趙昕宇, 何小松,檀文炳,高如泰,席北斗1,, 李 丹, 張 慧
1 北京師范大學水科學研究院,北京 100875 2 中國環(huán)境科學研究院環(huán)境基準與風險評估國家重點實驗室,北京 100012 3 中國環(huán)境科學研究院地下水與環(huán)境系統(tǒng)創(chuàng)新基地,北京 100012 4 廣東省浩藍環(huán)保水污染治理院士工作站,廣州 510631
?
典型胞外呼吸細菌的胞內(nèi)電子轉(zhuǎn)移機制研究進展
趙昕宇1, 2,3, 何小松2, 3, 4,*,檀文炳2,3,高如泰2,3,席北斗1,2,3, 李 丹2,3, 張 慧2, 3
1 北京師范大學水科學研究院,北京 100875 2 中國環(huán)境科學研究院環(huán)境基準與風險評估國家重點實驗室,北京 100012 3 中國環(huán)境科學研究院地下水與環(huán)境系統(tǒng)創(chuàng)新基地,北京 100012 4 廣東省浩藍環(huán)保水污染治理院士工作站,廣州 510631
胞外呼吸在污染物的降解轉(zhuǎn)化和微生物產(chǎn)電過程中具有重要作用。微生物進行胞外呼吸時,其電子受體多以固態(tài)形式存在于胞外,氧化產(chǎn)生的電子必須通過電子傳遞鏈從胞內(nèi)經(jīng)細胞周質(zhì)轉(zhuǎn)移到外膜。S.oneidensisMR- 1與G.Sulfurreducens作為微生物燃料電池中最常用的模式菌株,是現(xiàn)階段研究最深入和系統(tǒng)的胞外呼吸細菌,其胞內(nèi)電子傳遞過程目前研究最為清楚。這兩種胞外呼吸細菌的電子傳遞需多種細胞色素c的參與,S.oneidensisMR- 1位于內(nèi)膜及周質(zhì)上的細胞色素c-CymA和MtrA可將電子由內(nèi)膜上的醌池通過周質(zhì)到外膜蛋白MtrC和OmcA,MtrC和OmcA接收電子后可直接還原胞外受體,Type Ⅱ secretion system對外膜蛋白中的MtrC和OmcA起到了轉(zhuǎn)運及定位的作用。而在G.sulfurreducens中,電子由MacA傳遞到PpcA,最終由外膜蛋白OmcB、 OmcE、 OmcS及OmcZ接受電子,并在Type Ⅳ pili的共同作用下將電子傳遞到胞外電子受體。本文最后指出目前對Shewanella與Geobacter胞內(nèi)電子轉(zhuǎn)移研究尚不清楚的地方提出展望。
胞外呼吸;胞內(nèi)電子轉(zhuǎn)移;Shewanella;Geobacter
電子轉(zhuǎn)移是新陳代謝的基礎,在細胞水平的研究領域中,現(xiàn)如今所了解的電子轉(zhuǎn)移機制有光合作用和呼吸作用。在這兩種電子傳遞鏈中,水溶性電子受體如氧氣、硝酸鹽、延胡索酸等,可以通過細胞質(zhì)膜,穿過外膜蛋白或肽聚糖層,接受電子從而完成電子傳遞過程[1]。胞外呼吸是近年來新發(fā)現(xiàn)的微生物能量代謝方式,它是指在厭氧條件下,微生物在胞內(nèi)徹底氧化有機物釋放電子,產(chǎn)生的電子經(jīng)胞內(nèi)呼吸鏈傳遞到胞外電子受體使其還原并產(chǎn)生能量維持微生物自身的生長過程[2]。這與傳統(tǒng)胞內(nèi)厭氧呼吸不同,胞外電子受體為固體或大分子有機物,無法進入胞內(nèi),因此,電子要在多種細胞色素c及功能蛋白作用下,從內(nèi)膜通過周質(zhì)空間穿過外膜,傳至胞外受體使其還原,并產(chǎn)生能量維持自身的生長[2- 3]。
胞外呼吸菌在環(huán)境中廣泛存在,人們已經(jīng)在土壤、泥炭、污泥、湖泊沉積物、河流沉積物、海洋沉積物以及水體等環(huán)境介質(zhì)中分離富集出了許多具有胞外呼吸功能的微生物,而且在地球化學循環(huán)(碳、氮、硫)、污染物降解以及微生物燃燒料電池方面發(fā)揮重要作用[4]。根據(jù)胞外電子受體的不同,微生物胞外呼吸菌主要分為腐殖質(zhì)還原菌、異化金屬還原菌和產(chǎn)電微生物[5- 7]。除了常規(guī)微生物,許多極端環(huán)境微生物也具有胞外電子傳遞能力,例如嗜熱菌、嗜酸菌、嗜堿菌等[8]。根據(jù)對氧氣的需求,胞外呼吸菌可分為兼性厭氧菌和嚴格厭氧菌。其中大部分集中在以下3個門:Proteobacteria(變形桿菌門)、Acidobacteria(放線菌門)與Firmicutes(厚壁菌門)[4]。已發(fā)現(xiàn)的胞外呼吸菌種大多數(shù)為革蘭氏陰性菌,只有少數(shù)為陽性菌。目前報道的胞外呼吸菌的數(shù)量僅占自然界的極小部分,很多菌的功能機制還不完全清楚。隨著研究的不斷深入以及微生物分離方法和分子生物學技術的不斷完善,胞外呼吸菌的資源將會繼續(xù)不斷被發(fā)現(xiàn)和豐富。
ShewanellaoneidensisMR- 1與Geobactersulfurreducens作為微生物燃料電池中最常用的模式菌株,是迄今為止研究最深入和系統(tǒng)的胞外呼吸細菌[11]。到目前為止,兩種微生物基因組的研究發(fā)現(xiàn)在S.oneidensisMR- 1和G.sulfurreducensPCA中分別有42個和111個與細胞膜相關的細胞色素c基因[9-10],但已經(jīng)確定功能的細胞色素c僅有幾種,且大量的基因功能還不完全清楚。盡管這兩種功能菌參與電子傳遞的細胞色素c各不相同,但都可催化化學反應及其相應的電化學性能,使得電子由內(nèi)膜向胞外的最終電子受體傳遞,再通過不同的接觸機制對胞外電子受體進行還原。本文詳細闡述了S.oneidensisMR- 1與G.sulfurreducens的胞內(nèi)電子轉(zhuǎn)移機制和參與胞內(nèi)電子轉(zhuǎn)移細胞色素c的特點及功能,以期對胞內(nèi)電子轉(zhuǎn)移機制有更全面、深入的理解和認識。
1 電子轉(zhuǎn)移過程中的細胞色素c
細胞色素c普遍存在于幾乎所有的生物體中,它也是參與胞外電子傳遞過程的重要蛋白,存在于胞外呼吸菌的內(nèi)膜、周質(zhì)及外膜蛋白中,能夠介導電子從內(nèi)膜向外膜的傳遞[11]。不同細胞色素c的氨基酸序列各不相同,但它們都至少含有一種或幾種亞鐵血紅素。兩個鄰近的血紅素通過半胱氨酸(Cys)的硫醚鍵與蛋白部分相結(jié)合,從而促進其與氧氣結(jié)合的能力,其催化作用、電子轉(zhuǎn)移及積累能力取決于與其結(jié)合的功能蛋白[12-13]。多個亞鐵血紅素基團可還可形成一個連續(xù)的“電子導線”,并與蛋白復合形成多亞鐵血紅素的細胞色素c,而細胞色素c中至少有一個血紅素基團與另一個細胞色素c的血紅素基團接近,從而完成多個細胞色素c間的長距離的電子傳遞[13]。
2 S.oneidensis MR- 1參與電子傳遞的細胞色素c
S.oneidensisMR- 1通過質(zhì)子泵產(chǎn)生電子,電子經(jīng)脫氫酶(如甲酸脫氫酶或氫化酶)將醌還原為對苯二酚,對苯二酚在胞內(nèi)再次被氧化,產(chǎn)生的電子進入周質(zhì)內(nèi)可以對可溶性電子受體直接還原(如延胡索酸、硝酸鹽、三甲胺氧化氮、二甲亞砜、亞硫酸鹽及硫代硫酸鹽)[14]。而不能進入胞內(nèi)的大分子電子受體(如Fe(Ⅲ)、Mn(Ⅴ)、Cr(Ⅵ)及腐殖酸等),需要特殊的電子傳遞途徑將電子傳遞到胞外。
胞內(nèi)電子傳遞過程中的首先是脫氫酶從電子供體脫下電子,傳遞給醌類中間體。Saffarini等[15]用轉(zhuǎn)座子TN5插入突變得到甲基萘醌合成缺陷型的菌株,證明了甲基萘醌是胞內(nèi)電子傳遞中的一個必要構(gòu)件。電子從醌類中間體傳遞給鑲嵌到內(nèi)膜蛋白的CymA,再由CymA傳遞至周質(zhì)細胞色素并向外膜蛋白傳遞(圖1),目前發(fā)現(xiàn)鑲嵌在周質(zhì)和外膜上的MtrA是這一過程的主要電子受體,MtrA缺失將導致細胞與胞外電子受體之間的電子傳遞下降90%以上[16- 18]。而后電子從MtrA向胞外傳遞,即外膜電子傳遞。盡管目前關于外膜電子傳遞的機制還不甚清楚,但有一個共同的認識是,無論是將電子直接傳遞至不同的電子受體或是傳遞至可溶性的電子穿梭體,外膜蛋白細胞色素c(OMc-Cyt)在這一過程中扮演著至關重要的角色[19]。MtrB接受MtrA的電子,并傳遞給外膜蛋白OmcA和MtrC,后兩者通常被認為是Shewanella胞外電子傳遞的末端還原酶。
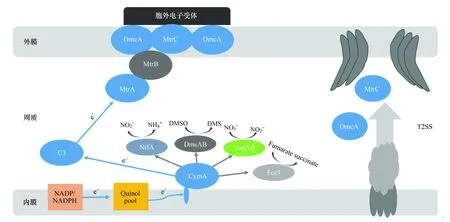
圖1 S.oneidensis MR- 1胞內(nèi)電子轉(zhuǎn)移機制Fig.1 Intracellular electron transfer mechanism by S.oneidensis MR- 1
2.1 CymA
CymA(SO_4591)參與Shewanella的厭氧呼吸過程,含4個血紅素,與NapC/NirT結(jié)構(gòu)類似,其N端鑲嵌于內(nèi)膜蛋白,C端連接4個血紅素延伸至周質(zhì)蛋白中(圖1)。CymA是Shewanella中起重要呼吸功能的細胞色素,當缺失編碼CymA的基因時,其最終電子受體的還原能力下降了80%—100%[20]。另有研究表明,厭氧條件下,CymA作為內(nèi)膜蛋白中醌泵與終端還原酶的電子傳遞鏈的中間體,可以對周質(zhì)蛋白中延胡索酸鹽、硝酸鹽、亞硝酸鹽、DMSO及外膜蛋白的Fe(Ⅲ)和Mn(Ⅴ)進行還原,但僅通過細胞色素c3才可將電子傳遞到MtrA(圖1)[21-22]。而除去與內(nèi)膜蛋白相聯(lián)N端的CymA仍保留其還原延胡索酸的能力,卻喪失對周質(zhì)中間體細胞色素c3的還原[21, 23]。為進一步證明這個結(jié)果,以電極作為S.oneidensisMR- 1的電子供體對延胡索酸進行還原,結(jié)果表明85%的電子通過CymA傳遞到延胡索酸,僅有15%通過周質(zhì)穿梭體傳遞到MtrA,這不僅說明FR的氧化還原電勢要高于細胞色素c3,而且CymA-FR-MtrA在周質(zhì)中形成了傳遞電子的復合體[23-24]。
2.2 MtrA
編碼MtrA的基因為SO_1777,與編碼MtrB (SO_1776)、MtrC(SO_1778)和OmcA(SO_1779)的基因位于同一基因群。MtrA位于周質(zhì)蛋白中,含有10個血紅素,在胞外電子受體的電子傳遞過程中起主要作用[18]。將缺失mtrA的突變菌株與野生菌株相比,突變菌株對檸檬酸鐵及金屬氧化物(Fe和Mn)的還原能力大大減弱,而對延胡索酸鹽、硝酸鹽、亞硝酸鹽、DMSO、TMAO及硫代硫酸鹽的還原沒有影響,說明MtrA是胞外電子傳遞過程中必要的特異蛋白[16]。但MtrA位于周質(zhì)內(nèi),并不能與胞外電子受體直接接觸,因此,電子要通過周質(zhì)蛋白應傳遞到MtrB。MtrB是一種不含血紅素的跨外膜蛋白,作為保護鞘參與了MtrA和MtrC之間的電子傳遞,并促進OmcA和OmcB在MR- 1內(nèi)的轉(zhuǎn)移和定位,是金屬氧化物還原過程中不可缺少的重要蛋白[17]。但MtrB如何將電子轉(zhuǎn)移到外膜的過程尚不清楚。
2.3 MtrC和OmcA
MtrC和OmcA是位于外膜蛋白的脂蛋白,各含10個血紅素[25-26],可將電子直接轉(zhuǎn)移到胞外電子受體。與MtrA相同,缺失編碼omcA或mtrC基因的突變體對可溶性電子受體的還原并無影響,但對胞外金屬氧化物(Fe和Mn)還原能力顯著下降,與野生菌株相比分別降低了45%和75%[27]。MtrC和OmcA都具有向胞外傳遞電子轉(zhuǎn)移的能力,但在Shewanella的電子傳遞過程中MtrC要起到更主要的作用[28-29]。這一結(jié)果被Jimmy等[30]再次證明:在檸檬酸鐵中培養(yǎng)缺失mtrC的突變菌株,發(fā)現(xiàn)其還原能力要明顯低于缺失omcA的突變菌株,證實MtrC是檸檬酸鐵的主要還原酶。這主要是由于:(1) MtrC穩(wěn)定態(tài)的濃度要高于OmcA;(2)插入失活的OmcA會導致MtrC含量的增加,反之不成立;(3)OmcA與MtrC在動力學方面的行為模式不同;(4)MtrC是OmcA發(fā)揮功能的必要條件。此研究也首次證明,OmcA與MtrC是MR- 1中唯一能夠?qū)㈦娮愚D(zhuǎn)移到Fe(Ⅲ)的細胞色素[30]。
缺失mtrC的突變體其外膜上細胞色素c的含量不足野生菌株的15%,說明mtrC對外膜其它細胞色素c的合成起到一定作用。對于缺失OmcA的突變菌株,MtrC仍可在胞質(zhì)內(nèi)合成OmcA,但不能使其轉(zhuǎn)移到外膜[31]。為了進一步說明OmcA和MtrC在電子傳遞過程中的作用及關系,Liang 等[11]將兩個多血紅素細胞色素c從野生菌株中分離純化后合成復合蛋白,由于復合體中MtrC∶OmcA為1∶2,也就是說外膜蛋白中至少含有30個血紅素,OmcA和MtrC復合體檸檬酸鐵的還原能力要遠遠高于其中任意單個蛋白,OmcA和MtrC在MR- 1的外膜蛋白中緊密結(jié)合成了一個穩(wěn)定的蛋白復合物并在電子傳遞途徑中發(fā)揮了重要作用。
OmcA和MtrC對不同電子受體的還原具有特異性,Shi等[11]將胞外電子受體V(Ⅴ)、U(Ⅵ)及Se(Ⅵ)作為Fe(Ⅲ)還原的競爭性底物,僅有V(Ⅴ)與Fe(Ⅲ)為共同的胞外電子受體時,Fe(Ⅲ)的還原效率會明顯降低,而U(Ⅵ)和Se(Ⅵ)對Fe(Ⅲ)的還原并無顯著影響,因此在OmcA和MtrC對U(Ⅵ)及Se(Ⅵ)的還原并不起主要作用。
2.4 T2SS
T2SS (Type Ⅱ secretion system) 是Shewanella的蛋白分泌系統(tǒng),在胞外電子傳遞中也起到十分重要的作用(圖1)。T2SS由多種蛋白組成,如GspD、GspE與GspG[32]。研究表明,插入失活的gspE的突變體對Fe(Ⅲ)或Mn(Ⅴ)的還原能力減弱,這也是首次證明了T2SS參與了金屬氧化物(Fe和Mn)的還原[33]。隨后Shi[34]首次證明了T2SS在MtrC與OmcA的轉(zhuǎn)移中起到了直接作用,缺失編碼T2SS的基因喪失了培養(yǎng)基中S.oneidensis釋放MtrC和OmcA的能力;并且缺失T2SS的S.oneidensisMR- 1突變體與缺失mtrC/omcA突變體有相似的表型,導致其突變體在生物電池中的產(chǎn)電能力下降[35]。MtrC和OmcA向外膜轉(zhuǎn)移的順序為[34]:(1)在胞質(zhì)內(nèi)合成;(2)通過Sec途徑跨過內(nèi)膜;(3)在周質(zhì)內(nèi)成熟;(4)通過T2SS轉(zhuǎn)移到外膜。
2.5 電子轉(zhuǎn)移模塊
對于S.oneidensisMR- 1,單個基因或多個基因(cymA或mtrABC)的敲除并不完全使電流消失,說明在電子傳遞過程中還存在其它可以代替上述蛋白的結(jié)構(gòu)。基因組分析表明編碼MtrABC的一系列同族蛋白在相同的操縱子上可編碼。其中MtrA的同族蛋白包括MtrD、DmsE與SO4360;MtrC的同族蛋白為OmcA和MtrF;MtrB有3個同族蛋白分為MtrE、dmsF與SO4359。這些同族蛋白組成的電子轉(zhuǎn)移模塊也可將電子從醌池轉(zhuǎn)移到胞外的電子受體,但其發(fā)揮的作用各不相同[36]。目前已經(jīng)對其中外膜電子傳遞通道中的一種十血紅素輔基細胞色素(MtrF)進行了X射線晶體結(jié)構(gòu)解析。根據(jù)這個結(jié)構(gòu)模型,可以研究不同類型的胞內(nèi)電子傳遞或解析可能的胞內(nèi)電子傳遞發(fā)生機制。MtrF晶體結(jié)構(gòu)的解析第一次確定了10個血紅素的空間排布構(gòu)型,其中血紅素以一種獨特的交叉構(gòu)型貫穿在4個結(jié)構(gòu)域(Domains I、Ⅱ、Ⅲ、Ⅳ)中[37]。這個結(jié)構(gòu)可以為人們提供分子水平研究的可能性,用于分析胞外呼吸菌如何還原不溶性底物(如礦物)、可溶性底物(如黃素)以及與細胞表面不同氧化還原細胞色素終端之間形成的電子傳遞鏈[37]。
通過其不同基因缺失的突變體對檸檬酸鐵的還原可知,在MtrA和OmcA存在的條件下,MtrD促進了電子的傳遞,而SO4360在電子傳遞過程中的貢獻較少,也就是說在功能上,MtrA的同族蛋白可取代MtrA,其還原檸檬酸鐵的順序為MtrD > DmsE >> SO4360。缺失mtrF的突變菌株對檸檬酸鐵的還原量與野生菌株相差不大,但對黃素及可溶性電子受體的還原能力要強于OmcA和MtrC,而MtrE在功上可替代MtrB。MtrDEF在Shewanella中形成了與MtrCBA重疊或交叉的呼吸網(wǎng)絡,對Shewanella的極端厭氧呼吸過程而言也起到至關重要的作用[36]。
Shewanella中最主要的電子傳遞模塊是MtrCAB,由基因omcA-mtrCAB編碼,位于外膜的細胞色素c(MtrC與OmcA)可將電子直接傳遞到胞外受體,但由于外膜的寬度為40 ?,MtrA和MtrC位于外膜的兩側(cè),電子無法從內(nèi)膜直接傳遞到外膜,需要通過中間體傳遞電子MtrB來完成內(nèi)膜與外膜間的電子傳遞[38]。Richard等[39]還提出了一種外膜蛋白組成的電子傳遞通道復合體的分子結(jié)構(gòu),由MtrC、OmcA、MtrA及MtrB構(gòu)成,其中MtrA是基于兩個五血紅素輔基NrfB單體末端相連組成的[40],MtrC和MtrA嵌入孔蛋白的深度是未知的。目前實驗方法還無法研究蛋白內(nèi)沿著血紅素組成的通道進行的電子傳遞過程,而高性能計算則可以從分子水平解析血紅素分子之間電子傳遞的熱力學和動力學性質(zhì)[41]。采用這些蛋白組成獨特的分子機器進行長距離的電子傳輸,轉(zhuǎn)移電子的距離可以超過100 ?,這對于生物納米技術設備的設計具有顯而易見的科學意義。
3 G. sulfurreducens中參與電子轉(zhuǎn)移的細胞色素c
Geobacter的電子傳遞機制與Shewanella存在較大差異,Shewanella可產(chǎn)生電子穿梭體將電子間接傳遞到胞外受體,而Geobacter則需要與胞外受體直接接觸才可使其還原[42-44]。二者胞內(nèi)細胞色素c種類與功能也各不相同,G.sulfurreducens的細胞色素c中含有100多個基因,并產(chǎn)生大量的細胞色素c,遠多于S.oneidensisMR- 1[10]。其中參與胞外電子傳遞細胞色素c包括MacA(位于內(nèi)膜表面與胞質(zhì)相連[45])、PpcA(存在胞質(zhì)中[46]),以及位于外膜蛋白的OMCs(包括OmcB、OmcE、OmcS及OmcZ)(圖2)[47]。圖2比較了ShewanellaMR- 1 和G.sulfurreducens胞外電子傳遞鏈的組成。
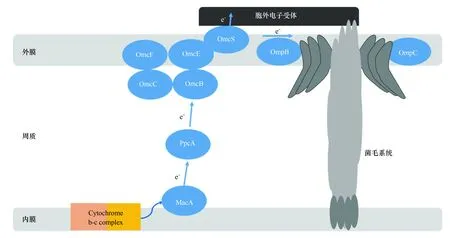
圖2 G. sulfurreducens胞內(nèi)電子轉(zhuǎn)移機制Fig.2 Intracellular electron transfer mechanism by G. sulfurreducens
3.1 MacA和PpcA
MacA和PpcA是位于周質(zhì)內(nèi)的兩個細胞色素c,它們將細胞色素的內(nèi)膜與外膜相聯(lián),可使電子從周質(zhì)傳遞到胞外的電子受體。MacA的分子量為35kDa[45]。X-射線衍射對MacA三維結(jié)構(gòu)分析結(jié)果顯示,它主要包含兩個球狀結(jié)構(gòu),其中各含一個亞鐵血紅素基團[42]。由于MacA表面帶正電荷,可與細胞質(zhì)膜中帶負電荷的表面緊密相聯(lián),并通過PpcA將電子傳遞到外膜蛋白。基因macA在Fe(Ⅲ)作為最終電子受體時的表達能力要明顯高于延胡索酸[45]。與野生菌株相比,缺失macA對氧化應激反應并無影響,而其還原Fe(Ⅲ)的能力明顯降低,說明MacA是調(diào)節(jié)電子向Fe(Ⅲ)傳遞的主要蛋白。然而,隨后的研究中表明,缺失macA的突變體并不能使電流完全消使,但omcB的反轉(zhuǎn)錄及蛋白質(zhì)水平明顯降低[48],并且omcB的反式表達使缺失macA的突變體對Fe(Ⅲ)的還原速率與omcB的表達成正相關。也就是說,MacA并不直接參與電子傳遞的過程,而是通過對omcB的表達調(diào)控間接影響胞外受體的還原能力[48]。而在近年來的研究中表明,MacA除可間接參與電子傳遞過程外,它與細菌細胞色素c的過氧化物酶也具有高度的相似性,說明MacA還是Geobacter在氧過量而發(fā)生中毒時可自身解毒的必要蛋白[49]。
PpcA位于周質(zhì)內(nèi),分子量為9.6kDa,包含3個血紅素和1個疏水信號肽,等電點為9.5,其N端的氨基酸序列與硫還原單胞菌中含3個血紅素的細胞色素c7緊密相聯(lián)[46]。缺失ppcA的突變體對延胡索酸還原影響并不顯著,而對Fe(Ⅲ)、AQDS及U(Ⅵ)的還原速率明顯降低,因此PpcA作為周質(zhì)中的電子載體,可將電子傳遞到外膜蛋白的最終還原電子受體如Fe(Ⅲ)還原酶、腐殖質(zhì)、AQDS及金屬氧化物(Fe和Mn)。PpcA的4個同源蛋白也位于周質(zhì)內(nèi),分別為PpcB、PpcC、PpcD及PpcE,與PpcA氨基酸序列的相似度分別為77%、62%、57%和65%[46]。在缺失ppcA時,PpcB-E的含量增多,可部分補償PpcA的缺失。而缺失ppcB-E,PpcA含量也會增多,而且其還原可溶性Fe(Ⅲ)的量要高于野生菌株,說明PpcA是周質(zhì)中最有效的電子載體[46]。
3.2 OmcB
OmcB是第一個被發(fā)現(xiàn)對可溶性Fe(Ⅲ)和Fe(Ⅲ)氧化物都有還原能力的細胞色素c[50]。為進一步證明這一觀點,微陣列分析表明omcB的反轉(zhuǎn)錄水平與它在Fe(Ⅲ)氧化物及檸檬酸鐵的生長程度類似,說明兩種受體分別被還原時,OmcB蛋白的含量相當[51]。這種高分子量的細胞色素c具有12個可與亞鐵血紅素結(jié)合的位點,其N端含有10個氨基酸脂蛋白信號肽,位于外膜蛋白,部分暴露于胞外空間。OmcC是OmcB唯一的同源蛋白,二者相似度為73%,但它并不參與Fe(Ⅲ)和Mn(Ⅴ)的還原[50]。缺失omcB的突變體對可溶性Fe(Ⅲ)和Fe(Ⅲ)氧化物的還原能力都大大降低,說明電子傳遞從周質(zhì)到OmcB的傳遞過程是Fe(Ⅲ)還原的重要途徑,但對Mn(Ⅴ)的還原并無影響,也就是說,電子從胞內(nèi)轉(zhuǎn)移遞到Mn(Ⅴ)還可能存在多種其它途徑[50,52]。
3.3 OmcS和OmcE
OmcS和OmcE位于外膜蛋白,松馳的附著在細胞表面[47]。缺失omcS與omcE的突變體大大降低了Fe(Ⅲ)氧化物的還原能力,但對可溶性電子受體及檸檬酸鐵的還原并無影響,因此缺失這兩種蛋白并不影響電流的產(chǎn)生[28]。
OmcS是硫還原單胞菌中含量最豐富的細胞色素c,其分子量大小為50kDa,位于外膜蛋白,含有6個亞鐵血紅素。omcS(GSU2504)在Fe(Ⅲ)或Mn(Ⅴ)氧化物分別作為電子受體進行培養(yǎng)時,轉(zhuǎn)錄水平有很大提高,omcS的同族基因omcT(GSU2503)位于omcS的下游,二者具有相同的操縱子,氨基酸序列相似度為62.6%[53]。在Fe(Ⅲ)氧化物作為電子受體培養(yǎng)的菌株中,基因omcS與omcT轉(zhuǎn)錄水平均是以檸檬酸鐵作電子受體的28.3倍;而Mn(Ⅴ)氧化物作子受體時,其轉(zhuǎn)錄水平分別是檸檬酸鐵作電子受體13.8和52.2倍[52],OmcS還可促進電子從菌毛傳遞到Fe(Ⅲ)氧化物,說明OmcS是金屬氧化物(Fe和Mn)的最終還原酶[54]。盡管omcT具有很強的表達能力,但OmcT在Fe(Ⅲ)氧化物生長的細胞蛋白質(zhì)組中的含量并不豐富[28],并且缺失omcT對金屬氧化物(Fe和Mn)的還原并無顯著影響[55]。
OmcE(GSU0618)含有4個血紅素,分子量大小為30kDa。在Fe(Ⅲ)氧化物電子供體時,細胞中omcE的轉(zhuǎn)錄水平是檸檬酸鐵的3倍,但在Mn(Ⅴ)作為電子受體時,omcE的轉(zhuǎn)錄水平并沒有升高[52]。有研究表明,缺失omcE會短暫抑制Fe(Ⅲ)和Mn(Ⅴ)氧化物的還原,但隨著時間增加,兩種氧化物的還原能力又恢復到正常水平。因此,與OmcS相比,OmsE不是Fe(Ⅲ)和Mn(Ⅴ)氧化物還原必要的蛋白[55]。免疫定位研究表明,在Fe(Ⅲ)氧化物作電子受體時,細胞中OmcE的含量要明顯低于OmcS,而且OmcE與OmcS不同,OmcS位于沿著電子傳遞方向的菌毛附近,可將電子直接傳遞到胞外,這也進一步說明了在金屬氧化物的還原中,OmcE并不起主要作用[56]。
3.4 OmcF
OmcF(GSU2432)位于外膜蛋白,只含1種血紅素,分子量大小為10kDa,其結(jié)構(gòu)與光合藻類Monoraphidium中細胞色素c6高度類似,是一種參與在光合作用中電子傳遞的細胞色素c[57]。研究表明,omcF參與了omcB的表達,缺失omcF使omcB轉(zhuǎn)錄水平大大降低,Fe(Ⅲ)的還原能力也有所下降[58]。缺失omcF的突變株在以Fe(Ⅲ)氧化物作為電子受體時的生長狀態(tài)明顯降低,而以Mn(Ⅴ)作電子受體時并沒有影響[52]。產(chǎn)生這一結(jié)果的原因是由于omcF的缺失直接或間接影響omcB的表達能力,導致Fe(Ⅲ)的還原能力降低,由于omcB并不是Mn(Ⅴ)還原的主要途徑,因此缺失omcF對Mn(Ⅴ)的還原并無影響。
3.5 OmcZ
OmcZ(GSU2076)是一種與細胞外基質(zhì)相聯(lián)的細胞色素c,并不存在于所有Geobacter中,OmcZ有兩種存在形式:OmcZL(50kDa)和OmcZs(30kDz),而對其亞細胞定位研究表明,OmcZs是OmcZ胞外存在的主要形式,包含8個血紅素,其氧化還原電勢從-420到-60mV[59-60]。OmcZL在周質(zhì)和外膜內(nèi)完成轉(zhuǎn)移后的修飾加工,而大多數(shù)的OmcZs存在于細胞外基質(zhì)[59]。在以石墨電極為唯一的電子受體時,OmcZ是產(chǎn)電過程中最重要的細胞色素,缺少omcZ的突變體使電流減少90%以上,但它并不參與延胡索酸鹽、檸檬酸鐵或Fe(Ⅲ)氧化物的還原[61]。近年來研究發(fā)現(xiàn),OmcZ在Mn(Ⅴ)氧化物作為電子受體時的生長數(shù)量明顯增多[52],也就說明OmcZ可還原Mn(Ⅴ),但不能還原Fe(Ⅲ),這與Kengo等[59]的研究結(jié)果一致,由于Mn(Ⅴ)氧化物的中點電位在25℃,pH值為7時可達到500—600mV,遠高于OmcZ(-220mV),而OmcZ與Fe(Ⅲ)氧化物中間電位(-300mV)相差不大,因此OmcZ可快速將電子傳遞到Mn(Ⅴ)。但缺失OmcZ的突變株對Fe(Ⅲ)及Mn(Ⅴ)的還原并沒有影響[52],說明OmcZ也不是參與Mn(Ⅴ)還原的主要細胞色素c。
3.6 OmpB和OmpC
OmpB和OmpC不屬于細胞色素c,它們是由硫還原單胞菌中的4個基因編碼的多銅氧化酶蛋白,OmpC與生盤纖發(fā)菌中的MofA較為接近,它是參與Mn(IV)氧化的功能蛋白[62-63]。而OmpB與枯草桿菌中的漆酶較為類似[64-65],位于細胞外基質(zhì),OmpC與它相鄰[66]。因此這兩種蛋白具有將電子傳遞到胞外不溶性電子受體的潛力。在G.sulfurreducens中,這兩種基因?qū)e(Ⅲ)或Mn(Ⅴ)的還原起重要作用[66-67]。基因芯片分析表明,ompB對Fe(Ⅲ)及Mn(Ⅴ)的還原起主要作用,而ompC僅參與Fe(Ⅲ)的還原,其還原能力相對ompB較弱[52]。
3.7 T4P
相比Shewanella需要利用OmcA與MtrC來進行胞外的電子傳遞,Geobacter則利用菌毛將電子從外膜蛋白傳遞到胞外電子受體[68]。研究表明,G.sulfurreducens上的菌毛具有強導電性,并不需要與胞外不溶性電子受體直接接觸,它具有作為納米導線的潛在作用,可利用納米導線將電子從胞內(nèi)傳遞到胞外受體[69]。硫還原單胞菌中T4P(Type Ⅳ pili)是電子到達胞外受體有效的傳遞方式[69]。T4P直徑為60—90?,長度1μm,由上千種菌毛蛋白構(gòu)成[70]。T4P高度保守的N末端α-螺旋作為高度聚合域,菌毛的表面結(jié)構(gòu)由C末端可變的球狀域形成,并決定了菌毛的多種功能[70]。將喪失形成菌毛的突變體培養(yǎng)在以不可溶的Fe(Ⅲ)作電子接受體的培養(yǎng)基中,發(fā)現(xiàn)其不能還原Fe(Ⅲ)。還有研究表明,野生菌株對U(Ⅵ)的還原能力也明顯強于喪失產(chǎn)生菌毛的突變體。PliA還促進蛋白的轉(zhuǎn)移,因此缺失pilA,其突變體中外膜上相關的細胞色素c不能夠準確定位。
4 存在的問題與研究展望
盡管目前已經(jīng)清楚了S.oneidensisMR- 1與G.sulfurreducens胞內(nèi)電子傳遞過程及其位于內(nèi)膜、周質(zhì)和外膜上的部分細胞色素c在胞內(nèi)電子轉(zhuǎn)移中的功能與相互關系,但對胞外呼吸菌胞內(nèi)電子轉(zhuǎn)移過程的研究還有許多問題尚未解決。首先,MtrB是否促進了電子從外膜傳遞到細胞表面這一點仍然是不確定的,MtrB結(jié)構(gòu)及功能的研究是必要的,以揭示其是否直接參與了電子傳遞過程;其次,電子從外膜蛋白CymA到MtrA是如何傳遞的,在周質(zhì)參與其轉(zhuǎn)移的蛋白有哪些尚未完全確定。細胞色素c具有專一性,參與電子傳遞的細胞色素c可識別位于胞外不同的電子受體,但胞外呼吸菌是如何通過調(diào)節(jié)自身的分子結(jié)構(gòu)來改變其參與電子傳遞的蛋白組分或采用不同的電子轉(zhuǎn)移途徑來進行識別的,這一問題也仍是未知。G.sulfurreducens的外膜蛋白及納米導線是電子傳遞過程中重要的組成部分,可介導不同菌群間直接或間接的電子傳遞,研究表明Geobacter與產(chǎn)甲烷菌為共生關系并且兩種菌群之間可進行電子傳遞,但大多數(shù)的產(chǎn)甲烷菌并不含有細胞色素c[71],因此,對于不含細胞色素的菌群,Geobacter與Shewanella是利用何種機制相互識別并進行傳遞電子的,這一過程也需要進一步研究。在復雜條件下進行胞外電子傳遞時,同一種微生物胞內(nèi)電子傳遞過程中參與的蛋白及傳遞機制是否相同,哪些蛋白參與其主要作用以及由哪些菌群協(xié)同完成還有待于進一步研究。現(xiàn)階段研究的胞外呼吸菌僅占自然界極小部分,胞內(nèi)電子傳遞機制的研究也僅限于Geobacter與Shewanella。因此,要分離出更多的胞外呼吸菌,完善其參與電子傳遞鏈重要組分及細胞色素c的分子學機制,并研究其在多種復雜條件的胞外電子傳遞過程,才可有效解決污染物的難降解和微生物產(chǎn)電效率低等實際問題。
[1] Jeffrey A Gralnick, Dianne K Newman. Extracellular respiration. Molecular Microbiology, 2007, 65(1): 1- 11.
[2] Derek R Lovley. Extracellular electron transfer: wires, capacitors, iron lungs, and more. Geobiology, 2008, 6(3): 225- 231.
[3] 馬晨, 周順桂, 莊莉, 武春媛. 微生物胞外呼吸電子傳遞機制研究進展. 生態(tài)學報, 2011, 31(7): 2008- 2018.
[4] Claudia M Martinez, Luis H Alvarez, Lourdes B Celis, Francisco J Cervantes. Humus-reducing microorganisms and their valuable contribution in environmental processes. Applide Microbiology Biotechnology, 2013, 97(24): 10293- 10308.
[5] Xu W, Hu P, Li Y H, Li X M, Zhou S G. Mechanisms of microbial Fe (Ⅲ) respiration: A review. Chinese Journal of Ecology, 2008, 27(6): 1037- 1042.
[6] 武春援, 李芳柏, 周順桂. 腐殖質(zhì)呼吸作用及其生態(tài)學意義. 生態(tài)學報, 2009, 29(3): 1535- 1542.
[7] Derek R Lovley. Bug juice: harvesting electricity with microorganisms. Nature Reviews Microbiology, 2006, 4(7): 497- 508.
[8] Derek R Lovley, Kazem Kashefi, Madelline Vargas, Jason M Tor, Elizabeth L Blunt-Harris. Reduction of humic substances and Fe (III) by hyperthermophilic microorganisms. Chemical Geology, 2000, 169(3/4): 289- 298.
[9] John F Heidelberg, Ian T Paulsen, Karen E Nelson, Eric J Gaidos, William C Nelson, Timothy D Read, Jonathan A Eisen, Rekha Seshadri, Naomi Ward, Barbara Methe, Rebecca A Clayton, Terry Meyer, Alexandre Tsapin, James Scott, Maureen Beanan, Lauren Brinkac, Sean Daugherty, Robert T DeBoy, Robert J Dodson, A Scott Durkin, Daniel H Haft, James F Kolonay, Ramana Madupu, Jeremy D Peterson, Lowell A Umayam, Owen White, Alex M Wolf, Jessica Vamathevan, Janice Weidman, Marjorie Impraim, Kathy Lee, Kristy Berry, Chris Lee, Jacob Mueller, Hoda Khouri, John Gill, Terry R Utterback, Lisa A McDonald, Tamara V Feldblyum, Hamilton O Smith, J Craig Venter, Kenneth H Nealson, Claire M Fraser. Genome sequence of the dissimilatory metal ion-reducing bacteriumShewanellaoneidensis. Nature Biotechnology, 2002, 20(11): 1118- 1123.
[10] B A Methé, K E Nelson, J A Eisen, I T Paulsen, W Nelson, J F Heidelberg, D Wu, M Wu, N Ward, M J Beanan, R J Dodson, R Madupu, L M Brinkac, S C Daugherty, R T DeBoy, A S Durkin, M Gwinn, J F Kolonay, S A Sullivan, D H Haft, J Selengut, T M Davidsen, N Zafar, O White, B Tran, C Romero, H A Forberger, J Weidman, H Khouri, T V Feldblyum, T R Utterback, S E Van Aken, D R Lovley, C M Fraser. Genome ofGeobactersulfurreducens: metal reduction in subsurface environments. Science, 2003, 302(5652): 1967- 1969.
[11] Shi L, Thomas C Squier, John M Zachara, James K Fredrickson. Respiration of metal (hydr) oxides byShewanellaandGeobacter: a key role for multihaemc-type cytochromes. Molecular Microbiology, 2007, 65(1): 12- 20.
[12] Julie M Stevens, Oliver Daltrop, James W A Allen, Stuart J Ferguson.C-type cytochrome formation: chemical and biological enigmas. Accounts of Chemical Research, 2004, 37(12): 999- 1007.
[13] Maria Luisa Rodrigues, Tnia F Oliveira, Inês A C Pereira, Margarida Archer. X-ray structure of the membrane-bound cytochromecquinol dehydrogenase NrfH reveals novel haem coordination. The EMBO Journal, 2006, 25(24): 5951- 5960.
[14] Orianna Bretschger, Anna Obraztsova, Carter A Sturm, In Seop Chang, Yuri A Gorby, Samantha B Reed, David E Culley, Catherine L Reardon, Soumitra Barua, Margaret F Romine, Jizhong Zhou, Alexander S Beliaev, Rachida Bouhenni, Daad Saffarini, Florian Mansfeld, Byung-Hong Kim, James K Fredrickson, Kenneth H Nealson. Current production and metal oxide reduction byShewanellaoneidensisMR- 1 wild type and mutants. Applied and Environmental Microbiology, 2007, 73(21): 7003- 7012.
[15] Daad A Saffarini, Seth L Blumerman, Karen J Mansoorabadi. Role of menaquinones in Fe (III) reduction by membrane fractions ofShewanellaputrefaciens. Journal of Bacteriology, 2002, 184(3): 846- 848.
[16] Alex S Beliaev, Daad A Saffarini, Jennifer L McLaughlin, David Hunnicutt. MtrC, an outer membrane decahaemccytochrome required for metal reduction inShewanellaputrefaciensMR- 1. Molecular Microbiology, 2001, 39(3): 722- 730.
[17] Charles R Myers, Judith M Myers. MtrB is required for proper incorporation of the cytochromes OmcA and OmcB into the outer membrane ofShewanellaputrefaciensMR- 1. Applied and Environmental Microbiology, 2002, 68(11): 5585- 5594.
[18] Katy E Pitts, Paul S Dobbin, Francisca Reyes-Ramirez, Andrew J Thomson, David J Richardson, Harriet E Seward. Characterization of theShewanellaoneidensisMR- 1 Decaheme Cytochrome MtrA expression inEscherichiacoliconfers the ability to reduce soluble Fe(III) chelates. The Journal of Biological Chemistry, 2003, 278(30): 27758- 27765.
[19] Kelly P Nevin, Sarah A Hensley, Ashley E Franks, Zarath M Summers, Jianhong Ou, Trevor L Woodard, Oona L Snoeyenbos-West, Derek R Lovley. Electrosynthesis of organic compounds from carbon dioxide is catalyzed by a diversity of acetogenic microorganisms. Applied and Environmental Microbiology, 2011, 77(9): 2882- 2886.
[20] Myers C R, Myers J M. Cloning and sequence of cymA, a gene encoding a tetraheme cytochrome c required for reduction of iron (III), fumarate, and nitrate byShewanellaputrefaciensMR- 1. Journal of Bacteriology, 1997, 179(4): 1143- 1152.
[21] Carsten Schwalb, Stephen K Chapman, Graeme A Reid. The tetraheme cytochrome CymA is required for anaerobic respiration with dimethyl sulfoxide and nitrite inShewanellaoneidensis. Biochemistry, 2003, 42(31): 9491- 9497.
[22] Douglas P Lies, Maria E Hernandez, Andreas Kappler, Randall E Mielke, Jeffrey A Gralnick, Dianne K Newman.ShewanellaoneidensisMR- 1 uses overlapping pathways for iron reduction at a distance and by direct contact under conditions relevant for biofilms. Applied Environmental Microbiology, 2005, 71(8): 4414- 4426.
[23] Mackenzie A Firer-Sherwood, Kathryn D Bewley, Jee-Young Mock, Sean J Elliott. Tools for resolving complexity in the electron transfer networks of multiheme cytochromesc. Metallomics, 2011, 3(4): 344- 348.
[24] Jimmy Borloo, Lina Desmet, Jozef Van Beeumen, Bart Devreese. Bacterial two-hybrid analysis of the Shewanella oneidensis MR- 1 multi-component electron transfer pathway. Journal of Integrated OMICS, 2011, 1(2): 260- 267.
[25] Myers C R, Myers J M. Cell surface exposure of the outer membrane cytochromes ofShewanellaoneidensisMR- 1. Letters in Applied Microbiology, 2003, 37(3): 254- 258.
[26] Myers C R, Myers J M. The outer membrane cytochromes ofShewanellaoneidensisMR- 1 are lipoproteins. Letters in Applied Microbiology, 2004, 39(5): 466- 470.
[27] Judith M Myers, Charles R Myers. Role for outer membrane cytochromes OmcA and OmcB ofShewanellaputrefaciensMR- 1 in reduction of manganese dioxide. Applied and Environmental Microbiology, 2001, 67(1): 260- 269.
[28] Katrin Richter, Marcus Schicklberger, Johannes Gescher. Dissimilatory reduction of extracellular electron acceptors in anaerobic respiration. Applied and Environmental Microbiology, 2012, 78(4): 913- 921.
[29] Daniel Baron, Edward LaBelle, Dan Coursolle, Jeffrey A Gralnick, Daniel R Bond. Electrochemical measurement of electron transfer kinetics byShewanellaoneidensisMR- 1. Journal of Biological Chemistry, 2009, 284(42): 28865- 28873.
[30] Jimmy Borloo, Bjorn Vergauwen, Lina De Smet, Ann Brigé, Bart Motte, Bart Devreese, Jozef Van Beeumen. A kinetic approach to the dependence of dissimilatory metal reduction byShewanellaoneidensisMR- 1 on the outer membrane cytochromescOmcA and OmcB. FEBS Journal, 2007, 274(14): 3728- 3738.
[31] Myers J M, Myers C R. Overlapping role of the outer membrane cytochromes ofShewanellaoneidensisMR- 1 in the reduction of manganese (IV) oxide. Letters in Applied Microbiology, 2003, 37(1): 21- 25.
[32] Yuri A Gorby, Svetlana Yanina, Jeffrey S McLean, Kevin M Rosso, Dianne Moyles, Alice Dohnalkova, Terry J Beveridge, In Seop Chang, Byung Hong Kim, Kyung Shik Kim, David E Culley, Samantha B Reed, Margaret F Romine, Daad A Saffarini, Eric A Hill, Liang Shi, Dwayne A Elias, David W Kennedy, Grigoriy Pinchuk, Kazuya Watanabe, Shun′ichi Ishii, Bruce Logan, Kenneth H Nealson, Jim K Fredrickson. Electrically conductive bacterial nanowires produced byShewanellaoneidensisstrain MR- 1 and other microorganisms. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(30): 11358- 11363.
[33] Thomas J DiChristina, Charles M Moore, Carolyn A Haller. Dissimilatory Fe (III) and Mn (IV) reduction byShewanellaputrefaciensrequiresferE, a homolog of thepulE(gspE) type II protein secretion gene. Journal of Bacteriology, 2002, 184(1): 142- 151.
[34] Shi L, Deng S, Matthew J Marshall, Wang Z M, David W Kennedy, Alice C Dohnalkova, Heather M Mottaz, Eric A Hill, Yuri A Gorby, Alexander S Beliaev, David J Richardson, John M Zachara, James K Fredrickson. Direct involvement of type II secretion system in extracellular translocation ofShewanellaoneidensisouter membrane cytochromes MtrC and OmcA. Journal of Bacteriology, 2008, 190(15): 5512- 5516.
[35] Jeffrey A Gralnick, Hojatollah Vali, Douglas P Lies, Dianne K Newman. Extracellular respiration of dimethyl sulfoxide byShewanellaoneidensisstrain MR- 1. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(12): 4669- 4674.
[36] Dan Coursolle, Jeffrey A Gralnick. Modularity of the Mtr respiratory pathway ofShewanellaoneidensisstrain MR- 1. Molecula Microbiology, 2010, 77(4): 995- 1008.
[37] Thomas A Clarke, Marcus J Edwards, Andrew J Gates, Andrea Hall, Gaye F White, Justin Bradley, Catherine L Reardon, Liang Shi, Alexander S Beliaev, Matthew J Marshall, Zheming Wang, Nicholas J Watmough, James K Fredrickson, John M Zachara, Julea N Butt, David J Richardson. Structure of a bacterial cell surface decaheme electron conduit. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(23): 9384- 9389.
[38] Robert S Hartshorne, Catherine L Reardon, Daniel Ross, Jochen Nuester, Thomas A Clarke, Andrew J Gates, Paul C Mills, Jim K Fredrickson, John M Zachara, Shi L, Alex S Beliaev, Matthew J Marshall, Ming Tien, Susan Brantley, Julea N Butt, David J Richardson. Characterization of an electron conduit between bacteria and the extracellular environment. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(52): 22169- 22174.
[39] David J Richardson, Marcus J Edwards, Gaye F White, Nanakow Baiden, Robert S Hartshorne, Jim Fredrickson, Shi L, John Zachara, Andrew J Gates, Julea N Butt, Thomas Clarke. Exploring the biochemistry at the extracellular redox frontier of bacterial mineral Fe (III) respiration. Biochemical Society Transactions, 2012, 40(3): 493- 500.
[40] Thomas Clarke, Jeffrey A Cole, David Richardson, Andrew M Hemmings. The crystal structure of the pentahaem c-type cytochrome NrfB and characterization of its solution-state interaction with the pentahaem nitrite reductase NrfA. Biochemical Journal, 2007, 406(1): 19- 30.
[41] Marian Breuer, Kevin M Rosso, Jochen Blumberger. Electron flow in multiheme bacterial cytochromes is a balancing act between heme electronic interaction and redox potentials. Proceedings of the National Academy of Sciences of the Unite States of America, 2014, 111(2): 611- 616.
[42] Kelly P Nevin, Derek R Lovley. Mechanisms for Fe (III) oxide reduction in sedimentary environments. Geomicrobiology Journal, 2002, 19(2): 141- 159.
[43] Kelly P Nevin, Derek R Lovley. Mechanisms for accessing insoluble Fe (III) oxide during dissimilatory Fe (III) reduction byGeothrixfermentans. Applied and Environmental Microbiology, 2002, 68(5): 2294- 2299.
[44] Kelly P Nevin, Derek R Lovley. Lack of production of electron-shuttling compounds or solubilization of Fe (III) during reduction of insoluble Fe (III) oxide byGeobactermetallireducens. Applied and Environmental Microbiology, 2000, 66(5): 2248- 2251.
[45] Jessica E Butler, Franz Kaufmann, Maddalena V Coppi, Cinthia Núez, Derek R Lovley. MacA, a dihemec-type cytochrome involved in Fe (III) reduction byGeobactersulfurreducens. Journal of Bacteriology, 2004, 186(12): 4042- 4045.
[46] Jon R Lloyd, Ching Leang, Allison L Hodges Myerson, Maddalena V Coppi, Stacey Cuifo, Barb Methe, Steven J Sandler, Derek R Lovley. Biochemical and genetic characterization of PpcA, a periplasmic c-type cytochrome inGeobactersulfurreducens. Biochemical Journal, 2003, 369: 153- 161.
[47] Ching Leang, M V Coppi, D R Lovley. OmcB, a c-type polyheme cytochrome, involved in Fe (III) reduction inGeobactersulfurreducens. Journal of Bacteriology, 2003, 185(7): 2096- 2103.
[48] Byoung-Chan Kim, Derek R Lovley. Investigation of direct vs. indirect involvement of thec-type cytochrome MacA in Fe (III) reduction byGeobactersulfurreducens. FEMS Microbiology Letters, 2008, 286(1): 39- 44.
[49] Julian Seidel, Maren Hoffmann, Katie E Ellis, Antonia Seidel, Thomas Spatzal, Stefan Gerhardt, Sean J Elliott, and Oliver Einsle. MacA is a second cytochromecperoxidase ofGeobactersulfurreducens. Biochemistry, 2012, 51(13): 2747- 2756.
[50] Ching Leang, L A Adams, K J Chin, K P Nevin, B A Methé, J Webster, M L Sharma, D R Lovley. Adaptation to disruption of the electron transfer pathway for Fe (III) reduction inGeobactersulfurreducens. Journal of Bacteriology, 2005, 187(17): 5918- 5926.
[51] Yan-Huai R Ding, Kim K Hixson, Muktak A Aklujkar, Mary S Lipton, Richard D Smith, Derek R Lovley, Tünde Mester. Proteome ofGeobactersulfurreducensgrown with Fe (III) oxide or Fe (III) citrate as the electron acceptor. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2008, 1784(12): 1935- 1941.
[52] M Aklujkar, M V Coppi, C Leang, B C Kim, M A Chavan, L A Perpetua, L Giloteaux, A Liu, D E Holmes. Proteins involved in electron transfer to Fe (III) and Mn (IV) oxides byGeobactersulfurreducensandGeobacteruraniireducens. Microbiology, 2013, 159(Pt 3): 515- 535.
[53] Qian X L, Tünde Mester, Leonor Morgado, Tsutomu Arakawa, Manju L Sharma, Kengo Inoue, Crisjoe Joseph, Carlos A Salgueiro, Michael J Maroney, Derek R Lovley. Biochemical characterization of purified OmcS, ac-type cytochrome required for insoluble Fe (III) reduction inGeobactersulfurreducens. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 2011, 1807(4): 404- 412.
[54] Ching Leang, Qian X L, Tünde Mester, Derek R Lovley. Alignment of thec-type cytochrome OmcS along pili ofGeobactersulfurreducens. Applied and Environmental Microbiology, 2010, 76(12): 4080- 4084.
[55] T Mehta, M V Coppi, S E Childers, D R Lovley. Outer membranec-type cytochromes required for Fe (III) and Mn (IV) oxide reduction inGeobactersulfurreducens. Applied and Environmental Microbiology, 2005, 71(12): 8634- 8641.
[56] Derek R Lovley, Toshiyuki Ueki, Zhang T, Nikhil S Malvankar, Pravin M Shrestha, Kelly A Flanagan, Muktak Aklujkar, Jessica E Butler, Ludovic Giloteaux, Amelia-Elena Rotaru, Dawn E Holmes, Ashley E Franks, Roberto Orellana, Carla Risso, Kelly P Nevin. Geobacter: the microbe electric′s physiology, ecology, and practical applications. Advances in Microbial Physiology, 2011, 59: 1- 100.
[57] P R Pokkuluri, Y Y Londer, N E C Duke, M Pessanha, X Yang, V Orshonsky, L Orshonsky, J Erickson, Y Zagyanskiy, C A Salgueiro, M Schiffer. Structure of a novel dodecaheme cytochromecfromGeobactersulfurreducensreveals an extended 12 nm protein with interacting hemes. Journal of Structural Biology, 2011, 174(1): 223- 233.
[58] Byoung-Chan Kim, Ching Leang, Yan-Huai R Ding, Richard H Glaven, Maddalena V Coppi, and Derek R Lovley. OmcF, a putativec-type monoheme outer membrane cytochrome required for the expression of other outer membrane cytochromes inGeobactersulfurreducens. Journal of Bacteriology, 2005, 187(13): 4505- 4513.
[59] Kengo Inoue, Qian X L, Leonor Morgado, Byoung-Chan Kim, Tünde Mester, Mounir Izallalen, Carlos A. Salgueiro, Derek R Lovley. Purification and characterization of OmcZ, an outer-surface, octahemec-type cytochrome essential for optimal current production byGeobactersulfurreducens. Applied and Environmental Microbiology, 2010, 76(12): 3999- 4007.
[60] Kengo Inoue, Ching Leang, Ashley E Franks, Trevor L Woodard, Kelly P Nevin, Derek R Lovley. Specific localization of thec-type cytochrome OmcZ at the anode surface in current-producing biofilms ofGeobactersulfurreducens. Environmental Microbiology Reports, 2011, 3(2): 211- 217.
[61] Kelly P Nevin, Byoung-Chan Kim, Richard H Glaven, Jessica P Johnson, Trevor L Woodard, Barbara A Methé, Raymond J DiDonato Jr, Sean F Covalla, Ashley E Franks, Liu A N, Derek R Lovley. Anode biofilm transcriptomics reveals outer surface components essential for high density current production inGeobactersulfurreducensfuel cells. PLoS One, 2009, 4(5): e5628.
[62] P L Corstjens, J P De Vrind, P Westbroek, E W De Vrind-De Jong. Enzymatic iron oxidation byLeptothrixdiscophora: identification of an iron-oxidizing protein. Applied and Environmental Microbiology, 1992, 58(2): 450- 454.
[63] Iman A El Gheriany, Daniela Bocioaga, Anthony G Hay, William C Ghiorse, Michael L Shuler, Leonard W Lion. Iron requirement for Mn (II) oxidation byLeptothrixdiscophoraSS- 1. Applied and Environmental Microbiology, 2009, 75(5): 1229- 1235.
[64] Francisco J Enguita, Lígia O Martins, Adriano O Henriques, Maria Arménia Carrondo. Crystal structure of a bacterial endospore coat component: a laccase with enhanced thermostability properties. Journal of Biological Chemistry, 2003, 278(21): 19416- 19425.
[65] Marie-Fran?oise Hullo, Ivan Moszer, Antoine Danchin, Isabelle Martin-Verstraete. CotA ofBacillussubtilisis a copper-dependent laccase. Journal of Bacteriology, 2001, 183(18): 5426- 5430.
[66] Dawn E Holmes, Tünde Mester, Regina A O′Neil, Lorrie A Perpetua, M Juliana Larrahondo, Richard Glaven, Manju L Sharma, Joy E Ward, Kelly P Nevin, Derek R Lovley. Genes for two multicopper proteins required for Fe (III) oxide reduction inGeobactersulfurreducenshave different expression patterns both in the subsurface and on energy-harvesting electrodes. Microbiology, 2008, 154(5): 1422- 1435.
[67] Teena Mehta, Susan E Childers, Richard Glaven, Derek R Lovley, Tünde Mester. A putative multicopper protein secreted by an atypical type II secretion system involved in the reduction of insoluble electron acceptors inGeobactersulfurreducens. Microbiology, 2006, 152(8): 2257- 2264.
[68] Susan E Childers, Stacy Ciufo, Derek R Lovley.Geobactermetallireducensaccesses insoluble Fe (III) oxide by chemotaxis. Nature, 2002, 416(6882): 767- 769.
[69] Gemma Reguera, Kevin D McCarthy, Teena Mehta, Julie S Nicoll, Mark T Tuominen, Derek R Lovley. Extracellular electron transfer via microbial nanowires. Nature, 2005, 435(7045): 1098- 1101.
[70] S Kolappan, E N Tracy, L O Bakaletz, R S Munson, L Craig. Expression, purification, crystallization and preliminary crystallographic analysis of PilA from the nontypeableHaemophilusinfluenzaetype IV pilus. Acta Crystallographica Section F: Structural Biology and Crystallization Communications, 2012, 68(3): 284- 287.
[71] Masahiko Morita, Nikhil S Malvankar, Ashley E Franks, Zarath M Summers, Ludovic Giloteaux, Amelia E Rotaru, Camelia Rotaru, Derek R Lovley. Potential for direct interspecies electron transfer in methanogenic wastewater digester aggregates. MBio, 2011, 2(4): e00159- 11.
Intracellular electron transfer mechanism of typical extracellular respiratory bacteria
ZHAO Xinyu1,2,3, HE Xiaosong2,3,4,*, TAN Wenbing2,3, GAO Rutai2,3, XI Beidou1,2,3, LI Dan2,3, ZHANG Hui2,3
1CollegeofWaterScience,BeijingNormalUniversity,Beijing100875,China2StateKeyLaboratoryofEnvironmentalCriteriaandRiskAssessment,ChineseResearchAcademyofEnvironmentalSciences,Beijing100012,China3InnovationBaseofGroundWater&EnvironmentalSystemEngineering,ChineseResearchAcademyofEnvironmentalScience,Beijing100012,China4CNHOMELANDEnvironmentalProtectionWaterPollutionGovernanceAcademicianWorkstation,Guangzhou510631,China
The reduction of humus and metals such as Fe and Mn is a challenge for microorganisms, as these substances have low water solubility and cannot enter into cell envelopes. Extracellular electron transfer is defined as the process through which electrons derived from the oxidation of electron donors are transferred from the inner membrane to the outer membrane of the cell to reduce an extracellular terminal electron acceptor.S.oneidensisMR- 1 andG.sulfurreducensare the most frequently used organisms for extracellular respiratory bacteria experiments because they have developed electron transfer strategies that require mutihemec-type cytochromes (c-Cyts). InS.oneidensisMR- 1, multihemec-Cyts, CymA, and MtrA are believed to transfer electrons from the inner membrane qunione/quinol pool through the periplasm to the outer membrane (OmcA, MtrC). The Type Ⅱ secretion system ofS.oneidensisMR- 1 was due to the direct involvement of translocation of MtrC and OmcA to the bacterial cell surface. The decahemec-Cyts, MtrC, and OmcA can directly reduce the extracellular electron acceptors. Likewise, forG.sulfurreducens, MacA delivered electrons from the inner membrane to PpcA in periplasm, and PpcA subsequently transferred electrons to the OMCs (OmcB, OmcE, OmcS, and OmcZ) and Type Ⅳ pili that were hypothesized to relay the electrons to extracellular electron acceptors. This review summarizes the recent advances of extracellular electron transfer mechanisms with a focus onShewanellaandGeobacter.
extracellular respiration; intracellular electron transfer;Shewanella;Geobacter
國家杰出青年科學基金項目(51325804);國家自然科學青年基金項目(51408573)
2014- 12- 26; 網(wǎng)絡出版日期:2016- 10- 29
10.5846/stxb201412262581
*通訊作者Corresponding author.E-mail: hexs82@126.com
趙昕宇, 何小松,檀文炳,高如泰,席北斗, 李丹, 張慧.典型胞外呼吸細菌的胞內(nèi)電子轉(zhuǎn)移機制研究進展.生態(tài)學報,2017,37(8):2540- 2550.
Zhao X Y, He X S, Tan W B, Gao R T, Xi B D, Li D, Zhang H.Intracellular electron transfer mechanism of typical extracellular respiratory bacteria.Acta Ecologica Sinica,2017,37(8):2540- 2550.

