己烯雌酚人工抗原的合成及抗血清的制備
楊興東++胡驍飛+王方雨++曾憲垠
摘要:由己烯雌酚(diethylstilbestrol,DES)經(jīng)過(guò)一系列化學(xué)反應(yīng),合成含有1個(gè)羥基活性基團(tuán)的半抗原己烯雌酚-單羧基丙基醚(DES-MCPE);應(yīng)用活潑酯法,使DES-MCPE與牛血清白蛋白(BSA)、卵清蛋白(OVA)偶聯(lián),合成人工免疫抗原DES-BSA和包被抗原DES-OVA,采用紫外分光光度法(UV)和聚丙烯酰胺凝膠電泳(SDS-PAGE)進(jìn)行鑒定,初步判定偶聯(lián)成功。用DES-BSA以60 μg/只的劑量免疫3只BALB/c小鼠,4次免疫后,采集血清,使用間接ELISA和間接競(jìng)爭(zhēng)ELISA分別測(cè)定抗血清的效價(jià)與抑制,3只小鼠的效價(jià)均可達(dá)到1×104以上,其中2號(hào)小鼠的半抑制率(IC50)為18.221 μg/L,表明已獲得靈敏、特異、高效價(jià)的抗血清。
關(guān)鍵詞:己烯雌酚;完全抗原;人工合成;抗血清;ELISA;高效價(jià);靈敏
中圖分類(lèi)號(hào): S852.5文獻(xiàn)標(biāo)志碼: A文章編號(hào):1002-1302(2017)08-0149-03
己烯雌酚(diethylstilbestrol,DES)是一種人工合成的非甾體雌激素,具有促進(jìn)動(dòng)物生長(zhǎng)、提高瘦肉率的作用,曾經(jīng)作為促生長(zhǎng)劑在畜禽生產(chǎn)中得到普遍應(yīng)用。但DES對(duì)人類(lèi)有很強(qiáng)的致畸、致癌等毒副作用[1-3],我國(guó)及大多數(shù)國(guó)家均明確規(guī)定禁止在畜牧養(yǎng)殖中使用DES。為降低動(dòng)物生產(chǎn)成本,不規(guī)范使用己烯雌酚的現(xiàn)象仍然存在。傳統(tǒng)的理化檢測(cè)技術(shù)雖然能夠監(jiān)測(cè)動(dòng)物源性食品中的DES殘留,但其存在用時(shí)長(zhǎng)、費(fèi)用多、程序繁瑣等缺陷,因此急需發(fā)展一種迅速、簡(jiǎn)便、敏感、精確、價(jià)廉的分析方法[4]。本試驗(yàn)旨在合成DES人工抗原和制備抗DES抗血清,為DES殘留血清學(xué)檢測(cè)的建立打下基礎(chǔ)。
1材料與方法
1.1試劑和溶液
DES、4-溴丁酸乙酯,Sigma產(chǎn)品;羥琥珀亞酰胺(NHS)和N,N-二環(huán)己基碳二亞胺(DCC),F(xiàn)luka公司;牛血清白蛋白(BSA)、雞卵清蛋白(OVA),弗氏完全佐劑(FCA)、弗氏不完全佐劑(FIA),Pierce產(chǎn)品;羊抗鼠酶標(biāo)二抗(GaMIgG-HRP),華美生物工程有限公司;二甲基亞砜、乙酸乙酯、二甲基甲酰胺均為AR級(jí)。
ELISA相關(guān)試劑配制:(1)洗液(PBST):含0.05%的Tween-20的磷酸鹽緩沖液(PBS,0.01 mol/L,pH值為7.4);(2)間接ELISA和間接競(jìng)爭(zhēng)ELISA所用的稀釋液、封閉液均為含50 mL/L豬血清的PBST;(3)包被液(CBS)為 0.05 mol/L pH值9.6的碳酸鹽緩沖液;(4)顯色液為四甲基聯(lián)苯胺(TMB)的醋酸-檸檬酸緩沖液;(5)終止液為2 mol/L的H2SO4溶液。
1.2主要儀器設(shè)備
U-3000紫外掃描儀(UV),日本島津公司;凝膠成像系統(tǒng)及分析軟件,Syngene公司;JM-250電泳儀,大連捷邁科貿(mào)有限公司;Bio-Rad 550型酶標(biāo)儀,美國(guó)Bio-Rad公司;超凈工作臺(tái),美國(guó)Forma Scientific公司;93-3定時(shí)恒溫雙向磁力攪拌器,上海亞榮生化儀器廠(chǎng);3K-18高速冷凍離心機(jī),德國(guó)SIGMA公司;HI9321酸度計(jì),美國(guó)HANNA公司;Jouan-RC1010z真空濃縮儀,法國(guó)Jouan公司;AE260電子天平,德國(guó)METTLER公司。
1.3實(shí)驗(yàn)動(dòng)物
SPF級(jí)6~8周齡的雌性BALB/c小白鼠,購(gòu)自鄭州大學(xué)醫(yī)學(xué)院實(shí)驗(yàn)動(dòng)物中心,由河南省農(nóng)業(yè)科學(xué)院動(dòng)物免疫學(xué)重點(diǎn)開(kāi)放實(shí)驗(yàn)室飼養(yǎng)。
1.4方法
1.4.1DES人工抗原的合成
1.4.1.1己烯雌酚-單羧基丙基醚(DES-MCPE)的合成(1)精確稱(chēng)量54 mg DES溶于2 mL無(wú)水二甲基亞砜(DMSO),加入27.5 mg無(wú)水K2CO3,在避光條件下,室溫?cái)嚢璺磻?yīng)1.5 h;(2)加入4-溴丁酸乙酯(C6H11BrO2)17 mg,室溫,避光,攪拌反應(yīng)8 h;(3)反應(yīng)產(chǎn)物轉(zhuǎn)移到10 mL預(yù)冷pH值 2.0 的稀鹽酸溶液中,加入醋酸乙酯(C4H8O2)進(jìn)行萃取,雙蒸水沖洗、放入真空濃縮儀中,抽提有機(jī)溶劑;(4)抽提后的產(chǎn)物加入適量的甲醇(CH3OH)溶液進(jìn)行溶解,再加入 2 mol/L 氫氧化鈉溶液,全部溶解后后,逐滴加入適量的HCl溶液,使溶液pH值在2~4之間,重復(fù)上述分離步驟,C4H8O2萃取,雙蒸水沖洗、真空干燥,得到目標(biāo)產(chǎn)物(DES-MCPE)[5]。
1.4.1.2DES-BSA免疫原、DES-OVA包被原的制備(1)稱(chēng)取DE-MCPE 42 mg溶于2 mL二甲基亞砜(DMSO),將25 mg DCC溶解在0.6 mL無(wú)水二甲基甲酰胺,加入15 mg NHS,暗處、室溫下攪拌反應(yīng)4 h。(2)2 900 r/min離心 5 min,棄去沉淀,收集上清。(3)精確稱(chēng)量BSA 60 mg溶于 2 mL 的pH值8.0的PBS中,冰浴,逐滴加入1 mL無(wú)水二甲基甲酰胺。(4)將上清液緩慢逐滴滴加到BSA溶液中,4 ℃攪拌8 h。(5)將反應(yīng)產(chǎn)物加入透析袋中,透析袋放入盛有 1 000 mL PBS緩沖液的燒杯中,將燒杯轉(zhuǎn)移到4 ℃冷凍室開(kāi)始透析,透析液需每天更換3次,持續(xù)透析3 d。(6)透析完成后,透析袋內(nèi)溶液移入離心管,離心5 min,收集上清液,用1 mL PE管分裝,-20 ℃存放待用。包被原DES-OVA的制備過(guò)程與DES-BSA相同,OVA的劑量為70 mg[6]。
1.4.2DES人工抗原的鑒定
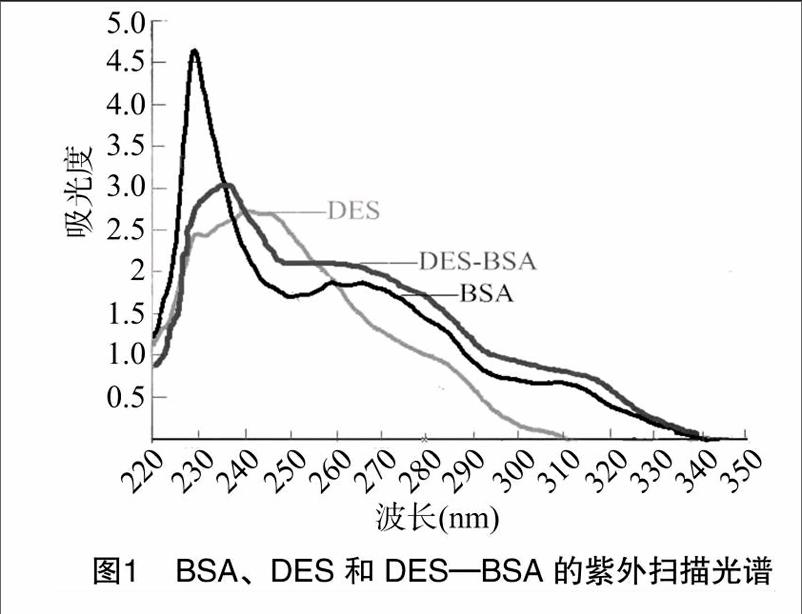
1.4.2.1UV鑒定使用核酸蛋白檢測(cè)儀DES-BSA溶液的質(zhì)量濃度,用PBS配制BSA溶液使其濃度與DES-BSA溶液的濃度相同,用二甲基甲酰胺(DMF)與PBS體積比為4 ∶6的混液配制DES標(biāo)準(zhǔn)溶液,在波長(zhǎng)220~350 nm之間,用紫外吸收法分別測(cè)定上述溶液的特征峰,通過(guò)觀察吸收峰的特征變動(dòng),判定偶聯(lián)成功與否,依據(jù)Yang等報(bào)道的方法[7],推算出DES-MCPE分別與BSA、OVA的分子偶聯(lián)比率。
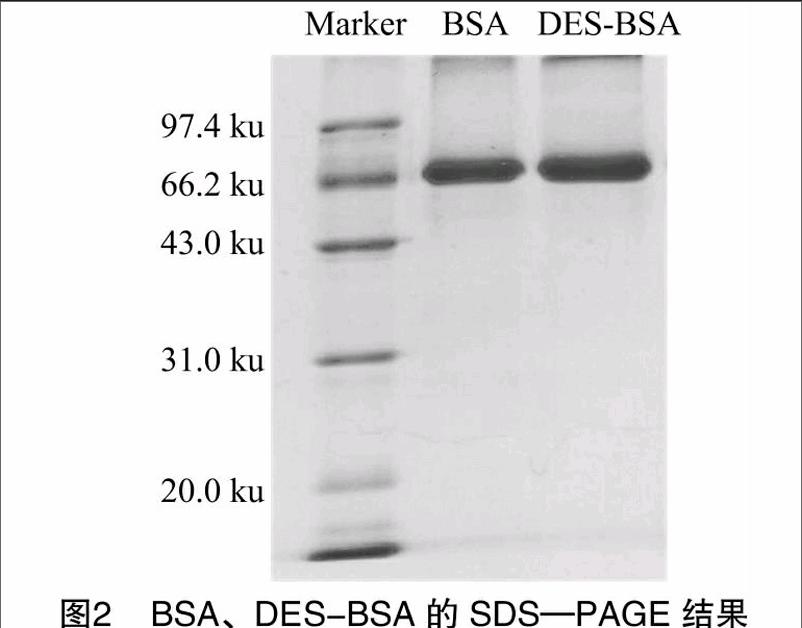
1.4.2.2SDS-PAGE凝膠電泳鑒定電泳溶液的配制依照Guo等的報(bào)道[8]來(lái)進(jìn)行:(1)濃縮膠ω=5%;分離膠ω=12%;濃縮膠電壓65 V;分離膠電壓100 V;(2)加入樣品 20 μL,其中含免疫原3 μg;(3)考馬斯亮藍(lán)染色7~8 h;(4)在脫色液中脫色6~7 h;(5)可以通過(guò)測(cè)定物的分子質(zhì)量的大小、條帶位點(diǎn)的變化能夠判定結(jié)合與否;(6)利用紫外凝膠成像系統(tǒng)分析軟件,推算DES-MCPE與BSA的分子偶聯(lián)比[9]。
1.4.3DES多抗血清的制備(1)用人工免疫原DES-BSA以60 μg/只的劑量,背部多點(diǎn)皮下注射的免疫方式來(lái)免疫3只實(shí)驗(yàn)小鼠;(2)第1次免疫,450 μL FCA和450 μL DES-BSA的無(wú)菌PBS溶液進(jìn)行混合,利用勻漿機(jī)乳化5~10 min;(3)28 d后加強(qiáng)免疫,用450 μL DES-BSA的無(wú)菌PBS溶液與450 μL FIA混合并乳化,注射劑量與第1次免疫劑量相同,總共免疫4次,每次間隔時(shí)間為21 d;(4)第4免10 d后剪斷免疫小鼠的尾稍,吸取10 μL血液放入裝有990 μL無(wú)菌PBS的1 mL PE管中,在振蕩器上振蕩使之充分混合均勻,離心5 min,收集上清液,于4℃存放待用。
1.4.4DES多抗血清的鑒定
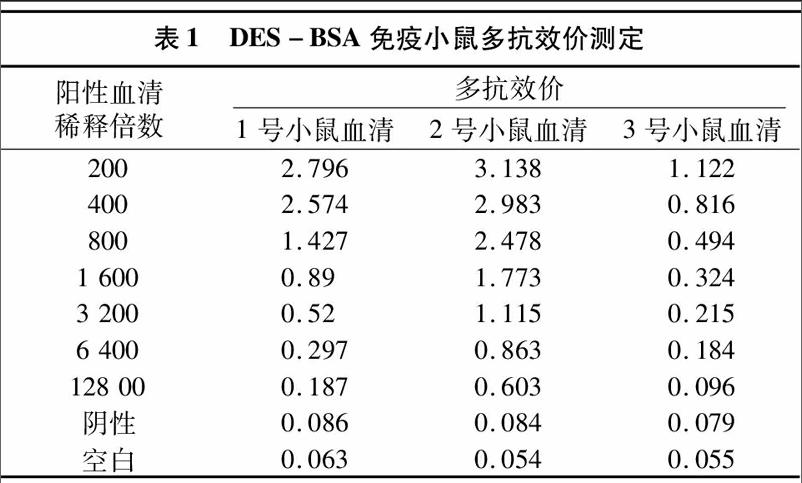
1.4.4.1效價(jià)測(cè)定采用間接ELISA測(cè)定DES抗血清效價(jià)[10],其步驟如下:第1步,以DES-OVA為包被抗原(2 μg/L),50 μL/孔,進(jìn)行包板,37 ℃溫育2 h,PBST洗板4次(每次間隔3 min),下同;第2步,37 ℃,5%的豬血清以 220 μL/孔 的劑量封閉60 min,洗板;第3步:稀釋100倍的DES抗血清以50 μL/孔的劑量加入第1孔,然后利用5%的豬血清進(jìn)行倍比稀釋?zhuān)瑫r(shí)設(shè)陰性對(duì)照(negative control,NC)和空白對(duì)照(blank control,BC),37 ℃溫育15 min,洗板;第4步:加入GaMIgG-HRP[V(GaMIgG-HRP) ∶V(封閉液)=1 ∶1 000],50 μL/孔,37 ℃溫育30 min,洗板;第5步:各孔加入TMB(四甲基聯(lián)苯胺)的CH3COOH-C6H8O7緩沖液 50 μL,室溫條件下靜置2~6 min;第6步:各孔加入2 mol/L硫酸溶液50 μL,使反應(yīng)結(jié)束,利用酶標(biāo)儀進(jìn)行測(cè)定;第7步,結(jié)果判斷,以待測(cè)孔D450 nm≥NC D450 nm的2.1倍(P/N≥2.1),判為陽(yáng)性。
1.4.4.2敏感性鑒定間接競(jìng)爭(zhēng)ELISA(ci-ELISA)方法[11]測(cè)定抗血清對(duì)DES的半數(shù)抑制質(zhì)量濃度(IC50),以IC50判定敏感度,操作步驟與間接ELISA類(lèi)似,區(qū)別在于第3步分別添加D450 nm值為1.0的3只小鼠血清50 μL和不同質(zhì)量濃度的抑制劑(DES溶液)50 μL。
1.4.4.3特異性測(cè)定交叉反應(yīng)(CR)試驗(yàn)鑒定其特異性。選用己烯雌酚(DES)、己烷雌酚(HEX)、雙烯雌酚(DIEN)和雌二醇(E2)等作為競(jìng)爭(zhēng)物,用ci-ELISA測(cè)定各競(jìng)爭(zhēng)物的IC50,交叉反應(yīng)率(CR%)是以抗血清對(duì)DES的IC50與各競(jìng)爭(zhēng)物的IC50之比的百分?jǐn)?shù)。
2結(jié)果與分析
2.1人工抗原鑒定結(jié)果
2.1.1UV鑒定結(jié)果DES-BSA的吸收峰向右稍有偏移,DES的吸收峰在240~245 nm處,BSA的吸收峰在278~280 nm 處(圖1),證明DES和BSA已發(fā)生偶聯(lián)。推算出 DES-MCPE與BSA、OVA的分子偶聯(lián)比分別為1 ∶12.8、1 ∶11.5。
2.1.2SDS-PAGE鑒定結(jié)果人工合成的DES-BSA的顯色條帶位于偶聯(lián)物之后,其泳動(dòng)速度小于DES(圖2),DES分子質(zhì)量的大小與樣品在SDS-PAGE中遷移距離成反比,結(jié)果分析表明,DES-BSA的分子量比BSA的大,證明BSA與DES成功偶聯(lián);應(yīng)用紫外凝膠成像系統(tǒng)分析軟件推算出 DES-BSA的分子量為7.039×104,BSA的分子量為6.62×104,BSA與DES的分子結(jié)合比約為1 ∶12.8,與UV鑒定結(jié)果基本一致。
2.2DES pAb的鑒定結(jié)果
2.2.1間接ELISA檢測(cè)結(jié)果表1顯示,免疫的3只 BALB/c 小鼠的多抗血清的效價(jià)均達(dá)到1.0×104以上,證明DES多克隆抗體(pAb)滴度高,DES-BSA免疫原性良好。
2.2.2敏感性鑒定結(jié)果3只免疫小鼠的抗血清都有抑制生成(表2),其中抗血清抑制效果最優(yōu)的是2號(hào)小鼠(圖3),以2號(hào)小鼠抗血清的抑制濃度的對(duì)數(shù)值為橫坐標(biāo),其對(duì)應(yīng)的B/B0值為縱坐標(biāo)進(jìn)行繪圖,曲線(xiàn)回歸分析顯示兩者存在良好的線(xiàn)性關(guān)系,其線(xiàn)性回歸方程為y=-0.397 5x+1.001 2,r2=0.977 3。據(jù)此回歸方程能夠計(jì)算出對(duì)DES抗血清的IC50為18.221 μg/L,證明所獲得的DES抗血清的敏感性較高。
2.2.3特異性鑒定結(jié)果DES抗血清與己烷雌酚、雙烯雌酚的交叉反應(yīng)率分別為8.09%、3.63%,與其類(lèi)似物無(wú)交叉反應(yīng)(表3)。證明DES多抗血清擁有較好的選擇性。
3討論
3.1DES人工抗原的制備
依據(jù)DES免疫學(xué)測(cè)定技術(shù)的報(bào)道,歸納活化DES重要的手段有2種:一種是改造己烯雌酚中的酚羥基產(chǎn)生醚鍵;另一種是改造DES中的酚羥基形成酯鍵,對(duì)DES分子含有2個(gè)對(duì)稱(chēng)結(jié)構(gòu)的酚羥基進(jìn)行衍生反應(yīng),對(duì)其可直接與琥珀酸酐衍生使之生成具有交聯(lián)功能基團(tuán)的化合物,然后再與載體交聯(lián)。要對(duì)其中一個(gè)酚羥基進(jìn)行化學(xué)改造,必須從反應(yīng)物的量上加以嚴(yán)格控制,按一定比例反應(yīng)后,保證生成的產(chǎn)物是DES-HS。我們按照此法對(duì)DES進(jìn)行多次改造,但結(jié)果沒(méi)有新的產(chǎn)物產(chǎn)生。Liu等報(bào)道動(dòng)物體內(nèi)酯酶使機(jī)體內(nèi)的酯鍵處于不穩(wěn)定狀態(tài),而且免疫原性不理想[12]。本研究為了避免這一現(xiàn)象的產(chǎn)生,選取后一種連接方式。
3.2DES人工抗原的鑒定
核磁共振碳譜、IR、標(biāo)記抗原示蹤法[13]、UV[14]、聚丙烯酰胺凝膠電泳等是檢測(cè)小分子抗原經(jīng)常使用的方法,前2種方法能夠很好地測(cè)出被檢物質(zhì)的化學(xué)式,但是操作者需要擁有辨析圖譜的能力和相當(dāng)程度的實(shí)際動(dòng)手經(jīng)歷,而且檢測(cè)成本高昂,第3種方法要求對(duì)小分子作標(biāo)記,還要求檢測(cè)合成抗原的放射強(qiáng)弱,操作過(guò)程步驟繁瑣、所需時(shí)間長(zhǎng)。使用后2種方法鑒定本試驗(yàn)合成的抗原,結(jié)果顯示,DES與BSA已經(jīng)發(fā)生偶聯(lián),斷定兩者是否發(fā)生偶聯(lián)的關(guān)鍵是合成的DES-BSA抗原免疫BALB/c小鼠后,是不是生成了針對(duì)DES的抗體[15]。本試驗(yàn)測(cè)定的3只BALB/c小鼠的多克隆抗體的效價(jià)都在 1×104以上,都對(duì)DES有抑制,最佳的IC50為 18.221 μg/L,結(jié)果表明,本研究合成的抗原可以激發(fā)機(jī)體產(chǎn)生高親和力的特異性抗體,充分證明該合成物是有效的。
參考文獻(xiàn):
[1]Palmer J,Boggs D,Hatch E,et al. Prenatal DES exposure in relation to breast size[J]. Cancer Causes & Control:CCC,2013,24(9):1757-1761.
[2]Tournaire M,Devouche E,Epelboin S,et al. Diethylstilbestrol exposure:evaluation of the doses received in France[J]. European Journal of Epidemiology,2012,27(4):315-316,318.
[3]Nakajima T,Iguchi T,Sato T. Involvement of activin signaling in abnormalities of mouse vagina exposed neonatally to diethylstilbestrol[J]. Cell and Tissue Research,2011,344(3):527-538.
[4]Xiong P,Gan N,Cui H,et al. Incubation-free electrochemical immunoassay for diethylstilbestrol in milk using gold nanoparticle-antibody conjugates for signal amplification[J]. Microchimica Acta,2014,181(3/4):453-462.
[5]Xu C L,Chu X G,Peng C F,et al. Comparison of enzyme-linked immunosorbent assay with liquid chromatography-tandem mass spectrometry for the determination of diethylstilbesterol residues in chicken and liver tissues[J]. Biomedical Chromatography,2006,20(10):1056-1064.
[6]Suzuki E,Nakagomi M,Hashimoto M,et al. Preparation of specific antisera to 15alpha-hydroxyestrogens[J]. Steroids,1999,64(8):551-557.
[7]楊利國(guó),胡少昶,魏平華,等. 酶免疫測(cè)定技術(shù)[M]. 南京:南京大學(xué)出版社,1998:252-258.
[8]郭堯君. 蛋白質(zhì)電泳實(shí)驗(yàn)技術(shù)[M]. 北京:科學(xué)出版社,1999:56-60.
[9]Kamps-Holtzapple C,Carlin R,Sheffield C,et al. Analysis of hapten-carrier protein conjugates by nondenaturing gel electrophoresis[J]. Journal of Immunological Methods,1993,164(2):245-253.
[10]Liu X,Eichenberger M,F(xiàn)ujioka Y,et al. Improved detection sensitivity and selectivity attained by open-sandwich selection of an anti-estradiol antibody[J]. Analytical Sciences,2012,28(9):861-867.
[11]Tolra F,Reig M.Analytical tools for assessing the chemical safety of meat and poultry[M]//Springer briefs in food,health,and nutrition. New York:Springer,2012:61-67.
[12]劉雅紅,單國(guó)強(qiáng),康彥龍. 己烯雌酚人工抗原的合成研究[J]. 中國(guó)獸醫(yī)科技,2003,33(10):43-46.
[13]Pallardy M,Alberici G,Goodman A,et al. Antibody recognition of substituted ammonium ions. Modulation by the counterion[J]. Journal of Immunological Methods,1987,99(2):179-183.
[14]Mcadam D P,Hill A S,Beasley H L,et al. Mono-and polyclonal antibodies to the organophosphate fenitrothion.1. Approaches to hapten-protein conjugation[J]. J Agri Food Chem,1992,40(8):1466-1470.
[15]沈關(guān)心,周汝麟. 現(xiàn)代免疫學(xué)實(shí)驗(yàn)技術(shù)[M]. 武漢:湖北科學(xué)技術(shù)出版社,1998:17-18.

