新疆野核桃F1表型性狀與SSR標記連鎖分析
李勤霞++張萍
摘要:以新疆伊犁鞏留縣平底圓核桃、橢圓核桃及其雜種F1,以及隨機選取的60份野核桃種質資源為研究材料,對其表型性狀、SSR遺傳多樣性及其親緣關系進行分析和評價。研究發現,8個表型性狀在群體中呈連續分布,與其正態分布曲線擬合較好,彼此之間具有相關性。變異系數表明各個性狀的變異均超過10%,說明個體間的表型值變異較大。進一步對其進行主成分分析,表明株高、莖粗、最大葉長、最小葉長、最小葉寬這5個指標是引起野核桃表型差異較大的因子。通過10對多態性高的SSR引物共檢測出35個等位變異位點,變異范圍在2~6之間,平均每對SSR引物可檢測到3.5個等位位點。遺傳相似系數(GS)變異范圍為0.51~0.95。GS值在0.55水平上的UPGMA聚類分析可將供試的野核桃種質資源劃分成Ⅰ、Ⅱ、Ⅲ、Ⅳ共4個組。豐富的遺傳變異可為野核桃遺傳改良及分子育種提供依據。
關鍵詞:野核桃;遺傳多樣性;SSR標記;表型性狀
中圖分類號: S664.101文獻標志碼: A
文章編號:1002-1302(2017)09-041-05
生物體遺傳多樣性的實質是其在遺傳物質組成、結構上的變異,表現在群體、個體、組織、細胞、分子水平等不同層次上[1]。以往人們常根據植株形態鑒定雜交子代,但形態學鑒定周期較長,易受栽培環境影響,具有很大的局限性。近年發展起來的基于物種DNA水平的分子標記技術,具有不易受環境影響、引物信息共享、鑒定速度快等優點,是鑒定雜交子代的有力手段[2]。于是,將形態學與分子手段相結合的研究方法隨之興起[3],如對不同類型小豆的SSR標記及其性狀進行研究[4],對大豆[Glycine max (L.) Merr]農藝性狀與SSR標作進行研究[5],以及對桃(Amygdalus persica L.)的形態特征進行研究[6-8]等,類似研究較多。
新疆野核桃(Juglans regia)為胡桃科胡桃屬植物,是栽培核桃的直系祖先,具有許多優良的遺傳特性,在我國僅分布于新疆伊犁鞏留縣野核桃溝自然保護區內,是我國珍貴的天然野生資源。新疆野核桃不僅是我國重要的野生核桃資源,更是研究栽培核桃起源、進化、自然選擇不可多得的原始材料。曾有報道,遺傳多樣性越高或遺傳變異越豐富,林木對環境變化的適應能力也就越強,而遺傳多樣性的降低或消失將導致林木在適應、繁殖方面產生衰退,同時抵抗力也會下降[9-10]。新疆野核桃作為一種重要的林木,對其遺傳多樣性的研究顯得尤為重要。目前,關于新疆野核桃的研究較多,王肇延對其DNA的提取方法以及野核桃遺傳多樣性進行了研究[11];王磊等對野核桃的形態特征進行了研究[12];袁海濤利用野核桃的表型基礎數據全面構建了新疆野核桃的基礎數據庫,并對其構建野核桃核心種質的方法進行了研究[13];張維等對其種群動態進行了研究[14],但對表型性狀還沒有進行較深入研究,而表型性狀不僅是遺傳多樣性的組成部分,更為野核桃的遺傳育種提供了依據。因此,本研究將野核桃的表型性狀及SSR標記的多態性相結合,以期了解其表型性狀的同時,更加全面地了解其形態多樣性的來源。
1材料與方法
1.1試驗材料
材料選自新疆伊犁河谷地鞏留縣西北部的野核桃溝,2014年5月下旬選取2棵長勢較好且表型性狀差異較大的野核桃樹(父本:平底圓核桃,母本:橢圓核桃,兩樹相隔50 m左右)進行人工授粉雜交,待果實成熟后,將F1種子移栽到新疆烏魯木齊縣花卉生產基地內,共計培養幼苗368株。
1.2研究方法
1.2.1表型性狀的選取
從培養的F1幼苗中隨機選取60[CM)]株進行測量,所取性狀包括株高、莖高、莖粗、最大葉長、最大葉寬、最小葉寬、最小葉長、側枝長。所有數據均使用游標卡尺測量。單位均為cm。
1.2.2DNA提取與SSR試驗過程
在苗期提取上述60株對應幼苗的嫩葉DNA,經0.8%瓊脂糖凝膠電泳檢測DNA的大小及降解情況,并用UVP凝膠成像系統對電泳的瓊脂糖凝膠觀察和拍照。將各材料的DNA濃度稀釋至30 ng/μL,于 -20 ℃ 冰箱保存備用。
試驗所用的20對SSR引物的堿基序列來源于NCBI網站公布的核桃SSR引物,由華大科技生物公司合成。對親本材料進行SSR引物篩選,試驗選出PCR擴增條帶清晰、重復性好、多態性豐富的引物10對用于進一步分析。
參照王肇延SSR反應體系和程序[11],經優化后確定反應體系為10 μL,其中包括Mg2+ 2.5 mmol/L、引物 0.25 μmol/L、dNTPs 0.18 mmol/L、Taq酶0.5 U,模板DNA約為30 ng。PCR擴增程序為94 ℃預變性3 min;94 ℃變性 30 s,56 ℃退火1 min,72 ℃延伸40 s,共30個循環;最后 72 ℃ 延伸9 min,4 ℃保存。PCR擴增反應在Thermal Cycler S1000型PCR儀上進行。擴增反應結束后,每個反應體系中加入2 μL的溴酚藍。用8%的非變性聚丙烯酰胺電泳技術對產物進行分離檢測。每樣品點樣2.5 μL,用DYY-6C型電泳儀在65 mA恒電流下電泳約2 h,取下凝膠在搖床上進行銀染處理(固定液搖洗13 min;加AgNO3溶液,搖床銀染 10 min;后再用雙蒸水清洗2次,洗去殘留的AgNO3;顯色液倒入直至出現清晰的條帶后終止反應,最后用雙蒸水沖洗 2~3次),結果拍照保存。
1.3數據統計分析
利用SPSS 18.0軟件對F1代個體表型性狀進行遺傳變異統計和分析。統計參數包括平均值、最大值、最小值、方差、標準差、偏度、峰度、變異系數,并繪制頻率分布圖。利用 Excel 對每對SSR引物擴增的多個等位位點上有帶的賦值為“1”,無帶的賦值為“0”。采用NTSYS-pc2.1軟件按照非加權配對平均法(UPGMA)和SHAN程序進行聚類分析。統計等位位點數、多態性位點數和多態性信息含量(PIC)參數值,無多態性的條帶未統計。采用SPSS 18.0對野核桃SSR標記基因型與株高、莖高、莖粗等性狀進行連鎖分析,利用Pearson相關系數判斷SSR標記與株高、莖粗、最大葉長等相關性狀的關聯度是否顯著。[HJ1.57mm]
2結果與分析
2.1F1代群體表型性狀遺傳變異
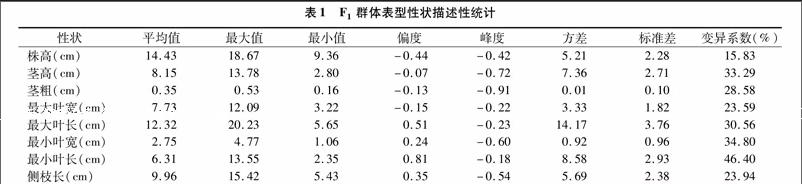
F1群體表型性狀在個體間存在差異(表1)。其中,株高最大值是18.67 cm,最小值9.36 cm,標準差2.28 cm,變異系數15.83%。莖高最大值13.78 cm,最小值2.80 cm,標準差2.71 cm,變異系數33.29%。莖粗最大值0.53 cm,最小值 0.16 cm,標準差0.10 cm,變異系數28.58%。最大葉寬最大值12.09 cm,最小值3.22 cm,標準差1.82 cm,變異系數 23.59%。最大葉長最大值20.23 cm,最小值5.65 cm,標準差3.76 cm,變異系數30.56%。最小葉寬最大值4.77 cm,最小值1.06 cm,標準差0.96 cm,變異系數34.80%。最小葉長最大值13.55 cm,最小值2.35 cm,標準差2.93 cm,變異系數46.40%。側枝長最大值15.42 cm,最小值5.43 cm,標準差2.38 cm,變異系數23.94%。F1個體間差異明顯,不同表型性狀的變異系數為15.83%~46.40%,變異程度最小的是株高,最大的為最小葉長。各個性狀的變異均超過10%,說明個體間的表型值變異較大。
株高、莖高、莖粗、最大葉寬的偏度均為負值,分別為 -0.44、-0.07、-0.13、-0.15,表示柱形圖向正態分布區域右側偏斜。而最大葉長、最小葉寬、最小葉長、側枝長的偏度均為正值,分別是0.51、0.24、0.81、0.35。其中,最小葉長峰度的絕對值最小,說明其離散程度最小,莖粗的峰度絕對值最大,說明其離散程度最大。8個表型性狀的偏度和峰度的絕對值均小于1,符合正態分布的特點(表1、圖1)。
2.2表型性狀的相關性及主成分分析
2.2.1相關性分析
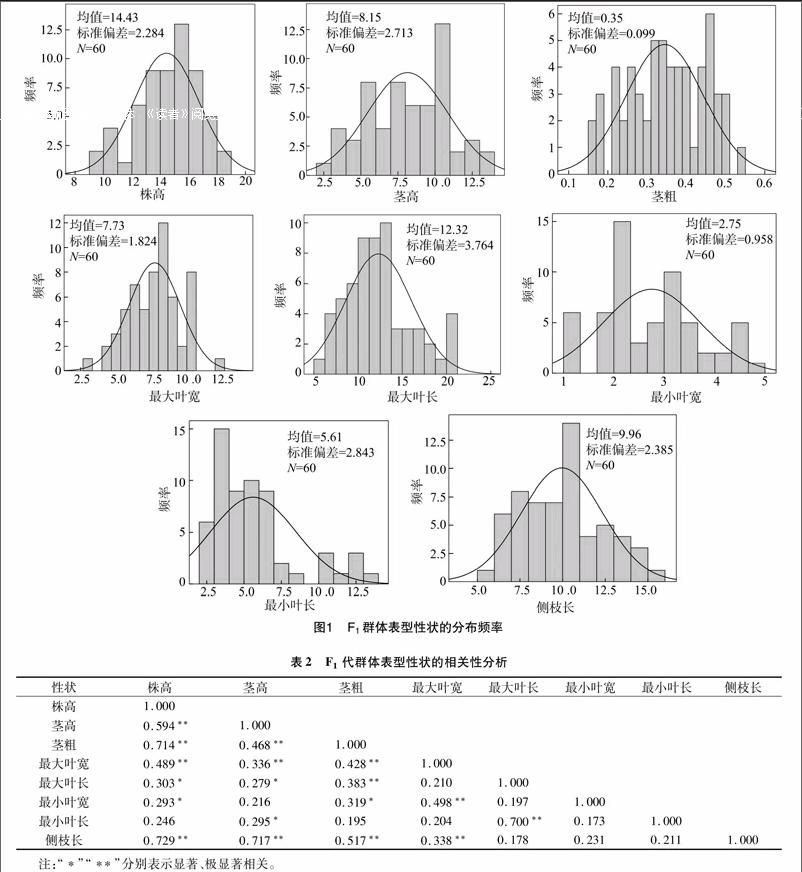
各性狀之間除最小葉長外,相關性多數較明顯,其中,株高與莖高、莖粗、最大葉寬及側枝長呈極顯著正相關,與最大葉長及最小葉寬呈顯著正相關,與最小葉長的相關性不顯著;莖高與株高、莖粗、最大葉寬及側枝長呈極顯著正相關,與最大葉長、最小葉長呈顯著正相關,與最小葉寬相關性不顯著;莖粗與株高、莖粗、最大葉寬、最大葉長及側枝長呈極顯著正相關,與最小葉寬呈顯著相關,與最小葉長相關性不顯著;最大葉寬與株高、莖高、莖粗、最小葉寬及側枝長呈極顯著正相關,與最大葉長、最小葉長相關性不顯著;最大葉長與莖粗、最小葉長呈極顯著正相關,與株高、莖高呈顯著正相關,與最大葉寬、最小葉寬及側枝長相關性不顯著;最小葉寬與最大葉寬呈極顯著正相關,與株高及莖粗呈顯著正相關,與莖高、最大葉長、最小葉長及側枝長相關性不顯著;最小葉長與最大葉長呈極顯著正相關,與莖高呈顯著正相關,與其他指標相關性均不明顯;側枝長與株高、莖高、莖粗及最大葉寬呈極顯著正相關,與其他指標相關性不顯著(表2)。
2.2.2主成分分析
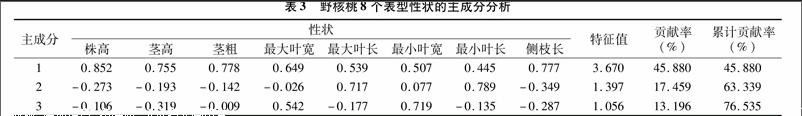
通過變異系數分析,表明野核桃表型性狀差異大小不同,在此基礎上,對8個表型性狀進行了主成分分析,從而獲得了這些性狀之間的特征值、貢獻率及累計貢獻率。研究發現,前3個主成分的累積貢獻率達到了76535%, 足以反映出原始因子所代表的大部分信息。在第1主成分中,株高、莖粗的絕對值較大;第2主成分中,最大葉長、最小葉長絕對值較大;第3主成分中,最小葉寬的絕對值較大(表3)。通過這3個主成分分析可以確定:株高、莖粗、最大葉長、最小葉長、最小葉寬這5個指標是引起野核桃表型差異較大的因子。
2.3野核桃SSR標記分析
試驗利用13對SSR引物對野核桃進行分析,共篩選出10對多態性高的SSR引物,對60份野核桃種質群體進行擴增,并對等位位點數、多態位點數以及多態性信息含量(PIC)等進行多樣性統計(表4)。10對SSR引物擴增得到的基因片段長度在100~450 bp, PCR 擴增總計得到35個等位變異位點,等位位點數在2~6之間,平均每對SSR引物可以檢測到3.5個等位位點數。多態信息含量(PIC值)變化范圍為0.332~0.736,平均為0.494。
2.4SSR聚類分析
通過10對多態性SSR引物分析,60份野核桃材料的遺傳相似系數(GS)變異范圍為0.51~0.95,平均值為0.642。其中個體1和3的GS值最大(0.85), 表明兩者的親緣關系很近。根據材料間的遺傳相似系數,采用UPGMA法對野核桃[CM(25]種質進行聚類分析(圖2),利用10對SSR標記將60份野核桃種質相互區分,在GS值為0.55水平上將所有的材料劃分成Ⅰ、Ⅱ、Ⅲ、Ⅳ共4個組,Ⅰ組包括了36份種質材料,Ⅱ組包括6份種質材料,Ⅲ組則包括了7份種質材料,Ⅳ組包括11份種質材料。
2.5SSR標記與表型性狀的連鎖分析
標記與性狀之間的連鎖分析,是根據標記位點的基因型以及數量性狀的表型對個體進行顯著性檢驗,差異顯著則說明標記與數量性狀存在關聯[15]。試驗共檢測到與8個表型性狀相連鎖的SSR標記位點5個,其中與莖粗相關的標記是SSR4,與最大葉長相關的標記有2個,分別是SSR5、SSR7;與最小葉寬相關的標記有2個,分別是SSR4、SSR9;與最小葉長相關的標記是SSR10(表5)。
3討論
遺傳多樣性是種質資源研究、保護和開發利用的基礎,不僅具有一定的理論意義,還具有重要的實際意義,對于揭示物種演化過程和進化潛能、了解群體遺傳結構及多態性水平有重要價值,也為物種起源的研究、親本的選配、品種的分類、保護等多個方面提供了依據。
3.1野核桃表型性狀分析
表型性狀具有直觀性的特點,對遺傳多樣性的研究及物種演化過程和進化潛能、了解群體遺傳結構及多態性有重要價值,并為物種起源研究、親本的選配、品種的分類及保護等提供依據[16]。本試驗通過對野核桃表型性狀的研究,表明F1群體的8個表型性狀均呈正態分布,且這些性狀均可進行后續作圖群體的QTL分析[17-18],也說明了這些性狀可能為多基因控制的數量性狀[19]。相關性分析表明,各性狀之間除最小葉長外,其他性狀相互之間相關性多顯著或極顯著,尤其是株高、莖高、莖粗、最大葉寬與其他性狀之間,以及它們相互之間的相關性多顯著或極顯著。變異系數結果表明個體間差異明顯,不同表型性狀的變異系數在15.83%~46.40%之間,變異程度最小的是株高(15.83%),最大的為最小葉長(4640%)。各個性狀的變異均超過10%,說明個體間的表型值變異較大,反映出即使是同一條件下,由于遺傳漂變、自然選擇、基因突變、基因流等遺傳變異因素的影響,個體的表型仍有較大的差異,同時也說明,表型具有可塑性,由生境及內部遺傳變異共同影響[20-21]。為了進一步探究引起野核桃表型變異的主要因素,進行了主成分分析,結果表明,株高、莖粗、最大葉長、最小葉長、最小葉寬這5個指標是引起野核桃表型差異較大的因子,可以為以后野核桃的相關研究提供依據,豐富的表型性狀多樣性為野核桃的品種選育和遺傳育種的親本選擇提供了豐富的種質資源。
3.2野核桃SSR遺傳多樣性分析
SSR標記可從DNA水平上鑒定雜種真偽,具備周期短、重復性高、不受時間和生長環境影響等優點。利用該方法輔助選擇雜種,可提高真雜種的選擇效率,有助于促進育種進程。另外,SSR標記具備鑒定苗期真雜種的特點,所以利用SSR標記輔助創建遺傳群體,可以確保所創建群體遺傳來源的可靠性[22]。本試驗對單個群體中的個體進行了聚類分析,結果表明,60個個體分成4大類,親緣關系最近的只有1對,即個體1號和5號,表明不同的單株之間即使給予相同的外部條件進行培養,其遺傳多樣性仍較為豐富。因此,可以得知各個單株即使分布在很近的地域范圍,同處在相同或相近的氣候和地域環境條件下,各自的遺傳背景卻仍存在一定的多樣性[23]。
3.3野核桃表型性狀與SSR標記相關性分析
本研究中通過對60份野核桃種質資源基于遺傳距離的聚類分析,在GS值0.54水平上將所有的材料劃分成Ⅰ、Ⅱ、Ⅲ、Ⅳ共4組,說明野核桃不同單株之間存在較大的遺傳差異。進一步研究發現,表型性狀分析與SSR標記分析聚類的結果具有顯著或極顯著的相關性。歲立云等在對中華稱猴桃和美味稱猴桃紅肉類型稱猴桃調查研究中發現,2種稱猴桃親緣關系較近,有按地理來源優先聚類的趨勢,且果實性狀數據和AFLP數據之間具有極顯著的相關性[24]。這說明同一個地理地域來源的野核桃種質資源SSR分子標記上的遺傳多樣性在一定程度上可以反映表型性狀上的多樣性。
總之,本試驗通過對野核桃表型形態及SSR標記的綜合研究,發現野核桃的表型形態豐富,不僅是受到自然選擇、環境等因素的影響,同時也是遺傳變異所導致的結果。因此,今后在對野核桃進行品種改良和遺傳育種工作過程中,其表型性狀和分子標記上表現出的豐富的遺傳變異,可以為野核桃繁育、改良及產業發展提供有價值的參考依據。
參考文獻:
[1]Zilber-Rosenberg I,Rosenberg E. Role of microorganisms in the evolution of animals and plants:The hologenome theory of evolution[J]. Fems Microbiology Reviews,2008,32(5):723-735.
[2]周文才,侯靜,郭煒,等. 基于SSR標記的美洲黑楊雜交子代的鑒定[J]. 南京林業大學學報(自然科學版),2015(3):45-49.
[3]趙波,葉劍,金文林,等. 不同類型小豆種質SSR標記遺傳多樣性及性狀關聯分析[J]. 中國農業科學,2011,44(4):673-682.[HJ1.65mm]
[4]張軍,趙團結,蓋鈞鎰. 大豆育成品種農藝性狀QTL與SSR標記的關聯分析[J]. 作物學報,2008,34(12):2059-2069.
[5]Yamamoto T,Shimada T S,Imai T,et al. Characterization of morphological traits based on a genetic linkage map in peach[J]. Breeding Science,2001,51(4):271-278.
[6]陳氏秋江,黨小景,劉強明,等. 水稻籽粒性狀的SSR關聯分析[J]. 中國水稻科學,2014(3):243-257.
[7]Aranzana M J,Abbassi E K,Howard W,et al. Genetic variation,population structure and linkage disequilibrium in peach commercial varieties[J]. BMC Genetics,2010,11(11):69.
[8]Barnaud A,Lacombe T,Doligez A. Linkage disequilibrium in cultivated grapevine,Vitis vinifera L.[J]. Theoretical and Applied Genetics,2006,112(4):708-716.
[9]季維智,宿兵. 遺傳多樣性研究原理與方法[M]. 杭州:浙江科技出版社,1999.
[10]Booy G,Hendriks R J J,Smulders M J M,et al. Genetic diversity and the survival of population[J]. Plant Biology,2000,2(4):379-395.
[11]王肇延. 新疆野核桃資源及遺傳多樣性的分析[D]. 烏魯木齊:新疆農業大學,2011.
[12]王磊,李霞,楊遼,等. 新疆野核桃種質資源數量分類研究[J]. 北方園藝,1998(1):5-7.
[13]袁海濤. 新疆野核桃種質資源基礎數據庫的建立與核心種質構建方法研究[D]. 烏魯木齊:新疆農業大學,2012.
[14]張維,焦子偉,尚天翠,等. 新疆西天山峽谷海拔梯度上野核桃種群統計與譜分析[J]. 應用生態學報,2015,26(4):1091-1098.
[15]Ovilo C,Pérezenciso M,Barragán C,et al. A QTL for intramuscular fat and back fat thickness is located on porcine chromosome 6[J]. Mammalian Genome,2000,11(4):344-346.
[16]解新明,云錦鳳. 植物遺傳多樣性及其檢測方法[J]. 中國草地,2000(6):51-59.
[17]趙文明,孟慶雷,王付娟,等. 玉米株型主要性狀作圖群體分析[J]. 安徽農業科學,2007,35(31):9876-9877.
[18]李博. 毛白楊與毛新楊轉錄組圖譜構建及若干性狀的遺傳學聯合分析[D]. 北京:北京林業大學,2009.
[19]張紅梅,劉小紅,羅綺,等. 玉米RIL群體的主要株型性狀調查研究[J]. 吉林農業科學,2009,34(5):10-11,17.
[20]Nevo E. Evolution of genome-phenome diversity under environmental stress[J]. Proceedings of the National Academy of Sciences of the United States of America,2001,98(11):6233-6240.
[21]Li J Q,Guo Y S,Franois R. Environmental hetetogeneity and population variability of sclerophyllous oaks(Quercus sec. suber)in East Himalayan region[J]. Forestry Studies in China,2000,2(1):1-15.
[22]陳靜,胡曉輝,石運慶,等. 花生品種間雜種F1代的SSR標記分析[J]. 核農學報,2009,23(4):617-620,625.
[23]湯佳樂,黃春輝,吳寒,等. 野生毛花獼猴桃果實表型性狀及SSR遺傳多樣性分析[J]. 園藝學報,2014,41(6):1198-1206.
[24]歲立云,劉義飛,黃宏文. 紅肉獼猴桃種質資源果實性狀及AFLP遺傳多樣性分析[J]. 園藝學報,2013,40(5):859-868.

